Журнал «Болезни и антибиотики» 2 (2) 2009
Вернуться к номеру
Азитромицин (Cумамед®) и другие макролиды: перспективы клинического использования
Авторы: Березняков И.Г., Харьковская медицинская академия последипломного образования
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
Антибиотики класса макролидов широко используются в клинической практике — как с лечебной, так и с профилактической целью. Они не только представляют собой наиболее приемлемую альтернативу βлактамам, могут применяться вместе с ними, но и во многих случаях рассматриваются как препараты выбора. Основными показаниями к назначению макролидов являются:
— внебольничные инфекции дыхательных путей (стрептококковый тонзиллофарингит, острый средний отит, острый бактериальный риносинусит, острый бронхит и обострения хронического бронхита, внебольничная пневмония);
— инфекции кожи и мягких тканей (импетиго, фурункулез, фолликулит, эритразма и др.);
— инфекции, передающиеся половым путем (прежде всего негонококковые уретриты);
— токсоплазмоз;
— заболевания, ассоциирующиеся с инфекцией Helicobacter pylori;
— оппортунистические инфекции у больных с иммунодефицитными состояниями (микобактериозы, криптоспоридиоз и др.).
Как альтернатива βлактамам макролиды используются при аллергии на βлактамы, а также в случаях недавнего (по отношению к нынешнему заболеванию) применения последних (изза повышенного риска того, что новое заболевание будет вызвано бактериями, приобретшими устойчивость к βлактамам в ходе предшествующего лечения этими антибиотиками). В педиатрической практике в связи с ограничениями по использованию тетрациклинов и фторхинолонов макролиды остаются, по существу, единственной альтернативой βлактамным антибиотикам.
Наряду с антибактериальными макролиды обладают иммуномодулирующими и противовоспалительными свойствами, причем последние присущи 14 и 15членным макролидам, но не 16членным [1]. Эти свойства заключаются в уменьшении секреции мокроты [2], снижении накопления нейтрофилов в дыхательных путях вследствие уменьшения экспрессии провоспалительных цитокинов, например интерлейкина8 (ИЛ8), и продукции молекул адгезии, таких как макрофагальная молекула адгезии 1 [3–5].
Толчком к изучению возможностей использования макролидов при хронических воспалительных заболеваниях дыхательных путей и ЛОРорганов послужило случайное обнаружение позитивных эффектов длительного применения низких доз эритромицина у больных диффузным панбронхиолитом [6]. Это прогрессирующее воспалительное заболевание дыхательных путей встречается почти исключительно в Японии. Клинически оно характеризуется хроническим кашлем, избыточной продукцией мокроты, одышкой при физической нагрузке, хроническим синуситом и колонизацией Pseudomonas spp. Со временем развиваются диффузные бронхоэктазы и дыхательная недостаточность [7]. Длительное применение макролидов позволило увеличить 5летнюю выживаемость с 63 до 92 % [7, 8], причем клиническая эффективность этого класса антибиотиков установлена как при наличии, так и в отсутствие хронической инфекции в дыхательных путях [9].
Позитивные эффекты 14 и 15членных макролидов при диффузном панбронхиолите имеют несколько объяснений. Вопервых, макролиды связываются с каналами, по которым в эпителиальных клетках транспортируются ионы хлора. Блокада каналов дополняется угнетением секреции воды, которая вместе с ионами хлора перемещается через клеточную мембрану [10, 11]. В результате снижается гиперсекреция мокроты. Вовторых, при длительном использовании в низких дозах макролиды уменьшают переизбыток полиморфноядерных нейтрофилов (ПМН) в легких. Указанный эффект достигается посредством угнетения экспрессии цитокинов (ИЛ8), в результате чего уменьшается хемотаксис ПМН в легкие.
Спустя месяцы после начала лечения макролидами изменяется качественный состав мокроты, которая становится похожей на таковую у здоровых людей, то есть в ней доля альвеолярных макрофагов превышает долю ПМН. Вследствие уменьшения воспаления у больных диффузным панбронхиолитом улучшается функция легких и снижается частота обострений заболевания. В клинических исследованиях продемонстрирована эффективность не только эритромицина, но также кларитромицина, рокситромицина и азитромицина (Сумамед®). Хотя позитивные эффекты макролидов закономерно выявляются во многих исследованиях, точное время наступления эффекта от начала терапии остается точно не установленным и колеблется, по разным данным, от 5 до 16 мес. [12].
Доказанная польза от применения макролидов при диффузном панбронхиолите побудила к оценке перспектив использования этого класса антибиотиков при других хронических воспалительных заболеваниях дыхательных путей: муковисцидозе, бронхоэктатической болезни, бронхиальной астме, облитерирующем бронхиолите, хроническом обструктивном заболевании легких (ХОЗЛ) и хроническом риносинусите.
Муковисцидоз
Обнадеживающие данные были получены у больных с муковисцидозом — заболеванием, которое наследуется по аутосомнорецессивному типу и характеризуется полиорганной дисфункцией, в особенности прогрессирующим поражением легких, панкреатической недостаточностью и повышенными концентрациями электролитов при выделении пота. Так, в плацебоконтролируемое исследование были включены 185 больных муковисцидозом в возрасте старше 6 лет (главным образом взрослые люди) с величиной объема форсированного выдоха за первую секунду (ОФВ1)> 30 % от должного. У всех пациентов имела место хроническая (длительностью ≥ 1 год) инфекция, вызванная P.aeruginosa. Азитромицин (Сумамед®) назначали по 250 или 500 мг (в зависимости от массы тела) 3 раза в неделю в течение 24 недель. Выбор азитромицина был продиктован стремлением сократить до минимума риск межлекарственных взаимодействий с многочисленными медикаментами, которые вынуждены принимать больные муковисцидозом. Пациенты из контрольной группы получали с той же периодичностью плацебо [13]. Ко времени завершения исследования установлено статистически значимое позитивное влияние приема азитромицина (Сумамед®) на частоту обострений заболевания и величину ОФВ1 (рис. 1, 2). Кроме того, ко времени завершения исследования масса тела у больных из группы вмешательства была в среднем на 0,7 кг больше, чем в группе плацебо (p = 0,02).
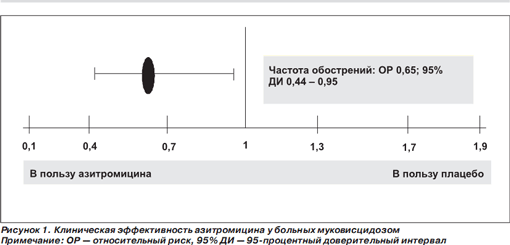
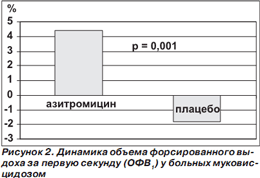
В более ранних работах азитромицин и у детей, и у взрослых, страдающих муковисцидозом, назначали ежедневно. В данном исследовании, в котором были получены результаты, сопоставимые с результатами предшествующих работ, показана принципиальная возможность применять этот антибиотик через день. На вопрос о том, можно ли назначать его еще реже, смогут дать ответ будущие исследования.
Отличительной особенностью использования макролидов при муковисцидозе является их эффективность в предупреждении обострений, вызванных P.aeruginosa. Общеизвестно, что макролиды не активны в отношении неферментирующих микроорганизмов (синегнойной палочки, ацинетобактера, стенотрофомонад). При хронических воспалительных заболеваниях дыхательных путей последние с течением времени колонизируются мукоидными штаммами P.aeruginosa, вырабатывающими большое количество альгината и существующими внутри биопленок, где они становятся неуязвимыми ни для антибиотиков, ни для иммунной системы пациента. Клиническая эволюция этих изолятов протекает в двух направлениях. Вопервых, при благоприятных условиях бактерии высвобождаются из биопленок и вызывают острую инвазивную инфекцию дыхательных путей. В подобных случаях применение системных антибиотиков может привести к временному улучшению клинической симптоматики вследствие уничтожения этих «свободноживущих» бактерий. Однако полная эрадикация (истребление) возбудителей невозможна, поскольку некоторая часть живых бактерий остается внутри биопленок [14]. Вовторых, альгинат, входящий в состав биопленок, в качестве антигена вступает в реакции с антителами, что сопровождается массивной лимфоцитарной инфильтрацией и формированием гранулем в окрестностях мелких дыхательных путей. Накопление иммунных комплексов в ткани легких стимулирует хемотаксис ПМН, что, в свою очередь, приводит к усугублению местного повреждения.
Даже в невысоких концентрациях 14 и 15членные макролиды способствуют разрушению и тормозят дальнейшее образование биопленок, защищающих мукоидные штаммы P.aeruginosa. Кроме того, при длительном использовании антибиотики накапливаются внутри микроорганизмов и нарушают в них синтез белка, что, по некоторым данным, может приводить к бактерицидным эффектам [15]. Макролиды также ослабляют факторы вирулентности у P.aeruginosa. В частности, азитромицин (Сумамед®) ингибирует у синегнойных палочек феномен «кооперативной чувствительности» (quorumsensing) путем снижения продукции аутоиндукторов с последующим уменьшением образования ИЛ8 [16–18]. По способности ослаблять факторы вирулентности у P.aeruginosa азитромицин превосходит 14членные макролиды [17].
В последние годы получены доказательства эффективности использования макролидов на ранних стадиях муковисцидоза, когда дыхательные пути большинства пациентов еще не колонизированы P.aeruginosa. В многоцентровое рандомизированное двойное слепое плацебоконтролируемое исследование было включено 82 человека в возрасте 6–21 года (средний возраст 11,0 ± 3,3 года) с ОФВ1 > 40 % от должного. У 23 % больных из дыхательных путей была выделена P.aeruginosa (по частоте выделения данный возбудитель уступал Staphylococcus aureus (весьма существенно) и Haemophilus influenzae). Пациенты из группы вмешательства получали азитромицин (Сумамед®) внутрь по 250 (при массе тела < 40 кг) или 500 мг (масса тела ≥ 40 кг) 3 раза в неделю на протяжении 12 мес., больные контрольной группы — плацебо [19].
Через 12 мес. величины ОФВ1 в контрольной группе не отличались от таковых ни в группе вмешательства целиком, ни в подгруппах пациентов, инфицированных и не инфицированных P. aeruginosa. В то же время у больных, получавших азитромицин, статистически значимо реже, чем в группе плацебо, отмечались легочные обострения и возникала потребность в дополнительных курсах лечения антибиотиками (рис. 3). У пациентов, принимавших азитромицин (Сумамед®), время до наступления обострения (медиана 8,7 мес.) существенно превышало таковое в контрольной группе (медиана 2,9 мес., p < 0,0001). Перечисленные различия зарегистрированы также в подгруппе лиц, не инфицированных P.aeruginosa, в то время как среди инфицированных P.aeruginosa они не достигли статистической значимости [19].
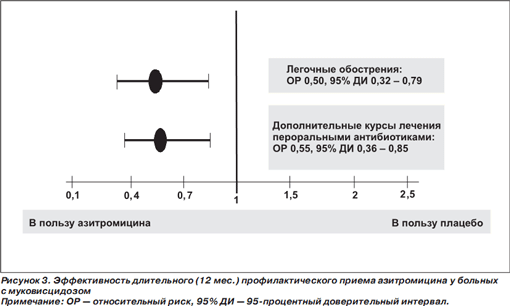
В целом применение макролидов при муковисцидозе имеет как достоинства, так и недостатки. К первым следует отнести снижение частоты инфекционных обострений, улучшение функции легких и улучшение состояния питания [6]. К сожалению, первоначальное улучшение функции легких исчезает при длительном лечении. Более того, у больных муковисцидозом установлено формирование резистентности S.aureus к макролидам в процессе лечения. Клиническое значение этого факта еще предстоит изучить.
Бронхоэктатическая болезнь (БЭ)
При БЭ антибиотики используются как для лечения обострений, так и для предупреждения повторных обострений [20]. При бронхоэктазии расширение воздухоносных путей и утолщение стенок бронхов сопровождается повреждением эпителия и нарушением мукоцилиарного клиренса. Повышение вязкости мокроты также затрудняет отделение секрета, что способствует персистированию микроорганизмов в дыхательных путях. Больные обычно предъявляют жалобы на хронический продуктивный кашель с периодическим усугублением клинической симптоматики (обострениями). Значимость обострений обусловлена не только их кратковременными эффектами на состояние здоровья (усиление одышки, кашля, потребность в госпитализации), но и долговременным негативным влиянием на функцию легких [21].
Воздухоносные пути больных с БЭ часто колонизированы различными микроорганизмами (табл. 1), что ведет к высвобождению провоспалительных цитокинов, таких как ИЛ1β, ИЛ8, лейкотриен B4 (LTB4) и фактор некроза опухолей альфа (ФНОα), привлечению нейтрофилов в очаг воспаления [22] и повышению гнойности мокроты. Нейтрофилы высвобождают нейтрофильную эластазу, протеиназы и матриксные металлопротеиназы, разрушающие эластин дыхательных путей и коллаген и протеогликан базальных мембран [23, 24]. В результате поражение дыхательных путей прогрессирует, а функция легких снижается. Таким образом, БЭ можно рассматривать как хроническое инфекционное заболевание.

Возможная польза от профилактики обострений БЭ заключается в снижении частоты госпитализаций, предупреждении ухудшения функции легких и поддержании приемлемого качества жизни. Однако использование антибиотиков с профилактической целью остается предметом дискуссий и четкие рекомендации по этой теме отсутствуют. Кандидатами для проведения антибиотикопрофилактики могут быть пациенты с частыми обострениями (> 4–6/год) либо больные с прогрессирующим ухудшением функции легких. Отсутствие консенсуса по этим вопросам оставляет окончательное суждение за лечащим врачом. Поскольку при БЭ имеет место хроническое воспаление дыхательных путей, колонизированных бактериями (видовой состав которых с течением времени остается довольно стабильным), для оптимизации выбора антибиотиков можно рекомендовать периодическое повторение культуральных исследований мокроты с определением чувствительности выделенных микроорганизмов к антибиотикам [20]. Предлагаются разные режимы использования антибиотиков с профилактической целью: повторные 7–10дневные курсы каждый месяц одним и тем же препаратом либо с заменой (ротацией) антибиотиков; длительные (например, 4недельные) курсы антибиотикопрофилактики; альтернирующий прием ингаляционных антибиотиков (1 месяц приема — 1 месяц перерыв) и даже периодические курсы внутривенной антибиотикопрофилактики [25].
Так, в проспективное несравнительное исследование были включены 33 больных с верифицированными при компьютерной томографии бронхоэктазами. Азитромицин (Сумамед®) назначали по 500 мг/сут в течение 6 дней, затем по 250 мг/сут в течение 6 дней, далее по 250 мг/сут 3 раза в неделю. Длительность приема в среднем составила 20,0 ± 10,1 мес. и ни у одного пациента не была менее 4 мес. [26]. По сравнению с прежним опытом пациентов установлено многократное снижение частоты инфекционных обострений заболевания, требующих приема антибиотиков внутрь (рис. 4).
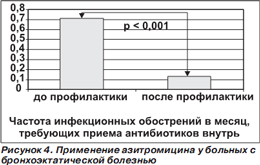
В целом применение макролидов у больных бронхоэктатической болезнью ассоциируется не только со снижением частоты инфекционных обострений, но и с уменьшением продукции мокроты [6]. С другой стороны, количество исследований эффективности макролидов (кроме азитромицина тестировались эритромицин, кларитромицин и рокситромицин) у больных с бронхоэктазами ограниченно, в них было мало включенных пациентов, продолжительность наблюдения за больными после завершения исследований невелика. Остаются неизвестными оптимальные дозы, частота и длительность применения препаратов. Неясно, каким именно больным показана антибиотикопрофилактика и в какие сроки ее следует начинать [25].
Разрешить имеющиеся вопросы призваны 2 крупных продолжающихся рандомизированных клинических исследования (РКИ), в одно из которых включено более 800, а во второе — более 1000 больных с бронхоэктазами. В обоих исследованиях тестируется азитромицин (Сумамед®).
Хроническое обструктивное заболевание легких
Количество исследований эффективности длительного применения макролидов у больных с ХОЗЛ весьма ограниченно. В самом крупном из них у 109 пациентов, получавших плацебо или эритромицин по 250 мг 2 раза в сутки на протяжении 1 года, оценивали количество обострений, требовавших лечения. В группе плацебо вероятность получать терапию в связи с возникновением обострения ХОЗЛ была статистически значимо выше, чем в группе больных, получавших макролид (отношение шансов (ОШ) 1,48, p = 0,004) [27]. Можно ожидать, что исследования в данной области будут продолжены.
Облитерирующий бронхиолит после трансплантации легких
В небольшом пилотном исследовании у больных после трансплантации легких с облитерирующим бронхиолитом азитромицин (Сумамед®) добавляли к стандартной терапии, направленной на недопущение отторжения пересаженного органа. Антибиотик применяли внутрь по 250 мг 3 раза в неделю. Длительность наблюдения составила в среднем 14 недель. Даже за такой небольшой период установлено статистически значимое увеличение ОФВ1 на 17 %. Достигнутый эффект не был вызван применением сопутствующих медикаментов либо благоприятными межлекарственными взаимодействиями, поскольку, вопервых, азитромицин был единственным вновь добавленным препаратом, а вовторых, он не вступает в значимые межлекарственные взаимодействия с компонентами стандартной терапии у данного контингента пациентов [28]. Улучшение ОФВ1 было подтверждено в ретроспективном и абсолютном большинстве проспективных исследований у больных с облитерирующим бронхиолитом, в которых тестировался азитромицин [6]. Таким образом, можно предположить, что макролиды станут использовать и для поддерживающей терапии у больных с облитерирующим бронхиолитом после трансплантации легких.
Хронический риносинусит
Позитивные эффекты длительного приема низких доз 14членных макролидов на клиническую симптоматику у больных с хроническим риносинуситом были продемонстрированы в нескольких открытых и одном двойном слепом рандомизированном плацебоконтролируемом исследовании [6]. Тем не менее истинную роль данного класса антибиотиков в лечении этого заболевания еще предстоит изучить.
Бронхиальная астма
Несмотря на наличие нескольких двойных слепых рандомизированных плацебоконтролируемых исследований эффективности макролидов в терапии больных с бронхиальной астмой, совокупная интерпретация полученных данных затруднительна. Основными причинами такого положения дел являются малое количество и гетерогенность включенных в исследования больных, а также непродолжительные сроки наблюдения (≤ 12 недель). В результате авторы Кокрейновского сотрудничества пришли к заключению, что в настоящее время недостаточно доказательств как в поддержку, так и в пользу отказа от использования макролидов у больных с бронхиальной астмой [29].
Подводя итог обсуждению перспектив использования макролидов при хронических воспалительных заболеваниях дыхательных путей, можно заключить, что при некоторых из них (диффузный панбронхиолит, муковисцидоз) антибиотики этого класса уже в настоящее время рассматриваются как необходимый компонент комплексной терапии. Дальнейшие исследования позволят точно определить, какие именно пациенты и с какими именно хроническими воспалительными заболеваниями дыхательных путей получат наибольшую пользу от применения макролидов, а также оптимальную продолжительность вмешательства. Уникальные свойства азитромицина (Сумамед®) (возможность неежедневного приема, доказанная эффективность, низкий потенциал межлекарственных взаимодействий) делают его приоритетным препаратом как для клинических исследований, так и для ежедневной клинической практики.
Место и значимость макролидов в терапии внебольничных инфекций дыхательных путей и ЛОРорганов в амбулаторных условиях общеизвестны. Значительно менее изучен вопрос о целесообразности использования антибиотиков этого класса у госпитализированных больных — как самостоятельно, так и в комбинации, прежде всего с βлактамами.
Внебольничные пневмонии
В соответствии с действующими рекомендациями макролиды являются одним из компонентов комбинированной антибактериальной терапии (АБТ) у госпитализированных больных с внебольничными пневмониями (ВП) — как в общетерапевтические отделения, так и в отделения реанимации и интенсивной терапии (ОРИТ) [30]. Назначают их обычно вместе с βлактамами.
В общем виде идея комбинированной терапии заключается в сочетании двух и более медикаментов с дополняющим друг друга механизмом действия для усиления желаемого терапевтического эффекта без увеличения побочных эффектов. Существует ряд концептуальных отличий комбинированной терапии при инфекционных болезнях от других заболеваний. В частности, при инфекциях побочные эффекты АБТ вызывают меньшую тревогу, нежели утрата эффективности антибиотиков в связи с появлением лекарственноустойчивых штаммов возбудителей. В присутствии антибиотика частота спонтанных мутаций бактерий, приводящих к возникновению резистентности, составляет 109 (т.е. в титре, который может расти в 1 мл культуры). При сочетании двух различных антибиотиков частота спонтанных мутаций бактерий составляет уже 1018 (т.е. 1 резистентный микроорганизм появится в 1 млн литров культуры), при сочетании 3 антибиотиков — 1027 [31]. Внедрение стратегии лечения госпитализированных больных с ВП двумя и более антибиотиками стало прежде всего ответом на стремительное распространение резистентности среди возбудителей болезни. Однако частота спонтанных мутаций находится под генетическим контролем, и у некоторых бактерий она стремительно возросла как компонент стратегии выживания [31].
Другим аргументом в пользу комбинированной АБТ является тот факт, что при использовании комбинаций антибиотиков расширяется перечень микроорганизмов, в отношении которых активны выбранные препараты. Это имеет большое значение, поскольку при первом обращении пациента за медицинской помощью только в единичных случаях удается предсказать, какой именно возбудитель (или возбудители) вызвал(и) у него заболевание. Соответственно, лечение в подавляющем большинстве случаев назначается эмпирически [32]. В связи с этим представляют интерес как клинические доказательства превосходства данной стратегии над монотерапией βлактамами, так и аргументы в пользу использования в составе комбинированной АБТ именно макролидов — прежде всего у наиболее тяжелых категорий больных с ВП.
1. Больные с внебольничной пневмонией и бактериемией
У 10–11 % госпитализированных больных с ВП имеет место бактериемия, причем S.pneumoniae выделяется в 60–67 % случаев [33, 34]. Наличие бактериемии ассоциируется с тяжелым течением заболевания и худшим прогнозом [35]. Хотя смертность от пневмококковой пневмонии снизилась в последние десятилетия, смертность от пневмококковой пневмонии с бактериемией осталась прежней. Вероятными причинами являются:
— «старение» населения;
— увеличение доли больных с нарушенным иммунитетом (синдром приобретенного иммунодефицита (СПИД), химиотерапия);
— сопутствующие заболевания (хроническое обструктивное заболевание легких, хроническая сердечная недостаточность) [36].
В проспективных мультинациональных рандомизированных клинических исследованиях не обнаруживают существенных различий в эффективности антибиотиков или смертности у больных с ВП в разных странах — вне зависимости от распространенности резистентности [37]. Резистентность in vitro непосредственно связана с исходами заболевания только при инфекциях с бактериемией [38, 39]. Данные о резистентности патогенов обычно получают в ходе исследований у госпитализированных больных, которые не вполне отражают ситуацию во внебольничной среде.
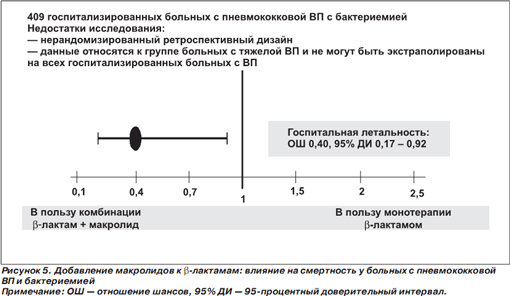
Превосходство комбинированной АБТ над монотерапией продемонстрировано в ряде исследований у больных с пневмококковой ВП и бактериемией. Это весьма небольшая группа пациентов с ВП, однако с точки зрения смертности — наиболее важная. Так, добавление макролида к βлактамному антибиотику приводило к снижению госпитальной летальности у больных с пневмококковой ВП и бактериемией [40] (рис. 5). Однако пневмококки не единственные микроорганизмы, которые могут быть обнаружены в крови у больных с тяжелыми ВП. В недавнем ретроспективном обсервационном исследовании были проанализированы 2209 эпизодов бактериемии у госпитализированных больных с пневмонией, в том числе с сепсисом и дыхательной недостаточностью [41]. Больные поступали со своего места жительства либо из домов длительного ухода. Бактериемию устанавливали в том случае, если имел место рост микроорганизмов из образцов крови, взятых в первые 36 ч пребывания в стационаре, при условии, что выделенный микроорганизм не трактовался как контаминант (например, коагулазонегативные стафилококки, Corynebacterium spp. (за исключением C.jeikeium), Clostridium spp., Micrococcus spp., Propionibacterium spp. и Bacillus spp.) [42]. В исследование не включали пациентов с фунгемией.
Больные трактовались как получающие антибиотики, активные в отношении атипичных патогенов, если в течение первых 24 ч пребывания в стационаре им вводили макролид, фторхинолон или тетрациклин в виде монотерапии или в комбинации с другими препаратами, неактивными в отношении атипичных патогенов.
Пациенты из группы не получавших антибиотики, активные в отношении атипичных патогенов, были старше, чаще поступали в стационар из домов длительного ухода, реже получали антибиотики в первые 8 ч пребывания в стационаре. Других различий в сравниваемых группах, включая частоту госпитализации в ОРИТ, не выявлено.
Смертность в течение 30 дней от момента госпитализации была выше в группе больных, не получавших антибиотики, активные в отношении атипичных патогенов. Однако по 4 другим изученным параметрам (госпитальная смертность, длительность пребывания в стационаре, выписка домой или перевод в другой стационар, повторная госпитализация в течение 30 дней) различий между группами сравнения не было.
Из антибиотиков, активных в отношении атипичных патогенов, только лечение макролидами ассоциировалось со снижением госпитальной смертности, смертности в течение 30 дней от момента госпитализации и повторной госпитализации в этот же промежуток времени (рис. 6). Косвенные данные указывают на то, что лучшие исходы (снижение смертности в течение 30 дней от момента госпитализации) отмечаются у больных, получавших макролиды свыше 96 ч, по сравнению с менее продолжительной терапией этим классом антибиотиков.

Преимущества макролидов не распространялись на другие антибиотики, активные в отношении атипичных патогенов [41]. Это наблюдение свидетельствует против гипотезы о том, что позитивные эффекты антибиотиков, активных в отношении атипичных патогенов, объясняются воздействием на коинфекцию микоплазмами, хламидофилами и т.д.
Таким образом, в настоящее время накапливаются аргументы в пользу использования макролидов в терапии больных с ВП и бактериемией. Однако они получены преимущественно в ретроспективных исследованиях и нуждаются в подтверждении в проспективных РКИ.
2. Больные с ВП и шоком
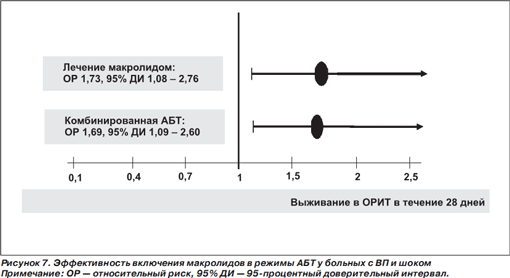
В проспективном когортном исследовании у больных с ВП и шоком, госпитализированных в ОРИТ, лучшая выживаемость в отделении реанимации в течение 28 дней зарегистрирована у больных, которым при поступлении назначали макролидный антибиотик и/или комбинированную АБТ (рис. 7) [43]. Эти данные также нуждаются в подтверждении в проспективных РКИ.
3. Больные с ВП и тяжелым сепсисом
В США ежегодно сепсис развивается более чем у 700 тыс. чел. [44], а тяжелый сепсис занимает девятое место среди причин смерти в этой стране [45]. Большинство случаев сепсиса обусловлено респираторными инфекциями — внебольничными и нозокомиальными [44–46]. ВП — седьмая по значению причина смерти и ведущая причина смерти от инфекционных болезней в США [47].
В патогенезе сепсиса важное значение придается ряду цитокинов, включая ФНОα и ИЛ1, 6 и 10. Макролиды модулируют эффекты этих цитокинов, что может позитивно сказываться на результатах лечения больных с тяжелым сепсисом.
В недавно опубликованном ретроспективном когортном исследовании, проведенном в 2 госпиталях США, изучали влияние макролидов на краткосрочную (30 дней) и долгосрочную (90 дней) смертность у госпитализированных больных с тяжелым сепсисом, обусловленным ВП [48]. Краткосрочная (30 дней) смертность обусловлена пневмонией, долгосрочная (90 дней) — другими причинами [49]. Вторичной конечной точкой была длительность пребывания в стационаре.
В исследование включали больных в возрасте 18 лет и старше, у которых диагноз ВП при поступлении подтверждался обнаружением в течение 24 ч от момента госпитализации при рентгенографии или компьютерной томографии признаков, совместимых с диагнозом пневмонии. Обязательным условием включения пациента было наличие дисфункции хотя бы одного органа. В исследование не включали инфицированных вирусом иммунодефицита человека (ВИЧ) и больных СПИДом [48]. Пациентов относили в группу лиц, принимавших макролиды, если они получали хотя бы одну дозу макролидного антибиотика в течение первых 48 ч от момента госпитализации (рис. 8). Индекс тяжести пневмонии (PSI) оказался сопоставимым в группах лиц с ВП и тяжелым сепсисом, получавших и не получавших макролиды: соответственно 108 ± 32 и 117 ± 39 баллов, p = 0,2.

В группе больных, не получавших макролиды, статистически значимо чаще встречались перенесенные инсульты и почечная недостаточность, в группе леченных макролидами — гипонатриемия и установленный этиологический диагноз (у 42 % больных по сравнению с 24,5 %). Всего в 29 % случаев возбудители были резистентными к макролидам.
30 и 90дневная смертность была ниже в группе больных, получавших макролиды (соответственно 11 и 29 %, p = 0,001; 12 и 34 %, p < 0,001). Смертность в группе больных, не получавших макролиды, была сопоставима с таковой в группе пациентов с тяжелым сепсисом, получавших плацебо в исследовании PROWESS, где тестировался рекомбинантный активированный человеческий протеин С [50]. Кривые выживаемости расходились спустя несколько дней после начала лечения макролидами и напоминали по внешнему виду кривые, зарегистрированные при использовании других иммуномодулирующих средств [50].
Статистически значимые различия в 30 и 90дневной смертности установлены среди пациентов как с культуральнопозитивным, так и с культуральнонегативным сепсисом. Более того, при сепсисе, вызванном грамотрицательными бактериями, 90дневная смертность также была статистически значимо ниже в группе лиц, получавших макролиды, — при том, что эти антибиотики не активны в отношении указанных возбудителей.
Длительность пребывания в стационаре, частота госпитализации в ОРИТ, потребность в искусственной вентиляции легких и во введении вазопрессоров в обеих группах были сопоставимы.
К недостаткам и ограничениям исследования следует отнести (1) ретроспективный дизайн; (2) определение тяжелого сепсиса post hoc; (3) выраженное преобладание мужчин (~ 80 %), поскольку одним из госпиталей, где проводилось исследование, был Медицинский центр по делам ветеранов.
Позитивные эффекты макролидов у больных с тяжелым сепсисом, обусловленным ВП, могут быть связаны с синергизмом антибиотиков, что представляется маловероятным, поскольку грамположительные бактерии в подобных случаях оказываются отнюдь не единственными возбудителями. Также сомнительно, что польза от добавления макролидов к βлактамам обусловлена активностью первых в отношении атипичных патогенов, например, потому, что комбинированная АБТ с включением фторхинолонов не улучшает выживаемость больных [51]. Наиболее вероятным представляется, что польза от применения макролидов обусловлена наличием у них иммуномодулирующих и противовоспалительных свойств. С другой стороны, отсутствие данных об этиологии заболеваний у включенных в исследование пациентов не позволяет исключить и возможность того, что польза от применения макролидов была обусловлена их активностью в отношении Legionella pneumophila, которая довольно часто вызывает тяжелые ВП [52, 53].
4. Больные со среднетяжелыми ВП
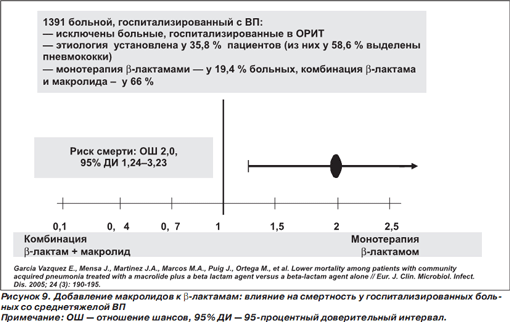
Превосходство комбинированной АБТ βлактамом и макролидом над монотерапией βлактамами продемонстрировано и в ряде исследований у госпитализированных больных со среднетяжелыми ВП. Так, из когортного исследования (всего 1391 больной с ВП) были исключены больные, госпитализированные в ОРИТ [54]. Этиологию заболевания установили у 35,8 % пациентов (из них у 58,6 % были выделены пневмококки). Выбор лечения оставлялся на усмотрение лечащего врача. Монотерапию βлактамами получал каждый пятый больной (19,4 %), а две трети пациентов — комбинацию βлактама и макролида (66 %).
При монотерапии βлактамами смертность составила 13,3 %, в группе комбинированной АБТ — 6,9 % (p = 0,001). Однако доля больных, относящихся к группе самого высокого риска смерти (V класс по шкале PSI), была статистически значимо выше среди пациентов на монотерапии (32,6 % по сравнению с 25,7 % в группе комбинированной АБТ, p = 0,02). После корректировки по числу баллов по шкале PSI, риск смерти оставался в 2 раза выше в группе больных, получавших монотерапию βлактамами (рис. 9). Авторы пришли к заключению, что добавление макролида к стартовой АБТ βлактамами ассоциируется с меньшей смертностью у больных с ВП вне зависимости от тяжести инфекции.
Совместимость βлактамов и макролидов
При выборе антибиотиков для лечения тяжелых и крайне тяжелых пациентов важнейшее значение имеет наличие лекарственных форм для парентерального применения, отсутствие значимых межлекарственных взаимодействий и хорошая переносимость. В клинической практике вместе с макролидами обычно используются цефалоспорины III поколения (цефтриаксон). В исследовании на добровольцах внутривенное введение комбинации цефтриаксона и азитромицина (Сумамед®) не вызывало никаких клинически значимых изменений фармакокинетики каждого из антибиотиков по сравнению с параметрами, зарегистрированными при использовании их в режиме монотерапии. Отсутствие изменений установлено как при введении одной дозы антибиотиков, так и при достижении ими устойчивой плазменной концентрации (steady state) [55].
В другом исследовании на добровольцах внутривенного введения эритромицина и кларитромицина каждый третий пациент прекратил прием эритромицина изза побочных эффектов со стороны желудочнокишечного тракта и каждый второй — кларитромицина изза возникновения флебита в месте инъекции [56]. В отличие от них в исследовании [55] внутривенное введение азитромицина ни разу не вынудило пациентов прекратить или приостановить прием препарата.
Возможные механизмы позитивных эффектов макролидов у больных с пневмониями
Для реализации позитивных эффектов макролидов у больных с диффузным панбронхиолитом требуется несколько месяцев. В то же время у некоего усредненного нестарого больного с ВП с нормальным уровнем иммунитета, получающего адекватную АБТ, температура тела нормализуется в среднем спустя 2,5 дня, лейкоцитоз — к 4му дню, кашель — спустя 7,9 сут., хрипы при аускультации — к 8му дню [57]. У пожилых пациентов и у лиц с тяжелой сопутствующей патологией сроки разрешения клинических симптомов более продолжительны, но никак не несколько месяцев. Отклонения при рентгенологическом исследовании могут сохраняться до 4–10 недель после возникновения [58].
Данные экспериментальных исследований свидетельствуют, что макролиды не препятствуют привлечению нейтрофилов в очаг инфекции и реализации их бактерицидных эффектов [59]. После уничтожения возбудителей макролиды индуцируют апоптоз нейтрофилов, что уменьшает выраженность воспаления. При этом азитромицин (Сумамед®) индуцирует апоптоз в концентрациях, меньших, чем эритромицин. Как полагают, эти противовоспалительные свойства макролидов лежат в основе сокращения сроков пребывания в стационаре и снижения смертности у больных с ВП, получающих антибиотики данной группы. Окончательное суждение о значимости описанных механизмов можно будет сделать после их проверки — как минимум в эксперименте на животных с ВП [59].
Заключение
Наличие у макролидов иммуномодулирующих и противовоспалительных свойств дало толчок к использованию этого класса антибиотиков при хронических воспалительных заболеваниях дыхательных путей. При некоторых из них (диффузный панбронхиолит, муковисцидоз) макролиды уже в настоящее время рассматриваются как необходимый компонент комплексной терапии, исследования при других заболеваниях (например, предупреждение обострений БЭ и ХОЗЛ) продолжаются.
Накапливаются данные о целесообразности применения макролидов в качестве компонента комбинированной АБТ не только при бактериемических пневмококковых и даже просто пневмококковых ВП, но и у больных с септическим шоком и тяжелым сепсисом.
Уникальные свойства Сумамеда® (возможность кратких курсов АБТ (3–5 суток) при использовании с лечебной целью и прием 1–3 раза в неделю во время антибиотикопрофилактики, доказанная эффективность, низкий потенциал межлекарственных взаимодействий, отсутствие клинически значимых изменений фармакокинетики при одновременном применении с цефалоспоринами III поколения, хорошая переносимость) делают его приоритетным препаратом для ежедневной клинической практики.
1. Rubin B.K. Immunomodulatory properties of macrolides: overview and historical perspective // Am. J. Med. — 2004; 117: Suppl. 9A, 2S-4S.
