Журнал «Болезни и антибиотики» 2 (2) 2009
Вернуться к номеру
Емпірична терапія тяжких інфекцій, що викликані «проблемними» збудниками
Уже багато десятиліть при серйозних інфекціях застосовують комбінацію цефалоспоринів з аміноглікозидами. Така комбінація забезпечує широкий спектр активності, високу бактерицидну ефективність, проявляє синергічні ефекти, а також зводить до мінімуму розвиток резистентності під час лікування (W.T. Hughes et al., 1997).
Цефепім є парентеральним цефалоспорином IV покоління з суттєвими перевагами над іншими цефалоспоринами та β-лактамними антибіотиками. Крім дуже широкого спектра антимікробної активності цефепім має низьку спорідненість до основних хромосомних β-лактамаз і тому істотно стійкіший до β-лактамазопродукуючих бактерій. Він активний щодо широкого спектра грампозитивних та грамнегативних аеробів, щодо проти більшості штамів Enterobacter, Escherichia coli, Klebsiella pneumoniae, Proteus spp., Providencia spp., Klebsiella spp., Pseudomonas spp., Serratia spp., Citrobacter freundii, Hafnia alvei та інших, а також окремих грампозитивних мікроорганізмів, наприклад, Staphylococcus, включаючи метицилінчутливі штами, Streptococcus pneumoniae, Streptococcus pyogenes та інших.
Амікацин є напівсинтетичним аміноглікозидом для лікування грамнегативних та деяких інших інфекцій. Він активний щодо аеробних грамнегативних паличок, влючаючи Pseudomonas spp.
Амікацин звичайно застосовують для лікування серйозних інфекцій, викликаних грамнегативними паличками, включаючи Pseudomonas spp., ускладнених інфекцій сечовивідних шляхів, ентерококового ендокардиту (в комбінації з пеніциліном). Амікацин частково ефективний проти бактерій, резистентних до інших аміноглікозидів, оскільки хімічна структура препарату робить його менш чутливим до кількох інактивуючих ферментів.
Мікробіологічна ефективність: 1 + 1 > 2
1) Комбінація цефепіму та амікацину показує кращу активність, ніж окремі препарати. У дослідженні (Sanjay et al., 2008) вивчали мікробіологічну ефективність фіксованої комбінації «цефепім/амікацин» порівняно з окремими компонентами (тільки цефепім, тільки амікацин). Ефективність оцінювали на основі аналізу мінімальних інгібуючих концентрацій (МІК) та кривої «час/знищення» щодо Enterobacter cloacae, Pseudomonas aeruginosa, Staphylococcus aureus та Klebsiella pneumoniae. Як свідчать дані табл. 1, МІК комбінації є суттєво нижчими від МІК окремих компонентів. Отже, поєднання цефепіму з амікацином істотно збільшує протимікробну активність порівняно з окремими компонентами.
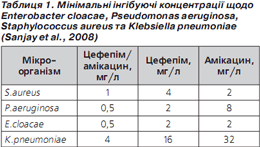
За результатами аналізу кривої «час/знищення» показане максимальне знищення бактерій (кількість колонієутворюючих одиниць (КУО) на 1 мл) через 4 години, потім (через 8 годин) активність зменшується, проте менше в комбінованого препарату (рис. 1–4). Отже, фіксована комбінація цефепіму та амікацину проявляє більшу бактерицидну активність, ніж окремі компоненти, під час аналізу in vitro.
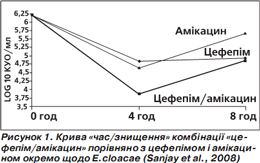
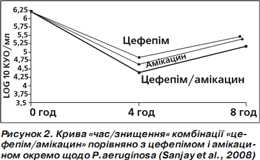
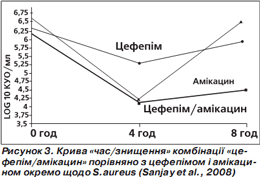

Подібний характер посилення протимікробної активності свідчить про універсальну (проти різних збудників) синергічну дію обох компонентів фіксованої комбінації цефепіму й амікацину (Sanjay et al., 2008).
Разом — вища ефективність проти клебсієли
2) Інше дослідження (Szabo et al., 2001) також виявило синергічну дію цефепіму й амікацину щодо K. pneumoniae, які продукують β-лактамази розширеного спектра (ESBL), що нині набувають дедалі більшого значення у резистентності. Аналіз кривої «час/знищення» (рис. 5) засвідчив, що спільне призначення цефепіму й амікацину має більшу активність на 3-тю годину, ніж активність окремо цефепіму та амікацину, а також іміпенему. На 9-ту годину активність цефепіму/амікацину дорівнювала активності амікацину та іміпенему, але була більшою від активності цефепіму. На 24-ту годину активність цефепіму й амікацину знову стала більшою від активності окремо цефепіму та амікацину і дорівнювала активності іміпенему. Результати цього дослідження (Szabo et al., 2001) показують не тільки синергічну дію комбінації цефепіму й амікацину, але й найшвидшу бактерицидну дію порівняно з цефепімом, амікацином та іміпенемом.
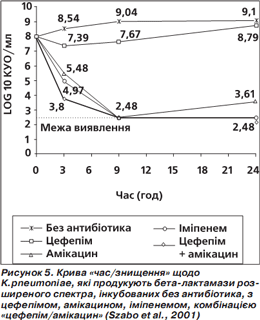
Разом — вища ефективність проти синьогнійної палички
Вивчали ерадикацію збудників у пацієнтів із внутрішньолікарняною пневмонією, основним з яких був Pseudomonas aeruginosa. Лікування проводили за допомогою цефепіму і комбінації цефепіму та амікацину. Досягнуто повної ерадикації в 91 % пацієнтів групи цефепіму + амікацину та лише в 70,8 % у групі цефепіму (Chaudhary et al., 2008).
Дуже ефективний синергічний вплив на полірезистентні штами Pseudomonas spp. справляє комбінація «амікацин + цефепім» (Samet et al. 2003; Dubois V. et al., 2001).
Отже, комбінація амікацину з цефепімом забезпечує майже 100% бактерицидний ефект проти синьогнійної палички, який є швидким і забезпечує відсутність росту навіть через 24 години після дії препарату.
Разом — вища ефективність проти ентеробактера
В експериментальній моделі пневмонії вивчали активність цефепіму та амікацину, а також їх комбінації проти штамів Enterobacter cloacae (дикого типу та цефтазидимрезистентних) (Mimoz et al., 1998). Антибіотики поодинці не змогли зменшити кількість бактерій у тканині легень, проте комбінація антибіотиків діяла синергічно та індукувала суттєве зменшення кількості бактерій у легеневій тканині вже через 24 години. Також не було засвідчено появи резистентних штамів (Mimoz et al., 1998).
Разом = безпечне лікування
Одночасне призначення амікацину та цефепіму не впливає на фармакокінетику обох препаратів, що було виявлено у дослідженнях на людях із нормальною функцією нирок.
При вивченні (Chaudhary et al., 2008) фіксованої комбінації «цефепім/амікацин» не виявлено порушень гематологічних показників, рівнів кальцію, тригліцеридів, білірубіну. Також не засвідчено істотних гістопатологічних змін у печінці та нирках.
Навіть у підвищених дозах комбінація «амікацин/цефепім» не порушувала функції нирок (Chaudhary et al., 2008) – гломерулярна фільтрація, оцінена за рівнем ендогенного креатиніну, не відрізнялася між групами активного лікування та групою контролю протягом 14 днів лікування. Автори роблять висновки, що фіксована комбінація амікацину з цефепімом не порушує гематологічних, біохімічних, а також гістологічних параметрів в експериментальній моделі.
Профіль безпечності: 1 + 1 > 2
Аміноглікозиди застосовують для лікування тяжких інфекцій, викликаних грамнегативними бактеріями (Dwivedi et al., 2009). Побічними ефектами аміноглікозидів можуть бути нефротоксичність та ототоксичність. Призначення аміноглікозидів індукує утворення вільних радикалів (Klemens et al., 2003) та порушення гломерулярної базальної мембрани (Gilbert, 2000). Вільні радикали відіграють важливу роль у медикаментозному ушкодженні нирок та інших органів (Mingeot-Leclercq et al., 1999).
Цефепім є цефалоспорином, який потенційно усуває вільні радикали, тобто має антиоксидантні властивості (Cantin, Woods, 1993). Комбінацію цефалоспоринів з аміноглікозидами багато років застосовують як емпіричне лікування внаслідок широкого спектра активності. Кілька досліджень указують на те, що цефалоспорини в комбінації з аміноглікозидами запобігають токсичності аміноглікозидів (Yazaki et al., 2002).
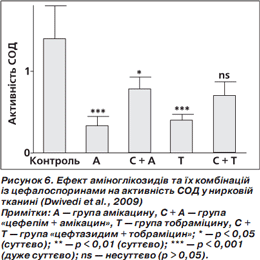
Результати дослідження (Dwivedi et al., 2009) показують істотне зменшення активності супероксиддисмутази (СОД — антиоксидантний фермент) у групі амікацину та тобраміцину. Проте активність СОД істотно підвищилась у групі «цефепім + амікацин» порівняно з групою амікацину. У групі «цефтазидим + тобраміцин» активність СОД також підвищилася, проте несуттєво, порівняно з групою тобраміцину (рис. 6).
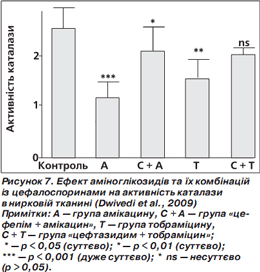
Активність каталази була також суттєво зменшена у групах амікацину та тобраміцину порівняно з контрольною групою. У випадку фіксованої комбінації «цефепім + амікацин» активність каталази підвищилася суттєво порівняно з групою амікацину. Проте у комбінації цефтазидиму з тобраміцином не виявлено суттєвої зміни активності каталази порівняно з групою тобраміцину (рис. 7) (Dwivedi et al., 2009).
Активність глутатіонредуктази також суттєво знижувалася у групах тобраміцину та амікацину, а в групах комбінованих препаратів суттєво підвищувалася.
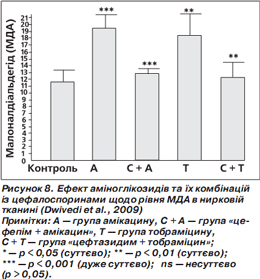
Ушкодження тканин вільними радикалами можна оцінити шляхом вимірювання ступеня пероксидації ліпідів за рівнем малонового діальдегіду (МДА). Суттєве підвищення рівня МДА спостерігали у групах амікацину та тобраміцину порівняно з контролем. Комбінації «цефепім + амікацин» та «цефтазидим + тобраміцин» суттєво знижували рівні МДА практично до рівня контролю (норми) (рис. 8) (Dwivedi et al., 2009).
У групах амікацину та тобраміцину були суттєво підвищені рівні креатиніну та білірубіну порівняно з контролем. У групах «цефепім + амікацин» та «цефтазидим + тобраміцин» рівні креатиніну та білірубіну істотно знизилися та майже досягли рівня контролю (норми) (рис. 9, 10) (Dwivedi et al., 2009).
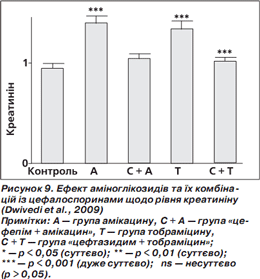
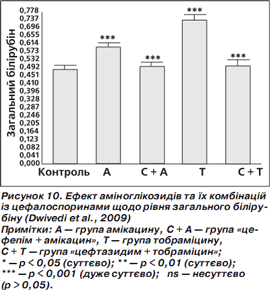
Результати досліджень (Dwivedi et al., 2009) чітко вказують, що, крім доведеної синергічної дії комбінації «цефепім + амікацин», антиоксидантні характеристики також суттєво зменшуватимуть оксидативний стрес, індукований патогенами, і таким чином поліпшуватимуть ефективність лікування.
Висновки
Результатом поєднання високої активності амікацину разом із значною активністю цефепіму є не тільки просте сумування ефектів. Їх дія взаємно потенціюється, посилюється. Мало того, цефепім завдяки своїм антиоксидантним властивостям захищає не тільки від потенційних побічних ефектів амікацину, характерних для аміноглікозидів, але й від оксидативного стресу, спричиненого самою інфекцією. Найближчим часом в Україні з’явиться перша фіксована комбінація цефепіму 1000 мг та амікацину 250 мг — Потентокс (Mili Healthcare). Отже, комбінація двох препаратів дає більше, ніж проста сумація їх властивостей. Новий препарат Потентокс також відрізняється зручністю у використанні (за рахунок фіксованої комбінації).
Матеріал наданий компанією Mili Healthcare
1. Barbhaiya R.H., Knupp C.A., Pfeffer M., Pittman K.A. Lack of pharmacokinetic interaction between cefepime and amikacin in humans // Antimicrob. Agents Chemother. — 1992 July. — 36(7). 1382-1386.
2. Cantin A., Woods D.E. Protection by antibiotics against myeloperoxidase-dependent cytotoxicity to lung epithelial cells in vitro // J. Clin. Invest. — 1993. — 91. — 38-45.
3. Chaudhary M., Shrivastava S.M., Varugehese L. Effect of cefepime/amikacin combination in sprague dawley rats // J. Appl. Biosci. — 2008 June. — 34(1). — 58-61.
4. Clarke A.M., Zemcov S.J.V., Wright J.M. HR-810 and BMY-28142, two new cephalosporins with broad spectrum activity: an in vitro comparison with other beta-lactam antibiotics // J. Antimicrob. Chemother. — 1985. — 15. — 305-310.
5. Dwivedi V.K., Chaudhary M., Soni A., Shrivastava S.M. Nephrotoxicity Reduction by Fixed Dose Combination of Cephalosporins and Aminoglycosides in Mus musculus Mice Asian // Journal of Biochemistry. — 2009. — Vol. 4, Issue 1. — 13-21.
6. Gilbert D.N. Aminoglycosides // Principles and practice of infectious diseases / Ed. by G.L. Mandell, I.E. Bennett, R. Dolin — 5th ed. — Philadelphia: Churchill Livingstone, 2000. — 307-336.
7. Gilbert D.N. Aminoglycosides // Principles and Practice of Infectious Diseases / Ed. by G.L. Mandell, I.E. Bennett, R. Dolin — 4th ed. — New York: Churchill Livingston, 1995.
8. Hughes W.T., Armstrong D. et al. Guidelines for the use of antimicrobial agents in neutropenic patients with unexplained fever. Infectious Diseases Society of America // Clinical Infectiuos Diseases. — 1997. — 25. — 551-73.
9. Klemens J.J., Meech R.P., Hughes L.F., Somani S., Campbell K.C.M. Antioxidant enzyme levels inversely covary with hearing loss after amikacin treatment // J. Am. Acad. Audiol. — 2003. — 14(4). — 134-42.
10. Lang Hainan, Liu Chan. Apoptosis and hair cell degeneration in the vestibular sensory epithelia of the guinea pig following a gentamicin insult // Hearing Research. — 1997 September. — Vol. 111, Issues 1–2. — P. 177-184.
11. Lapenna D., Cellini L., Gioia D.S. et al. Cephalosporins are scavengers of hypochlorous acid // Biochem. Pharmacol. — 1995. — 49(9). — 1249-54.
12. McGrath B.J., Bailey E.M., Lamp K.C., Rybak M.J. Pharmacodynamics of once-daily amikacin in various combinations with cefepime, aztreonam, and ceftazidime against Pseudomonas aeruginosa in an in vitro infection model // Antimicrob. Agents. Chemother. — 1992 December. — 36(12). — 2741-2746.
13. Mimoz O., Jacolot A., Padoin C. et al. Cefepime and amikacin synergy in vitro and in vivo against a ceftazidime-resistant strain of Enterobacter cloacae // Journal of antimicrobial chemotherapy. — 1998. — Vol. 41. — № 3. — P. 367-372.
14. Mingeot-Leclercq M.P., Glupczynski Y., and Tulkens P.M. Aminoglycosides: activity and resistance // Antimicrob. Agents Chemother. — 1999. — 43. — 727-737.
15. Oliveira J.F.P., Cipullo J.P., Burdmann E.A. Aminoglycoside nephrotoxicity // Braz. J. Cardiovasc
Surg. — 2006. — 21. — 444-452.
16. Phelps D.J., Carlton D.D., Farell C.A., Kessler R.E. Affinity of cephalosporins for beta-lactaamses as a factor in antibacterial efficacy // Antimicrob Agents Chemother. — 1986. — 29. — 845-848.
17. Rybak L.P., Somani S. Ototoxicity. Amelioration by protective agents // Ann. N.Y. Acad. Sci. — 1999. — 884. — 143-151.
18. Sanjay M.S., Sandeep S., Dharmendra R., Manu C. Comparative evaluation of microbial efficacy of Potentox, a fixed dose combination of cefepime amikacin with cefepime and amikacin alone // I. Natcon. — 2008. — 20(1). — 121-126.
19. Selimoglu E: Aminoglycoside-induced ototoxicity // Curr. Pharm. Des. — 2007. — 13. — 119-126.
20. Szabo D., Mathe A., Fileto Z. et al. In Vitro and In Vivo Activities of Amikacin, Cefepime, Amikacin plus Cefepime, and Imipenem against an SHV-5 Extended-Spectrum β-Lactamase-Producing Klebsiella pneumoniae Strain // Antimicrobial. Agents. and Chemotherapy. — 2001 Apr. — Vol. 45. — № 4. — P. 1287-1291.
21. Tauber N.M.G., Hackbarth C.J., Scott K.G., Rusnak M.G., Sande M.A. New cephalosporins cefotaxime, cefpimizole, BMY 28142 and HR 810 in experimental pneumococcal meningitis in rabbit // Antimicrob. Agents. Chemother. — 1985. — 27. — 340-342.
22. Tsuji A., Maniatis A., Bertram M.A., Young L.S. In vitro activity of BMY-28142 in comparison with those of other beta-lactam antimicrobial agents // Antimicrob. Agents Chemother. — 1985. — 27. — 515-519.
23. Yazaki T., Yoshiyama Y., Wong P., Beauchamp D., Kanke M. Protective effect of fleroxacin against the nephrotoxicity of isepamicin in rats // Biological & pharmaceutical bulletin. — 2002. — 25. — 516-9.
