Журнал «Болезни и антибиотики» 2 (2) 2009
Вернуться к номеру
Левофлоксацин: новые возможности терапевтического использования
Авторы: Березняков И.Г., Харьковская медицинская академия последипломного образования
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
Наряду с β-лактамными антибиотиками и макролидами фторхинолоны относятся к числу самых назначаемых антимикробных средств. В конце прошлого века на фармацевтическом рынке появились фторхинолоны с повышенной антипневмококковой активностью, которые с тех пор часто именуются «новыми», или «респираторными», фторхинолонами. Самым успешным среди них оказался левофлоксацин. В последние годы для лечения ряда инфекций стали использовать короткие курсы лечения левофлоксацином в высокой дозе. Они были предложены для повышения бактерицидной активности антибиотика (которая зависит от его концентрации) и снижения риска возникновения резистентности. В США такие курсы (прием левофлоксацина в дозе 750 мг 1 раз в сутки на протяжении 5 дней) официально одобрены для лечения больных і 18 лет с внебольничными пневмониями (ВП), острым бактериальным синуситом (ОБС), а также с осложненными инфекциями мочевых путей (ОИМП) и острым пиелонефритом (ОП) у людей с нормальной функцией почек (клиренс креатинина і 50 мл/мин). В настоящей работе будут рассмотрены особенности и место левофлоксацина и других фторхинолонов в современной клинической практике.
Историческая справка
Первым хинолоном, нашедшим клиническое применение, стала налидиксовая кислота. Препарат был открыт в процессе очистки хлорохина — вещества с антималярийной активностью. Вот уже более 40 лет налидиксовая кислота применяется для лечения инфекций мочевых путей (ИМП). Она обладает умеренной активностью в отношении ряда грамотрицательных микроорганизмов и не проявляет системного действия. Введение атома фтора в химическую формулу налидиксовой кислоты положило начало новому классу химических соединений — фторхинолонам. Первые из них, в частности норфлоксацин, обладали значительно более широким спектром активности в отношении грамотрицательных микроорганизмов, но, как и препаратпрототип, не проявляли системного действия. Внедрение в клиническую практику в середине 80х гг. прошлого века ципрофлоксацина и офлоксацина открыло путь к признанию фторхинолонов во всем мире. Оба препарата проявляли высокую активность в отношении не только грамотрицательных, но и ряда грамположительных, атипичных и анаэробных микроорганизмов. Они «вывели» фторхинолоны за узкие рамки «антибиотиков для лечения ИМП» и положили начало широкому использованию препаратов этого класса для лечения инфекций разных локализаций.
Дальнейшая эволюция фторхинолонов была направлена на создание препаратов с повышенной активностью в отношении грамположительных бактерий (прежде всего пневмококков) при сохранении высокой активности в отношении грамотрицательных микроорганизмов [1]. Много внимания уделялось улучшению фармакокинетических свойств препаратов. К сожалению, ряд «новых» фторхинолонов, в том числе таких многообещавших, как тровафлоксацин, клинафлоксацин, ситафлоксацин, либо снят с производства, либо используется по весьма ограниченным показаниям. Главная проблема кроется в неприемлемом профиле безопасности этих препаратов. По этой же причине в 2008 г. в США было запрещено использование гатифлоксацина. В июле того же года ввиду повышенного риска нежелательных лекарственных реакций со стороны печени Европейское медицинское агентство рекомендовало использовать таблетки моксифлоксацина у больных с ВП только при невозможности применять другие антибиотики. Отсутствие лекарственной формы для парентерального введения и неоптимальный профиль безопасности сдерживают широкое внедрение гемифлоксацина в клиническую практику. На этом фоне левофлоксацин, завоевавший мировое признание, действительно приковывает внимание.
Попытки классифицировать фторхинолоны предпринимались неоднократно. В качестве классификационного критерия предлагали использовать сроки регистрации отдельных препаратов, спектр действия, показания к применению в клинике и другие параметры. Тем не менее общепризнанной классификации фторхинолонов сегодня не существует. Пожалуй, наиболее известным является деление этих антибиотиков на «старые» и «новые». К первым относятся норфлоксацин, пефлоксацин, ломефлоксацин, ципрофлоксацин, офлоксацин, ко вторым — левофлоксацин, моксифлоксацин, гатифлоксацин и гемифлоксацин. Другим популярным подходом к классификации фторхинолонов является разделение их на несколько поколений. В большинстве случаев различают 3 поколения препаратов [1–4]; некоторые авторы выделяют в рамках поколений подгруппы «a» и «b», а также, в зависимости от химической структуры, делят антибиотики на собственно «фторхинолоны» и «нафтиридоны» [1]. Существенные разночтения встречаются и при отнесении отдельных препаратов к тому или иному поколению. В ряде случаев трудности при классификации имеют объективные причины. Так, например, левофлоксацин представляет собой левовращающий изомер офлоксацина. С формальной точки зрения его следовало бы рассматривать вместе с ципрофлоксацином и офлоксацином. На практике он — препарат нового поколения. Левофлоксацин обладает повышенной активностью в отношении пневмококков (и в отличие от ципрофлоксацина и офлоксацина рекомендуется для лечения инфекций дыхательных путей), улучшенной фармакокинетикой (в связи с чем эффективен при назначении 1 раз в сутки) и практически 100%ной биодоступностью при приеме внутрь (что позволяет проводить ступенчатую терапию — переводить больного с инъекционной формы антибиотика на пероральную — без какойлибо корректировки дозы). Наконец, левофлоксацин, повидимому, самый безопасный из фторхинолонов [5, 6]. Для сравнения: два других фторхинолона с повышенной антипневмококковой активностью, появившиеся примерно в одно время с левофлоксацином, либо сняты с производства (грепафлоксацин [1]), либо их применение резко ограничено (спарфлоксацин).
Хинолоновая структура (рис. 1) имеет в своем ядре два шестичленных цикла, содержащих различные радикалы. Для фторированных хинолонов принципиальным является наличие атома фтора в шестом положении.
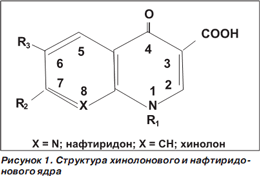
Механизм действия
В бактериальной клетке мишенями для действия фторхинолонов являются ферменты топоизомераза IV (отвечает за организацию пространственного расположения хромосомы внутри бактерии и за разделение хромосом в процессе деления клетки) и ДНКгираза (отвечает за суперспирализацию (сверхпереплетение, «упаковку») бактериальной ДНК). Каждый из этих ферментов состоит из четырех субъединиц: ДНКгираза — из двух gyrA и двух gyrB субъединиц, которые кодируются соответственно генами gyrA и gyrB, топоизомераза IV — из двух parC и двух parE субъединиц, которые кодируются генами parC и parE. Участок полипептидной цепи ДНКгиразы или топоизомеразы IV, в котором происходит связывание фторхинолона и фермента, получил название «хинолонового кармана». У грамположительных бактерий основной мишенью для действия левофлоксацина является топоизомераза IV, у грамотрицательных — ДНКгираза.
Микробиологическая активность
Грамположительные бактерии
Левофлоксацин проявляет высокую активность в отношении Streptococcus pneumoniae, причем как чувствительных, так и устойчивых (резистентных) к пенициллину штаммов. Подавляющее большинство штаммов Staphylococcus aureus, чувствительных к метициллину/оксациллину (MSSA), чувствительны к левофлоксацину, в то время как среди устойчивых к метициллину/оксациллину штаммов (MRSA) чувствительность к левофлоксацину и другим фторхинолонам сохраняют не более 20–25 % изолятов (табл. 1 [7, с изменениями]).
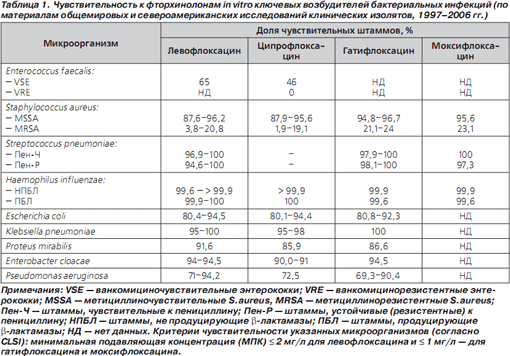
Активность «новых» фторхинолонов в отношении грамположительных бактерий превышает таковую «старых». Обычно для доказательства большей активности того или иного препарата in vitro используют величины минимальной подавляющей концентрации (МПК), не менее чем в 4 раза отличающиеся от таковых у препарата сравнения [5]. Хотя активность левофлоксацина в отношении пневмококков (независимо от их чувствительности к пенициллину) только в 2 раза выше, чем у офлоксацина и ципрофлоксацина, она находится в пределах, рекомендованных американским Институтом клинических и лабораторных стандартов (CLSI) для трактовки микроорганизмов как чувствительных к данному антибиотику. Повышенная антипневмококковая активность левофлоксацина позволила FDA (Комиссия по контролю качества продуктов питания и лекарственных средств США) первым из фторхинолонов одобрить его применение при ВП, вызванных пенициллинорезистентными пневмококками.
Фторхинолоны проявляют ограниченную активность в отношении Enterococcus faecalis. Так, среди штаммов E.faecalis, чувствительных к ванкомицину, только 65 % изолятов чувствительны к левофлоксацину и 46 % — к ципрофлоксацину.
Высокую чувствительность к левофлоксацину сохраняют Streptococcus pyogenes (99,9 % штаммов) [8, 9] и βгемолитические стрептококки группы А (99,1–100 % штаммов) [10], в то время как среди коагулазонегативных стафилококков доля чувствительных изолятов значительно меньше (54,1 %) [11].
Грамотрицательные бактерии
Фторхинолоны проявляют высокую активность в отношении распространенных возбудителей инфекций дыхательных путей — Haemophilus influenzae и Moraxella catarrhalis, причем как не продуцирующих, так и продуцирующих βлактамазы штаммов. Активность левофлоксацина в отношении Escherichia coli сопоставима с таковой других фторхинолонов (ципрофлоксацин, гатифлоксацин). Антибиотики этого класса обычно активны в отношении Klebsiella pneumoniae, хотя штаммы, вырабатывающие βлактамазы расширенного спектра действия (БЛРС), нередко проявляют устойчивость. Чувствительность Proteus mirabilis к левофлоксацину превышает 90 % и несколько выше, чем к другим фторхинолонам. Левофлоксацин и другие фторхинолоны обычно высоко активны в отношении Enterobacter cloacae (табл. 1).
Неферментирующие микроорганизмы менее чувствительны к левофлоксацину. Если активность антибиотика в отношении Pseudomonas aeruginosa (71–94,2 % чувствительных штаммов) и Stenotrophomonas maltophilia (по данным исследования SENTRY, 86 % чувствительных штаммов) [12] остается довольно высокой, то, например, среди штаммов Acinetobacter baumannii, резистентных к цефтазидиму, лишь 19,6 % сохраняют чувствительность к левофлоксацину [13].
Атипичные бактерии и анаэробы
Левофлоксацин проявляет высокую активность в отношении Chlamydophila pneumoniae, Legionella pneumophila и Mycoplasma pneumoniae, но практически не действует на анаэробов [14].
Резистентность
Возникновение устойчивости к антибиотикам этой группы связано:
1) с мутацией генов ДНКгиразы и топоизомеразы IV, локализованных в хромосоме;
2) активацией механизмов активного выведения (т.е. фторхинолоны начинают активно «выкачиваться» из бактериальных клеток; этот механизм касается в основном «старых» хинолонов).
Основой формирования резистентности к фторхинолонам являются мутации (аминокислотные замены) на участке между 67м и 106м аминокислотными остатками в области «хинолонового кармана» чувствительных ферментов, которые приводят к снижению их аффинности (сродства) к антибиотикам. В зависимости от того, в какой точке «хинолонового кармана» произошла аминокислотная замена, наблюдается разной степени выраженности повышение минимальной подавляющей концентрации антибиотика [15].
У одного и того же микроорганизма мутации в одном или двух генах могут накапливаться, поэтому формирование устойчивости носит ступенчатый характер.
В последние 10–15 лет отмечается повсеместный рост устойчивости клинически значимых бактерий к традиционно используемым антибиотикам. Тем не менее, несмотря на появление резистентности к левофлоксацину среди S.pneumoniae, она остается на стабильно низком уровне (Ј 1 %). Например, по данным исследования TRUST, за период с 2000 по 2005 г. резистентность пневмококков к левофлоксацину изменилась с 0 до 0,5 %, в то время как к клиндамицину за тот же период времени она выросла в 1,5 раза (с 12,1 до 18,6 %), а к амоксициллину/клавуланату — в 2 раза (с 6,5 до 12,9 %) [16]. Более того, если S.pneumoniae проявляли устойчивость к двум и более антибиотикам разных классов (множественная резистентность), 99,1 % из них сохраняли чувствительность к левофлоксацину (к цефуроксиму — только 18,3 %, к азитромицину — 16,8 %) [16].
Согласно данным крупных общемировых исследований, проводившихся в 1998–2005 гг., все штаммы H.influenzae и M.catarrhalis сохраняют чувствительность к левофлоксацину [7, 9, 17–21]. В то же время в микробиологических исследованиях зарегистрировано возникновение и распространение резистентности к левофлоксацину среди E.coli (5,1–15,4 %), P.aeruginosa (24,7 %), MSSA (3,4–10,1 %) и MRSA (76,6–79,2 %) [11, 22, 23].
Некоторые особенности фторхинолонов
Интерес к этому классу антибиотиков объясняется наличием у фторхинолонов целого ряда позитивных свойств. Вопервых, они, подобно βлактамам и аминогликозидам и в отличие от макролидов, оказывают быстрое бактерицидное действие в отношении большинства чувствительных к ним микроорганизмов. Этому обстоятельству придается все большее значение в связи с ростом числа больных с тяжелыми заболеваниями, а также с различными нарушениями иммунной системы [24]. Если бактериостатические антибиотики (макролиды, тетрациклины и др.) пригодны для лечения легких и среднетяжелых инфекций, то бактерицидные — для лечения заболеваний любой степени тяжести, включая самые тяжелые [24].
Вовторых, фторхинолоны, подобно макролидам и в отличие от βлактамов и аминогликозидов, проявляют высокую активность в отношении внутриклеточных возбудителей. Атипичные микроорганизмы играют значительную роль в этиологии многих распространенных инфекций, в частности ВП. При этом они часто проникают и размножаются внутри макрофагов. Пневмококки и золотистые стафилококки также могут выживать и размножаться внутри клеток [25]. Следовательно, способность уничтожать возбудителей заболеваний, находящихся внутри клеток человеческого организма, является важным достоинством антибактериальных средств.
Фторхинолоны не только хорошо проникают внутрь клеток и проявляют активность в специфических внутриклеточных условиях, как, например, низкий pH. Благодаря бактерицидному действию они имеют определенные преимущества перед бактериостатическими антибиотиками. Это утверждение можно проиллюстрировать на примере Chlamydophila pneumoniae — внутриклеточного возбудителя, существующего в репликативной и «спящей» формах. Фторхинолоны проявляют высокую активность в отношении обеих форм, в то время как бактериостатические антибиотики — только в отношении репликативной [26].
Третья особенность фторхинолонов — хорошее проникновение в органы и ткани. Например, концентрация βлактамов и аминогликозидов в тканях дыхательных путей составляет 60–70 % от их концентрации в плазме. Концентрации же фторхинолонов и макролидов в этих тканях значительно превышают плазменные.
Следующее достоинство фторхинолонов — уничтожение возбудителей с минимальным высвобождением различных компонентов бактериальных клеток. Наибольшей способностью стимулировать образование провоспалительных цитокинов обладает липополисахарид грамотрицательных бактерий. Обильное высвобождение этого эндотоксина из погибших бактерий может привести к развитию серьезных осложнений, вплоть до септического шока. Механизм действия фторхинолонов и аминогликозидов связан с нарушением синтеза соответственно ДНК и белка в микробной клетке. В результате они вызывают меньшее высвобождение эндотоксина, чем βлактамные антибиотики, которые нарушают синтез клеточных стенок бактерий [26, 27]. Некоторые компоненты клеточной стенки грамположительных бактерий, например тейхоевые и липотейхоевые кислоты, также индуцируют образование провоспалительных цитокинов, хотя способность индуцировать их выработку у грамположительной микрофлоры значительно ниже, чем у грамотрицательных микроорганизмов [28]. Тем не менее, βлактамные антибиотики, вызывающие обширную дезинтеграцию и разрывы клеточной стенки бактерий, приводят к большему высвобождению указанных кислот, чем другие классы антимикробных средств, включая фторхинолоны. В свою очередь, выраженное влияние на образование провоспалительных цитокинов может негативно сказываться на длительности сохранения симптомов заболевания [29].
В лабораторных условиях было показано, что многие антибиотики проявляют постантибиотический эффект, а также способны подавлять размножение микроорганизмов в концентрациях ниже МПК для данных возбудителей (так называемый субМПКэффект). Антимикробные препараты дозируются с тем расчетом, чтобы их концентрация в очаге воспаления превышала МПК вероятного (или установленного) возбудителя. Тем не менее, после снижения концентрации антибиотика ниже МПК рост и размножение бактерий возобновляются не сразу. Вот этот период «запаздывания» и получил название постантибиотического эффекта. Так, например, наличие постантибиотического эффекта у левофлоксацина документировано для S.pneumoniae, S.aureus, S.epidermidis, E.coli, E.faecalis, B.fragilis и других микроорганизмов [30–33], причем длительность постантибиотического эффекта в отношении S.pneumoniae, MRSA, K.pneumoniae, L.pneumophila колеблется от 2 до 4,5 ч [14]. Клиническое значение постантибиотического и субМПК эффектов еще предстоит изучить, но, как представляется, они могут быть дополнительными теоретическими обоснованиями для уменьшения кратности назначения антибиотиков.
Фармакодинамика фторхинолонов
Все антибиотики можно разделить на дозозависимые и времязависимые. Если антибактериальная активность антимикробного препарата зависит от его концентрации в очаге воспаления (так называемые дозозависимые антибиотики), то наилучшего эффекта можно добиться при использовании высоких доз препарата, примыкающих к токсическим [24]. При этом чем выше отношение максимальной (пиковой) концентрации антибиотика в плазме к величине МПК возбудителя заболевания, тем лучше. Фторхинолоны вместе с аминогликозидами, амфотерицином B и метронидазолом входят в группу дозозависимых антимикробных средств.
В последние годы было показано, что предсказать эффективность дозозависимого антибиотика можно с помощью еще одного фармакодинамического параметра — отношения площади под фармакокинетической кривой (AUC), отражающей изменение концентрации препарата за время после его введения, к МПК (или минимальной бактерицидной концентрации). В числителе нередко указывают величину AUC за промежуток времени от момента введения препарата (нулевой временной отрезок) до истечения суток (AUC24). При прочих равных условиях, чем выше AUC/МПК, тем эффективнее препарат. В исследованиях с фторхинолонами с повышенной активностью в отношении пневмококков (левофлоксацин, гатифлоксацин, моксифлоксацин, гемифлоксацин) было показано, что эрадикация (истребление) чувствительных грамположительных микроорганизмов достигается при величине AUC/МПК не меньше 30 [34]. МПК левофлоксацина для S.pneumoniae составляет 1 мг/л. При этом AUC/МПК равно 50, т.е. почти в 1,7 раза превышает необходимую величину для эрадикации пневмококков [24]. Что касается грамотрицательных микроорганизмов, то их эрадикация достигается при величине AUC/МПК не меньше 100. Все хинолоны, начиная со «старых», обеспечивают отношение AUC/МПК, которое намного превышает минимальную потребность.
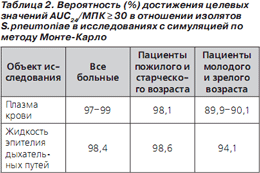
В исследованиях с симуляцией по методу МонтеКарло была продемонстрирована высокая вероятность достижения целевых величин фармакодинамических параметров в отношении пневмококков при применении левофлоксацина в дозе 750 мг 1 раз в сутки (табл. 2) [35–37].
Фармакокинетика левофлоксацина
Биодоступность левофлоксацина в таблетках по 500 и 750 мг составляет » 99 % [38].
Препарат почти не метаболизируется в печени и выводится с мочой в неизмененном виде. У больных со сниженной функцией почек необходима корректировка дозы. У больных с печеночной недостаточностью коррекция дозы не требуется [38].
Возрастные, половые и расовые различия, тяжелые внебольничные бактериальные инфекции не влияют на фармакокинетику левофлоксацина [38].
Межлекарственные взаимодействия
Всасывание левофлоксацина в желудочнокишечном тракте снижается при одновременном использовании с сукральфатом, антацидами, содержащими магний или алюминий, цинкосодержащими мультивитаминами и катионами металлов (например, железа). Поэтому между приемом антибиотика и перечисленных соединений должно пройти не менее 2 часов [38]. Ни в одном из исследований внутривенного введения левофлоксацина не изучалось его взаимодействие при одновременном использовании с перечисленными пероральными средствами. Тем не менее следует избегать введения через один катетер левофлоксацина и соединений, содержащих поливалентные катионы [38].
Применение высокодозовых кратких курсов левофлоксацина у больных с внебольничными пневмониями
В сравнительное исследование эффективности высокодозового короткого (левофлоксацин по 750 мг 1 раз в сутки в течение 5 дней) и традиционного (левофлоксацин по 500 мг 1 раз в сутки в течение 10 дней) курсов лечения были включены 528 больных с ВП разной степени тяжести (классы I–IV по шкале PSI) в возрасте і 18 лет [39]. Больные из группы 5дневной терапии в течение последующих 5 дней (то есть с 6го по 10й дни) получали плацебо антибиотика. Место лечения пациента (амбулаторно, в стационаре) определял врач исходя из конкретной клинической ситуации и класса по шкале PSI. Путь введения антибиотика (внутрь, внутривенно) также оставлялся на усмотрение лечащего врача. Первичной конечной точкой исследования была оценка клинической эффективности (излечение + улучшение) на 7–14й день после завершения лечения. Под клиническим излечением понимали исчезновение всех симптомов заболевания и отсутствие необходимости в дальнейшей антибактериальной терапии. При клиническом улучшении имело место значительное уменьшение числа и выраженности симптомов болезни, но без полного их устранения; тем не менее продолжение антибактериальной терапии не требовалось. Под клинической неудачей понимали отсутствие ответа на лечение (или неполный ответ) и необходимость в продолжении антибактериальной терапии.
Микробиологическая эффективность оценивалась по результатам культурального исследования образцов секрета дыхательных путей или крови. Различали эрадикацию (исчезновение всех возбудителей, которые были выделены при включении пациента в исследование), персистенцию (повторное выделение хотя бы одного из патогенов, выделенных при включении пациента в исследование) и неизвестность (включая больных, по разным причинам не сдавших повторные образцы биологического материала после завершения исследования).
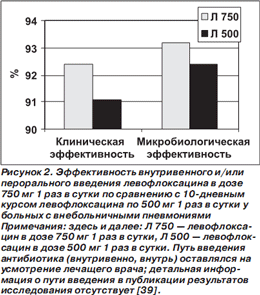
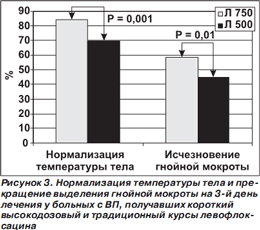
Результаты исследования представлены на рис. 2. По клинической и микробиологической эффективности высокодозовый короткий курс лечения левофлоксацином не уступал традиционному ни во всей популяции больных с ВП, ни — по данным субанализов — у больных с ВП, вызванной атипичными микроорганизмами (L.pneumophila, C.pneumoniae и/или M.pneumoniae), у больных со среднетяжелой/тяжелой ВП (III–IV классы по шкале PSI), у пациентов в возрасте ≥ 65 лет [39–42]. Более того, при анализе post hoc (то есть не спланированном заранее, а проведенном после завершения исследования) у больных из группы высокодозового курса на 3й день лечения статистически значимо чаще регистрировали нормализацию температуры тела и прекращение выделения гнойной мокроты (рис. 3).
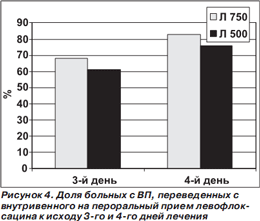
Не выявлено существенных различий между сравниваемыми режимами терапии в сроках перевода больных, которым антибиотик сразу вводился внутривенно, на пероральный прием препарата (рис. 4).
По данным субанализа, у больных с ВП, вызванной атипичными микроорганизмами, клиническая эффективность короткого высокодозового курса левофлоксацина составила 95,5 %, традиционного — 96,5 % (95%ный доверительный интервал –6,8… +8,8) [40]. Таким образом, установлена высокая эффективность кратких курсов приема левофлоксацина в высокой дозе у категории пациентов, которым традиционно рекомендуется более длительный прием антибиотиков (до 14–21 суток по сравнению с 7–10 днями при ВП, вызванных типичными патогенами — S.pneumoniae, H.influenzae и др.).
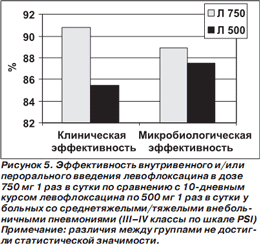
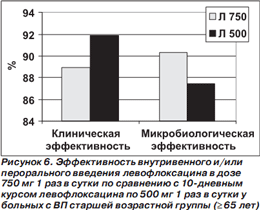
Результаты субанализов у больных со среднетяжелой/тяжелой ВП (III–IV классы по шкале PSI) и у пациентов в возрасте ≥ 65 лет представлены на рис. 5, 6.
Применение высокодозовых кратких курсов левофлоксацина у больных с острым бактериальным синуситом
В сравнительное исследование эффективности высокодозового короткого (левофлоксацин по 750 мг 1 раз в сутки в течение 5 дней) и традиционного (левофлоксацин по 500 мг 1 раз в сутки в течение 10 дней) курсов лечения были включены 780 больных с ОБС в возрасте > 18 лет [43]. Все пациенты получали антибиотики внутрь. Больные из группы 5дневной терапии в течение последующих 5 дней (то есть с 6го по 10й дни) получали плацебо антибиотика. При микробиологическом исследовании материала чаще других выделяли S.pneumoniae, H.influenzae и S.aureus. Результаты исследования представлены на рис. 7.
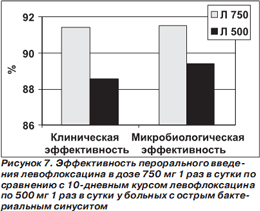
Установлено, что высокодозовый короткий курс левофлоксацина у больных с ОБС не уступает по эффективности традиционному 10дневному курсу. К недостаткам исследования можно отнести позднюю оценку эффективности вмешательства (на 17–24й день от начала лечения). Поскольку для больных с ОБС характерна высокая частота спонтанного излечения, определить действительный вклад антибиотика в достижение излечения или улучшения затруднительно [43].
Осложненные инфекции мочевыводящих путей и острый пиелонефрит
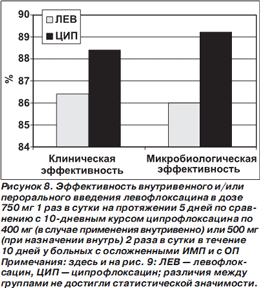
В сравнительное исследование эффективности высокодозового короткого курса левофлоксацина по 750 мг 1 раз в сутки в течение 5 дней и традиционного курса ципрофлоксацина по 400 мг (в случае применения внутривенно) или 500 мг (при назначении внутрь) 2 раза в сутки в течение 10 дней были включены 782 больных с осложненными ИМП (ОИМП) и 311 пациентов с ОП в возрасте > 18 лет [44]. Обязательным условием включения было обнаружение > 105 колониеобразующих единиц (КОЕ) одного или двух уропатогенов при посеве мочи. Рандомизация больных производилась с учетом диагноза (ОИМП или ОП), условий лечения (амбулаторно или в стационаре) и наличия или отсутствия катетера в мочевыводящих путях. Выбор пути введения антибиотика (внутрь, внутривенно) оставлялся на усмотрение лечащего врача. Первичной конечной точкой исследования была оценка микробиологической эффективности (частота эрадикации возбудителей) на 15–22й день от начала лечения.
Установлено, что высокодозовый короткий курс левофлоксацина у больных с ОИМП и ОП не уступает по эффективности традиционному 10дневному курсу лечения ципрофлоксацином (рис. 8). При наличии катетера в мочевыводящих путях частота эрадикации возбудителей была статистически значимо ниже, чем у больных без катетеров. При этом у больных с катетеризированными мочевыводящими путями, получавших левофлоксацин, частота эрадикации возбудителей статистически значимо превышала таковую по сравнению с пациентами, получавшими ципрофлоксацин [44].
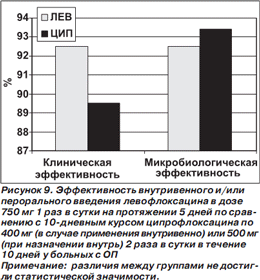
Результаты исследования у больных с ОП представлены на рис. 9 [45]. Полученные данные не отличались от таковых в общей группе больных с осложненными ИМП и ОП.
К ограничениям исследования можно отнести оценку клинической и микробиологической эффективности в одни и те же сроки вне зависимости от продолжительности лечения, что могло стать аргументом в пользу предпочтения более длительного курса. Кроме того, обязательная микробиологическая верификация этиологии заболевания могла привести к тому, что в исследование включались более тяжелые пациенты, что, в свою очередь, не исключало недооценку эффективности обоих тестировавшихся антибиотиков [44].
Переносимость кратких высокодозовых режимов применения левофлоксацина
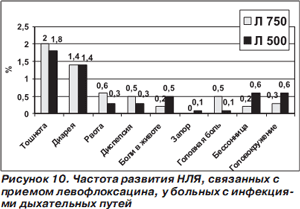
Высокодозовый короткий режим лечения левофлоксацином хорошо переносится больными. По данным анализа переносимости высокодозового короткого (1141 человек) и традиционного (3268 больных) режимов применения левофлоксацина у больных с инфекциями дыхательных путей, частота нежелательных лекарственных явлений (НЛЯ), которые, по мнению врачейисследователей, определенно, возможно или вероятно были связаны с приемом антибиотика, не различалась в обеих группах (соответственно 8 и 7,6 %). Перечень и частота возникновения НЛЯ представлены на рис. 10. Статистически значимые различия по частоте развития установлены только в отношении головной боли, которая, к тому же, регистрировалась очень редко [46].
При лечении левофлоксацином описаны редкие случаи возникновения НЛЯ, характерных для приема фторхинолоновых антибиотиков: диарея, вызванная Clostridium difficile; поражение сухожилий; полинейропатия; реакции повышенной чувствительности и др. Хотя фторхинолоны способны увеличивать длительность интервала QT на электрокардиограмме, ни в клинических, ни в постмаркетинговых исследованиях левофлоксацина не было зарегистрировано ни одного случая тахикардии по типу «пируэт» (torsade de pointes) [38, 46]. В исследованиях III фазы не выявлено различий в переносимости левофлоксацина у лиц старшей возрастной группы по сравнению с больными молодого и зрелого возраста [38]. Частота отказов от продолжения лечения в связи с возникновением НЛЯ, связанных с приемом левофлоксацина, у больных с инфекциями дыхательных путей составила 1,5–1,6 % [46].
Способ применения левофлоксацина
Внутривенно левофлоксацин вводится путем медленной инфузии длительностью не менее 60–90 мин (в зависимости от дозы). Таблетки антибиотика можно применять вне зависимости от приема пищи. В то же время жидкие лекарственные формы левофлоксацина для приема внутрь следует принимать за 1 ч до или спустя 2 ч после приема пищи. Вне зависимости от пути введения препарата для предупреждения образования высококонцентрированной мочи следует обеспечить адекватную гидратацию организма [38].
У больных с нарушенной функцией почек, получающих левофлоксацин в дозе 750 мг, дозирование корректируется следующим образом. При клиренсе креатинина 20–49 мл/мин препарат вводится по 750 мг каждые 48 ч; при клиренсе креатинина 10–19 мл/мин, а также у больных на гемодиализе или хроническом амбулаторном перитонеальном диализе сначала вводится доза 750 мг, затем — по 500 мг каждые 48 ч.
У больных ≥ 65 лет препарат применяют с осторожностью в случаях одновременного приема антиаритмических средств класса IA или III (опасность удлинения интервала QT) и глюкокортикоидов (повышенный риск поражения сухожилий) [38].
У больных с сахарным диабетом, получающих пероральные гипогликемические средства или инсулин, следует периодически контролировать уровень гликемии (во избежание гипергликемии или гипогликемии с соответствующей симптоматикой, описанных при одновременном использовании фторхинолонов, включая левофлоксацин).
Обсуждение
Применение кратких высокодозовых курсов левофлоксацина способствует не только повышению удобства при лечении, но и снижению риска возникновения резистентности по сравнению с использованием низких доз в течение более длительного периода времени (например, по 500 мг на протяжении 10 дней) [47–49].
Распространение штаммов E.coli, Klebsiella spp. и других бактерий, вырабатывающих bлактамазы расширенного спектра действия, ограничило возможности использования антибиотиков. Чаще других в подобных случаях назначаются карбапенемы (монотерапия) или комбинация фторхинолонов с аминогликозидами. Данные о значимости продукции БЛРС противоречивы. Если в одних публикациях утверждается, что клиническая эффективность антибиотиков при инфекциях, вызванных продуцирующими и не продуцирующими БЛРС штаммами E.coli и Klebsiella spp. не различается, а сама продукция БЛРС не является независимым фактором риска клинической неудачи [50], то в других указывается на значительное увеличение стоимости лечения инфекций (не ИМП), вызванных продуцирующими БЛРС штаммами E.coli и Klebsiella spp. (главным образом изза возрастания длительности пребывания больных в стационаре) [51]. По данным немногочисленных и небольших по объему исследований активность левофлоксацина в отношении продуцирующих БЛРС штаммов E.coli и Klebsiella spp. снижается, однако этот вопрос нуждается в дальнейшем изучении [8].
Перечисленные сравнительные исследования высокодозовых кратких и традиционных курсов лечения левофлоксацином были спланированы таким образом, чтобы доказать, что один режим не уступает по эффективности другому. Полученные результаты нельзя распространять на иные нозологические формы заболеваний. Точно так же эффективность высокодозовых кратких курсов лечения левофлоксацином по сравнению с другими антибиотиками, которые используются для лечения ВП, ОБС, осложненных ИМП и ОП, еще только предстоит установить.
Заключение
Левофлоксацин — фторхинолон с повышенной активностью в отношении пневмококков, который в отличие от ципрофлоксацина и офлоксацина рекомендуется для лечения инфекций дыхательных путей. Он обладает улучшенной фармакокинетикой (в связи с чем эффективен при назначении 1 раз в сутки) и практически 100%ной биодоступностью при приеме внутрь (что позволяет проводить ступенчатую терапию — переводить больного с инъекционной формы антибиотика на пероральную — без какойлибо корректировки дозы). Левофлоксацин имеет высокий профиль безопасности, что выгодно отличает его от других фторхинолонов с повышенной антипневмококковой активностью (в 2008 г. в США прекращено использование гатифлоксацина, а Европейское медицинское агентство рекомендовало не применять моксифлоксацин в таблетированной форме).
В последние годы для лечения ряда инфекций с успехом используют короткие курсы лечения левофлоксацином в высокой дозе. Они были предложены для повышения бактерицидной активности антибиотика (которая зависит от его концентрации) и снижения риска возникновения резистентности. В США такие курсы (прием левофлоксацина в дозе 750 мг 1 раз в сутки на протяжении 5 дней) официально одобрены для лечения больных > 18 лет с внебольничными пневмониями, острым бактериальным синуситом, а также с осложненными инфекциями мочевых путей и острым пиелонефритом у людей с нормальной функцией почек (клиренс креатинина > 50 мл/мин).
Клиническая и микробиологическая эффективность коротких высокодозовых курсов левофлоксацина при указанных заболеваниях продемонстрирована в сравнительных исследованиях с традиционным (10дневным) курсом лечения левофлоксацином (при внебольничных пневмониях и остром бактериальном синусите) и ципрофлоксацином в стандартных дозировках (при осложненных инфекциях мочевых путей и остром пиелонефрите). При этом у больных с внебольничной пневмонией из группы высокодозового курса на 3й день лечения статистически значимо чаще регистрировали нормализацию температуры тела и прекращение выделения гнойной мокроты.
Внедрение в клиническую практику коротких высокодозовых курсов левофлоксацина при вышеуказанных инфекциях дыхательных и мочевыводящих путей будет способствовать повышению удобства и эффективности лечения и снижению риска селекции резистентности в процессе лечения.
1. Ball P. Quinolone generations: natural history or natural selection? // J. Antimicrob. Chemother. 2000; 46 (Suppl. Topic T1): 17-24.
