Журнал «Болезни и антибиотики» 2 (2) 2009
Вернуться к номеру
Сокращенные курсы антибактериальной терапии амоксициллином острого максиллярного риносинусита у лиц молодого возраста. Анализ клинического опыта
Авторы: Гучев И.А., к.м.н., начальник терапевтического отделения; Колосов А.В., старший ординатор оториноларингологического отделения ФГУ «421-й военный госпиталь МВО» МО РФ, г. Смоленск
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
ра в лечении острого бактериального риносинусита (ОБРС). Длительность антибактериальной терапии (АТ) ОБРС определена в пределах 7–14 сут. В то же время ограниченное число исследований демонстрирует сравнимую эффективность коротких 5-суточных курсов АТ. Преимущество подобного подхода заключается в уменьшении риска распространения устойчивости среди респираторных патогенов и в повышении комплайентности пациентов.
Цели. Первичная: оценка эффективности 5–7-суточных режимов АТ ОБРС амоксициллином (АМО). Вторичная: определение чувствительности бактериальных возбудителей ОБРС.
Материалы и методы. Под наблюдением находились пациенты 18–28 лет с легким и среднетяжелым, согласно определению степени тяжести EPOS 2007, острым максиллярным риносинуситом, не принимавшие антибактериальные препараты (АБ) в предшествующие 6 нед. и с длительностью симптоматики ≥ 7 сут. В течение 5 сут. проводилась АТ амоксициллином 0,5 г 3 раза в сутки с оценкой динамики симптомов в день предполагаемого окончания АТ. Критерии прекращения АТ: нормотермия ≤ 37,1 оС, устойчивое снижение симптомов ОБРС не менее 3 сут. Состояние пациентов и симптомы нежелательных реакций (НР) оценивались на момент поступления и ежедневно до выписки из стационара на 15–21-е сут.; рентгенологическое исследование выполнено в момент поступления и при необходимости на 10–12-е сут. При ранней неэффективности АТ (3 сут.) назначался амоксициллин/клавуланат (АКК) 625 мг 3 раза в сутки. В отсутствие критериев для отмены АБ на
5-е сут. терапия АМО продолжалась до 7, а при необходимости — до 10 сут. При пункции максиллярного синуса, выполненной до начала АТ, производился забор материала для бактериологического исследования, проводимого в соответствии с рекомендациями СLSI-2007.
Результаты. Включено 112 пациентов в возрасте 19,4 ± 1,4 года. Клиническая эффективность АМО составила 94,6 % (106/112), в группе сокращенной АТ — 89,3 % (100/112). Средняя длительность АТ в группе клинической эффективности (n = 106) — 5,3 ± 0,4 (Q3 = 5) сут. Возбудители как в монокультуре, так и в ассоциациях выделены у 55 % (62/112). В монокультуре преобладали Haemophilus influenzae (29 %; 32/112) и Streptococcus pneumoniae (12 %; 13/112); их ассоциация выявлена в 3,6 % (4/112), а сочетание H.influenzae с другими микроорганизмами — в 1,8 % (2/112) случаев. Чувствительность H.influenzae к ампициллину и АКК составила соответственно 94 и 100 %, S.pneumoniae к оксациллину (ОХА) и эритромицину — 82 и 100 %. 6 случаев неэффективной АТ было связано с H.influenzae, 2 — со S.pyogenes, 1 — с чувствительными к ОХА S.pneumoniae, 1 — с K.pneumoniae и 1 — с P.fluorescens. В 1 случае возбудитель не выделен. В 2 случаях, связанных с устойчивыми к ампициллину H.influenzae, отмечена ранняя неэффективность на 3-и сут., в остальных лечение АМО продолжалось до 10 сут. с эффектом. Частота легких НР, не требующих отмены АБ, достигла 9,8 %.
Выводы. Основная роль в этиологии ОБРС у лиц молодого возраста из организованных коллективов принадлежит H.influenzae и в меньшей степени — S.pneumoniae, для которых характерна высокая чувствительность к амоксициллину. Сокращенные до 5 сут. курсы АТ амоксициллином характеризуются 89% клинической эффективностью, превышающей продемонстрированный в предшествующих работах эффект плацебо. Это позволяет рекомендовать их для широкого применения у лиц молодого возраста, не имеющих факторов риска инфицирования антибиотикоустойчивыми возбудителями. Возможность неограниченного доступа к медицинскому обеспечению определяет безопасность сокращенного курса АТ АМО.
Амоксициллин, амоксициллин/клавуланат, антибактериальные препараты, антимикробная терапия, военнослужащие, ко-амоксиклав, неэффективность терапии, организованный коллектив, острый риносинусит, этиология, Haemophilus influenzae, Streptococcus pneumoniae.
Введение
Острый риносинусит (ОРС) занимает одно из ведущих мест в структуре инфекций дыхательных путей (ИДП). В России доля лиц с ОРС, госпитализируемых в ЛОРотделения, достигает 36 % [1]. Антимикробные препараты (АМП) занимают основное место в терапии острого бактериального риносинусита (ОБРС). В США частота применения антибактериальных препаратов (АБ) при ОРС достигает 80 % [2], в Европе — 72–92 % [3–6]. По мнению ведущих экспертов, столь частое их назначение является необоснованным, так как значительное число случаев заболевания связано с вирусной инфекцией [3, 5, 6].
Как и при других внебольничных ИДП, основные бактериальные возбудители ОРС представлены H.influenzae и S.pneumoniae. Несколько меньшая роль принадлежит M.catarrhalis и метициллиночувствительному Staphylococcus aureus [7]. В организованных коллективах возможно увеличение частоты bгемолитических стрептококков. Особенностью бактериальных возбудителей является вариабельность чувствительности к АБ. В последние десятилетия отмечается повсеместный рост устойчивости S.pneumoniae к макролидам и тетрациклину, H.influenzae и M.catarrhalis — к незащищенным аминопенициллинам [8–11].
В условиях неблагоприятной динамики резистентности важное значение приобретает выбор АБ. В современных рекомендациях, посвященных проблемам нетяжелых форм ОРС, в качестве средств выбора предлагаются амоксициллин (АМО), амоксициллин/клавуланат (АКК) и цефалоспорины. При определенных условиях оправданно применение респираторных фторхинолонов и макролидов [12–16]. Исходя из особенностей этиологии и невысокого уровня устойчивости основных возбудителей ОБРС в России, следует признать, что АМО удовлетворяет требованиям, предъявляемым к препаратам выбора, но только частично. Возможности препарата ограничиваются в присутствии штаммов M.catarrhalis, H.influenzae и S.aureus, синтезирующих βлактамазы.
Одним из важных вопросов ведения ОБРС является определение оптимальной длительности антибактериальной терапии (АТ). Отсутствие достаточного количества исследований не позволяет уверенно ответить на вопрос об эффективности сокращенных курсов АТ. В связи с этим длительность последней в большинстве руководств определена в пределах 7, но чаще — 10–14 сут. [17]. Лишь немногие специалисты рассматривают возможность 5суточных курсов АТ [18–21]. Целью настоящего исследования явилась оценка эффективности 5–7суточных режимов АТ АМО у лиц молодого возраста, не имеющих факторов риска резистентной флоры и сопутствующей патологии.
Материал и методы
Пациенты
Ранее здоровые лица 18–28 лет с легкой и среднетяжелой формой максиллярного ОРС [22, 23] получали АТ диспергируемой формой амоксициллина длительностью до 10 сут. В качестве отличительных признаков бактериального риносинусита от острой респираторной вирусной инфекции, сопровождающейся экссудацией в синусах, использовались такие симптомы, как длительность заболевания ≥ 7 сут. или двухфазное течение с ухудшением через 5 сут. и более от момента первых проявлений ОРС. В анализ не включались пациенты: 1) принимавшие АБ в предшествующие 6 нед.; 2) с анамнестическими указаниями на непереносимость амоксициллина или анафилактические реакции на пенициллин; 3) страдающие поллинозом и бронхиальной астмой; 4) с хроническим синуситом; 5) нуждающиеся в использовании топических назальных и системных кортикостероидов.
Проводимая терапия
Амоксициллин (диспергируемая форма) внутрь по 500 мг 3 раза в сутки длительностью до 10 сут.
При значительном улучшении или исчезновении симптоматики и при отсутствии гипертермии спустя 5 сут. от начала приема антибиотика АТ прекращалась. При положительной динамике, но сохранении гипертермии ≥ 37,2 oC либо незначительной положительной динамике болевого симптома/болезненности на 5е и 7е сут. АТ пациент продолжал прием АМО до 10 сут.
В отсутствие клинического эффекта или при ухудшении клинического состояния пациента на 3и — 4е сут. АТ осуществлялся перевод на лечение амоксициллином/клавуланатом внутрь по 625 мг 3 раза в сутки.
В качестве дополнительной симптоматической терапии всем пациентам назначались назальные деконгестанты (нафазолин, ацетаминофен, псевдоэфедрин), при выраженном болевом синдроме — нестероидные противовоспалительные препараты (ибупрофен, диклофенак) и при наличии трудно отделяемого густого секрета — ацетилцистеин по 600 мг/сут длительностью до 5 сут.
Методы этиологической диагностики
Забор материала для бактериологического исследования осуществлялся методом пункции максиллярного синуса. В течение 1,5 ч материал доставлялся в лабораторию НИИ антимикробной химиотерапии Смоленской государственной медицинской академии на транспортных средах (модифицированная среда Дорсэ и среда Трансгроу), где дискодиффузионным методом и в соответствии с рекомендациями Института по клиническим лабораторным стандартам США (CLSI, 2007) [24] проводилось бактериологическое исследование на анаэробную и аэробную флору. Оценивалась чувствительность H.influenzae к ампициллину, амоксициллину/клавуланату, левофлоксацину; чувствительность S.pneumoniae к пенициллину (OXA), эритромицину, левофлоксацину, триметоприму/сульфаметоксазолу, тетрациклину.
Оценка клинической эффективности
Состояние пациентов оценивалось на момент поступления и ежедневно на протяжении 5–7 сут. Регистрация данных для дальнейшего анализа произведена на 3и, 5, 7, 10, 12 и 15е сут. Рентгенологическое исследование выполнялось при поступлении и, в случае сохранения фациальной боли/болезненности, гноетечения из устьев пазух, на 10–12е сут.
Симптомы ОРС (гнойное отделяемое при передней риноскопии, боль и болезненность при перкуссии над проекцией синуса, заложенность носа, гипосмия, отечность мягких тканей лица, головная боль) оценивались по следующей шкале: 0 — отсутствуют, 1 — слабо выраженные, 2 — выраженные, 3 — сильно выраженные.
Заключительная оценка клинической эффективности АТ выполнена на 15е сут. Использованы следующие критерии: «эффективен» (исчезновение или почти полное исчезновение всех субъективных и объективных признаков ОРС, возможность прекращения АТ на 5–7е сут.), «неэффективен» (отсутствие эффекта через 3 сут. АТ; персистенция, ухудшение первоначально выявленных симптомов через 7 сут. АТ; появление новых симптомов (рецидив или реинфекция), потребовавших назначения альтернативного или дополнительного АБ; появление новых очагов инфекции) или «невозможно оценить» (невозможность получения достаточных для анализа данных).
Статистическая обработка
Описательная статистика проведена на 3и, 5, 7, 10, 12 и 15е сут. от момента включения пациента в исследование. Сравнение характеристик исходного состояния пациентов выполнялось с использованием критерия cквадрат или точного критерия Фишера для качественных характеристик, с использованием tкритерия Стьюдента или рангового критерия Вилкоксона для количественных характеристик.
Этические нормы
В связи с соответствием методов диагностики и лечения общепринятым принципам ведения пациентов с ОРС одобрения этического комитета не требовалось.
Результаты исследования
За период от начала исследования были осмотрены 147 человек, жалобы которых могли быть обусловлены ОБРС. В исследование были включены и завершили его 112 пациентов в возрасте 19,4 ± 1,4 года. Пациенты, отнесенные в группы эффективной (группа 1, n = 100) и неэффективной (группа 2, n = 12) сокращенной АТ, не различались по демографическим признакам, в том числе стажу табакокурения и наличию сопутствующей, не препятствующей разрешению заболевания патологии ЛОРорганов. Частота повторных санационных пункций составила: в группе 1 — 1,2; 0,7 (от 0 до 2; 3й квартиль 2) и в группе 2 — 2.
Результаты микробиологического исследования содержимого 125 максиллярных синусов представлены в табл. 1.
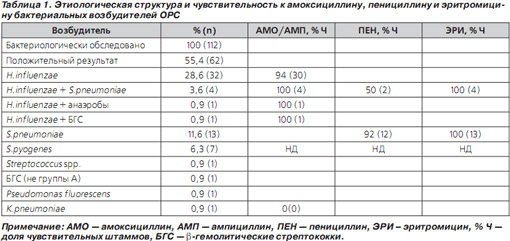
Бактерии как в монокультуре, так и в ассоциациях выделены у 55 % пациентов (62/112). В монокультуре преобладали H.influenzae (28,6 %; 32/112) и S.pneumoniae (11,6 %; 13/112); ассоциация данных возбудителей выявлена в 3,6 % (4/112), а сочетание H.influenzae с другими микроорганизмами — в 1,8 % (2/112) случаев. Чувствительность H.influenzae к ампициллину и АКК составила 94 и 100 %, S.pneumoniae к пенициллину и эритромицину — 82 и 100 % соответственно (табл. 1). В итоге АМО по спектру активности перекрыл возбудителей ОБРС в популяции лиц с уточненным этиологическим диагнозом на 94 % (58/62).
Средняя длительность АТ в группе 1 составила 5,3; 1,1 (3й квартиль = 5) сут., а среди всех исследуемых пациентов — 5,6; 1,5 (минимум 3, максимум 10) сут. Клиническая эффективность АМО составила 94,6 % (106/112). Клиническая эффективность сокращенного курса АТ — 89,3 % (100/112). 6 случаев неэффективности АТ (группа 2) связано с H.influenzae, 2 — со S.pyogenes, 1 — с чувствительными к пенициллину (ПенЧ) S.pneumoniae, 1 — с Klebsiella pneumoniae и 1 — с Pseudomonas fluorescens. В 1 случае возбудитель, в том числе при повторной пункции на 3и сут. АТ, не выделен. В 2 случаях ОБРС, ассоциированных с устойчивыми к ампициллину H.influenzae, констатирована ранняя неэффективность АТ, в остальных лечение АМО продолжалось до 10 сут. с эффектом, несмотря на связь заболевания с нечувствительными к препарату микроорганизмами в 2 случаях (Klebsiella pneumoniae и Pseudomonas fluorescens) (табл. 1).
Достоверных различий в динамике клинических проявлений ОРС в группах эффективной и неэффективной АТ не выявлено, за исключением гипертермии на 3и и 5е сут., субъективного ощущения тяжести в проекции синуса на 1е и 3и сут., а также гипосмии на 3и сут. АТ. В бактериологически определенной группе не выявлено различий в клинических проявлениях на момент включения и в динамике заболевания при стратификации по типу возбудителя, в том числе при включении смешанной гемофильной и пневмококковой инфекции в группу пневмококка или гемофильной палочки.
Обсуждение
Эффективность применения АБ при нетяжелых формах ОРС до сих пор является проблемой, открытой для обсуждения и изучения [25]. Это связано прежде всего с высокой частотой вирусной этиологии заболевания, склонного к спонтанному разрешению. Традиционные критерии бактериального ОРС, например длительность симптомов более 7 и даже 10 сут., наличие гнойного отделяемого и лихорадка > 38 oC, не являются надежным основанием для постановки достоверного диагноза ОБРС и, следовательно, для определения показаний к назначению АТ [25, 26].
В данной ситуации сравнительные исследования, посвященные оценке эффективности различных АБ или плацебо при ОРС, не способны в полной мере выявить реальную эффективность, достигаемую при проведении АТ [27, 28]. Более того, ранее уже неоднократно было продемонстрировано отсутствие значительных преимуществ АТ перед плацебо [29–33] или назальными кортикостероидами [34–37] у лиц с нетяжелым ОРС [26, 33]. Показано, что клиническая эффективность различных АБ при нетяжелых формах ОРС достигает в среднем 81–90 % и более, что ненамного превышает почти 80%ную эффективность плацебо [29, 38].
Однако следует отметить и слабое место работ, демонстрирующих незначительную роль АБ в лечении ОРС. В частности, в метаанализе J. Young и соавт. [25] показано отсутствие кардинальных преимуществ АБ перед плацебо при нетяжелых формах ОРС, наблюдаемых в амбулаторных условиях, где методы выявления бактериальных форм заболевания ограничены и имеется недостаток времени и возможностей для наблюдения за больным. Авторы обратили внимание, что в группе лиц, не получающих АБ по поводу ОРС, к 14м суткам от начала заболевания выздоравливают 37–68 % пациентов, что подтверждается и другими исследователями [25, 26, 39]. Для достижения эффекта от АТ препарат необходимо назначить 15 пациентам с симптомами ОРС и 8 пациентам, имеющим ключевой признак ОРС — гнойное отделяемое по задней стенке носоглотки [25].
В то же время следует вспомнить об обстоятельствах, в которых выполнялись включенные в метаанализ исследования. Большинство из них проводилось в 2000–2005 гг., когда уровень устойчивости пневмококка к пенициллину, макролидам и доксициклину в США превышал 20–35 %. Различные уровни резистентности наблюдались и в странах Европы [40–43]. Включение в метаанализ [25] исследований, в которых использовались неэффективные против устойчивых микроорганизмов препараты (амоксициллин, пенициллин, доксициклин, азитромицин), не позволяет полностью доверять приведенным результатам, так как в ряде случаев активность АБ не превышала эффект плацебо. Вполне очевидно, что применение препаратов, активных против большинства возбудителей ОБРС, в том числе и устойчивых, будет более эффективным.
Можно констатировать, что высокая частота выздоровления в нашем исследовании была обусловлена именно благоприятным профилем чувствительности пневмококка и гемофильной палочки, превышающим подобные показатели в эпидемиологически неблагоприятных регионах. Нельзя исключить, что высокая 95%ная эффективность АТ может быть связана и с высокой частотой спонтанного разрешения на фоне адекватного дренажа синусов. Этот факт подтверждается эффективностью терапии в случаях, когда выделенный из синусов микроорганизм характеризовался устойчивостью к АМО.
В исследовании нам удалось подтвердить эффективность сокращенных до 5 сут. режимов АТ АМО. Возможность подобного подхода при нетяжелых формах заболевания неоднократно подчеркивалась ведущими специалистами. Одинаковая эффективность 3 и 10суточных курсов терапии ОРС котримоксазолом продемонстрирована в работе J. Williams, выполненной в период благоприятного профиля чувствительности к препарату основных возбудителей ОБРС [28]. Сравнимый с длительными курсами эффект 5суточного режима терапии АКК продемонстрирован N. Ratau и соавт. [44]. В данном случае следует отметить, что дополнительный эффект ингибитора bлактамаз отсутствовал при этиологической роли пневмококка и непродуцирующей βлактамазы H.influenzae. Одинаковая эффективность подтверждена для 5 и 10суточных курсов АТ гатифлоксацином [45], 3суточного курса АТ фармакологически субоптимальным при ОРС азитромицином по сравнению с 10суточным приемом АКК [46], а также для других, преимущественно бактерицидных, препаратов [21, 47–50].
В ходе настоящего исследования подтверждена ключевая роль чувствительных штаммов H.influenzae и S.pneumoniae в развитии ОБРС. Устойчивые к ампициллину (вероятно, исключительно за счет продукции βлактамаз) штаммы H.influenzae выделены в 5 % (2/40) случаев. Учитывая, что этиологическая структура определяет выбор АБ, вполне адекватно рассматривать 5суточные режимы АТ АМО как допустимые при нетяжелых формах ОБРС у лиц молодого возраста, не имеющих факторов риска инфицирования устойчивыми возбудителями. Основанием для такого предположения являются данные, свидетельствующие о санирующем эффекте АБ, достигающих высоких концентраций в полости синусов, уже с 1–3х сут. приема [47, 49, 51, 52].
Весомым аргументом в пользу адекватности сокращенных курсов АТ АМО является и продемонстрированный в ряде российских и зарубежных исследований благоприятный профиль чувствительности возбудителей ОБРС. В частности, показано, что АМО, обладающий быстрым бактерицидным эффектом, сохраняет свои позиции в ряду активных антипневмококковых препаратов [53, 54]. Хотя проблема резистентности не обошла и H.influenzae, устойчивость, связанная с продукцией βлактамаз или изменением пенициллинсвязывающих белков, в Российской Федерации, тем более у лиц молодого возраста [55], не распространена (3–11 % случаев) [54, 56–58]. Активность препарата сохраняется и в отношении актуального для лиц молодого возраста возбудителя ОБРС — S.pyogenes [59].
Сокращенные курсы АТ АМО практически не исследовались при ОРС и в то же время достаточно хорошо исследованы при внебольничной пневмонии. В последнем случае 3–4суточный прием АМО и цефалоспоринов обеспечивал сравнимую с традиционными курсами АТ эффективность [60–65]. Результаты подобных исследований еще требуют дальнейших подтверждений и не могут быть перенесены на случаи ОРС. Тем не менее есть все основания полагать, что использование критерия продолжительности АТ в виде дополнительных 7 сут. терапии после достижения выраженного клинического улучшения [66] не имеет под собой достаточных оснований.
Достигаемые при сокращении длительности АТ преимущества находят подтверждение в современных исследованиях [15]. В частности, в широко цитируемой работе P. Kardas показано, что применение АБ до 7 сут. сопровождается лучшими показателями комплайентности, чем более длительные режимы [67], в том числе за счет снижения частоты НР.
Выводы
1. Основными возбудителями ОБРС у лиц молодого возраста являются непродуцирующие βлактамазы H.influenzae (58 %; 36/62) и чувствительные к амоксициллину S.pneumoniae (27 %; 17/62).
2. По спектру активности амоксициллин перекрывает возбудителей ОБРС в популяции лиц с уточненным этиологическим диагнозом на 94 % (58/62).
3. Сокращенные до 5 сут. курсы АТ максиллярного ОРС амоксициллином обеспечивают 89%ную клиническую эффективность в условиях низкой распространенности устойчивых возбудителей.
