Журнал «Болезни и антибиотики» 2 (2) 2009
Вернуться к номеру
Укусы собак и кошек: эпидемиология, микробиология, клиника, лечение
Авторы: Березняков В.И., Городская клиническая больница № 20, г. Харьков
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
Содержание домашних животных — явление весьма распространенное во всем мире. В настоящее время в одних только США в качестве домашних питомцев зарегистрировано около 75 млн собак и 88 млн кошек. Вместе с хозяевами домашние животные проживают более чем в 60 % домов или квартир. В Великобритании количество домашних животных, которыми владеют обитатели более 40 % домов и квартир, достигает 27 млн.
Однако при столь близком соседстве домашних животных и людей возрастает риск укусов с возможной передачей пострадавшему различных инфекционных агентов. Каждый второй американец в течение жизни становится жертвой укусов животных. В 2001 г. в США более 350 000 человек были госпитализированы изза укусов собак. Ежегодные затраты на медицинское обслуживание пациентов, искусанных собаками, оцениваются ориентировочно в 165 млн долларов.
Эпидемиология
Среди всех укусов животных более двух третей случаев приходится на долю собак, 10–20 % — кошек. Жертвами укусов кошек чаще всего оказываются женщины и пожилые люди.
Среди собак в списке агрессоров лидируют питбультерьеры, за ними следуют представители таких пород, как ротвейлер и немецкая овчарка. Крупные собаки могут причинить значительные увечья, поскольку располагают мощными челюстями. Нередко жертвами укусов становятся маленькие дети, которых кусают собаки непривязанные либо с ненадетыми намордниками. Наибольшему риску подвержены мальчики в возрасте от 5 до 9 лет. Играя или дразня животное, дети легко могут спровоцировать нападение. Изза своего небольшого роста дети часто становятся жертвами укусов за лицо, шею или голову.
У взрослых людей чаще встречаются укусы за голову, в частности лицо, шею, за конечности. Укусы кошек обычно локализуются на лице или конечностях, являются менее травматичными и, как правило, не угрожают жизни. Однако острые и тонкие зубы кошек наносят более глубокие раны по сравнению с зубами собак, увеличивая тем самым риск возникновения инфекции в ране и развития абсцесса мягких тканей. В тех случаях, когда место укуса располагается вблизи суставов и костей, возможны осложнения в виде септического артрита или остеомиелита. У пациентов, обратившихся за медицинской помощью спустя 8 часов после укуса, чаще возникают инфекционные осложнения. В таких случаях при укусах кошек инфекция развивается быстрее, нежели при укусах собак.
В целом при укусах собак инфекция развивается в 15–20 % случаев. Риск инфекции наибольший при колотых ранах, размозжении тканей и укусах за руку. Инфекция при укусах собак обычно проявляется локализованным целлюлитом, хотя возможно появление и региональной лимфаденопатии, лимфангита и лихорадки.
Микробиология
В большинстве инфицированных укушенных ран обнаруживают аэробов и анаэробов с кожи пациента и из пасти укусившего его животного (табл. 1). При укусах кошек чаще всего выделяются такие микроорганизмы, как Pasteurella multocida, Streptococccus spp. (включая Streptococcus pyogenes), Staphylococcus spp. (в том числе метициллиноустойчивые Staphylococcus aureus — MRSA), Neisseria spp., Corynebacterium spp., Fusobacterium spp., Bacteroides spp., Porphyromonas spp., Moraxella spp. На долю P.multocida приходится около 50 % всех случаев. Возбудитель, как правило, чувствителен к пенициллину, амоксициллину/клавуланату, доксициклину и фторхинолонам (ципрофлоксацин).
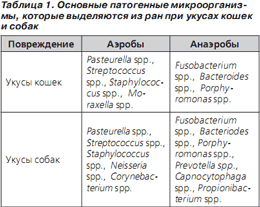
При укусах собак, как и при укусах кошек, патогенная флора представляет собой сочетание аэробов и анаэробов. Чаще других обнаруживаются следующие микроорганизмы: Pasteurella canis, P.multocida, Streptococcus spp., Staphylococcus spp., Neisseria spp., Corynebacterium spp., Fusobacterium spp., Bacteroides spp. и Capnocytophaga canimorsus.
У лиц, злоупотребляющих алкоголем, больных после спленэктомии, пациентов с заболеваниями печени, почечной недостаточностью, лимфопролиферативными заболеваниями и у лиц, принимающих иммуносупрессанты, описаны тяжелые инфекции, вызываемые C.canimorsus. В исследовании, проведенном в Дании (C. Pers et al., 1996), из 39 случаев сепсиса, вызванного C.canimorsus, 56 % были связаны с укусами собак, а еще 10 % — с облизыванием. Смертность составила 31 %. Препаратом выбора при инфекциях, вызванных C.canimorsus, является пенициллин.
Анамнез
Для квалифицированной оценки последствий укусов и определения риска возникновения инфекции у пациента следует обратить внимание на следующие обстоятельства:
— в каких условиях животное напало на пациента (в особенности время нападения);
— что известно о напавшем животном;
— было нападение животного спровоцировано или нет;
— где находится напавшее животное в настоящее время;
— сведения о случаях аллергии, имевших место у пациента в прошлом;
— медикаменты, которые принимает пациент в настоящее время;
— наличие сопутствующих заболеваний;
— сведения о прививках против столбняка и бешенства.
Среди факторов, позволяющих отнести пациента к группе повышенного риска возникновения инфекции вследствие укуса, можно выделить следующие:
— колотые раны;
— хронический алкоголизм;
— стойкий отек пострадавшей конечности;
— укус с размозжением тканей;
— сахарный диабет;
— иммунодефицитное состояние (состояние после трансплантации органа, инфицирование вирусом иммунодефицита человека (ВИЧ), прием иммуносупрессантов);
— дисфункция печени;
— локализация укуса на руке, стопе или лице;
— заболевание периферических артерий;
— укус в окрестностях протезированного сустава;
— спленэктомия;
— задержка с обращением за медицинской помощью спустя более 12 ч после укуса.
Клинические проявления
Тяжелые инфекционные заболевания, вызываемые укусами кошек и собак, возникают примерно в каждом пятом случае. В зависимости от преобладающего микроорганизма инфекция может приобретать системный характер с бактериемией и другими тяжелыми осложнениями. Изза анатомических особенностей строения руки являются наиболее частым местом возникновения инфекции при укусе. В отличие от укусов другой локализации укусы на руках в 30–40 % случаев становятся инфицированными. При укусах кошек зубы животного проникают в ткани глубже, в том числе в суставы и кости, оставляя после себя лишь небольшой кожный дефект. Поэтому возникновение глубоких абсцессов, распространяющихся вдоль фасциальных слоев, более вероятно при укусах кошек.
Укусы за голову и шею могут привести к крайне тяжелым последствиям, если их жертвами стали дети. Укусы собак могут стать причиной вдавленных или открытых переломов костей черепа, кровотечений из сосудов мягких тканей головы или внутричерепных кровотечений. При подобных повреждениях показатель смертности достаточно высок. Кошки также могут поцарапать или укусить за лицо, однако повреждения при таких травмах намного менее тяжелые.
Тщательное физикальное исследование пациента должно включать:
— описание локализации и протяженности всех ран;
— оценку глубины повреждений (в том числе вовлечение сухожилий, суставов и костей);
— исследование неврологического статуса и выявление поражения сосудов;
— обнаружение любых признаков инфекции (выраженный отек и эритема в окрестностях раны, гнойное отделяемое, лихорадка, лимфаденопатия).
Лечение
Можно выделить несколько компонентов диагностических и лечебных мероприятий при укусах кошек и собак.
1. Забор материала для культурального исследования.
Несмотря на то что лечение укусов кошек и собак по большей части эмпирическое, мазки из ран (предпочтительно из глубоких слоев) для окраски по Граму, а также посева на среды для выращивания аэробных и анаэробных культур следует брать в каждом случае инфицированной раны до начала лечения. Наличие абсцесса, тяжелого целлюлита, некротизированных тканей или сепсиса является показанием к получению материала и направлению его на микробиологическое исследование. В тех случаях, когда рана исследуется спустя более 24 часов после укуса, а признаки инфекции отсутствуют, культуральное исследование не показано.
Окраска по Граму позволяет выявить потенциальных возбудителей, хотя чувствительность этого метода исследования невелика. Окраска по Граму не дает возможности предсказать риск возникновения инфекции в клинически неинфицированных ранах и ее не следует рутинно использовать при исследовании укушенных ран.
2. Промывание раны.
Своевременное и обильное промывание раны физиологическим раствором хлорида натрия (не менее 150 мл) в сочетании с промыванием струей под давлением из шприца объемом 20–50 мл помогает удалить из раны инородные тела и бактерии, проникшие в рану при укусе, а также замедлить (возможную) передачу вируса бешенства.
3. Хирургическая обработка раны.
Крайне важным является тщательное удаление некротизированных тканей из области поражения, включая инородные тела.
4. Визуализирующие исследования.
Для обнаружения таких повреждений костей, как трещины и переломы, а также выявления инородных тел (например, зубов животного) необходимо применение рентгенографического исследования. Дополнительные методы исследования (компьютерная томография, магнитнорезонансная томография) используются при наличии клинических показаний, например при подозрении на остеомиелит.
5. Закрытие раны.
Полное закрытие раны, как правило, не показано.
6. Консультации.
При укусах за руку необходима консультация ортопедатравматолога с последующими иммобилизацией конечности, приданием ей возвышенного положения и физиотерапевтическими процедурами. При локализации укуса на шее или лице необходимо назначить консультацию пластического хирурга. При укусах за лицо изза обильного кровоснабжения риск развития инфекции ниже, поэтому такие раны можно закрывать посредством косметической операции. В случаях повреждения черепа у детей необходима консультация нейрохирурга.
Нельзя недооценивать возможность развития у пациента посттравматического нервного расстройства. Рекомендуется совместная с психологом просветительная работа с больным для недопущения подобных травм в будущем.
В каждом случае нападения (укуса) животного следует проконсультироваться с инфекционистом и/или эпидемиологом на предмет необходимости прививок от бешенства, в особенности в случаях: 1) неспровоцированных нападений, 2) укусов, нанесенных животными, потерявшими хозяев, 3) когда не удалось схватить напавшее животное, а также в тех случаях, 4) когда неизвестно, прививалось ли животное от бешенства. В медицинских документах следует детально охарактеризовать обстоятельства нападения животного, его поведение и место, где произошло нападение.
7. Иммунизация.
Вакцинация против бешенства проводится с учетом местной эпидемиологической ситуации. Кроме того, ранее привитым против столбняка людям необходима иммунизация противостолбнячной вакциной — если только они не прививались в предшествующем году. Если же пациент вообще не был привит против столбняка, ему следует сделать прививку и ввести противостолбнячный иммуноглобулин. По прошествии 48 часов больного рекомендуется осмотреть повторно.
8. Антимикробная профилактика и/или терапия.
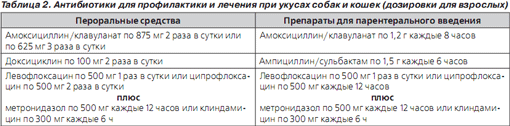
Профилактическое применение антибиотиков рекомендуется во всех случаях, за исключением тех, когда рана поверхностная и легко может быть санирована. Назначаются препараты, активные в отношении микроорганизмов, населяющих ротовую полость укусившего животного и обитающих на кожных покровах пострадавшего. Поскольку Pasteurella spp. обычно нечувствительны к оксациллину, цефалексину, клиндамицину и эритромицину, эти антибиотики не должны использоваться в качестве монотерапии при укусах домашних животных. Препаратом выбора для пероральной профилактики/терапии является амоксициллин/клавуланат, проявляющий высокую активность в отношении P.multocida, Capnocytophaga spp., анаэробов и чувствительных к нему S.aureus. У больных с аллергией на пенициллин в анамнезе предпочтение следует отдавать доксициклину (монотерапия и в сочетании с метронидазолом). Альтернативными средствами могут быть комбинация клиндамицина с фторхинолоном или у детей — клиндамицина с котримоксазолом. У беременных может использоваться цефтриаксон, а для приема внутрь — цефуроксим аксетил и цефподоксим. Если в данном регионе отмечается высокая заболеваемость инфекциями, вызванными внебольничными штаммами MRSA, антибиотики выбирают с учетом этого обстоятельства. Среди препаратов для приема внутрь предпочтение следует отдавать доксициклину и котримоксазолу, который более приемлем для применения у детей. При низкой вероятности того, что внебольничные штаммы MRSA являются носителями мутаций, ответственных за индуцибельную резистентность к клиндамицину, может использоваться клиндамицин.
Профилактическое применение антибиотиков обычно не требуется, если со времени укуса прошло более 2 суток, а признаки местной или системной инфекции отсутствуют. Напротив, при осложненных ранах после укусов собак и кошек (то есть затрагивающих глубокие структуры: кости, суставы, сухожилия и т.д.) всем больным сразу назначается антибактериальная терапия.
Антибиотики, рекомендуемые для профилактики и лечения при укусах собак и кошек, представлены в табл. 2.
9. Госпитализация.
Развившаяся инфекция может потребовать госпитализации пациента и хирургической обработки и дренирования раны. Показаниями к госпитализации служат лихорадка, сепсис, распространяющийся целлюлит, выраженный отек, синдром раздавливания, потеря функции сустава, иммунодефицитные состояния, некомплайентность (невыполнение врачебных рекомендаций).
До введения антибиотиков следует взять образцы гнойного отделяемого — для подтверждения обоснованности выбора именно этих препаратов и последующего сужения спектра применяемых медикаментов. Мазки из ран обычно малоинформативны изза контаминации посторонней флорой. Для лечения госпитализированных пациентов обычно используют комбинации βлактамов с ингибиторами βлактамаз, такие как ампициллин/ сульбактам, амоксициллин/клавуланат, пиперациллин/тазобактам или тикарциллин/клавуланат. Приемлемыми альтернативами являются цефтриаксон, карбапенемы (меропенем, дорипенем, имипенем/циластатин) и фторхинолоны в комбинации с метронидазолом.
Септические синдромы
Тяжелым осложнением укусов животных, в частности, при инфицировании C.canimorsus, P.multocida, Staphylococcus spp., Streptococcus spp., может быть сепсис. Среди других осложнений следует упомянуть менингиты, эндокардиты и перитониты. Некоторые микроорганизмы (Bacteroides spp., Fusobacterium spp., Neisseria spp., Prevotella spp.) могут вызвать сепсис у больных лейкозами или системной красной волчанкой, а также у людей, длительное время принимающих гормональные препараты. Клиническая картина у лиц из этих групп развивается по такому же сценарию, как и любая диссеминированная инфекция. Ниже представлена краткая характеристика инфекций, вызванных C.canimorsus, Pasteurella spp. и MRSA.
Capnocytophaga canimorsus
Эпидемиология
C.canimorsus является представителем нормальной микрофлоры собак и кошек. Иногда микроорганизм выделяется при исследовании материала, полученного от пациентов, искусанных этими животными. Отдельная группа представителей рода Capnocytophaga — DF1 — происходит из полости рта человека и вызывает тяжелые инфекции только у пациентов с выраженными иммунодефицитными состояниями. Род Capnocytophaga включает 9 видов, но тяжелые инфекции у людей вызывает только C.canimorsus.
Спектр инфекций, обусловленных C.canimorsus, охватывает многие заболевания — от целлюлита до менингита и эндокардита. Со времени первого подтвержденного случая в 1976 г. было описано не менее 160 новых наблюдений, в том числе гангрены, сепсиса, менингита и эндокардита. В большинстве случаев заболевания возникали на фоне иммунодефицитных состояний, включающих спленэктомию, злоупотребление алкоголем и цирроз печени, хотя у 40 % пациентов выделить факторы риска не удалось.
Capnocytophaga spp. не продуцируют эндотоксин, и риск возникновения инфекции у лиц, не страдающих иммунодефицитными состояниями, сравнительно невелик. Микроорганизмы вырабатывают вещество, ингибирующее подвижность нейтрофилов, что, повидимому, ассоциируется с умеренной резистентностью к фагоцитозу. У микроорганизмов, выделенных из крови, была выявлена устойчивость к бактерицидному действию сыворотки крови, что, вероятно, является результатом мутации липополисахаридной структуры клеточной стенки, ингибирующей, в свою очередь, процесс фагоцитоза.
Тяжелый сепсис, вызванный C.canimorsus, — крайне редкое явление. В большинстве случаев инфекции возникают у людей старше 40 лет. Почти в 80 % случаев имеет место контакт с собаками. При этом 58 % больных сообщали об укусах, а у 20 % контакт был без укусов или царапин (как, например, облизывание поврежденной кожи). Смертность от сепсиса колеблется от 25 до 30 % и достигает 60 % у пациентов с септическим шоком. 60 % больных, у которых развивается септический шок, умирают в течение 30 дней (C. Pers et al., 1996).
Клинические проявления
Клиническая симптоматика включает в себя лихорадку, ознобы, миалгии, рвоту, диарею, абдоминальные боли, общее недомогание, расстройства дыхания, нарушения сознания и головные боли. По прошествии инкубационного периода (от 1 до 7 дней) у пациентов внезапно появляются недомогание, боли в животе, которые могут симулировать синдром острого живота, спутанность сознания, одышка; симптомы заболевания быстро прогрессируют, и в итоге развивается тяжелый септический шок. При физикальном обследовании обращает на себя внимание петехиальная сыпь на туловище, нижних конечностях и слизистых оболочках, которая может прогрессировать вплоть до гангрены. Клинические проявления сепсиса вторичны по отношению к массивному воспалительному ответу, который приводит к повреждению эндотелия капиллярной сети и в конечном итоге — к развитию синдрома диссеминированного внутрисосудистого свертывания, острому расстройству дыхания, гангрене и повреждениям органов. В самых тяжелых случаях развиваются септический шок, полиорганная недостаточность, что, как правило, влечет за собой летальный исход. Риск смерти значительно выше у лиц старше 50 лет. В литературе редко сообщалось об эндокардитах, вызванных C.canimorsus, однако немало публикаций о бактериемии и сепсисе, когда септический очаг не был выявлен. Как и в случаях с инфекциями, вызванными «привередливыми» грамотрицательными бактериями, истинный показатель заболеваемости в связи с C.canimorsus, повидимому, выше, чем об этом можно судить по опубликованным данным. Очевидно, что вполне могут иметь место миокардиты и культуральнонегативные эндокардиты. Типичные для эндокардита симптомы (шумы в сердце, лихорадка, появление Среактивного белка) в начале заболевания могут быть недостаточно выражены. Кроме того, заболевание может возникнуть у людей без предшествующих заболеваний сердца. Обнаружение клинических признаков эндокардита у лиц с анамнестическими указаниями на недавние укусы кошек или собак должно наводить на мысль о возможном инфицировании C.canimorsus.
Обстоятельства, при которых этот микроорганизм вызывает менингит у человека, до конца не выяснены. Хотя септический шок, обусловленный инфицированием C.canimorsus, описывается достаточно часто, случаи возникновения менингита довольно редки. Кроме следов от укусов, выявляемых при физикальном обследовании пациента, неизвестно никаких других симптомов, которые бы позволили отличить эту редкую форму менингита от менингитов, вызываемых другими микроорганизмами. Обнаружение маленьких грамотрицательных палочек в спинномозговой жидкости позволяет подтвердить диагноз, однако примерно в трети всех опубликованных случаев никаких бактерий сначала выявлено не было. Менингиты капноцитофаговой этиологии следует подозревать лишь в случаях совпадения клинических проявлений с данными анамнеза, свидетельствующими о недавнем укусе собаки или кошки.
В литературе описано несколько случаев смертельной острой геморрагической недостаточности надпочечников (синдром Уотерхауза — Фридериксена), вызванной с C.canimorsus.
Лечение
Обычно диагноз базируется на клинических данных, поскольку вырастить чистую культуру возбудителя на питательных средах чрезвычайно сложно. До появления признаков роста колоний на типичных средах может пройти вплоть до 14 дней. Наличие в мазке периферической крови нейтрофилов, в цитоплазме которых в большом количестве обнаруживаются веретенообразные палочки, позволяет сформулировать предположительный диагноз. C.canimorsus чувствительны к пенициллину и комбинациям bлактамов с ингибиторами βлактамаз. Высокую активность проявляют также клиндамицин, линезолид, тетрациклин, карбапенемы и хлорамфеникол. К антибиотикам с изменчивой активностью можно отнести эритромицин, рифампицин, хинолоны, метронидазол, ванкомицин, пенициллины и цефалоспорины. Полимиксины B и E, фузидовая кислота, фосфомицин, аминогликозиды и триметоприм проявляют ограниченную активность. Учитывая довольно агрессивную природу C.canimorsus, а также сложность выделения возбудителя, начинать лечение следует как можно раньше.
Pasteurella spp.
Эпидемиология
Pasteurella spp. являются факультативными анаэробами и представляют собой грамотрицательные, не образующие спор палочки, которые при микроскопии обнаруживаются парами или короткими цепочками. К факторам вирулентности относят капсульный липополисахарид, цитотоксин и железосвязывающие белки. Инфекции у людей вызывают следующие виды и подвиды микроорганизмов: P.multocida, P.canis, P.multocida septic, P.stomatis и P.dogmatis. P.multocida может быть компонентом нормальной микрофлоры верхних дыхательных путей некоторых млекопитающих, в частности кошек. Большинство инфекций человека вызывается укусами собак и кошек. Облизывание животными также может послужить причиной возникновения инфекции. Описаны случаи возникновения инфекций даже без документированных контактов с животными.
Клинические проявления
Pasteurella spp. могут вызывать тяжелые инфекции, в том числе некротический фасциит, септический артрит, остеомиелит и, в более редких случаях, септический шок и менингит. Тяжелые инфекции (например, сепсис, септический шок) бывают у младенцев, беременных женщин, людей, длительно принимающих гормональные препараты, ВИЧинфицированных лиц, реципиентов трансплантатов тканей или органов, а также при различных иммунодефицитных состояниях. При инфекциях, вызванных P.multocida, частота бактериемии у пациентов с пневмониями, менингитом, септическим артритом колеблется в пределах 25–50 %. У многих больных с бактериемией обнаруживают выраженные признаки поражения печени. Тем не менее изредка бактериемию обнаруживали у ранее здоровых лиц; в подобных случаях смертность оставалась значительной — на уровне 25 %. Менингиты, вызванные Pasteurella spp., чаще отмечаются у детей в возрасте до 1 года и пожилых людей в возрасте старше 60 лет. Результаты исследования цереброспинальной жидкости сходны с таковыми при других бактериальных менингитах; характерно увеличенное количество лейкоцитов, высокое содержание белка и низкое — глюкозы. У 80 % больных при исследовании цереброспинальной жидкости обнаруживают палочки, не окрашивающиеся по Граму, однако их часто путают с Haemophilus influenzae или Neisseria meningitidis.
К редким осложнениям инфекции P.multocida относят эндокардиты естественных и протезированных клапанов и перитониты у больных, длительное время находящихся на амбулаторном перитонеальном диализе.
Лечение
Анамнестические указания на укус собаки или кошки облегчают постановку диагноза. У больных группы риска (например, с заболеваниями печени) следует учитывать возможность диссеминации инфекции и развития септического шока. При выделении Pasteurella spp. сложностей обычно не возникает: колонии бактерий хорошо растут на многих средах, как, например, шоколадный агар, хотя и не растут на некоторых селективных кишечных средах.
Так же как и C.canimorsus, P.multocida нечувствительна к большинству пероральных антибиотиков, которые обычно используются при инфекциях кожи и мягких тканей, в том числе к оксациллину, цефалексину и клиндамицину. Кроме того, многие штаммы резистентны к эритромицину (несмотря на чувствительность к азитромицину). В большинстве случаев эффективным оказывается лечение βлактамными антибиотиками, такими как пенициллин или ампициллин, хотя в литературе имеются сообщения о штаммах Pasteurella spp., устойчивых к пенициллину. В качестве альтернативных средств могут использоваться цефалоспорины второго и третьего поколений (цефуроксим, цефподоксим), а у больных с аллергическими реакциями на пенициллин в анамнезе — доксициклин или фторхинолоны.
Инфекции, вызванные внебольничными штаммами метициллинрезистентных Staphylococcus aureus
Долгое время MRSA рассматривались как возбудители госпитальных (нозокомиальных) инфекций. В последнее десятилетие широкое распространение приобрели внебольничные штаммы MRSA, которые отличаются от внутрибольничных тем, что легко передаются друг другу членами одной семьи, часто вызывают инфекции кожи и мягких тканей и чувствительны к большинству отличных от βлактамов антибиотиков.
По мере распространения внебольничных штаммов MRSA накапливаются данные о случаях колонизации этими штаммами домашних животных, зачастую в результате заражения животного от своего хозяина. MRSA были выделены от собак, кошек и лошадей; эти животные в настоящее время рассматриваются как возможные резервуары инфекции. Любопытно, что S.aureus преобладают среди всех стафилококков у людей и лошадей, в то время как у собак и кошек их доля в общей массе стафилококков составляет от силы 10 %, а доминируют S.intermedius.
Немногим более 20 лет тому назад в доме престарелых в Англии была впервые описана передача штамма MRSA человеку от животного (кошки). После применения соответствующих мер по контролю над инфекциями вспышка была быстро подавлена, а кошку удалили из учреждения. Спустя несколько лет был зафиксирован еще один случай передачи MRSA, связанный с домашним животным. Эпидемический штамм MRSA был выделен от пациента в отделении интенсивной терапии. Попадание штамма в отделение проследили до среднего медработника и его жены, которая также работала медсестрой в другом отделении. Несмотря на принятые меры по деколонизации, оба сотрудника оказались связаны и со следующей вспышкой в учреждении шесть месяцев спустя. Медработник из отделения интенсивной терапии позже сообщил, что у его собаки в течение нескольких недель имела место инфекция глаз. Мазки, взятые у животного, подтвердили наличие того же самого эпидемического штамма MRSA. Одновременное проведение дезинфекции во всем учреждении, включая обоих супругов и их собаку, дало в конце концов положительный результат.
В последующем с помощью генетических исследований была подтверждена возможность передачи штаммов MRSA от человека к человеку или от человека к домашним животным и наоборот.
Штамм внебольничного MRSA от домашнего животного (короткошерстного кота с аллергией на блох и пиодермией) впервые выделен в 2006 г. (C.B. Vitale et al.).
В недавних исследованиях штаммов MRSA, выделенных от домашних питомцев, продемонстрирована возможность передачи фторхинолонрезистентных штаммов от животных людям (A.E. Lin, J.E. Davies, 2007). Таким образом, лечение инфекций животных с применением фторхинолонов может способствовать появлению фторхинолонрезистентных штаммов у животных и последующей передаче этих штаммов человеку. При микробиологическом исследовании более 100 культур S.aureus, выделенных от собак и кошек, находившихся на лечении в ветеринарной клинике при Пенсильванском университете, штат Филадельфия (США), оказалось, что 35 % (39 из 111) штаммов были резистентными к метициллину. Чувствительность к клиндамицину среди этих 39 штаммов MRSA составила 28 %, эритромицину — 15 %, к фторхинолоновым препаратам — 10 %, что подтвердило предположение о том, что штаммы MRSA, выделенные от животных, зачастую являются множественноустойчивыми к антибиотикам. Наиболее активными пероральными средствами оказались хлорамфеникол (90 %) и котримоксазол (97 %).
Лечение
Специфическая терапия MRSAинфекций, связанных с домашними животными, аналогична таковой при инфекциях, вызванных внебольничными штаммами MRSA. Контакт с бессимптомным животным не является фактором риска заражения S.aureus для лиц с иммунодефицитными состояниями, так как у большинства домашних питомцев вероятность быть носителем штамма MRSA сравнительно невелика. Поскольку в большинстве случаев поражаются мягкие ткани и кожа, легкие и средние формы инфекций можно лечить антистафилококковыми антибиотиками. Основными препаратами выбора для перорального приема являются котримоксазол, доксициклин, миноциклин или клиндамицин. При более тяжелых инфекциях в качестве альтернативы можно использовать линезолид для приема внутрь. Если были назначены котримоксазол или доксициклин и возникло подозрение на присоединение стрептококковой инфекции, следует добавить второй пероральный антибиотик, поскольку указанные препараты проявляют довольно слабую активность в отношении Streptococcus pyogenes. При осложненных гнойных или системных инфекциях рекомендуется парентеральная терапия гликопептидными антибиотиками (ванкомицин, тейкопланин), линезолидом или тигециклином.
Несмотря на прогресс в изучении путей передачи патогенных штаммов MRSA между людьми и домашними животными, особенностей чувствительности к лекарственным средствам, на многие вопросы получить ответы еще только предстоит. Целью будущих исследований станет изучение связи между носителем и патогеном в случае «собачьих» штаммов MRSA, механизмов передачи инфекции от собаки к человеку, факторов вирулентности MRSA и штаммов, ассоциированных с домашними питомцами.
Заключение
Владельцы домашних животных часто не имеют понятия о возможности приобретения опасных для жизни микроорганизмов от домашних собак и кошек. Риск заражения, особенно у детей, наибольший при укусах в область предплечья, кисти, лица, шеи и головы. Возбудителями заболеваний чаще оказываются анаэробы полости рта, P.multocida, C.canimorsus и MRSA. Лечение укусов кошек и собак включает в себя обработку раны, в том числе хирургическую, и уход за ней, культуральное исследование образцов из глубоких отделов раны, рентгенографическое исследование, при необходимости — профилактику бешенства. Выбор антибиотиков осуществляется в зависимости от предполагаемых возбудителей. Клиницистам следует проводить санитарнопросветительную работу с населением, в частности обращать внимание на возможность предотвращения передаваемых домашними питомцами инфекций при соблюдении некоторых простых правил и мер предосторожности.
1. Lo Re III V. Management of dog, cat, and human bites // Infectious Diseases: hot topics / Ed. by Lo Re III V. — Philadelphia (PEN), USA: Hanley & Belfus, 2004. — P. 177-184.
