Газета «Новости медицины и фармации» Нефрология (297) 2009 (тематический номер)
Вернуться к номеру
Глюкокортикоидная терапия в клинической практике
Авторы: А.И. Дядык, А.Э. Багрий, Н.Ф. Яровая, Донецкий национальный медицинский университет им. М. Горького, кафедра внутренних болезней, общей практики и семейной медицины
Версия для печати
В клинической практике сегодня используются исключительно синтетические глюкокортикостероиды (ГК), обладающие мощной противовоспалительной, иммуносупрессивной и антиаллергической активностью при слабых или даже нулевых минералокортикоидных эффектах, в связи с чем они относятся к наиболее часто применяемым препаратам в различных областях медицины.
Механизм действия глюкокортикоидов
В настоящее время принято разграничивать два механизма действия ГК — геномный и негеномный.
Геномный механизм, осуществляемый посредством связывания специфических цитоплазматических рецепторов, наблюдается при любых дозировках и проявляется не ранее чем через 30 мин после образования гормонорецепторного комплекса.
Фундаментальным механизмом действия ГК является регулирование транскрипции генов, контролирующих синтез протеинов и ДНК. Воздействие ГК на ГК-рецепторы (являющиеся представителями семейства мембранных стероидных рецепторов) ведет к развитию комплекса событий с участием специфической мессенджерной РНК, ядерной РНК и других промоторных субстанций. Итогом этого каскада является стимуляция или ингибиция транскрипции генов. ГК оказывают влияние на большое число генов, включая гены, контролирующие образование таких цитокинов, как IL-1a, IL-4, IL-6, IL-9 и гамма-интерферон. При этом ГК могут как усиливать транскрипцию генов, так и подавлять ее.
ГК контролируют клеточный синтез белка. Легко и быстро проникая через клеточные мембраны, они формируют в цитоплазме комплексы со стероидными рецепторами, мигрирующие в клеточные ядра, осуществляя воздействие на генетический аппарат транскрипцией специфической мессенджерной РНК для синтеза регуляторных пептидов и белков, прежде всего связанных с системой энзимов, которые, в свою очередь, контролируют клеточную функцию. Эти энзимы могут выполнять как стимулирующие, так и ингибирующие функции. Например, они могут стимулировать продукцию ингибиторных протеинов в некоторых клетках, что полностью прекращает транскрипцию генов в лимфоидных клетках, тем самым модулируя иммунные и воспалительные ответы.
ГК оказывают воздействие на клеточные и гуморальные иммунные функции. Развивающаяся под их влиянием лимфоцитопения обусловлена торможением продукции и выхода из костного мозга лимфоидных клеток, угнетением их миграции и перераспределением лимфоцитов в другие лимфоидные отделы. ГК оказывают влияние на кооперативное взаимодействие Т- и В-клеток в иммунном ответе. Они дифференцированно воздействуют на различные субпопуляции Т-лимфоцитов, вызывая снижение уровня Т-клеток, несущих рецепторы для Fc-фрагмента IgM, и не изменяя уровень Т-лимфоцитов, несущих рецепторы для Fc-фрагмента IgG. Под влиянием ГК подавляются пролиферативные способности Т-клеток как in vivo, так и in vitro. Влияние ГК на В-клеточные ответы проявляется в меньшей мере, чем на Т-клетки. Так, у больных, получающих средние дозы ГК, наблюдаются нормальные антительные ответы на иммунизацию. В то же время кратковременное введение больших дозировок ГК вызывает снижение сывороточных уровней IgG и IgA и не влияет на уровни IgM. Воздействие ГК на В-клеточную функцию может осуществляться опосредованно за счет их влияния на макрофаги.
В отличие от геномных негеномные эффекты ГК являются результатом прямого физико-химического взаимодействия с биологическими мембранами и/или стероидселективными мембранными рецепторами. Негеномные эффекты ГК развиваются под влиянием более высоких дозировок и проявляются через несколько секунд или минут.
Негеномный противовоспалительный эффект ГК связывают со стабилизацией лизосомальных мембран, уменьшением проницаемости клеточных мембран, снижением капиллярной проницаемости и локального кровотока в участках воспаления, уменьшением набухания эндотелиальных клеток, снижением способности иммунных комплексов проникать через базальную мембрану, торможением роста фибробластов, подавлением синтеза коллагена и мукополисахаридов, сужением сосудов в очаге воспаления и понижением их проницаемости (частично за счет ингибиции синтеза простагландинов), уменьшением в очаге воспаления количества моноцитов и мононуклеарных клеток, а также воздействием на полиморфноядерные лейкоциты. Очевидно, ведущая роль в противовоспалительном эффекте ГК принадлежит ингибиции миграции и аккумуляции лейкоцитов в очагах воспаления. Под влиянием ГК нарушаются бактерицидная активность, Fс-рецепторное связывание и другие функции моноцитов и макрофагов, а также снижаются уровни эозинофилов, моноцитов и лимфоцитов в циркуляции. Кроме того, изменяются клеточные ответы на кинины, гитамин, простагландины и хемотаксические факторы, а также уменьшается высвобождение простагландинов из стимулированных клеток. Хорошо изученный негеномный механизм включает активацию эндотелиальной синтазы оксида азота. Доза ГК определяет их эффективность, а также частоту и тяжесть побочных эффектов. Геномные эффекты ГК развиваются при минимальных дозировках и возрастают по мере достижения примерно 100 мг преднизолонового эквивалента в сутки и в дальнейшем остаются стабильными. Если при использовании ГК в дозе до 30 мг преднизолонового эквивалента терапевтический результат практически полностью определяется геномными механизмами, то в дозе свыше 30 мг преднизолонового эквивалента значимыми становятся негеномные эффекты, роль которых стремительно нарастает по мере повышения дозы.
Фармакокинетика глюкокортикоидов
ГК хорошо реабсорбируются при всех вариантах их применения, т.е. при пероральном, в/м, в/в или внутрисуставном. После приема внутрь абсорбируется около 50–90 % ГК. Связывание ГК с белками крови составляет приблизительно 40–90 %. Метаболизм ГК осуществляется преимущественно в печени, а экскреция — преимущественно почками в виде метаболитов. Пик концентрации ГК в крови при пероральном применении наступает через 4–6 часов. При в/в введении ГК пик их концентрации достигается намного быстрее. Так, при введении 1,0 г метилпреднизолона натрия сукцината пик его концентрации в плазме наблюдается через 15 минут. При в/м применении ГК пик их концентрации в плазме наступает значительно позже. Например, при в/м введении метилпреднизолона ацетата его максимальная концентрация в крови достигается приблизительно через 7 часов.
В табл. 1 представлены некоторые характеристики пероральных ГК.
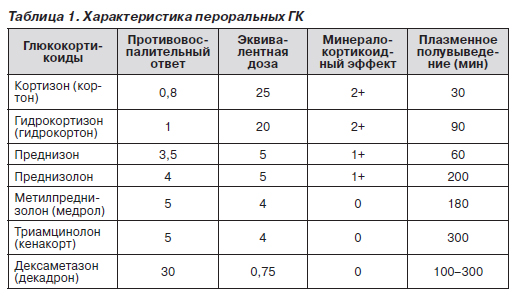
Как показано в табл. 1, время плазменного полувыведения различных представителей ГК характеризуется небольшими различиями: от 90 минут у кортизона; 180–200 минут — у преднизолона и метилпреднизолона и до 100–300 минут — у дексаметазона. В то же время небольшие различия в плазменном полувыведении существенно контрастируют в мощности противовоспалительного ответа и минералокортикоидного эффекта, а также в продолжительности действия ГК.
Номенклатура дозировок и режимов применения глюкокортикоидов
На уже упомянутом Европейском симпозиуме по глюкокортикоидной терапии (ГКТ) был принят Консенсус по номенклатуре доз и режимов применения ГК. Согласно обсуждаемому Консенсусу, суточные дозировки ГК 7,5 мг и ниже обозначаются как низкие; суточные дозиров-ки > 7,5 мг ≤ 30 мг — как средние; суточные дозировки > 30 мг ≤ 100 мг — как высокие; суточные дозировки > 100 мг — как очень высокие и пульс-терапия ≥ 250 мг/сутки в/в. Все дозировки ГК даны в преднизолоновом эквиваленте.
В зависимости от характера заболевания, его остроты и тяжести, а также вовлечения в патологический процесс жизненно важных органов и систем разнятся как пути введения ГК, так и их дозировки.
При проведении пероральной терапии средними и высокими дозами ГК используются различные методики их приема: непрерывный (ежедневный) и прерывистые (альтернативный и интермиттирующий) варианты. Непрерывный вариант предусматривает ежедневный прием суточной дозы (однократно в утренние часы или в несколько приемов). Последний метод приема ГК обычно показан в острых клинических ситуациях, протекающих с высокой лихорадкой и тяжелым поражением внутренних органов. Однократный прием при непрерывном (ежедневном) варианте снижает их побочные эффекты на желудочно-кишечный тракт и функцию надпочечников, сохраняя при этом достаточную клиническую эффективность.
В последние два-три десятилетия интенсивно изучается возможность перорального приема ГК прерывистыми вариантами. При альтернативном варианте установленную 48-часовую дозу ГК назначают однократно утром через день. При таком варианте проведения ГКТ уменьшается частота и тяжесть таких побочных эффектов, как снижение функции надпочечников, развитие интеркуррентных инфекций и выраженность катаболический проявлений. При интермиттирующем варианте ГКТ прием установленной суммарной недельной дозы ГК осуществляется 3–4 дня подряд, а в оставшиеся дни недели делается перерыв. При этом варианте также отмечают снижение вышеописанных побочных эффектов ГК.
Описанные мощные многогранные эффекты послужили основанием для их широкого применения в различных областях медицины при многих заболеваниях и патологических состояниях. При этом в зависимости от характера патологического процесса используются различные пути введения ГК, их дозировки и продолжительность применения.
За последние 15–20 лет значительно изменились подходы к ГКТ и ее тактика при ревматических и других заболеваниях.
При отсутствии поражения жизненно важных органов и систем или прогностически неблагоприятных проявлений заболевания в зависимости от нозологии хороший клинический эффект может быть достигнут назначением нестероидных противовоспалительных препаратов (НПВП) и/или противомалярийных препаратов. Если при такой комбинации удерживается симптоматика, то обосновано назначение ГК, причем следует начинать с низких дозировок ГК (2,5–7,5 мг/сут преднизолона, или 2–6 мг метилпреднизолона, или эквивалентные дозы других ГК). При необходимости каждую 1–2 недели следует увеличивать первоначальную дозировку ГК на 20–25 %. Не следует назначать большие дозы ГК, чем это необходимо для достижения клинического эффекта, так как риск побочных эффектов при ГКТ дозозависимый, а в последующем приходится решать важную и трудную проблему рациональной отмены ГК.
Диаметрально противоположная тактика при заболеваниях, при которых в патологический процесс вовлекаются жизненно важные органы и системы или имеются прогностически неблагоприятные проявления заболевания. Например, при тяжелых аллергических реакциях, шоковых состояниях различного происхождения, тромбоцитопенических кризах, тяжелой гемолитической или аутоиммунной анемии, тяжелых перикардитах или миокардитах, поражении ЦНС, пульмонитах, коронаритах, быстро прогрессирующих или стероидочувствительных гломерулонефритах (ГН) терапией выбора нередко является назначение высоких или очень высоких дозировок ГК (перорально или в/в в зависимости от конкретной клинической ситуации). При этом продолжительность приема первоначальной дозы должна обычно составлять не менее 6 недель, а при необходимости и больше.
Отмена глюкокортикоидной терапии
После достижения ремиссии или адекватного контроля активности заболевания под влиянием ГКТ возникает необходимость в снижении первоначальной дозы ГК или полной их отмены. Интенсивность уменьшения дозы ГК (т.е. скорость и величина снижения) определяются такими факторами, как первоначальная дозировка ГК, продолжительность и режим их приема.
При снижении или полной отмене ГК не рекомендуют назначать адренокортикотропный гормон (АКТГ), так как не получено убедительных доказательств, что он способен предотвращать или уменьшать проявления синдрома отмены и, в частности, способствовать восстановлению гипоталамо-гипофизарно-надпочечниковой функции.
Американские ревматологи рекомендуют следующие подходы к снижению дозировок и/или отмене ГК. У больных, получающих первоначально высокие и очень высокие дозы ГК в течение нескольких недель, на 10 % эта доза может уменьшаться с интервалом в 4 дня. Если же больной получал эту дозу в течение нескольких месяцев, то 10% уменьшение первоначальной дозы следует проводить с интервалом в несколько недель. У больных, получающих средние дозы ГК, снижать их на 10 % можно каждые две недели. У некоторых больных, получающих длительно 5 мг преднизолона или 4 мг медрола в сутки, снижение дозы на 0,5–1,0 г может сопровождаться появлением артралгий и недомогания. В таких случаях величина и скорость снижения дозы должны быть минимальны.
У больных, длительно получающих средние, высокие и очень высокие дозы ГК, при снижении дозировок, когда они достигают 7,5 мг преднизолона или 6 мг медрола в сутки, в последующем уменьшать дозу следует на 1 мг в месяц, так как время восстановления гипоталамо-гипофизарно-надпочечниковой функции варьирует у различных пациентов и может достигать одного года. Тест на АКТГ позволяет судить о восстановлении гипофизарно-надпочечниковой функции. При проведении этого теста ее восстановление констатируется, если через 30 минут после введения 250 мкг синтетического АКТГ внутримышечно уровень плазменного кортизола повышается на 6–20 мкг/мл.
Неадекватное снижение дозы ГК может сопровождаться как обострением заболевания, так и развитием синдрома отмены, которые нередко тяжело отличить друг от друга.
Различают четыре типа синдрома отмены у больных, длительно получавших ГК.
При первом типе представлены клинические и лабораторные признаки нарушения гипоталамо-гипофизарно-надпочечниковой функции, которые исчезают при назначении заместительной терапии кортизолом.
При втором типе (наиболее часто наблюдаемом) имеет место появление симптомов, обусловленных неадекватно быстрым снижением дозы ГК: артралгии, недомогание, утомляемость, депрессия, лихорадка и др. В таких случаях необходимо замедлить интенсивность снижения дозы ГК.
Третий тип характеризуется развитием глюкокортикоидной зависимости. Клиническая симптоматика при этом не обусловлена активностью заболевания. Гипота-ламо-гипофизарно-надпочечниковая функция в норме, но для контроля клинических проявлений необходимо назначение «супрафизиологических» доз ГК (более 5 мг преднизолона или 4 мг метилпреднизолона в сутки).
При четвертом типе синдрома отмены у больных отсутствуют какие-либо клинические проявления, но имеются лабораторные доказательства депрессии гипоталамо-гипофизарно-надпочечниковой функции. При этом возможно кратковременное назначение заместительной терапии кортизолом.
Выбор глюкокортикоидного препарата
Мы не располагаем убедительными доказательствами, что какой-либо из используемых сегодня ГК препаратов оказывает более специфическое действие на патологические процессы, развивающиеся при ревматических и других заболеваниях.
Выраженность иммунодепрессивного эффекта различных ГК не всегда коррелирует с противовоспалительным эффектом. Наиболее мощный иммунодепрессивный эффект in vitro демонстрируют метилпреднизолон и бетаметазон, промежуточный — дексаметазон, преднизолон, гидрокортизон и наименьший — преднизон.
Некоторые особенности механизма действия, фармакокинетики и частоты побочных эффектов позволяют рекомендовать определенный дифференциальный подход к выбору препарата и характеру его введения. Так, следует избегать назначения гидрокортизона при тяжелых поражениях почек и сердца из-за его потенциальной способности задерживать натрий и воду. Введение в молекулу синтетических ГК фтора (триамцинолон, дексаметазон, бетаметазон) обусловило не только повышение противовоспалительной активности, но и ухудшение их переносимости за счет ряда побочных эффектов. Наиболее частыми побочными эффектами триамцинолона являются амиотрофия, кушингоид и психические нарушения, но ему присущ наименьший аппетит-стимулирующий эффект. Дексаметазон обладает наибольшим аппетит-стимулирующим эффектом. Дексаметазон и бетаметазон в большей степени, чем другие ГК, способствуют увеличению массы тела, повышению АД, развитию остеопороза, пептических язв и кожных осложнений (экхимозы, стрии, угри, гирсутизм). Дексаметазон оказывает более выраженный ингибирующий эффект на функцию нейтрофильных гранулоцитов, в связи с чем его применение малоприемлемо у больных с повышенным риском развития интеркуррентных инфекций. В целом среди используемых ГК наилучшей переносимостью обладает метилпреднизолон, что наглядно представлено в табл. 2.
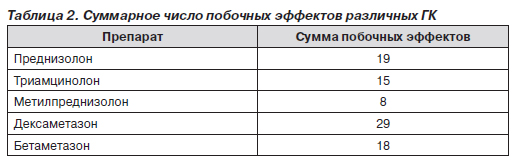
Сумма побочных эффектов при применении метилпреднизолона составила 8, оказавшись значительно ниже у других ГК. При использовании метилпреднизолона частота и тяжесть таких побочных эффектов, как угнетение гипофиза, потеря К+, задержка Na+, развитие АГ, диабетогенный эффект, стимуляция аппетита, прибавка в массе тела, воздействие на психику, развитие кушингоида, остеопороза и мышечной атрофии, в целом оказались ниже, чем у других ГК, что показано в табл. 3. В связи с этим метилпреднизолон является препаратом выбора для больных с нестабильной психикой, АГ, избыточной массой тела, инсулиновой резистентностью, с риском развития язвенных поражений ЖКТ и сахарного диабета.
В
Пульс-терапия метилпреднизолоном подразумевает в/в капельное введение около
Введение здоровым людям сверхвысоких доз метилпреднизолона вызывает выраженную лимфоцитопению в сочетании с нейтрофилией, удерживающиеся на протяжении 1–2 суток. Лейкоцитопения обусловлена преимущественным уменьшением рециркулирующих Т-клеток. Кроме того, в течение 24–48 часов наблюдается значительное подавление ответа периферических лимфоцитов на стимуляцию различными митогенами. При пульс-терапии метилпреднизолоном наблюдается выраженная и длительная депрессия NK-клеток. Под влиянием сверхвысоких доз метилпреднизолона значительно нарушаются (кратковременно — до 24 часов) адгезивные способности полиморфноядерных лейкоцитов (ПМЯЛ) и другие их функции. Генерация свободных радикалов и дегрануляция изменяются несущественно. Кроме того, наблюдается замедление секреции лактоферрина ПМЯЛ, а также нарушение уничтожения и переваривания бактерий. Последнее может способствовать повышенному риску развития интеркуррентных инфекций у больных, получающих пульс-терапию метилпреднизолоном.
Во многих сообщениях, посвященных неконтролируемым исследованиям эффективности пульс-терапии метилпреднизолоном при острых тяжелых клинических проявлениях ревматических заболеваний и васкулитах, отмечается благоприятная динамика клинической картины под влиянием такого лечебного режима. Наряду с этим также наблюдается нормализация или отчетливая положительная динамика лабораторных (в том числе и серологических) показателей.
В единичных контролируемых исследованиях, включавших небольшое количество больных, не выявлено особых преимуществ (или преимущество было кратковременным) перед традиционной пероральной ГКТ.
Чрезмерный оптимизм, наблюдавшийся на начальных этапах использования пульс-терапии метилпреднизолоном, сегодня уступил место трезвой оценке возможностей рассматриваемого варианта ГК терапии и показаний к ее применению. Однозначно оправданно использование пульс-терапии метилпреднизолоном при различных заболеваниях и патологических состояниях, когда показана ГКТ для быстрого устранения (или уменьшения) жизнеопасных проявлений.
Необоснованное назначение пульс-терапии, нарушение методики ее применения (чрезмерно быстрое введение препарата), а также отсутствие адекватного мониторинга за больным во время введения препарата и после процедуры может быть причиной довольно серьезных осложнений, включающих аритмии, остановку сердца, тяжелые интеркуррентные инфекции и др.
В связи с вышеизложенным необходимо проведение крупных контролируемых исследований по оценке как непосредственных, так и отдаленных результатов пульс-терапии метилпредизолоном при заболеваниях с различной активностью течения и вовлечением в патологический процесс различных органов и различной тяжестью их поражения.
Наряду с пероральным и в/в применением ГК важное место в клинической практике занимают фармакологические формы ГК, предназначенные для в/м введения для достижения пролонгированного противовоспалительного, иммунодепрессивного и противоаллергического эффектов. Причем эти формы ГК позволяют достигать системного эффекта, а также применяются in situ, прежде всего внутрисуставно, с целью местного (локального) эффекта.
Одним из представителей этой формы ГК является метилпреднизолона ацетат (40 мг в 1 мл суспензии). Последний обладает теми же фармакологическими свойствами и клиническими эффектами, что и метилпреднизолон, но хуже растворяется и менее активно метаболизируется, с чем связано более продолжительное его клиническое действие.
Метилпреднизолона ацетат подвергается гидролизу под влиянием холинестераз сыворотки крови с образованием активных метаболитов. Около 40–90 % метилпреднизолона связываются с альбумином и транскортином.
Продолжительность противовоспали-тельной активности ГК ассоциируется с продолжительностью угнетения ими гипоталамо-гипофизарно-надпочечни-ковой оси (ГГНО). После однократного в/м введения метилпреднизолона ацетата (40 мг/мл) его максимальная концентрация в крови достигается через 7–8 часов, а продолжительность угнетения ГГНО составляет 4–8 дней.
Дозировка метилпреднизолона ацетата, вводимого в/м 1 раз в неделю, определяется особенностью заболевания. При этом необходимая его недельная дозировка при сравнении с необходимой пероральной дозой должна составлять суточную величину последней, умноженную на 7.
В/м и внутрисуставное введение ГК рассматривается как вспомогательная терапия и обычно (за исключением подагры, бурсита, тендинита) производится на фоне базисной (болезнь-модифицирующей) терапии. Ниже представлены показания для внутрисуставного использования ГК.
Показания для внутрисуставного применения ГК:
— болезнь Рейтера;
Для в/м и внутрисуставного применения используются препараты различных ГК, которые представлены в табл. 4.
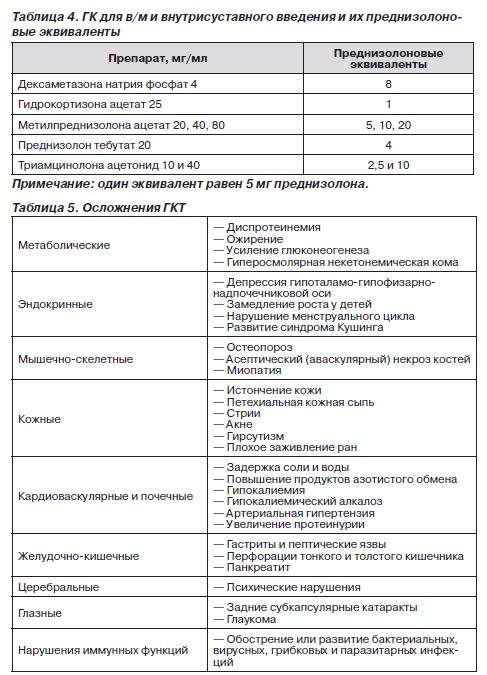
Дозировки метилпреднизолона ацетата, используемые при РА и остеоартрите (при наличии синовита), определяются размерами пораженного сустава. Так, дозировка метилпреднизолона ацетата при введении в крупные суставы (коленные, голеностопные, плечевые) составляет 20–80 мг; в средние суставы (локтевые, лучезапястные) — 10–40 мг; и в мелкие (пястно-фаланговые, межфаланговые, грудинно-ключичные, акромиально-ключичные) — 4–10 мг.
Осложнения глюкокортикоидной терапии
Применение ГК сопряжено с возможностью разнообразных осложнений, риск развития и тяжесть которых ассоциируются с уровнями их дозировок и длительностью использования. Наиболее частые осложнения ГКТ представлены в табл. 5. Считаем важным остановиться на некоторых наиболее часто развивающихся осложнениях ГКТ, знание которых необходимо для проведения профилактики, а также своевременного распознавания и устранения их за счет как уменьшения дозировок (или полной отмены) ГК, так и проведения необходимых лечебных мероприятий.
Длительное лечение ГК приводит к гипер- и дислипидемии, характеризующейся повышением плазменных уровней триглицеридов, холестерина и липопротеидов низкой плотности, что ассоциируется с повышенным риском развития ишемической болезни сердца. В связи с этим у больных, получающих ГК, необходимы постоянный контроль липидов плазмы, проведение профилактических мероприятий, а при развитии гипер- и дислипидемии — применение статинов.
Стероидный диабет довольно часто развивается при применении больших доз ГК, в связи с чем необходимо проведение постоянного контроля за уровнями глюкозы крови, а также регулярные исследования мочи на наличие глюкозы. Кетоацидоз и гиперосмолярная кома развиваются редко.
Развитие гипоталамо-гипофизарно-надпочечниковой дисфункции довольно часто наблюдается у больных, получающих ГКТ. Дисфункция и ее выраженность ассоциируются с дозировкой ГК, продолжительностью применения, а также режимом их перорального применения и отмены.
Замедление роста представляет серьезное осложнение ГКТ у детей и подростков, длительно принимающих ГК. При режиме альтернативного дня приема ГК замедление роста выражено в меньшей мере. Истинные механизмы этого осложнения ГКТ остаются малоизученными. Некоторые клиницисты считают, что замедление роста можно предотвратить назначением гормона роста.
При длительном применении ГК могут развиваться признаки, характерные для синдрома Кушинга, т.е. увеличение массы тела, перераспределение жировой ткани, лунообразное лицо, гирсутизм, абдоминальные стрии и нарушения менструального цикла.
Остеопороз представляет одно из главных и серьезных осложнений ГКТ. Патофизиологические механизмы, участвующие в его развитии, являются сложными и многогранными. К ним относят нарушение абсорбции кальция в тонком кишечнике, снижение почечной канальцевой реабсорбции кальция, обусловливающее увеличение его потерь с мочой, а также депрессию функции остеобластов, приводящую к нарушению формирования кости.
Развитие остеопороза, его тяжесть тесно коррелируют с дозировками ГК и длительностью их применения. Характер режима перорального применения ГК существенно не влияет на это осложнение.
В развитии асептического (аваскулярного) некроза, наблюдаемого у 5–10 % больных СКВ, определенную роль играет длительность ГКТ.
При длительном приеме ГК возможно развитие миопатии, что связывают с применением определенных ГК, содержащих в молекуле атом фтора. При миопатиях, вызванных ГКТ, уровни сывороточных энзимов обычно не изменены, хотя имеются сообщения о повышении лактатдегидрогеназы (ЛДГ) сыворотки крови. У большинства больных выявляется повышение экскреции креатинина с мочой. Уменьшение дозы ГК или отмена их при «стероидных миопатиях» сопровождается положительной клинической динамикой и снижением значений ЛДГ.
Задержка натрия и воды (особенно на ранних этапах применения ГК) и повышение артериального давления — хорошо известные осложнения ГКТ. Механизмы этих проявлений представляются сложными, а частота и выраженность их повышаются при больших дозировках ГК.
При развитии гипокалиемии у больных, принимающих ГК, показано применение препаратов калия.
Назначение больших доз ГК может сопровождаться повышением уровня продуктов азотистого обмена в сыворотке, что связывают с их катаболическими эффектами. Уровни креатинина сыворотки при отсутствии тяжелого поражения почек существенно не изменяются.
У больных, находящихся на ГКТ, наблюдаются побочные эффекты со стороны желудочно-кишечного тракта, что проявляется изжогой, тошнотой (реже рвотой), болью в эпигастральной области, которые обусловлены развитием гастрита, и/или пептических язв желудка, и/или двенадцатиперстной кишки. Возможность развития пептических язв и таких осложнений, как перфорация и кровотечение, под влиянием ГКТ остается предметом дискуссий. При анализе результатов контролируемых исследований делается вывод, что вероятность повышенного риска развития пептических язв (по сравнению с общей популяцией) увеличивается только при длительном (более 300 дней) приеме ГК в суммарной дозе, превышающей 1000 мг преднизона или эквивалентной дозе других ГК. Во многих исследованиях отмечается, что частота развития петических язв при проведении ГКТ реально возрастает при ее комбинации с аспирином или другими НПВП.
Наличие острой пептической язвы не может служить абсолютным противопоказанием для ГКТ у больных, у которых отмена ГК сопровождается тяжелым обострением заболевания, при этом продолжение ГКТ должно проводиться в комбинации с ингибиторами протонного насоса. Частота кровотечений у больных со стероидными пептическими язвами не превышает таковую у больных с пептическими язвами, не связанными с приемом ГК.
Лечение ГК может осложняться различными психическими нарушениями. Среди них наиболее частыми являются эйфория, депрессия и психозы, частота которых в различных сообщениях существенно варьирует. Показано наличие тесной корреляции частоты психических нарушений и их тяжести с дозой ГК и продолжительностью их приема. Стероидные психические нарушения и, в частности, психозы проходят при уменьшении дозы ГК, однако в ряде случаев требуется полная их отмена.
Роль ГКТ в повышении частоты инфекционных осложнений общепризнана. При этом увеличивается риск развития инфекций любого типа. При присоединении различных инфекций часто развивается септицемия, несвоевременная диагностика которой и неадекватная антибактериальная терапия могут быть причиной летальных исходов.
Дифференциальная диагностика клинических проявлений, обусловленных присоединением инфекции, с таковыми, связанными с обострениями основного заболевания, довольно затруднительна. Реальную помощь при этом могут оказывать постоянная настороженность врача, знание клинических проявлений инфекционных процессов, использование в диагностике комбинации анамнестических, физикальных и лабораторных данных.
В последние годы появились публикации, отмечающие увеличение риска развития злокачественных лимфом у лиц с различными аутоиммунными заболеваниями, получающими ГКТ. Нельзя не согласиться с мнением J. Askling et al. (2005), что эти данные отличаются некорректностью, так как они базируются на изучении больных с такими заболеваниями, как СКВ, РА и др., при которых наблюдается повышенный риск развития лимфом. Кроме того, многие из таких больных получали ГК с препаратами цитотоксического действия, которые, по мнению большого числа авторов, увеличивают риск развития лимфом.
С нашей точки зрения, в обсуждаемом контексте уместно привести результаты недавно опубликованного (декабрь 2005) крупномасштабного исследования шведских авторов, показавших отсутствие ассоциаций ГКТ (применялись умеренные и большие дозировки ГК) с риском развития лимфом у больных с гигантоклеточным артериитом и ревматической полимиалгией.
Глюкокортикоиды — беременность и лактация
В целом ГК хорошо переносятся беременными. Плацента обладает способностью конвертировать преднизолон и метилпреднизолон в неактивный преднизолон. Напротив, дексаметазон свободно проходит через плаценту, в связи с чем его концентрация у матери и плода одинаковая. Исходя из этого, если ГК назначаются для лечения роженицы, должны использоваться преднизон, преднизолон или метилперднизолон. В то же время если ГКТ необходима плоду (например, при фетальном миокардите или для превентирования дистресс-синдрома), следует назначать дексаметазон.
Отсутствуют данные о тератотоксических и фетотоксических эффектах на фоне применения ГК независимо от срока гестации.
Концентрация преднизона, преднизолона и метилпреднизолона в молоке матери невелика, в связи с чем кормление грудью возможно у женщин, получающих эти препараты.
Показания к применению глюкокортикоидов
Описанные многогранные механизмы действия ГК и различные точки их приложения послужили основанием для их широкого применения при многих заболеваниях внутренних органов, а также ряде патологических состояний. Наряду с ревматическими заболеваниями и системными васкулитами, при которых ГК нередко являются базисными препаратами, ГКТ также используется в эндокринологии, гастроэнтерологии, реаниматологии, кардиологии, пульмонологии, нефрологии, травматологии и др.
Ниже мы приводим заболевания и патологические состояния, где находят применение ГК.
Ревматология
— Ревматоидный артрит — при отсутствии тяжелых экстраартикулярных проявлений заболевания (системный васкулит, серозиты, миокардит, фиброзирующий альвеолит, облитерирующий бронхиолит) применяются низкие дозировки ГК на фоне болезнь-модифицирующей терапии. При развитии вышеперечисленных экстраартикулярных проявлений РА применяются средние, а при необходимости — высокие дозировки ГК.
Васкулиты
— Гигантоклеточный артериит — в острой стадии ГК являются терапией выбора и назначаются в высоких дозировках.
Гломерулонефриты
— ГН с минимальными изменениями (идиопатический нефротический синдром) — на начальных этапах заболевания или при его обострениях терапией выбора являются ГК, назначаемые в средних или высоких дозировках.
При вторичных ГН (т.е. ГН, развившихся при СКВ, РА, полимиозите, дерматомиозите, васкулитах) используют средние или высокие дозы ГК.
Эндокринная патология
— Дефицит АКТГ при различных заболеваниях гипофиза — в качестве заместительной терапии применяются гидрокортизон или альтернативно низкие дозы ГК.
Желудочно-кишечный тракт
— Болезнь Крона — в острой стадии используются высокие дозы ГК.
Кардиология
— Поствирусный и неспецифический лимфоцитарный миокардит — назначаются средние или высокие дозы ГК.
Пульмонология
— Бронхиальная астма — пероральные ГК (средние или высокие дозировки) назначаются при острой тяжелой астме, тяжелых обострениях астмы, когда неэффективны ингаляционные ГК и бронходилататоры.
Гематология
— Гемобластозы — используются высокие и очень высокие дозы ГК.
Острые состояния
— Шоки различного происхождения — используют высокие и очень высокие дозы ГК; предпочтительно проведение пульс-терапии.
Трансплантология
В зависимости от особенностей клинической ситуации используются ГК от низких до очень высоких дозировок, а при необходимости — пульс-терапия.
Заключение
Требования к проведению ГКТ
1. Четкое обоснование необходимости применения ГК.
2. Аргументированный выбор ГК препарата, характеризующегося как высокой эффективностью, так и относительно низким спектром побочных эффектов. Этим требованиям соответствует метилпреднизолон, метилпреднизолона натрия сукцинат и метилпреднизолона ацетат, аргументы чему приведены выше.
3. Выбор первоначальной дозы ГК препарата, обеспечивающего необходимый клинический эффект при минимальных его дозировках, должен базироваться на углубленной оценке состояния пациента, включающей нозологию заболевания, его активность, наличие поражения жизненно важных органов и систем, а также общепризнанные рекомендации в тактике ГКТ при различных клинических ситуациях. Сегодня ГКТ однозначно признается терапией выбора при многих ревматических заболеваниях, включающих СКВ, дерматомиозит и полимиозит, васкулиты, ГН и др. При этом первоначальные дозировки существенно разнятся в зависимости от особенностей клинической картины и лабораторных показателей. Так, например, при высокой активности СКВ, дерматомиозита, полимиозита, системных васкулитов и/или вовлечении при этих заболеваниях жизненно важных органов и систем показано применение высоких или очень высоких дозировок ГК. В то же время при низкой активности СКВ, васкулитов хороший клинический эффект может быть достигнут низкими дозировками ГК, а при отсутствии поражения внутренних органов и ЦНС для достижения клинической ремиссии нет необходимости в назначении ГКТ, так как достаточный клинический эффект может быть достигнут использованием НПВП, обычно в сочетании с аминохинолиновыми препаратами. При этом ряд больных нуждается в дополнительном применении низких доз ГК (метилпреднизолон 4–6 мг/сутки или преднизолон 5–7,5 мг/сутки).
Широкое использование болезнь-модифицирующих препаратов уже на ранних этапах РА, отсутствие данных о положительном влиянии средних и высоких дозировок ГК на отдаленный прогноз у больных РА и высокий риск серьезных побочных эффектов при их применении существенно изменили подходы к использованию ГК. Сегодня при отсутствии серьезных экстрасуставных проявлений РА (например, васкулиты, пневмониты) не рекомендуется применение ГК в дозировках, превышающих 7,5 мг/сутки преднизолона или 6 мг метилпреднизолона. Более того, у многих больных РА добавление к болезнь-модифицирующей терапии 2–4 мг/сутки метилпреднизолона характеризуется хорошим клиническим эффектом.
4. Установить методику приема ГК: непрерывный (ежедневный) или прерывистый (альтернативный и интермиттирующий) варианты.
5. При большинстве ревматических заболеваний, васкулитах, ГН ГК обычно недостаточно для достижения полной или частичной клинико-лабораторной ремиссии, что требует их комбинации с различными препаратами цитотоксического действия (имуран, циклофосфан, метотрексат и др.). Кроме того, использование цитостатиков позволяет существенно снижать дозировку ГК (или даже отменить их) при сохранении полученного клинического эффекта, что существенно снижает частоту и тяжесть побочных эффектов ГКТ.
6. Многие клиницисты рекомендуют продолжать длительно использовать очень низкие дозировки ГК (2–4 мг/сутки метилпреднизолона или 2,5–5,0 мг/сутки преднизолона) у многих больных ревматическими заболеваниями после достижения клинико-лабораторной ремиссии.
