Газета «Новости медицины и фармации» Неврология (299) 2009 (тематический номер)
Вернуться к номеру
Сахарный диабет и цереброваскулярные заболевания
Авторы: Т.С. Мищенко, Т.Г. Перцева, ГУ «Институт неврологии, психиатрии и наркологии АМН Украины», г. Харьков
Версия для печати
Цереброваскулярные заболевания (ЦВЗ) являются одной из основных причин смертности и инвалидизации населения земного шара. В ближайшие десятилетия эксперты ВОЗ предполагают дальнейший рост распространенности этой патологии, что обусловлено «постарением» населения планеты и увеличением частоты встречаемости в популяции таких факторов риска развития сосудистых заболеваний головного мозга, как артериальная гипертензия (АГ), болезни сердца, сахарный диабет (СД), гиперхолестеринемия, гиподинамия, курение и другие [1–5].
В настоящее время многочисленными широкомасштабными исследованиями доказано, что сахарный диабет является одной из основных причин и важнейшим фактором риска различных форм ЦВЗ [4].
В последние годы значительно возрос интерес неврологов к проблеме СД, что связано с рядом причин. Во-первых, увеличилось число больных с поражением как центральной, так и периферической нервной системы, обусловленным СД. Это связано со стремительным ростом в мире заболеваемости СД и превращением ее в глобальную эпидемию. Так, согласно данным ВОЗ, в 1985 году во всем мире насчитывалось около 30 млн человек, страдающих СД, десять лет спустя — 135 млн, в 2000 году — 177 млн. К 2025 году эта цифра может удвоиться и составить 300 млн [4, 5]. В среднем от 1,2 до 13,3 % населения планеты страдает СД. При этом около 90–95 % всех заболеваний приходится на СД II типа. Почти 2/3 всех диабетиков проживает в развитых странах. Ежегодно около 4 млн смертей во всем мире происходит по причине СД [5]. Таким образом, диабет быстро распространяется, поражая все большее количество людей, увеличивая затраты на здравоохранение.
Несмотря на значительные достижения в понимании патофизиологии и молекулярной биологии сахарного диабета, это заболевание остается серьезной медицинской и социальной проблемой, что объясняется негативной тенденцией к росту заболеваемости населения (240 млн больных в мире), высокой частотой поражений разных органов и систем, ростом инвалидности и смертности.
По данным Всемирной организации здравоохранения, в экономически развитых странах до 4–6 % населения болеет сахарным диабетом. В Европе удельный вес таких больных составляет около 4 %. ВОЗ констатирует, что сахарный диабет предопределяет повышение смертности в 2–3 раза и сокращает продолжительность жизни на 10–30 %.
Также актуальна эта проблема в Украине, в которой на 01.01.2008 г. официально зарегистрировано 1 млн 94,124 тыс. больных СД (2,4 % населения). Эта ситуация осложняется тем, что на 1 больного с выявленным СД по подсчетам приходится около 3–4 больных с недиагностированной патологией [6].
Вместе с ростом числа больных СД увеличивается количество пациентов, страдающих от осложнений этого грозного заболевания, которые являются основной причиной инвалидизации и смертности. СД характеризуется генерализованным поражением как мелких сосудов (микроангиопатия), так и сосудов среднего и крупного калибра (макроангиопатия), которое получило собирательное название «диабетическая ангиопатия». Наличие и выраженность диабетической ангиопатии определяют прогноз заболевания и судьбу больного [7]. Изменения в мелких сосудах (артериолах, капиллярах, венулах) носят специфический для СД характер, в крупных — расцениваются как ранний и распространенный атеросклероз. Важным является тот факт, что диабетическая макроангиопатия не имеет специфических отличий от атеросклеротических изменений у людей без СД. Однако атеросклероз у больных с СД развивается на 10–15 лет раньше, чем у лиц без него. Он не щадит людей молодого и среднего возраста, особенно при многолетнем течении заболевания. Если у больных с атеросклерозом без СД преимущественно поражаются венечные, мозговые или периферические сосуды, то при СД атеросклероз затрагивает большинство артерий, что объясняется метаболическими нарушениями, предрасполагающими к сосудистым поражениям. СД по сущности обменных нарушений — естественная модель атеросклероза. Распространенности атеросклеротического процесса при СД способствует микроангиопатия. Такие особенности поражения сосудистой системы при СД объясняют значительную распространенность сердечно-сосудистых заболеваний, в том числе ЦВЗ, при этой патологии.
Уже в момент выявления клинически манифестного СД II типа более чем у половины пациентов имеются признаки сердечно-сосудистых заболеваний [8]. На основании проведенных широкомасштабных исследований было установлено, что СД повышает риск развития мозгового инсульта в 2–6 раз, ишемической болезни сердца (ИБС) — в 2–4 раза, инфаркта миокарда — в 6–10 раз по сравнению с риском в общей популяции [4, 9–13]. Согласно последним рекомендациям по профилактике сердечно-сосудистых заболеваний, СД приравнивается по своей силе к такому сильному и доказанному фактору риска ИБС, как перенесенный в прошлом инфаркт миокарда [14]. Риск развития сердечно-сосудистых катастроф у больных СД значительно повышается, когда у этих пациентов имеются и другие факторы риска. Так как СД II типа, как правило, развивается у лиц старше 50 лет, он часто протекает на фоне АГ, дислипидемии, которые обычно возникают в таком возрасте. Больные СД II типа часто страдают ожирением или у них отмечается перераспределение жира с преимущественным накоплением в абдоминальной области. Сочетание СД с этими заболеваниями значительно повышает риск развития сосудистых катастроф и объясняет их более тяжелое течение и высокую смертность среди больных. По данным эпидемиологических исследований, проведенных в европейских странах и США, сердечно-сосудистые заболевания являются причиной смерти у 75 % лиц, болеющих СД [8].
Относительный риск развития инсульта выше у лиц с СД II типа в 1,8–6 раз по сравнению с лицами без СД. В исследовании MRFIT риск смерти от инсульта среди пациентов с СД был в 2,8 раза выше по сравнению с пациентами без СД, при этом риск смерти от ишемического инсульта был выше в 3,8 раза, от субарахноидального кровоизлияния — в 1,1 раза и от внутримозгового кровоизлияния — в 1,5 раза. Высокая частота ишемических инсультов при СД II типа во многом определяется его вкладом в развитие атеротромбоза, который рассматривается как один из основных механизмов развития ишемического инсульта. В то же время в подавляющем большинстве проспективных исследований не отмечено достоверных корреляционных связей между ведущим фактором риска атеросклероза — холестерином — и частотой развития инсульта.
До недавнего времени доминировало представление, что снижение уровня холестерина не имеет профилактического значения в отношении инсульта и даже может увеличить частоту геморрагического инсульта. Отсутствие связи между уровнем холестерина и риском инсульта подтвердилось и в исследовании POSCH, в котором снижение холестерина достигалось за счет хирургического вмешательства на тонком кишечнике. Снижение уровня холестерина в этом исследовании привело к достоверному снижению сердечно-сосудистой смертности, но не уменьшило риск инсульта. В связи с этим особый интерес вызывает современное представление о ведущей роли дисфункции эндотелия в развитии и прогрессировании атеросклероза при СД II типа. Инсулинорезистентность и факторы сердечно-сосудистого риска встречаются значительно чаще при СД II типа, чем в общей выборке, что приводит к значительному повышению риска атеросклероза.
Таким образом, СД является сильным и независимым фактором риска развития сердечно-сосудистых заболеваний и причиной высокой смертности.
Есть еще одна важная причина, которая объясняет возрастающий интерес неврологов к проблеме СД. Это проблема метаболического синдрома (МС), который патогенетически тесно связан с СД II типа. К сожалению, как СД, так и МС прогрессивно распространяются среди населения земного шара. Согласно эпидемиологическим данным, в некоторых странах до 24 % взрослого населения имеет клинические признаки этого синдрома [15]. МС является «болезнью» современного образа жизни, расплатой за урбанизацию (малоподвижный образ жизни, нерациональное питание, отсутствие необходимой физической нагрузки). МС встречается у 60 % больных, которые имеют факторы риска сердечно-сосудистых заболеваний. Наличие МС повышает риск развития сердечно-сосудистых осложнений в 5–6 раз, в том числе риск развития мозгового инсульта (МИ) в 7 раз [15, 16].
Проявлением большого внимания неврологов к проблеме СД и МС явилась 14-я Европейская конференция по инсульту (Болонья, Италия, 25–28 мая
СД — фактор риска развития всех форм ЦВЗ
Сегодня имеется достаточно данных о том, что СД является важнейшим фактором риска развития всех форм ЦВЗ.
По данным проведенных эпидемиологических исследований, СД отмечается у 8–20 % больных с МИ. 15–28 % больных с МИ имеют клинические признаки СД, но не знают об этом [3].
Результаты проведенных широкомасштабных исследований свидетельствуют о том, что СД повышает риск развития ишемического мозгового инсульта в 1,8–6 раз [18, 19]. Пациенты с СД II типа имеют более высокий риск развития МИ, чем больные СД I типа. Хотя в среднем МИ у больных СД I типа происходит на 10 лет раньше, чем у больных без СД. Мозговой инсульт у больных СД, как правило, возникает в возрасте 50–70 лет и чаще у женщин.
Исследование Honolulu Heart Prog-ram, проведенное среди гавайских японцев, показало, что наличие СД повышает риск развития тромбоэмболического инсульта в 2 раза [18]. При этом была установлена зависимость риска развития ишемического и геморрагического инсульта от уровня глюкозы в крови.
Во Фрамингемском исследовании показано повышение риска развития мозгового инсульта в 4 раза при наличии у больных СД [19].
Также многочисленными исследованиями было установлено, что наличие СД повышает риск развития транзиторных ишемических атак (ТИА) в 3 раза [10].
Основными причинами развития мозгового инсульта у больных СД являются ускоренное развитие атеросклероза, снижение фибринолитической активности, повышение агрегации и адгезии тромбоцитов и как следствие — повышенный риск развития тромбозов сосудов головного мозга. Важную роль в развитии острых нарушений мозгового кровообращения у больных СД играют хроническая церебральная ишемия, эндотелиальная дисфункция, нарушение ауторегуляции мозгового кровотока и цереброваскулярной реактивности, повышенная вязкость крови, нарушение синтеза простациклина и др. [20]. Роль СД в развитии МИ не исчерпывается перечисленными механизмами, а является более сложной и многогранной.
У больных СД чаще развиваются атеротромботический и лакунарный инсульты. Причинами увеличения частоты инфаркта мозга тромботического характера у больных СД являются значительные атеросклеротические изменения сосудов мозга, повышение вязкости крови и нарушение ее коагуляционных свойств (угнетение антисвертывающей и активация свертывающей системы).
Следует отметить, что у больных СД преимущественно поражаются сосуды вертебробазилярного бассейна, поэтому ишемические инсульты чаще возникают в этом сосудистом бассейне. Только у 25–28 % больных с мозговым инсультом имеет место стеноз внутренней сонной артерии (ВСА) > 50 %.
В развитии лакунарного инфаркта мозга у больных СД ведущая роль принадлежит артериальной гипертензии, которая часто сопровождает СД, а также хронической мозговой недостаточности. Лакунарные инфаркты возникают у больных при активной деятельности, когда существенно возрастает потребность в увеличении кровоснабжения мозга, вследствие чего создаются условия для нарастания цереброваскулярной недостаточности.
Таким образом, наличие выраженных церебральных макро- и микроангиопатий, поражения симпатических вазомоторных нервов, характерных сдвигов в свертывающей и антисвертывающей системах крови позволяют объяснить причины увеличения частоты ишемических инсультов у диабетиков при относительной редкости кровоизлияний в мозг, которые возникают преимущественно при небольшой длительности заболевания и продолжительной гипогликемической коме у больных молодого возраста.
Отмечены особенности клинического течения мозговых инсультов у больных СД [17]. Как отмечалось выше, у больных СД значительно чаще развивается атеротромботический и лакунарный ишемический инсульт. МИ чаще возникает в дневные часы, во время бодрствования больного, на фоне повышенного АД. У некоторых больных он протекает по псевдотуморозному типу. Часто происходит трансформация ишемического очага в геморрагический, что связано с высоким уровнем гипергликемии. Смертность от ишемического инсульта значительно выше у пациентов с СД, чем без него, и составляет от 40 до 59 %. Наиболее распространенными причинами летальности у этих пациентов являются большие размеры очага, декомпенсация диабетических нарушений, развитие инфаркта миокарда, нефропатии, пролежни и др.
Геморрагические инсульты у больных СД встречаются значительно реже и имеют особенности клинического течения. Так, паренхиматозные кровоизлияния в большинстве случаев развиваются постепенно. При субарахноидальных кровоизлияниях также начало не острое, менингеальные симптомы выражены не резко, имеет место умеренное психомоторное возбуждение. Однако в дальнейшем почти у половины больных развиваются коматозные состояния. Смертность у этих больных значительно выше, чем у пациентов без СД.
Особого обсуждения заслуживают подходы к контролю метаболизма глюкозы у больных с МИ. Контроль метаболизма глюкозы является важной составляющей общей терапии МИ. Опыт, накопленный при проведении многоцентровых проспективных клинических исследований, свидетельствует о том, что необходим постоянный и строгий контроль сахара крови в остром периоде МИ, особенно у пациентов, страдающих СД. Известно, что как гипер-, так и гипогликемия оказывают негативное влияние на исход МИ [2, 3].
При уровне сахара крови >10 ммоль/л показано применение инсулина. Больным, у которых имеются явления гипогликемии (сахар крови < 2,8 ммоль/л), необходимы инфузии 10–20% раствора глюкозы.
Восстановление нарушенных функций у выживших после МИ больных, страдающих СД, протекает значительно хуже. У таких больных выше степень инвалидизации. Чаще в постинсультном периоде у них развиваются повторные нарушения мозгового кровообращения и сосудистая деменция.
Таким образом, сегодня мы имеем достаточно данных, чтобы считать СД независимым фактором риска развития МИ, равным по своей силе такому фактору риска, как перенесенный инсульт.
Кроме того, СД отводится важная роль в формировании хронической прогрессирующей недостаточности мозгового кровообращения — диабетической энцефалопатии.
Термин «диабетическая энцефалопатия» предложен R. De Jong в
Патогенез диабетической энцефалопатии до конца неясен. И все же ведущими звеньями патогенеза диабетической энцефалопатии считают поражения мелких церебральных артерий, сосудов среднего калибра и магистральных (сонных и позвоночных) артерий, которые приводят к развитию гипоксии мозга [20].
Облигатными признаками диабетической энцефалопатии являются когнитивные нарушения, которые определяются при нейропсихологических исследованиях [20, 21]. У пациентов с СД часто возникают нарушения праксиса, гнозиса, речевых и пространственных функций, зрительной и слуховой памяти, а также нарушения межполушарных взаимоотношений. Особенность проблемы когнитивного дефицита у больных СД II типа состоит в том, что такой дефицит может быть следствием не только СД, но и старения.
Особым вопросом в проблеме СД является влияние инсулина на когнитивные функции. Несмотря на то что инсулин не проникает через гематоэнцефалический барьер и потому не должен оказывать влияния на мозг, в ряде исследований показано существование инсулиновых рецепторов и самого инсулина в лимбических структурах головного мозга [22]. Более того, оказалось, что инсулин и инсулиновые рецепторы играют важную роль в синаптической передаче и могут быть связаны с такими важнейшими функциями мозга, как пищевое поведение, обучение и память [22]. Гиперинсулинемия сама по себе может определять когнитивное снижение, а нарушения в системе инсулина — негативно влиять на когнитивные функции, вплоть до развития болезни Альцгеймера [21]. Было установлено, что у больных, получающих инсулин, высок риск развития деменции, которая не просто отражает тяжесть диабета, но может быть и непосредственно связана с инсулинотерапией. Наличие сопутствующей диабету артериальной гипертензии значительно способствует прогрессированию когнитивных нарушений.Исходя из приведенных данных можно предположить, что инсулин, в том числе содержащийся в ткани головного мозга, играет большую роль в патогенезе диабетической энцефалопатии.
Итак, с одной стороны, инсулинотерапия полезна для мозга, так как ослабляет токсический эффект хронической гипергликемии, что подтверждается улучшением у больных СД когнитивных функций после нормализации гликемического профиля сахароснижающими препаратами. С другой стороны, инсулинотерапия может приводить к гиперинсулинемии и обусловливать прямое поражающее действие инсулина на головной мозг в связи с нарастающими изменениями в синаптических структурах и клеточных мембранах [22].
Когнитивные нарушения у больных СД быстро прогрессируют и часто заканчиваются развитием сосудистой деменции, которая не просто отражает тяжесть диабета, но может быть непосредственно связана с инсулинотерапией.
У части больных СД в результате гипогликемических состояний развивается гипогликемическая энцефалопатия. Клинически она проявляется нарастанием вялости, апатии, адинамии у больных после физической работы и натощак, расстройством сознания, чаще всего по типу делирия. Характерно наличие судорожного синдрома, возможны пирамидные гемипарезы.
Таким образом, больные с СД входят в группу риска развития деменции, а наличие АГ способствует усугублению когнитивного дефицита.
Вышеприведенные данные свидетельствуют о том, что СД является фактором риска развития всех форм ЦВЗ — мозгового инсульта, транзиторных ишемических атак, диабетической энцефалопатии и сосудистой деменции.
Все это подтверждает необходимость проведения мероприятий по раннему выявлению и адекватному лечению больных СД.
Конечная цель этих мероприятий предполагает предотвращение развития как острых, так и хронических нарушений мозгового кровообращения, и в итоге улучшение качества жизни и снижение смертности у больных СД.
Лечение и профилактика цереброваскулярных заболеваний у больных СД
С целью предотвращения развития сосудистых заболеваний, в том числе цереброваскулярных, у больных СД, необходимо проведение комплекса лечебных мероприятий, направленных: 1) на коррекцию гипергликемии; 2) коррекцию сопутствующих факторов риска — АГ, дислипидемии, ожирения; 3) нормализацию тромбоцитарного гемостаза; 4) улучшение мозгового кровотока и метаболизма мозга.
Исходя из данных, полученных при проведении многочисленных исследований, были установлены целевые значения уровней сахара крови, гликозилированного гемоглобина, артериального давления (АД), липопротеидов низкой и высокой плотности, к достижению которых следует стремиться у больных СД для предупреждения развития макро- и микроангиопатий [8].
Коррекция гипергликемии играет важную роль в снижении риска развития сосудистых осложнений, особенно микроангиопатий.
Показано снижение уровня сахара крови > 110 мг/дл (6,1 ммоль/л), гликозилированного гемоглобина ≤ 7,0 %. Выводы 20-летнего исследования у больных СД II типа (UKPDS) свидетельствуют о том, что снижение уровня гликозилированного гемоглобина < 7,0 % на 1 % уменьшает риск микрососудистых осложнений на 35 %, и на 25 % — всех осложнений. Кроме того, снижение содержания гликозилированного гемоглобина на каждый процент обусловливает сокращение смертности на 25 % [23]. Достичь необходимого уровня сахара крови и гликозилированного гемоглобина можно, применяя сахароснижающие препараты в правильно подобранных дозах. Однако сегодня еще окончательно не установлено, играет ли роль тщательный контроль глюкозы крови в профилактике развития МИ [24].
Коррекция артериальной гипертензии. АГ является одним из основных факторов, который способствует прогрессированию ЦВЗ у больных СД. АД у больных СД должно быть снижено более агрессивно, чем у пациентов без СД и находиться в пределах АД < 130/85 мм рт.ст. [25]. Добиться этого можно путем применения антигипертензивных препаратов и диеты. Гипотензивная диета состоит в уменьшении потребления пищевой соли до
Гипотензивные препараты для коррекции АД у больных СД должны отвечать следующим требованиям: оказывать пролонгированное действие в течение суток, способствовать регрессированию поражений органов-мишеней (уменьшение гипертрофии левого желудочка), обладать положительным метаболическим действием. Использование препаратов пролонгированного действия позволяет обеспечивать равномерный терапевтический эффект в течение суток и нормализовать суточную вариабельность АД, изменения которой наблюдаются у большинства больных с признаками ЦВЗ.
Результаты проведенных многочисленных исследований свидетельствуют о том, что ингибиторы АПФ относятся к препаратам первого ряда для лечения АГ и профилактики сердечно-сосудистых заболеваний у больных СД.
В исследовании HOPE, в которое были включены лица с высоким риском развития сердечно-сосудистых заболеваний, в том числе, естественно, и больные, страдающие СД, было выявлено, что прием ингибитора АПФ приводит к уменьшению числа всех случаев сердечно-сосудистых заболеваний у больных СД на 25 %, инфаркта миокарда — на 22 %, инсульта — на 33 %, сердечно-сосудистой смертности — на 37 %, общей смертности — на 24 % [26].
Результаты проведенного международного многоцентрового исследования PROGRES [27], в которое были включены пациенты, перенесшие МИ или ТИА, свидетельствуют о том, что назначение ингибиторов АПФ периндоприла и индапамида способствовало снижению частоты повторного инсульта на 28 %, в том числе ишемического — на 24 %, геморрагического — на 50 %.
Результаты исследований EUROPA и PERSUADE убедительно подтвердили эффективность периндоприла в снижении риска сердечно-сосудистых заболеваний у больных СД.
Коррекция дислипидемии. Коррекция дислипидемии является важным направлением лечения и играет существенную роль в формировании и уменьшении прогрессирования ЦВЗ у больных СД. Необходимо поддерживать уровень холестерина липопротеидов низкой плотности ≤ 2,6 ммоль/л, холестерина липопротеидов высокой плотности ≤ 1,2 ммоль/л, триглицеридов ≤ 1,7 ммоль/л. Недавно закончившиеся 5 крупных исследований, оценивающих эффективность терапии статинами, подтвердили включение больных диабетом в категорию высокого риска и пользу снижающей холестерин терапии у этих больных.
Результаты исследований 4S, CARE, LIPID, MIRACH, HPS продемонстрировали нейропротективные эффекты статинов и показали снижение риска развития инсульта от 19 до 51 % [28–31].
До настоящего времени наиболее крупные исследования по коррекции дислипопротеинемий статинами включали небольшое количество больных и проводились в рамках вторичной профилактики ИБС, то есть у больных с установленной ИБС. К таким исследованиям относятся 4S, CARE, LIPID, в которых приняло участие 4444, 4159, 9014 человек, в том числе больных СД 202, 603 и 777 соответственно. В этих трех исследованиях статины достоверно снижали риск инсульта у пациентов с ИБС, но без предшествующих цереброваскулярных заболеваний: в исследовании 4S лечение симвастатином привело к снижению риска инсульта и ТИА на 28 % (р = 0,033). В подгруппе из 202 больных сахарным диабетом применение симвастатина в течение 5,4 года снизило риск коронарной смерти на 55 %, острых нарушений мозгового кровообращения — на 62 %, общую смертность — на 43 %. В исследовании 4S впервые было продемонстрировано, что снижение ХС ЛПНП способно улучшить прогноз у больных СД II типа в сочетании с ИБС, а абсолютная польза снижения ЛПНП у больных СД с ИБС превышала таковую у лиц без СД. В исследовании CARE лечение правастатином снизило риск инсульта на 32 % (р = 0,03); в исследовании LIPID терапия правастатином привела к снижению негеморрагического инсульта на 23 % (р = 0,02). Результаты этих рандомизированных плацебо-контролируемых исследований позволили сделать вывод о необходимости лечения статинами больных СД, имеющих различные формы ИБС, с целью первичной профилактики инсульта. Одним из наиболее крупных исследований, посвященных изучению влияния аторвастатина на сердечно-сосудистый риск, в том числе и на риск инсульта у больных СД II типа (в рамках первичной профилактики сердечно-сосудистых осложнений и инсульта), является исследование CARDS. Это испытание было прекращено почти за 2 года до намеченного срока в связи с очевидными преимуществами аторвастатина [37–45].
Следует подчеркнуть, что наиболее строгие доказательства эффективности статинов получены при применении симвастатина. Результаты исследования HPS в подгруппе пациентов с СД подтвердили высокую гиполипидемическую эффективность симвастатина и снижение риска развития микро- и макроваскулярных осложнений и в итоге снижение риска тяжелых сосудистых осложнений на 33 %. При этом риск развития инсульта снизился на 24 % [30, 31]. Сведения по другим препаратам этой группы основаны на анализе данных в отношении существенно меньшего числа больных.
Недавно закончившееся исследование CARDS показало, что назначение аторвастатина снижает риск мозгового инсульта с 2,46 до 1,54 у больных, страдающих СД.
В течение последних лет в нескольких исследованиях изучалась концепция о возможном более выраженном терапевтическом эффекте статинов при более агрессивной тактике снижения ЛПНП (основанием для этого стали результаты исследований CARDS и HPS). Два из них представляют бесспорный интерес, так как проводились с целью изучения концепции по агрессивному снижению холестерина и влиянию такого лечения на первичную профилактику инсульта у больных с ИБС — исследование TNT; и вторичную профилактику инсульта у пациентов с ТИА или инсультом без ИБС — SPARCL.
Результаты этих исследований легли в основу новых рекомендаций по более жесткой цели снижения ЛПНП у больных из групп очень высокого риска для первичной и вторичной профилактики инсульта. Эти исследования продемонстрировали, что снижение ЛПНП < 1,8 ммоль/л следует рассматривать как целевое у категорий очень высокого сердечно-сосудистого риска [46–48].
Проведенные исследования свидетельствуют о том, что для коррекции дислипидемии и профилактики развития ЦВЗ показано назначение статинов (даже при отсутствии признаков атеросклеротического поражения артериального русла).
Нормализация массы тела. Снижение массы тела является очень важным направлением в лечении больных СД, особенно с метаболическим синдромом, и часто недооценивается врачами и пациентами. Особенно важно бороться с абдоминальным ожирением. Необходимо стремиться к тому, чтобы окружность талии у мужчин была меньше
Антитромбоцитарная терапия. Исходя из патогенетических механизмов развития ЦВЗ у больных СД, антитромбоцитарную терапию можно считать важнейшей составляющей профилактики развития сердечно-сосудистых заболеваний у этих больных. Мета-анализ 287 многоцентровых исследований с участием 212 тыс. пациентов, в том числе страдающих СД, показал, что применение антитромбоцитарных препаратов позволяет снизить риск развития инсульта, инфаркта миокарда, смерти от сердечно-сосудистых заболеваний на 22 %. При этом риск развития нефатального инсульта снижается на 25 % [33]. Наибольшее количество исследований выполнено по изучению эффективности аспирина в профилактике ЦВЗ у больных СД [34, 35]. Показано, что аспирин в дозе 81–325 мг в сутки является препаратом первого выбора у больных СД. Исходя из анализа результатов этих исследований, Американская диабетическая ассоциация предлагает всем больным СД при наличии клинических признаков макроангиопатий назначать аспирин. Согласно этим рекомендациям, назначение аспирина показано больным СД I и II типа с высоким риском в первичной профилактике сердечно-сосудистых заболеваний, и в первую очередь ЦВЗ. К таким пациентам относятся больные, у которых имеют место энцефалопатия, ИБС, АГ, ожирение, курение, альбуминурия, дислипидемия, а также пациенты старше 30 лет.
Важной проблемой у больных СД является вторичная профилактика МИ. Больные СД относятся к группе высокого риска развития повторных нарушений мозгового кровообращения. Хорошо известно, что каждый повторный инсульт повышает риск смерти, утяжеляет имеющийся неврологический дефицит и инвалидизацию, часто приводит к развитию сосудистой деменции. Кроме того, у больных, которые перенесли МИ и страдают СД, высокий риск развития инфаркта миокарда, особенно в течение 1-го года. Поэтому антитромбоцитарная терапия, которая позволяет снизить риск развития повторного инсульта или других сосудистых событий на 23–25 % должна стать необходимой составляющей лечения больных СД.
Среди антитромбоцитарных препаратов наиболее изученным лекарственным средством для вторичной профилактики является аспирин. Показано, что назначение аспирина в дозе 50–325 мг в сутки позволяет снизить риск развития повторного инсульта на 25 %. Однако, при применении аспирина у многих больных развиваются побочные явления со стороны желудочно-кишечного тракта, кровотечения. У 20–25 % больных СД развивается аспиринорезистентность (клиническая или биохимическая).
В связи с этим шел поиск новых, более эффективных и безопасных антитромбоцитарных препаратов.
В дальнейшем было установлено, что антагонисты АДФ-рецепторов (тиенопиридиновые производные) оказывают более выраженное профилактическое действие по сравнению с аспирином и эффективны во вторичной профилактике. Данные одного из наиболее крупных исследований по вторичной профилактике МИ CAPRIE продемонстрировали преимущества клопидогреля перед аспирином в снижении риска атеротромботических осложнений у пациентов с перенесенными ТИА и ишемическими инсультами [36]. Результаты этого исследования свидетельствуют о более совершенном профилактическом воздействии клопидогреля по сравнению с аспирином у пациентов с повышенным риском сосудистых осложнений и особенно больных с СД [36]. У больных СД клопидогрель предотвращал 38 случаев осложнений на 1000 леченых больных в год, в то время как у больных без СД — лишь 21 случай.
Результаты этого исследования позволяют рекомендовать клопидогрель в дозе 75 мг в сутки в лечении больных СД, которые перенесли ТИА или МИ.
Улучшение мозгового кровотока и метаболизма мозга. Для уменьшения субъективных и объективных неврологических проявлений диабетической энцефалопатии (ДЭ), а также для улучшения когнитивных функций показано назначение вазоактивных препаратов и препаратов, улучшающих метаболизм мозга.
Исходя их вышесказанного, целью нашего исследования явилось изучение структурно-функциональных и гемодинамических особенностей течения дисциркуляторной энцефалопатии на фоне сахарного диабета II типа.
Задачи исследования:
1. Изучить особенности клинического течения хронических нарушений мозгового кровообращения (ДЭ) у больных сахарным диабетом II типа.
2. Определить характер структурных изменений вещества головного мозга у этих больных.
3. Исследовать состояние церебральной и периферической гемодинамики у обследуемых больных.
Материалы и методы исследования
Для достижения поставленной цели и задач исследования были обследованы 138 больных в возрасте от 45 до 65 лет с дисциркуляторной энцефалопатией II ст. Все обследованные больные были разделены на две группы. Основную группу больных составляли пациенты с сахарным диабетом II типа и признаками ДЭ II степени (88 больных). Группу сравнения составляли 50 пациентов соответствующего пола и возраста с ДЭ II ст. без признаков сахарного диабета. Контрольную группу составляли 30 человек соответствующего пола и возраста без клинических признаков цереброваскулярной патологии и сахарного диабета.
В основной группе больные страдали сахарным диабетом II типа на протяжении 2–10 лет. СД II типа легкой степени тяжести наблюдался у 50 (56,8 %) пациентов, средней степени тяжести — у 38 (43,2 %) больных. Пациентов с тяжелой степенью СД не было. В состоянии компенсации сахарный диабет был у 52 (59,1 %) пациентов, в состоянии субкомпенсации — у 36 (40,9 %) пациентов. Пациенты в состоянии декомпенсации не включались в исследование.
У всех обследованных больных, как у основной группы, так и у больных группы сравнения, ДЭ сопровождалась артериальной гипертензией II ст. Длительность артериальной гипертензии составляла от 5 до 20 лет (в среднем 12,3 ± 4,5 года). Кроме этого, у большинства обследованных больных ДЭ сопровождалась сопутствующей патологией (кардиальной, почечной, легочной и др.).
Была проведена тщательная оценка анамнеза заболевания. Для подтверждения цереброваскулярного поражения головного мозга у больных дисциркуляторной энцефалопатией также проводились параклинические, биохимические исследования и консультации специалистов смежного профиля — терапевта, эндокринолога, офтальмолога и других.
Для выявления когнитивных нарушений в работе была применена шкала оценки психического статуса (Mini-Mental State Examination (MMSE)), которая является скрининговой шкалой для исследования психического статуса больных и позволяет оценить такие основные характеристики, как ориентирование, память, вычислительные функции, основные двигательные и перцептивно-гностические функции.
Магнитно-резонансная томография (МРТ) проводилась на томографе «Образ», компьютерная томография (КТ) проводилась на вычислительном рентгеновском томографе СРТ 1010 (Киев). КТ и МРТ головного мозга дали возможность определить прижизненно морфологические изменения вещества головного мозга у больных дисциркуляторной энцефалопатией у каждого обследованного больного. Томографический анализ содержал в себе общую визуальную оценку и количественные показатели. Учитывались размеры, количество и локализация очагов сниженной плотности, диффузное снижение плотности (лейкоареозис), а также размеры желудочковой системы и субарахноидальных пространств.
Исследование состояния церебральной и периферической гемодинамики оценивалось с применением цветного допплеровского исследования сосудов шеи и нижних конечностей, которое проводилось по стандартной методике на ультразвуковом сканере ULTIMA Pro30 (Украина, РАДМИР).
При исследовании каждой артерии оценивались: анатомическая (структурная) характеристика хода артерий, которая включала состояние просвета артерий, состояние стенки артерий, характеристика внутрипросветных и пристеночных патологических наложений; гемодинамическая характеристика, отображающая характер и спектр кровообращения, цветное допплеровское картирование, направленное энергетическое картирование, которое проводилось для поиска участков с аномальным кровообращением, количественная характеристика кровообращения. Все скоростные параметры кровообращения для каждой артерии измерялись в режиме автоматической оценки параметров кровообращения, усредненной по трем сердечным циклам. Спектральные параметры кровообращения вычислялись программным обеспечением сканера.
Статистическую обработку данных проводили общепринятыми методами, достоверность отличий оценивали по t-критерию Стьюдента.
В задачу корреляционного анализа входило количественное определение плотности связи между двумя признаками (при парной связи) и между результативным признаком и множеством факторных признаков (при многофакторной связи).
Результаты исследования и их обсуждение
В ходе клинико-неврологического обследования больных ДЭ обращало на себя внимание разнообразие субъективной симптоматики. Большинство клинических симптомов можно считать характерными для всех обследованных больных основной группы и группы сравнения. К их числу относились: головная боль, головокружение, шум в голове (как периодический, так и постоянный), шаткость при ходьбе, слабость в нижних конечностях, онемение дистальных отделов конечностей, нарушения сна, общая слабость, быстрая утомляемость, снижение фона настроения, снижение памяти, разнообразные ухудшения состояния пароксизмального характера.
Жалобы на головную боль отмечали 89,8 % больных основной группы и 90 % больных группы сравнения. По нашим данным, у 85,2 % больных основной группы практически постоянная головная боль отмечалась чаще, чем у пациентов группы сравнения — 62 %. Интенсивность головной боли была более выражена у больных группы сравнения. Боль имела преимущественно пульсирующий, волнообразный, распирающий характер. А у больных основной группы интенсивность боли была меньше, она носила более постоянный тупой, ноющий, сжимающий характер и менее зависела от уровня АД и погодных изменений, чаще беспокоила в ночное время и сочеталась с онемением и болью в нижних конечностях. Головная боль часто имела комбинированный характер (сосудистая и ликворная дисфункция). Головокружение системное, несистемное и смешанное тревожило 90,9 % больных основной группы и 72 % пациентов группы сравнения. У 27,3 % пациентов основной группы и 24 % пациентов группы сравнения при возникновении головокружения отмечался шум, звон в голове или ушах, тошнота, ощущение заложенности ушей. У 95,5 % больных основной группы и 76 % больных группы сравнения отмечалась шаткость, неуверенность при ходьбе. При этом на слабость, тяжесть в нижних конечностях жаловались 52,3 % пациента основной группы и 18 % пациентов группы сравнения. Тупые диффузные боли в дистальных отделах нижних конечностей наблюдались у 37,5 % больных основной группы. 27,3 % пациентов основной группы жаловались на онемение дистальных отделов конечностей, тяжесть в ногах, судороги в мышцах, которые возникают чаще в покое во время ночного сна. 52,3 % больных основной группы жаловались на слабость в нижних конечностях, ощущение «ватных» ног. 8 % пациентов группы сравнения также предъявляли жалобы на периодическое ощущение онемения дистальных отделов конечностей, возникающее чаще после пробуждения. 14 % пациентов группы сравнения отмечали периодические умеренно выраженные боли в ногах, возникающие чаще при изменении погоды и при переутомлении и имеющие чаще артралгический характер. Слабость в нижних конечностях отмечали 18 % пациентов группы сравнения, чаще на фоне физической нагрузки. Также для больных основной группы были характерны: повышенный аппетит, жажда, зуд кожи.
У 46,6 % больных основной группы и 46 % больных группы сравнения отмечались нарушения сна. Чаще других встречались проявления астении: общая слабость, адинамия, вялость, повышенная утомляемость, снижение работоспособности у 89,8 % больных основной группы и 86 % больных группы сравнения. Различные психоэмоциональные нарушения в той или иной степени наблюдались практически у всех больных. 59,1 % пациентов основной группы и 50 % пациентов группы сравнения жаловались на немотивированную тревогу, ухудшение настроения, эмоциональную лабильность, повышенную раздражительность, вспыльчивость, иногда плаксивость. Кроме этого, больные отмечали снижение умственной работоспособности: повышенную невнимательность, сложность в концентрации внимания, невозможность длительного сосредоточения на работе, снижение памяти как на текущие события, так и на события в прошлом. Такие нарушения наблюдались у 76,1 % больных основной группы и 68 % пациентов группы сравнения.
У 69 (78,4 %) больных основной группы и 24 (48 %) больных группы сравнения преобладали расстройства памяти (сужение объемов и снижение прочности запоминания) и ухудшение внимания. Наблюдалось сужение круга интересов, появлялась вязкость мышления, снижение умственной работоспособности. У 52 (59,1 %) пациентов основной группы и 25 (50 %) больных группы сравнения отмечалась эмоциональная лабильность, проявления астении в сочетании с тревогой, страхами, сниженным фоном настроения.
Для уточнения степени выраженности когнитивных нарушений всем больным проводилось тестирование с помощью шкалы MMSE. У обследованных нами больных были выражены когнитивные дисфункции, которые, однако, не достигали степени выраженного когнитивного снижения. Средний общий балл в основной группе составлял 24,5 ± 2,7 и 26,1 ± 1,3 в группе сравнения. При этом легкие когнитивные нарушения (27–26 баллов) отмечались у 7 (8 %) больных основной группы и 20 (40 %) больных группы сравнения, а умеренные когнитивные нарушения (25–24 балла) были выявлены у 62 (70,5 %) пациентов основной группы и только у 4 (8 %) пациентов группы сравнения. Анализ структуры полученных показателей свидетельствует, что функции ориентирования были снижены в обеих группах без значительных различий — 8,7 ± 1,1 в основной группе и 8,8 ± 0,7 — в группе сравнения. На этом фоне у всех больных доминировали умеренно выраженные нарушения вербальной памяти (3,8 ± 1,2 у больных основной группы и 4,2 ± 1,2 у больных группы сравнения), вычислительных операций (3,4 ± 1,1 у пациентов основной группы и 3,9 ± 0,4 в группе сравнения) и функций (4,6 ± 1,1 перцептивно-гностических функций в основной группе и 5,6 ± 0,6 в группе сравнения). Полученные показатели у обследованных больных статистически значимо не отличались.
Для оценки структурных нарушений головного мозга всем больным были проведены КТ и МРТ головного мозга.
Проведенные КТ и МРТ исследования показали, что у всех больных отмечалось умеренное расширение желудочков и субарахноидальных пространств (p < 0,05) больших полушарий головного мозга. Проведение анализа субтенториального уровня головного мозга у 90 % больных основной группы и 85 % больных группы сравнения выявило расширение парастволовых цистерн.
Кроме увеличения размеров ликворосодержащих пространств, у обследованных больных отмечались очаговые изменения вещества головного мозга у 45 (51 %) больных основной группы и 16 (32 %) больных группы сравнения.
Единичные мелкие очаги сниженной плотности диаметром меньше 1,5–2 см были выявлены у 15 (17 %) больных основной группы. У больных группы сравнения — в 10 случаях (20 %).
У 25 (28 %) больных сахарным диабетом встречались множественные мелкие очаги сниженной плотности (рис. 1). В группе сравнения такие изменения выявлены у 4 (8 %) больных. У 5 (5,7 %) больных основной группы были обнаружены более крупные очаги (диаметром >
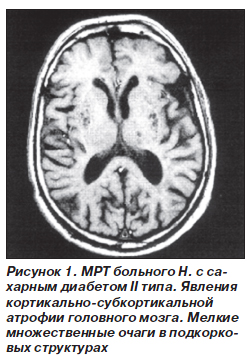 Локализация очагов в коре головного мозга выявлена у 6 (6,8 %) больных основной группы и у 1 (2 %) больного группы сравнения. В подкорковом белом веществе головного мозга визуализировались очаговые изменения у 7 (8 %) больных основной группы и у 2 (4 %) пациентов группы сравнения. У 3 (3,4 %) больных основной группы и у 4 (8 %) больных группы сравнения очаговые изменения были найдены в базальных ганглиях и таламусе. Локализация очагов в среднем мозге встречалась у 1 (1,1 %) пациента основной группы и 2 (4 %) пациентов группы сравнения. В стволе мозга и мозжечке очаговые изменения определялись у 1 (1,1 %) больного основной группы и у 2 (4 %) больных группы сравнения.
Локализация очагов в коре головного мозга выявлена у 6 (6,8 %) больных основной группы и у 1 (2 %) больного группы сравнения. В подкорковом белом веществе головного мозга визуализировались очаговые изменения у 7 (8 %) больных основной группы и у 2 (4 %) пациентов группы сравнения. У 3 (3,4 %) больных основной группы и у 4 (8 %) больных группы сравнения очаговые изменения были найдены в базальных ганглиях и таламусе. Локализация очагов в среднем мозге встречалась у 1 (1,1 %) пациента основной группы и 2 (4 %) пациентов группы сравнения. В стволе мозга и мозжечке очаговые изменения определялись у 1 (1,1 %) больного основной группы и у 2 (4 %) больных группы сравнения.
Следует отметить, что у 9 (10,2 %) больных основной группы выявленные очаги не сопровождались клиническими проявлениями.
Кроме очаговых изменений, у 13 (14,8 %) больных основной группы и у 6 (12 %) больных группы сравнения были выявлены диффузные изменения плотности вещества мозга в виде билатерально расположенных участков сниженной плотности вокруг тел боковых желудочков — явления «лейкоареозиса».
Таким образом, кроме расширения ликворосодержащих пространств, ДЭ характеризовалась наличием очаговых и диффузных изменений вещества головного мозга, чаще у больных с СД, однако эти данные недостоверны.
Сопоставления КТ- и МРТ-данных в зависимости от подавляющего клинического синдрома показали: вестибуло-атактический синдром, доминирующий в клинической картине у больных основной группы в 10 (11,4 %) случаях и у 5 (10 %) больных группы сравнения, находил свое отображение в виде расширения субарахноидальных пространств полушарий мозжечка и цистернальных пространств моста.
У 6 (6,8 %) больных с подкорковым синдромом наблюдалось более выраженное расширение боковых желудочков и субарахноидальных пространств, что иногда сочеталось с очаговыми изменениями в веществе головного мозга.
У больных с сочетанием нескольких синдромов наблюдалось подавляющее расширение желудочков, что в ряде случаев сопровождалось очаговыми изменениями вещества головного мозга. Достоверного соответствия макроструктурных изменений клиническим признакам выявлено не было.
Такие клинические и структурные изменения головного мозга предусматривали нарушение гемодинамики. Исследование состояния церебральной и периферической гемодинамики оценивалось с применением цветного допплеровского исследования сосудов шеи и нижних конечностей.
При измерении диаметра левой общей сонной артерии (ОСАл) нами были получены следующие показатели: 7,95 ± 0,20 у основной группы, 7,88 ± 0,30 в группе сравнения. Диаметр правой общей сонной артерии (ОСАп) составлял 7,88 ± 0,20 в основной группе и 8,11 ± 0,10 в группе сравнения. При обследовании общих сонных артерий нами было установлено, что у больных обеих групп на фоне увеличения толщины комплекса интима-медиа наблюдались нарушения его дифференциации на слои. Толщина комплекса интима-медиа в правых и левых общих сонных артериях у больных основной группы была достоверно (p < 0,01) больше (ОСАл — 1,47 ± 0,05, ОСАп — 1,54 ± 0,05), чем у больных группы сравнения (ОСАл — 1,21 ± 0,05, ОСАп — 1,13 ± 0,08). При этом толщина комплекса интима-медиа общих сонных артерий у больных группы сравнения была достоверно (p < 0,05) меньше, чем у больных основной группы и достоверно (p < 0,05) больше, чем у больных группы контроля.
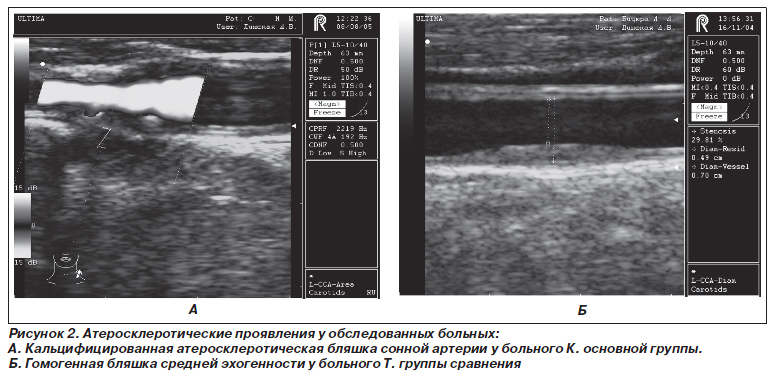
Кроме того, у больных основной группы намного чаще в сосудах, которые исследовались, наблюдались атеросклеротические бляшки неоднородной структуры, с фокусами кальцификации (рис. 2).
При измерении скоростных параметров кровообращения, индексов систоло-диастолы и пульсации достоверных отличий выявлено не было.
Достоверные изменения были выявлены между пациентами основной группы и группы сравнения, а также между пациентами контрольной группы и группы сравнения по показателю индекса резистивности в общих сонных артериях. Индекс резистивности у больных основной группы составлял в ОСАл — 0,740 ± 0,006, в ОСАп — 0,750 ± 0,007, у больных группы сравнения в ОСАл — 0,70 ± 0,01, в ОСАп — 0,71 ± 0,01 и в группе контроля в ОСАл — 0,76 ± 0,09, в ОСАп — 0,76 ± 0,09.
Диаметр правых и левых внутренних сонных артерий у больных основной группы был более достоверным (у ВСАл — 5,94 ± 0,09 и у ВСАп — 5,89 ± 0,10), чем у больных группы сравнения (ВСАл — 5,06 ± 0,19, ВСАп — 5,19 ± 0,22) и контрольной группы (ВСАл — 4,72 ± 1,16, ВСАп — 4,92 ± 1,20).
Гемодинамически незначимые стенозы (до 30 % сужения просвета артерий) у больных основной группы определялись в ОСА у 31 больного (35,2 %), во ВСА — у 16 больных (18,2 %), а у больных группы сравнения в ОСА у 11 больных (22 %), во ВСА у 5 больных (10 %) — во всех парах отличия недостоверные. Гемодинамически значимых стенозов и существенной асимметрии кровотока выявлено не было.
При измерении диаметра общих бедренных артерий (ОБА) мы получили следующие показатели: у основной группы ОБАл — 7,84 ± 0,11, ОБАп — 8,06 ± 0,08, в группе сравнения ОБАл — 7,68 ± 0,18, ОБАп — 7,76 ± 0,18, достоверная разница с группой контроля не выявлена.
Толщина комплекса интима-медиа в правых и левых общих бедренных артериях у больных основной группы была достоверно (p < 0,01) больше (ОБАл — 1,18 ± 0,11, ОБАп — 1,22 ± 0,02), чем у больных группы сравнения (ОБАл — 0,79 ± 0,06, ОБАп — 0,88 ± 0,04) и контрольной группы (ОБАл — 0,80 ± 0,37, ОБАп — 0,80 ± 0,38). Толщина комплекса интима-медиа общих бедренных артерий была достоверно большей у больных основной группы.
При измерении скоростных параметров кровообращения периферических сосудов, индексов систоло-диастолы, пульсации и индекса резистивности достоверных отличий не выявлено.
По показателям: индекс ускорения (А), индекс замедления (D), время замедления (T3) — отличия основной группы и группы сравнения от группы контроля не выявлены.
Достоверные отличия наблюдались между пациентами основной группы и группы сравнения, а также между пациентами контрольной группы и группы сравнения по показателю ускорения времени тока крови (Ту) в подколенных и задних большеберцовых артериях. Обращает на себя внимание отсутствие соответствующей разницы между пациентами основной и контрольной группы. Уменьшение времени ускорения кровообращения в подколенном сегменте артерий нижних конечностей у больных с артериальной гипертензией является результатом повышения сосудистого тонуса.
Диабетическая макроангиопатия приводит к уменьшению эластичности сосудистой стенки и увеличению времени ускорения кровообращения. Возможно, что повышенный сосудистый тонус (результат артериальной гипертензии) вместе со снижением эластичности (результат СД) представляется «нормализацией» времени ускорения кровообращения. Учитывая то, что на время ускорения кровообращения артерий в дистальных отделах конечностей влияет сразу несколько разноплановых факторов, у больных с СД и АГ этот показатель как маркер атеросклеротического поражения не будет информативным.
Стенозы артерий у больных основной группы в ОБА не были выявлены, в ПкА выявлены у 4 больных (4,5 %), а у больных группы сравнения в ОБА — у 2 больных (4 %) и в ПкА стенозирования не выявлено. Во всех парах отличия недостоверные. При этом у больных основной группы преимущественно наблюдалось неравномерное сужение просвета ЗББА в дистальном ее отделе. Достоверных отличий в парах артерий средних диаметров, которые исследовались, у больных основной группы и группы сравнения выявлено не было.
Вместе с тем у больных основной группы намного чаще (в 71 случае; 80,7 %), чем у больных группы сравнения, в 5 случаях (10 %), наблюдались признаки атеросклеротического поражения в дистальных отделах сегментов голеней артерий нижних конечностей в виде мелких, плоских, кальцифицированных атеросклеротических бляшек, которые неравномерно сужали внутренний диаметр артерий.
При анализе полученных данных мы выявили следующие особенности макроангиопатии у больных СД II типа: в сонных артериях — прогрессирующее увеличение толщины комплекса интима-медиа преимущественно в «классическом» месте (на уровне бифуркации) и неоднородность структуры атеросклеротических бляшек при относительно большей степени их кальцификации; в артериях нижних конечностей — подавляющее поражение дистальных отделов сегментов голеней с кальцифицированными, мелкими, плоскими атеросклеротическими бляшками.
На основании проведенных клинических, инструментальных, нейровизуализационных исследований установлены основные принципы формирования хронических нарушений мозгового кровообращения на фоне СД II типа. При сахарном диабете II типа страдают сосуды как мелкого, так и среднего и крупного калибров, развиваются микро- и макроангиопатии, в результате чего нарушается гемодинамика во всем организме. При сочетании диабета с другими факторами риска развития ЦВЗ (АГ, фибрилляция предсердий, курение, ожирение, гиподинамия и др.) усиливаются гемодинамические и метаболические нарушения, что приводит к раннему развитию острых и хронических нарушений мозгового кровообращения.
Таким образом, ввиду повышенного риска развития ЦВЗ, больные СД требуют особого внимания не только эндокринологов, кардиологов, но и неврологов, а также более активного профилактического лечения, направленного на предотвращение развития сосудистых заболеваний головного мозга. Именно эти заболевания являются одной из основных причин инвалидизации и смертности больных СД.
Невзирая на это, многие больные, а порой и врачи в клинической практике часто недооценивают серьезность прогноза при СД и необходимость интенсивного медикаментозного вмешательства.
Сегодня врач и больной СД имеют в своем распоряжении все, что необходимо для профилактики и эффективного лечения ЦВЗ у больных СД. Чем больше общество будет знать о проблемах СД и его цереброваскулярных осложнений, тем качественнее будут профилактика и лечение, способные сберечь миллионы человеческих жизней.
Выводы
1. Установлены характерные клинические особенности ДЭ у больных с СД II типа, быстрое прогрессирование и более тяжелое течение заболевания: вестибуло-атактический (95,5 %), ликворно-гипертензионный (85,2 %), астенический (89,8 %) синдромы, когнитивные нарушения (у 78,4 % больных). 77 % случаев ДЭ при сахарном диабете сопровождаются поражением периферической нервной системы.
2. У больных с ДЭ на фоне СД II типа выявлены характерные структурные изменения вещества головного мозга — множественные лакунарные инфаркты (в коре, в подкорковом белом веществе головного мозга, подкорковых ядрах), большая часть которых имеет асимптомное течение.
3. При наличии СД II типа у больных с ДЭ II ст. больше увеличивается частота и выраженность стенозирующих процессов магистральных артерий головы и шеи по сравнению с больными без диабета (53,4 и 32 % соответственно), из них множественные поражения в 42 % случаев (в группе сравнения — 20 %).
4. Для больных с ДЭ II ст. и наличием СД II типа более характерной является макроангиопатия, что подтверждается дуплексным сканированием стенок сонных артерий: достоверным (р < 0,01) увеличением толщины комплекса интима-медиа, лишением его дифференциации на слои, большим количеством кальцифицированных бляшек, что свидетельствует в пользу более выраженного атеросклеротического процесса.
5. При исследовании артерий нижних конечностей у больных ДЭ II ст. и СД II типа толщина комплекса интима-медиа была достоверно (р < 0,01) большей, чем у пациентов без сахарного диабета. Преобладало двустороннее поражение дистальных отделов и чаще наблюдалась кальцификация стенок сосудов. Это подтверждает наличие системного поражения мелких сосудов у больных СД — микроангиопатии.
1. Wolfe C.D.A., Giroud M., Kolomisnky-Rabas P. et al. Variations in stroke incidence and survival in 3 areas of Europe // Stroke. 2000; 31: 2074-2079.
2. Brainin M., Olsen T.S., Chamorro A. et al. Organization of Stroke Care: Education, Referral, Emergency Management and Imaging, Stroke Units and Rehabilitation // Cerebrovascular Diseases. 2004; 17 (suppl. 2): 1-14.
3. Leys D., Kwiecinski H., Bogous-slavsky J. et al. Prevention for the EUSI Executive Committee and the EUSI Writing Committee // Cerebrovascular Diseases. 2004; 17 (suppl. 2): 15-29.
4. Howard B.V., Rodrigues B.L., Bennett P.H. et al. Diabetes and Cardiovascular Disease: Writing Group I: epidemiology // Circulation. 2002; 105: e132-e137.
5. Jennifer E. Ho, Furcy Paultre, Lori Mosca. Is Diabetes Mellitus a Cardiovascular Disease Risk Equivalent for Fatal Stroke in Women? // Stroke. 2003; 34: 2812-2816.
6. Тронько Н.Д. Государственная комплексная программа «Сахарный диабет» // Doctor. — 2003. — № 5. — С. 9-12.
7. Ефимов А., Зуева Н., Скробонская Н. Диабетические ангиопатии: этиология и патогенез // Ліки України. — 2004, листопад. — С. 36-38.
8. Маньковский Б.Н. Снижение риска сердечно-сосудистых заболеваний у пациентов с сахарным диабетом // Здоров''я України. — 2004, травень. — № 10 (95). — С. 13.
9. Haffner S.M., Lehto S., Ronnemaa T. et al. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabeticsubjects with and without prior myocardial infarction // N. Engl. J. Med. 1998; 339: 229-234.
10. Barrett-Connor E., Khaw K.T. Diabetes mellitus: an independent risk factor for stroke? // Am. J. Epidemiol. 1988; 128: 116-123.
11. Tuomilehto J., Rastenyte D., Jousilahti Р., Sarti C., Vartiainen E. Diabetes mellitus as a risk factor for death from stroke: prospective study of the middle-aged Finnish population // Stroke. 1996; 27: 210-215.
12. Lichtman J.H., Krumholz H.M., Wang Y. et al. Risk and predictors of stroke after myocardial infarction among the elderly: results from the Cooperative Cardiovascular Project // Circulation. 2002; 105: 1082-1087.
13. Evans J.M., Wang J., Morris A.D. Comparison of cardiovascular risk between patients with type 2 diabetes and those who had a myocardial infarction: cross sectional and cohort studies // BMJ. 2002; 324: 939-942.
14. Коваленко В.М., Лутай М.І. Серцево-судинні захворювання. Методичні рекомендації з діагностики та лікування // Здоров''я України. — 2005.
15. Ford E.S., Giles W.H., Dietz W.H. Prevalence of the metabolic syndrome among US adults // JAMA. 2002; 287: 356-359.
16. O''Brien R.E., Hildreth A.J., O''Connell J.E., Gray C.S. (UK) Presentation and outcome from stroke in patients with diabetes mellitus: the influence of pre-stroke care // Cerebrovasc. Dis. 2005; 19 (suppl. 2): 66.
17. Silvestrelli. G., Lanari A., Paciaroni M. et al. Prevalence of stroke subtypes in patients with diabetes mellitus // Cerebrovasc. Dis. 2005; 19 (suppl. 2): 67.
18. Burchfiel C.M., Curb J.D., Rodriguez B.L. et al. Glucose intolerance and 22-year stroke incidence: the Honolulu Heart Program // Stroke. 1994; 25: 951-957.
19. Kannel W.B., McGee D.L. Diabetes and cardiovascular disease: the Framingham Study // JAMA. 1979; 241: 2035-2038.
20. Прихожан В.М. Поражение нервной системы при сахарном диабете (основы нейродиабетологии). — 2-е издание. — М.: Медицина, 1981. — 296 с.
21. Luchsinger J.A., Tang M.X., Stern Y. et al. Diabetes mellitus and risk of Alzheimer''s disease and dementia with stroke in a multiethnic cohort // Am. J. Epidemiol. 2001; 154: 635-641.
22. Коркина М.В., Елфимова Е.В. Диабет и когнитивное старение // Журнал неврологии и психиатрии. — 2004. — № 3. — С. 80-83.
23. Turner R.C., Cull C.A., Frighi V., Holman R.R. Glycemic control with diet, sulfonylurea, metformin, or insulin in patients with type 2 diabetes mellitus: progressive requirement for multiple therapies (UKPDS 49). UK Prospective Diabetes Study (UKPDS) Group // JAMA. 1999; 281: 2005-2012.
24. Weir C.J., Murray G.D., Dyker A.G., Lees K.R. Is hyperglycemia an independent predictor of poor outcome after acute stroke? Results of a long-term follow up study // BMJ. 1997; 314: 1303-1306.
25. Scott J.F., Robinson G.M., French J.M. et al. Blood pressure response to glucose potassium insulin therapy in patients with acute stroke with mild to moderate hyperglycemia // J. Neurol. Neurosurg Psychiatry. 2001; 70: 401-404.
26. Sleight P., Yusuf S., Pogue J., Tsuyuki R., Diaz R., Probstfield J., for the Heart Outcomes Prevention Evaluation (HOPE) Study Investigators. Blood-pressure reduction and cardiovascular risk in HOPE study // Lancet. 2001; 358: 2130-2131.
27. PROGRESS Collaborative Group. Randomised trial of a herindopril-based blood-pressure-lowering regimen among 6105 individuals with previous stroke or transient ischaemic attack // Lancet. 2001; 358: 1033-1041.
28. Scandinavian Simvastatin Survival Study Group. Randomized trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S) // Lancet 1994; 344: 1383-1389.
29. VacMahon S., Sharpe N. et al. Effects of lowering average or below-average cholesterol levels on the progression of carotid atherosclerosis: results the LIPID Atherosclerosis Substudy. LIPID Trial Research Group // Circulation. 1998; 97: 1784-1790.
30. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20.536 high-risk individuals: A randomised placebo-controlled trial // Lancet. 2002; 360 (9326): 7-22.
31. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol-lowering with simvastatin in 5963 people with diabetes: A randomised placebo-controlled trial // Lancet. 2003; 361 (9374): 2005-2016.
32. Мамедов М.Н. Алгоритмы диагностики и лечения метаболического синдрома в клинико-диагностических условиях // Кардиология. — 2005. — № 5. — С. 92-100.
33. Antithrombotic Trialists'' Collaboration. Collaborative meta-analysis of randomized trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients // Br. Med. J. 2002; 324: 71-86.
34. Aspirin Therapy in diabetes. American diabetes association // Diabetes care. 2002. Vol. 25, Suppl. n. Р. 8-9.
36. CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE) // Lancet. 1996; 248: 1329-1339.
37. Caballero A.E. Endothelial Dysfunction in Obesity and Insulin Resistance: A Road to Diabetes and Heart Disease // Obesity Research. 2003; Vol. 11 (11): 1278-1289.
38. Gorelick P.B. Stroke prevention therapy beyond antithrombotics: unifying mechanisms in ischemic stroke pathogenesis and implications for therapy // Stroke. 2002; 33: 862.
39. American Diabetes Association. Management of dyslipidemia in adults with diabetes // Diabetes Care. 2002; 25 (suppl.): S74-S77.
40. Expert panel on detection, evaluation, and treatment of high blood cholesterol in adults (NCEP), Adult Treatment Panel III // JAMA. 2001; 285: 2486-97.
41. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of antioxidant vitamin supplementation in 20536 high-risk individuals: a randomized placebo-controlled trial // Lancet. 2002; 360: 23-33.
42. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20536 high-risk individuals: a randomized placebo-controlled trial // Lancet. 2002; 360: 7-22.
43. Sandercock P. Statins for stroke prevention? // Lancet. 2001; 357: 1548-49.
44. The Long-term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group // N. Engl. J. Med. 1998; 339: 1349-57.
45. LaRosa J.C., Grundy S.M., Waters D.D. et al., for the Treating to New Targets (TNT) investigators. Intensive lipid lowering with atorvastatin in patients with stable coronary disease // N. Engl. J. Med. 2005; 352 (14): 1425-1435.
46. The Stroke Prevention by Aggressive Reduction in Cholesterol Level (SPARCL). Investigators «High-dose atorvastatin after stroke or transient aschemic attack» // N. Engl. J. Med. 2006; 355: 549-559.
47. American Diabetes Association. Standards of Medical Care in Diabetes: Dislipidemia Management // Diabetes Care. 2007; 30 (Suppl. 1): S4-S41.
