Газета «Новости медицины и фармации» Неврология (299) 2009 (тематический номер)
Вернуться к номеру
Пучковая головная боль
Авторы: А.А. Козелкин, А.А. Кузнецов, С.А. Медведкова, Ю.Н. Нерянова. Кафедра нервных болезней с курсом психиатрии, наркологии и медицинской психологии Запорожского государственного медицинского университета
Версия для печати
Пучковая головная боль (ПГБ) — пожалуй, самая мучительная не только среди других форм головной боли, но и среди всего многообразия болевых синдромов — является практически исключительно мужской «привилегией». Начинаясь между 20 и 30 годами жизни, ПГБ не отступает вплоть до 60–65 лет, проявляясь характерными болевыми периодами (так называемыми болевыми пучками) с периодичностью от 2 раз в год до одного раза в 6–8 лет; длительность пучка колеблется от 2 недель до 3 месяцев. В «светлом» межприступном периоде, длящемся в большинстве случаев годами, больной с пучковой ГБ совершенно забывает о своем заболевании и живет полноценной жизнью. При хронической форме ПГБ, которая, к счастью, встречается редко, ремиссии отсутствуют или не превышают 3 недель.
ПГБ является наиболее частым вариантом первичных тригеминально-вегетативных цефалгий (trigeminal autonomic cephalgias — TACs), в структуре которых также выделяют пароксизмальную гемикранию и SUNCT-синдром [92]. Впервые симптомы ПГБ описаны Харрисом в
Эпидемиология
ПГБ — редкая форма головных болей, ее распространенность колеблется от 0,5 до 1 % среди населения [20, 28, 30, 32, 41, 87, 91, 93–95]. Результаты многочисленных эпидемиологических исследований по ПГБ суммированы в табл. 1.
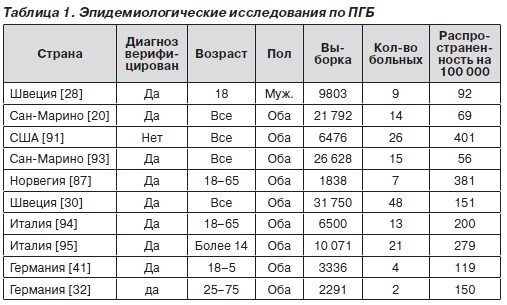
Большинство из них основаны на анализе клинической картины заболевания, а также данных опросников и телефонного интервью. В специализированных клиниках головной боли ПГБ диагностирована у 2,73 % пациентов, при этом выявлено достоверно четкое преобладание заболевания у мужчин. С возрастом отмечена тенденция как к редукции степени выраженности симптомов, так и к уменьшению распространенности [56], что может быть обусловлено повышением выявляемости ПГБ среди женщин [9]. Первый приступ обычно происходит на третьем десятилетии жизни. Однако у большинства пациентов ПГБ диагностируется с некоторым опозданием [4, 100]. В детском возрасте этот вид головной боли встречается весьма редко [44], описаны единичные клинические наблюдения, согласно которым самым маленьким пациентам было 3 года [35]. Выраженность симптоматики ПГБ коррелирует с интенсивностью курения и уменьшается после 70 лет [15].
Этиология и патогенез
Несмотря на значительный прогресс фундаментальных наук на современном этапе развития неврологии, этиология ПГБ остается неизвестной и унифицированная теория патогенеза еще не сформулирована. Однако целый ряд феноменологических исследований позволил предположить некоторые патогенетические звенья заболевания.
В настоящее время убедительно доказано, что вазодилатация офтальмической артерии и проксимальной части внутренней сонной артерии, возникающая в период боли, сочетается с повышением содержания болевых нейропептидов (кальцитонин-связанного пептида и интестинального пептида), что указывает на возможность нейрогенного происхождения вазодилатации в связи с активацией волокон тройничного нерва. В пользу правомочности вышеизложенной концепции патогенеза дополнительно свидетельствует оценка эффекта вазоактивных веществ при ПГБ (вазодилататоры обусловливают возникновение боли, вазоконстрикторы — завершение приступа). Также предполагается неполноценность региональной симпатической иннервации на стороне боли и роль изначальной дисфункции или воспаления сосудов в пределах кавернозного синуса, что инициирует гиперактивность ноцицептивных путей первой ветви тройничного нерва. Однако действительно ли вышеуказанная тригеминально-васкулярная активация, зафиксированная при ПГБ, является ее непосредственной причиной, остается неясным.
На участие в генезе церебральных структур (в частности, гипоталамических) указывает наличие нарушения циклических гормональных сдвигов и ряда вегетативных параметров (в период боли нарушается секреция тестостерона, пролактина, мелатонина, кортизола, эндорфинов, а также изменяется температура тела, артериальное давление и др.), что также может быть связано с дисфункцией гипоталамо-гипофизарно-надпочечниковой системы и в определенной степени объясняет цикличность течения заболевания. Позитронно-эмиссионная томография показала определенную активацию заднего отдела гипоталамуса во время приступов и подтвердила гипотезу об участии супрасегментарных вегетативных структур в патогенезе [60]. У пациентов с ПГБ по сравнению с контрольной группой, по данным объемной морфометрии, было выявлено увеличение объема вещества в заднем гипоталамусе [59]. Роль стволовых систем мозга в генезе заболевания отражают следующие факты: возникновение атак преимущественно в период сна, нарушение структуры сна в период болевого пучка (исчезновение фазы быстрого сна перед атакой) и нормализация сна в период ремиссии, а также изменение реактивности хеморецепторов, связанное с нарушением взаимоотношений сосудодвигательного и дыхательного центров на уровне ствола мозга, что подтверждается наличием сонных апноэ у лиц, страдающих кластерными головными болями.
Некоторые исследователи изучали уровни различных гуморальных субстанций у больных при приступе, в периоды ремиссии и серии приступов ПГБ. При этом концентрации гистамина, простагландинов, оксида азота, моноаминооксидазы, серотонина и цитокинов оказались весьма вариабельными по сравнению со здоровыми людьми. Ни одно из проведенных в данном направлении исследований не позволило получить когерентные представления о патогенезе ПГБ.
Выявленная парасимпатическая активация предположительно опосредована тригеминально-вегетативным рефлексом, реализуемым при участии стволовых структур и лицевого нерва. Симпатическая иннервация верхнего века и внутренних мышц глаза обеспечивается трехнейронной рефлекторной дугой, однако точная локализация очага поражения, лежащего в основе дисфункции при ПГБ, достоверно неизвестна.
Молекулярные исследования в области генома стали качественно новым этапом развития знаний об этиопатогенезе ПГБ, которая изначально не считалась генетическим заболеванием. С появлением официальных критериев диагностики и повышением выявляемости генетические аспекты ПГБ были идентифицированы. Опубликованы клинические случаи близнецов, страдающих ПГБ [19, 77, 88]. При этом монозиготные близнецы демонстрируют большую конкордантность (2/12 пар), чем двузиготные (0/25 пар), что является непосредственным доказательством генетических факторов, участвующих в возникновении ПГБ [30, 90]. Семейный анамнез когорты пациентов оказался положительным у 7–20 %, относительный риск для родственников первой линии родства оказался 14–39 % [31, 54, 96]. Патологический локус, ассоциированный с возникновением ПГБ, а также способ его передачи остаются неизвестными. Значительное количество работ посвящено полиморфизму гена HCRTR2, кодирующего рецептор 2-го типа к гипокретину [70, 71]. Нейроны, содержащие гипокретин, локализуются только в дорсальном и латеральном гипоталамусе и проецируются практически во все отделы мозга, в частности к образованиям, участвующим в регуляции цикла «сон — бодрствование». Они обладают модулирующим действием по отношению к норадренергическим нейронам locus coeruleus; активирующими эффектами; участвуют в контроле цикла «сон — бодрствование», пищевого поведения, эндокринных и кардиоваскулярных функций. Таким образом, различная экспрессия рецептора 2-го типа к гипокретину интегрируется с полученными ранее данными о гипоталамической дисфункции, является ведущей в понимании вариабельной восприимчивости к ПГБ и открывает широкое поле для дальнейших исследований в данной области [52, 67, 79]. В отдельных исследованиях предполагается аутосомно-доминантный тип наследования патологического локуса с неполной пенетрантностью [80], другие ученые описывают аутосомно-рецессивное наследование [21]. Х-сцепленной передачи пока не было зафиксировано. Серия генетических исследований также не выявила причину преобладания мужчин среди больных с этим видом головной боли.
Использование комбинации новых технологий визуализации и генетических исследований позволит углубить представления об этиопатогенезе ПГБ для оптимизации лечения и улучшения качества жизни пациентов.
Клиническая картина
Характерен внешний вид больных с пучковой головной болью. Мужчины часто высокого роста, атлетического телосложения с хорошо развитой мускулатурой; женщины мужеподобны и также имеют атлетическое телосложение. Кожа на лице утолщена, хорошо выражены поперечные складки на лбу, нередко на коже лица развиваются телеангиэктазии. Наряду с конституциональными особенностями больные кластерной головной болью имеют и определенные психологические особенности: амбициозность, высокий уровень притязаний, однако это сочетается с нерешительностью, чувством внутренней беспомощности, что послужило основанием для их характеристики: «внешность льва, а сердце мыши». Провоцируют атаку некоторые вазоактивные вещества: подкожное введение гистамина, прием нитроглицерина и алкоголя. Парадоксально, что прием большого количества алкоголя обладает профилактическим действием, предупреждая развитие болевой атаки в период пучка. Этим можно объяснить злоупотребление алкоголем у ряда больных с кластерной головной болью. Важно отметить, что провоцирующее действие названных веществ проявляется лишь в период болевого пучка и отсутствует полностью во время ремиссии.
Клинический паттерн ПГБ весьма специфичен и позволяет дифференцировать ее от мигрени, а также других первичных цефалгий [5]. Атака пучковой головной боли характеризуется односторонними (чаще левосторонними) резчайшими болями сверлящего, жгучего, распирающего характера в области глаза (он является основным локусом интенсивности боли, пациенты часто описывают эту боль как «выдавливание глаза», «как будто острым ножом, раскаленным добела, пронизывают глаз», «глаз как будто разрывается»), лобно-глазничной или височно-глазничной области с иррадиацией в ипсилатеральные отделы лица: щека, ухо, зубы, реже боль может иррадиировать в область шеи, лопатки, плеча. Патогномоничным симптомом является поведение больного во время приступа: невозможность лежать во время атаки. Физическая активность частично может облегчить боль при ПГБ. Во время приступа пациенты стремятся к деятельности, беспокойны, мечутся от невыносимой боли, интенсивность которой так велика, что кластерную головную боль называют «суицидальной». Они могут покачиваться из стороны в сторону, хлопать в ладоши, бить предметы или стену кулаком. Такие симптомы могут быть полезными в дифференциальной диагностике с мигренью, при которой пациенты избегают движений, стремятся быть неподвижными, выглядят усталыми и невнимательными. По причине своей интенсивости ПГБ — наиболее болезненное состояние, которое испытывает мужчина. Пациенты прозвали эту боль «чудовищем» [97].
Тошнота и рвота наблюдаются редко, в 20–30 % случаев. Продолжительность приступа боли варьирует от 15 минут до 3 часов, но обычно средняя продолжительность атаки составляет 45 мин. Боль возникает внезапно и в течение нескольких минут достигает максимума. Однако заканчивается она так же быстро. Факт окончания приступа через 1 или 2 часа нельзя связывать с эффектом аналгетиков, обычно принимаемых больными, так как они неэффективны при ПГБ. Приступы идут сериями от 1 до 8 (чаще 2–4) в сутки, как правило, у каждого пациента возникают в одно и то же время, от 50 до 75 % атак возникают во время сна, чаще в 2–3 ч утра («будильниковая боль») [43, 92]. Описанные болевые атаки длятся в типичных случаях в течение 2–6 нед., а затем боли исчезают на несколько месяцев или лет, т.е. они идут как бы пучками — отсюда и название «пучковые», или «кластерные» (от английского cluster — пучок), головные боли. Частота «пучков» у больных индивидуальна, обострения происходят циклично, их возникновение связано с сезонными колебаниями световой активности (чаще ранней весной или осенью). Обычно между приступами больные чувствуют себя удовлетворительно, но возможен дискомфорт в областях локализации боли [97].
Облигатным признаком ПГБ является ипсилатеральная вегетативная дисфункция. Парасимпатическая гиперактивация включает в себя на стороне головной боли слюнотечение, гиперемию конъюнктивы, заложенность носа или ринорею, отечность, повышенное потоотделение в области лба. Симпатическая гипоактивация во время приступа проявляется неполным синдромом Горнера: птоз и миоз ипсилатерально. Вегетативные симптомы ярко выражены у подавляющего большинства больных, однако могут и отсутствовать, что наблюдается приблизительно в 3 % случаев [27].
Аура не характерна для ПГБ [26], однако 14 % пациентов отмечают такие симптомы, как транзиторное нарушение зрения, двигательных или чувствительных функций, предшествующие приступу боли [5]. При хронической ПГБ аура может наблюдаться у 20 % больных [23]. Тошнота, рвота, фотофобия могут быть у 50 % пациентов, что не должно исключать диагноз при наличии других основных критериев. У 15 % больных может наблюдаться перемещение пораженной стороны от приступа к приступу [5]. Описаны даже случаи ПГБ без цефалгии, которые представлены наличием изолированной односторонней вегетативной дисфункции в области лица без болевого синдрома, но этот вариант встречается чрезвычайно редко [78, 81].
Диагноз
Диагностика заболевания базируется на клинических критериях и исключении причин симптоматической (вторичной) ПГБ. Диагностическими критериями ПГБ, согласно Международной классификации головных болей второго пересмотра (International Classification of Headache Disorders, second edition, ICHD-II), являются [92]:
А. Как минимум 5 приступов, отвечающих критериям В–D.
В. Интенсивная или чрезвычайно интенсивная односторонняя боль орбитальной, супраорбитальной и/или височной локализации продолжительностью 15–180 минут без лечения.
С. Головная боль сопровождается как минимум одним из следующих симптомов:
D. Частота приступов — от 1 раза в два дня до 8 раз в сутки.
E. Не связана с другими причинами (нарушениями).
В зависимости от частоты кластерных периодов ПГБ выделяют эпизодическую и хроническую формы. Для эпизодической формы характерно периодическое возникновение болевых пучков продолжительностью от 7 дней до 1 года (обычно от 2 недель до 3 месяцев), которые перемежаются свободными от боли периодами (ремиссиями) продолжительностью 1 месяц и более.
ICHD-II критерии эпизодической ПГБ:
Хроническая форма ПГБ характеризуется возникновением приступов на протяжении 1 года и более без ремиссий или с ремиссиями, продолжительность которых менее 1 месяца. Хроническая пучковая головная боль может возникать de novo (ранее использовался термин «первичная пучковая головная боль») или быть следствием трансформации эпизодической формы (ранее использовался термин «вторичная пучковая головная боль»). У некоторых пациентов может отмечаться переход хронической формы в эпизодическую.
ICHD-II критерии хронической ПГБ:
В 80 % случаев ПГБ носит эпизодический характер с 1 или 2 кластерными периодами в году или даже с периодами ремиссии в несколько лет. У 20 % пациентов атаки частые, без периодов ремиссии. Такие больные нередко рефрактерны к проводимой терапии [5].
В среднем диагностика ПГБ запаздывает на 3 года. Однако по сравнению с шестидесятыми годами прошлого века диагностика значительно улучшилась. В то время в среднем она запаздывала на 20 лет. Около 30 % пациентов безуспешно лечились у стоматологов, ЛОР-врачей, хирургов, окулистов [4, 100].
В литературе описаны случаи «симптоматического кластера», который может быть «фасадом» опухоли гипофиза (асимметрично расположенной) [55], аневризмы передней соединительной артерии, диссекции внутренней сонной артерии [76], синдрома Толосы — Ханта, этмоидита. В связи с этим нетипичная локализация, возраст дебюта старше 50 лет, появление неврологической симптоматики, персистенция синдрома Бернара — Горнера между атаками при эпизодической ПГБ служат сигналами опасности и требуют тщательного обследования с использованием нейровизуализации (МРТ, КТ головы и шеи), ультразвуковой допплерографии магистральных сосудов головы и шеи для исключения органической патологии [13, 33, 46]. Любой рефрактерный к терапии случай ГБ должен быть показанием к проведению МРТ.
Дифференциальная диагностика
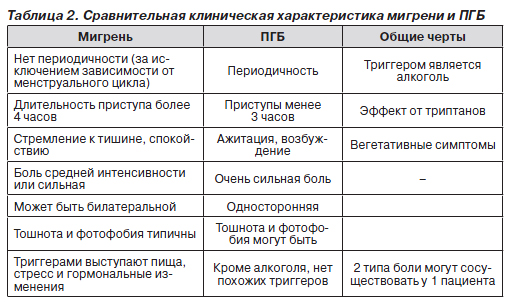
Пучковую головную боль приходиться дифференцировать с мигренью и другими первичными цефалгиями. Единственный способ отличить мигрень от ПГБ — анамнестические данные. Мигрень и ПГБ имеют много общих черт, однако и отличаются по специфическим признакам (табл. 2). Мигрень встречается чаще (15 % от общей популяции по сравнению с 0,5–1 % для ПГБ), поражает в основном женщин, начинается в более раннем возрасте, чаще в подростковом или в период полового созревания. Приступы мигрени возникают с периодичными регулярными интервалами, без длительных ремиссий. У некоторых больных сезонные триггеры могут вызвать учащение приступов (стресс, воздействие аллергенов). Приступы мигрени длятся дольше (от 4 до 72 часов) [5]. Приступы имеют продромальный период: ощущения голода, усталости, возбуждения. Начало приступа более постепенное, боль начинается с одной стороны, но во время приступа обычно распространяется по всей голове. У многих больных стороны боли чередуются. Боли сильные, но не описываются как невыносимые, мучительные. Наличие тошноты и/или фотофобии — главный клинический критерий, но неспецифический для мигрени, так как при ПГБ он тоже может быть у 50 % больных [5, 40]. Кроме того, у 30 % пациентов с мигренью присутствуют вегетативные симптомы — слезотечение и заложенность носа. Оба заболевания провоцируются приемом алкоголя, и в обоих случаях головная боль уменьшается при приеме триптанов, но при ПГБ необходимы парентеральные пути введения лекарств. Стресс, пища (например, шоколад) и фазы менструального цикла — неспецифические триггеры для ПГБ. И наконец, у некоторых пациентов мигрень может сочетаться с ПГБ, что требует соответствующего лечения.
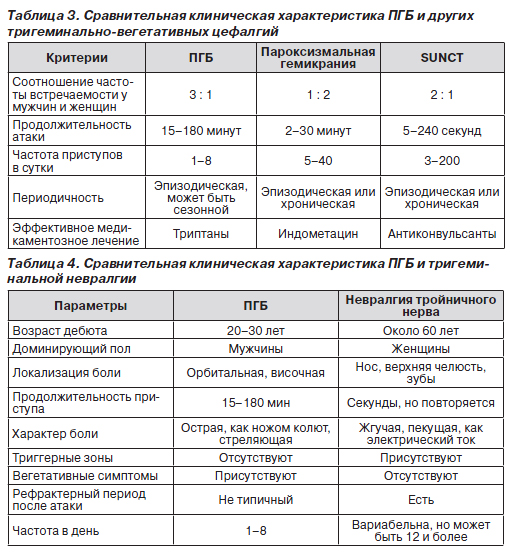
ПГБ следует дифференцировать с другими вариантами тригеминально-вегетативных цефалгий (табл. 3). Так, пароксизмальная гемикрания наиболее часто встречается у женщин (80–90 %) и отличается от ПГБ более короткой продолжительностью приступов и частыми атаками [8, 36, 37]. Положительный эффект адекватной дозы индометацина (150 мг/сут или более) подтверждает диагноз пароксизмальной гемикрании [5, 57, 72, 86].
SUNCT-синдром — один из наиболее редких вариантов кратковременных форм головной боли из группы тригеминально-вегетативных цефалгий. Термин SUNCT — аббревиатура международного англоязычного обозначения Short-lasting, Unilateral, Neuralgiform headache with Conjunctival injection and Tearing — кратковременная односторонняя невралгического типа головная боль с покраснением конъюнктивы глаза и слезотечением. Этот редко встречающийся синдром представляет собой повторяющиеся пароксизмы односторонней кратковременной боли продолжительностью 15–120 с преимущественно в окологлазничной или лобно-височной области, сопровождающейся инъекцией конъюнктивы и слезотечением, реже носовой секрецией, усилением потоотделения в области лба. Характер боли — невралгический, интенсивность боли — от умеренной до сильной. Боль чаще возникает в дневное время, является строго односторонней, без смены сторон, хотя наблюдались случаи, когда на поздних стадиях вовлекалась противоположная сторона. Приступы могут вызываться незначительными стимулами различной модальности в пределах зоны иннервации тройничного нерва, а также движениями шеи. Частота приступов варьирует от 3 до 100 в сутки. Ремиссии длятся от нескольких месяцев до нескольких лет. Имеются описания вторичного синдрома SUNCT на фоне артериовенозной мальформации мостомозжечкового угла, гемангиомы ствола мозга, трансформации тригеминальной невралгии. Для синдрома SUNCT характерна резистентность к медикаментозной терапии и блокадам с местными анестетиками (над- и подглазничного нерва, слезного, большого затылочного, звездчатого ганглия, полости рта или носа), в отдельных случаях наблюдался некоторый положительный эффект карбамазепина, кортикостероидов, нестероидных противовоспалительных средств [17, 101].
Тригеминальная невралгия и ПГБ проявляются пароксизмами односторонней сильной боли, но при подробном опросе обнаруживаются специфические признаки. Тригеминальная невралгия наиболее часто встречается у женщин более 50 лет. Боль локализуется в области верхней и/или нижней челюсти, характеризуется как удар электрического тока, более частая, короткая по продолжительности, провоцируется при раздражении специфических зон на лице или ротовой полости. Прием пищи, разговор, бритье или чистка зубов могут спровоцировать приступ. Больные могут терять вес из-за избегания приема пищи. Тригеминальная невралгия хорошо купируется карбамазепином [5, 22]. В табл. 4 представлены дифференциально-диагностические симптомы, позволяющие различить ПГБ и тригеминальную невралгию.
Лечение
Этиотропная терапия ПГБ на сегодняшний день отсутствует. Стратегия медикаментозной коррекции направлена на максимально быстрое и полное купирование приступа пучковой цефалгии (лечение приступа), а также уменьшение частоты и дальнейшее предупреждение возникновения атак в период обострения (профилактическое лечение). Рекомендации по ведению пациентов с ПГБ разработаны Европейской федерацией неврологических обществ (European Federation of Neurological Societies) [61].
Лечение приступа
Достоверно наиболее эффективными средствами для купирования атаки ПГБ являются агонисты 5HT1-рецепторов B/D типа — суматриптан и золмитриптан. Суматриптан является агонистом 5HT1-рецепторов B/D типа; воздействуя на рецепторы стволовой локализации, оказывает вазоконстрикторный эффект. Ввиду значительной интенсивности приступа ПГБ наиболее предпочтительным для его купирования является парентеральный путь введения препарата, обеспечивающий максимальную биодоступность, а соответственно, и наиболее быстрое наступление клинического эффекта [18]. Используют подкожный, интраназальный и пероральный способы введения. Наиболее эффективным является подкожное введение 6 мг суматриптана (уровень рекомендаций А) [98]. После инъекции больные могут почувствовать стеснение в груди, исчезающее в течение нескольких минут и сопровождающееся быстрым уменьшением боли. Интраназальный путь введения 20 мг суматриптана [84, 99] или 5–10 мг золмитриптана [73] также весьма эффективен (уровень рекомендаций А) и может быть использован у пациентов с абсолютными противопоказаниями к п/к введению суматриптана в период беременности и лактации, инсульта, окклюзионно-стенотических поражений периферических артерий. Относительными противопоказаниями являются: возраст до 18 и после 65 лет, феномен Рейно, аллергия на сульфаниламиды, параллельный прием ингибиторов обратного захвата серотонина. Пероральный прием золмитриптана в разовой дозе 5–10 мг менее эффективен (уровень рекомендаций В). Максимальная суточная доза суматриптана составляет 12 мг п/к или 40 мг интраназально, золмитриптана — 10 мг интраназально [14, 65].
При наличии противопоказаний к применению триптанов весьма эффективным и достаточно безопасным средством купирования атаки ПГБ является использование ингаляции нормобарического потока 100% кислорода в объеме 10–15 литров в минуту, подаваемого через маску (уровень рекомендаций А) [34, 42].
Препараты спорыньи (эрготамин и дигидроэрготамин) в лечении приступа ПГБ используются нечасто из-за недостаточно выраженного эффекта, невозможности сочетания с триптанами в течение суток вследствие идентичных противопоказаний и соответствующего потенцирования побочных эффектов. Наиболее эффективен среди производных спорыньи дигидроэрготамина мезилат в форме назального спрея (0,5 мг в каждый носовой ход) [29].
Интраназальная аппликация 4% раствора лидокаина или подкожное введение 100 мкг октреотида могут быть использованы при рефрактерной ПГБ или при наличии противопоказаний к применению триптанов, однако эффективность данных препаратов окончательно не доказана (уровень рекомендаций В).
Профилактика приступов
Целью профилактической терапии является уменьшение частоты приступов в период обострения. Длительное применение профилактических препаратов при эпизодической ПГБ не рекомендуется, так как отсутствуют доказательства предотвращения последующих атак. Поэтому доза может быть прогрессивно снижена через 2–3 месяца после окончания серии последних приступов. Пациентам с несколькими приступами в течение недели, реагирующими на препараты острого периода, профилактическое лечение обычно не назначается.
Блокатор кальциевых каналов верапамил остается основным средством при эпизодической и хронической ПГБ (уровень рекомендаций А) [10, 47]. Суточные дозы варьируют в широком диапазоне от 360 до 960 мг/сут, при этом необходимым является достижение максимально толерантной дозы перед решением вопроса о ее эффективности. Побочные эффекты верапамила: слабость, усталость, отеки нижних конечностей, нарушения внутрисердечной проводимости. Необходимо проведение ЭКГ-мониторинга в начале терапии и при каждом повышении дозы свыше 480 мг в сутки [16].
При тяжелых атаках, рефрактерности к верапамилу, длительном пучковом периоде рекомендуется преднизолон в дозе 1 мг/кг/сут в течение 7–14 дней, а затем поддерживающие дозы около 2 недель (уровень рекомендаций А), однако побочные эффекты глюкокортикостероидной терапии несколько ограничивают возможности ее применения при хронической форме ПГБ. С этой же целью используют и карбонат лития (уровень рекомендаций В) [10, 75, 89], который может купировать атаку в дозе от 300 до 900 мг/сут (максимальная суточная доза 1200 мг) на протяжении нескольких недель, затем по окончании болевого пучка с профилактической целью принимают по 150–200 мг в течение 1–3 недель. При хронической форме рекомендуется не более 600 мг в день в течение 1–1,5 мес., но при условии контроля уровня лития в крови, а также функции щитовидной железы и почек. Побочные эффекты: тремор, инсомния, усталость, тошнота, расстройства зрения.
Применение топирамата показало достаточную эффективность при ПГБ (уровень рекомендаций В) [49, 64]. Суточная дозировка колеблется от 25 до 200 мг и составляет в среднем 100 мг. Побочные эффекты включают онемение и парестезии конечностей, потерю массы тела, когнитивные нарушения, которые являются обратимыми и полностью исчезают при отмене препарата.
Возможно использование серотонинолитического препарата метисергид (уровень рекомендаций В) в дозе от 6 до 12 мг/сут. Некоторые пациенты хорошо реагируют на данный препарат, однако основное ограничение при его использовании — невозможность параллельного назначения триптанов и эрготамина из-за опасности серотонинового синдрома. Его применение обосновано в случаях, если основным средством купирования приступов является кислород. Длительность применения составляет 6 месяцев с перерывом 1 месяц. Во избежание синдрома отмены препарат отменяют постепенно, в течение 2–3 нед.
Вальпроевая кислота [74], пизотифен, габапентин [45, 83], баклофен [39], мелатонин [48, 69], капсаицин интраназально показали некоторую эффективность для профилактики ПГБ и могут быть использованы в качестве терапии третьей линии (уровень рекомендаций С).
Хирургическая коррекция
В терапии резистентных к медикаментозной коррекции форм хронической ПГБ применяются хирургические манипуляции [6]. В рандомизированном исследовании выявлена возможность прекращения приступа и снижения количества атак в сутки с помощью субокципитальной блокады большого затылочного нерва. Однако для широкого распространения этой процедуры необходима более широкая доказательная база [1–11].
Стимуляция гипоталамуса продемонстрировала определенную эффективность у пациентов, рефрактерных к консервативной терапии [7, 50, 51, 82], однако обладает серьезными осложнениями. Механизм эффективности данной процедуры до конца неясен [58]. Кроме того, отсутствует доказательная база по этому виду лечения [68].
Стимуляция большого затылочного нерва совсем недавно описана как вид лечения ПГБ [11, 12, 53, 85]. Она обладает преимуществом в сравнении со стимуляцией гипоталамуса ввиду меньшей инвазивности, но стоит значительно дороже. Долгосрочная эффективность остается неизвестной.
Результаты применения рассечения тройничного нерва, термокоагуляции гассерова узла, глицерольной ризотмии [38, 66] и радиохирургии тройничного нерва [24, 25, 62] в терапии ПГБ весьма неоднозначны и противоречивы.
Прогноз
Факторы, предрасполагающие к хронизации процесса, неизвестны, поэтому ПГБ имеет довольно непредсказуемое течение. Описана полная ремиссия болезни. Характерным является уменьшение с возрастом выраженности и частоты возникновения приступов.
1. Afridi S.K., Shields K.G., Bhola R. et al. Greater occipital nerve injection in primary headache syndromes — prolonged effects from a single injection // Pain. — 2006. — Vol. 122. — P. 126-129.
2. Ambrosini A., Vandenheede M., Rossi P. et al. Suboccipital injection with a mixture of rapid- and long-acting steroids in cluster headache: a double-blind placebo-controlled study // Pain. — 2005. — Vol. 118. — P. 92-96.
3. Ashkenazi A., Levin M. Greater occipital nerve block for migraine and other headaches: is it useful? // Curr. Pain Headache Rep. — 2007. — Vol. 11. — P. 231-235.
4. Bahra A., Goadsby P.J. Diagnostic delays and mis-management in cluster headache // Acta Neurol. Scand. — 2004. — Vol. 109. — P. 175-179.
5. Bahra A., May A., Goadsby P.J. Cluster headache: a prospective clinical study with diagnostic implications // Neurology. — 2002. — Vol. 58. —
P. 354-361.
6. Bartsch T., Goadsby P.J. Increased responses in trigeminocervical nociceptive neurons to cervical input after stimulation of the dura mater // Brain. — 2003. — Vol. 126. — P. 1801-1813.
7. Bartsch T., Pinsker M.O., Rasche D. et al. Hypothalamic deep brain stimulation for cluster headache: experience from a new multicase series // Cephalalgia. — 2008. — Vol. 28. — P. 285-295.
8. Boes C. Differentiating paroxysmal hemicrania from cluster headache // Cephalalgia. — 2005. — Vol. 25. — P. 241-243.
9. Broner S.W., Sun-Edelstein C., Lay C.L. Cluster headache in women // Curr. Pain Headache Rep. — 2007. — Vol. 11. — P. 127-130.
10. Bussone G., Leone M., Peccarisi C. et al. Double blind comparison of lithium and verapamil in cluster headache prophylaxis // Headache. — 1990. — Vol. 30. — P. 411-417.
11. Busch V., Jakob W., Juergens T. et al. Occipital nerve blockade in chronic cluster headache patients and functional connectivity between trigeminal and occipital nerves // Cephalalgia. — 2007. — Vol. 27. — P. 1206-1214.
12. Burns B., Watkins L., Goadsby P.J. Treatment of medically intractable cluster headache by occipital nerve stimulation: long-term follow-up of eight patients // Lancet. — 2007. — Vol. 369. — P. 1099-1106.
13. Carter D.M. Cluster headache mimics // Curr. Pain Headache Rep. — 2004. — Vol. 8. — P. 133-139.
14. Centonze V., Bassi A., Causarano V. et al. Sumatriptan overuse in episodic cluster headache: lack of adverse events, rebound syndromes, drug dependence and tachyphylaxis // Funct. Neurol. — 2000. — Vol. 15. — P. 167-170.
15. Cirillo M., Stellato D., Lombardi C. et al. Headache and cardiovascular risk factors: positive association with hypertension // Headache. — 1999. — Vol. 39. — P. 409-416.
16. Cohen A.S., Matharu M.S., Goadsby P.J. Electrocardiographic abnormalities in patients with cluster headache on verapamil therapy // Neurology. — 2007. — Vol. 69. — P. 668-675.
17. Cohen A.S., Matharu M.S., Goadsby P.J. Short-lasting unilateral neuralgiform headache attacks with conjunctival injection and tearing (SUNCT) or cranial autonomic features (SUNA) — a prospective clinical study of SUNCT and SUNA // Brain. — 2006. — Vol. 129. — P. 2746-2760.
18. Cohen A.S., Matharu M.S., Goadsby P.J. Trigeminal autonomic cephalalgias: current and future treatments // Headache. — 2007. — Vol. 47. — P. 969-980.
19. Couturier E.G., Hering R., Stei-ner T.J. The first report of cluster headache in identical twins // Neurology. — 1991. — Vol. 41. — P. 761.
20. D''Alessandro R., Gamberini G., Benassi G. et al. Cluster headache in the Republic of San Marino // Cephalalgia. — 1986. — Vol. 6. — P. 159-162.
21. De Simone R., Fiorillo C., Bonuso S. et al. A cluster headache family with possible autosomal recessive inheritance // Neurology. — 2003. — Vol. 61. — P. 578-579.
22. De Simone R., Marano E., Ranieri A. et al. Hypnic headache: an update // Neurol. Sci. — 2006. — Vol. 27. — P. 144-148.
23. Donnet A., Lanteri-Minet M., Guegan-Massardier E. et al. Chronic cluster headache: a French clinical descriptive study // J. Neurol. Neurosurg. Psychiatry. — 2007. — Vol. 78. — P. 1354-1358.
24. Donnet A., Tamura M., Valade D. et al. Trigeminal nerve radiosurgical treatment in intractable chronic cluster headache: unexpected high toxicity // Neurosurgery. — 2006. — Vol. 59. — P. 1252–1257.
25. Donnet A., Valade D., Regis J. Gamma knife treatment for refractory cluster headache: prospective open trial // J. Neurol. Neurosurg. Psychiatry. — 2005. — Vol. 76. — P. 218-221.
26. Ekbom K. A clinical comparison of cluster headache and migraine // Acta Neurol. Scand. — 1970. — Р. 1.
27. Ekbom K. Evaluation of clinical criteria for cluster headache with special reference to the classification of the International Headache Society // Cephalalgia. — 1990. — Vol. 10. — P. 195-197.
28. Ekbom K., Ahlborg B., Schele R. Prevalence of migraine and cluster headache in Swedish men of 18 // Headache. — 1978. — Vol. 18. — P. 9-19.
29. Ekbom K., Paalzow L., Waldenlind E. Low biological availability of ergotamine tartrate after oral dosing in cluster headache // Cephalalgia. — 1981. — Vol. 1. — P. 203-207.
30. Ekbom K., Svensson D.A., Pedersen N.L. et al. Lifetime prevalence and concordance risk of cluster headache in the Swedish twin population // Neurology. — 2006. — Vol. 67. — P. 798–803.
31. El Amrani M., Ducros A., Boulan P. et al. Familial cluster headache: a series of 186 index patients // Headache. — 2002. — Vol. 42. — P. 974-977.
32. Evers S., Fischera M., May A. et al. Prevalence of cluster headache in Germany: results of the epidemiological DMKG study // J. Neurol. Neurosurg. Psychiatry. — 2007. — Vol. 78. — P. 1289-1290.
33. Favier I., van Vliet J.A., Roon K.I. et al. Trigeminal autonomic cephalgias due to structural lesions: a review of 31 cases // Arch. Neurol. — 2007. — Vol. 64. — P. 25-31.
34. Fogan L. Treatment of cluster headache. A double-blind comparison of oxygen v air inhalation // Arch. Neurol. — 1985. — P. 362-363.
35. Garrido C., Tuna A., Ramos S. et al. Cluster headache in a 3 year old child // Rev. Neurol. — 2001. — Vol. 33. — P. 732-735.
36. Goadsby P., Lipton R. A review of paroxysmal hemicranias, SUNCT syndrome, and other short lasting headaches with autonomic features, including new cases // Brain. — 1997. — P. 193-209.
37. Goadsby P.J. Trigeminal autonomic cephalalgias. Pathophysiology and classification // Rev. Neurol. (Paris). — 2005. — Vol. 161. — P. 692-695.
38. Hassenbusch S.J., Kunkel R.S., Kosmorsky G.S. et al. Trigeminal cisternal injection of glycerol for treatment of chronic intractable cluster headaches // Neurosurgery. — 1991. — Vol. 29. — P. 504-508.
39. Hering-Hanit R., Gadoth N. The use of baclofen in cluster headache // Curr. Pain Headache Rep. — 2001. — Vol. 5. — P. 79-82.
40. Irimia P., Cittadini E., Paemeleire K. et al. Unilateral photophobia or phonophobia in migraine compared with trigeminal autonomic cephalalgias // Cephalalgia. — 2008. — Vol. 28. — P. 626-630.
41. Katsarava Z., Obermann M., Yoon M.S. et al. Prevalence of cluster headache in a population-based sample in Germany // Cephalalgia. — 2007. — Vol. 27. — P. 1014-1019.
42. Kudrow L. Response of cluster headache attacks to oxygen inhalation // Headache. — 1981. — P. 1-4.
43. Kudrow L. The cyclic relationship of natural illumination to cluster period frequency // Cephalalgia. — 1987. — Vol. 7. — P. 76-78.
44. Lampl C. Childhood-onset cluster headache // Pediatr. Neurol. — 2002. — Vol. 27. — P. 138-140.
45. Leandri M., Luzzani M., Cruccu G. et al. Drug-resistant cluster headache responding to gabapentin: a pilot study // Cephalalgia. — 2001. — Vol. 21. — P. 744-746.
46. Leira E.C., Cruz-Flores S., Leacock R.O. et al. Sumatriptan can alleviate headaches due to carotid artery dissection // Headache. — 2001. — Vol. 41. — P. 590-591.
47. Leone M., D''Amico D., Frediani F. et al. Verapamil in the prophylaxis of episodic cluster headache: a double-blind study versus placebo // Neurology. — 2000. — P. 1382-1385.
48. Leone M., D''Amico D., Moschiano F. et al. Melatonin versus placebo in the prophylaxis of cluster headache: a double-blind pilot study with parallel groups // Cephalalgia. — 1996. — Vol. 16. — P. 494-496.
49. Leone M., Dodick D., Rigamonti A. et al. Topiramate in cluster headache prophylaxis: an open trial // Cephalalgia. — 2003. — Vol. 23. — P. 1001-1002.
50. Leone M., Franzini A., Broggi G. et al. Hypothalamic deep brain stimulation for intractable chronic cluster headache: a 3-year follow-up // Neurol. Sci. — 2003. — Vol. 24. — P. 143-145.
51. Leone M., Franzini A., Broggi G. et al. Hypothalamic stimulation for intractable cluster headache: long-term experience // Neurology. — 2006. — Vol. 67. — P. 150-152.
52. Leone M., Franzini A., Bussone G. Stereotactic stimulation of posterior hypothalamic gray matter in a patient with intractable cluster headache // N. Engl. J. Med. — 2001. — P. 1428-1429.
53. Leone M., Franzini A., Cecchini A.P. et al. Stimulation of occipital nerve for drug-resistant chronic cluster headache // Lancet Neurol. — 2007. — Vol. 6. — P. 289-291.
54. Leone M., Russell M.B., Rigamonti A. et al. Increased familial risk of cluster headache // Neurology. — 2001. — Vol. 56. — P. 1233-1236.
55. Levy M.J., Matharu M.S., Meeran K. et al. The clinical characteristics of headache in patients with pituitary tumours // Brain. — 2005. — Vol. 128. — P. 1921-1930.
56. Manzoni G.C. Male preponderance of cluster headache is progressively decreasing over the years // Headache. — 1997. — Vol. 37. — P. 588-589.
57. Matharu M.S., Goadsby P.J. Trigeminal autonomic cephalgias // J. Neurol. Neurosurg. Psychiatry. — 2002. — Vol. 72. — P. 1119-1126.
58. May A. Hypothalamic deep-brain stimulation: target and potential mechanism for the treatment of cluster headache // Cephalalgia. — 2008. — Vol. 28. — P. 799-803.
59. May A., Ashburner J., Buchel C. et al. Correlation between structural and functional changes in brain in an idiopathic headache syndrome // Nat. Med. — 1999. — Vol. 5. — P. 836-838.
60. May A., Bahra A., Buchel C. et al. Hypothalamic activation in cluster headache attacks // Lancet. — 1998. — Vol. 352. — P. 275-278.
61. May A., Leone M., Afra J. et al. EFNS guidelines on the treatment of cluster headache and other trigeminal-autonomic cephalalgias // Eur. J. Neurol. — 2006. — Vol. 13. — P. 1066-1077.
62. McClelland S., Barnett G.H., Neyman G. et al. Repeat trigeminal nerve radiosurgery for refractory cluster headache fails to provide long-term pain relief // Headache. — 2007. — Vol. 47. — P. 298–300.
63. McClelland S., Tendulkar R.D., Barnett G.H. et al. Long-term results of radiosurgery for refractory cluster headache // Neurosurgery. — 2006. — Vol. 59. — P. 1258-1262.
64. McGeeney B.E. Topiramate in the treatment of cluster headache // Curr. Pain Headache Rep. — 2003. — Vol. 7. — P. 135-138.
65. Paemeleire K., Evers S., Goadsby P.J. Medication-overuse headache in patients with cluster headache // Curr. Pain Headache Rep. — 2008. — Vol. 12. — P. 122-127.
66. Pieper D.R., Dickerson J., Hassenbusch S.J. Percutaneous retrogasserian glycerol rhizolysis for treatment of chronic intractable cluster headaches: long-term results // Neurosurgery. — 2000. — Vol. 46. — P. 363-368.
67. Pinessi L., Rainero I., Rivoiro C. et al. Genetics of cluster headache: an update // J. Headache Pain. — 2005. — Vol. 6. — P. 234-236.
68. Pinsker M.O., Bartsch T., Falk D. et al. Failure of deep brain stimulation of the posterior inferior hypothalamus in chronic cluster headache — report of two cases and review of the literature // Zentralbl Neurochir. — 2008. — Vol. 69. — P. 76-79.
69. Pringsheim T., Magnoux E., Dobson C.F. et al. Melatonin as adjunctive therapy in the prophylaxis of cluster headache: a pilot study // Headache. — 2002. — Vol. 42. — P. 787-792.
70. Rainero I., Gallone S., Rubino E. et al. Haplotype Analysis Confirms the Association Between the HCRTR2 Gene and Cluster Headache // Headache. — 2008. — Vol. 48. — P. 1108-14.
71. Rainero I., Rubino E., Valfre W. et al. Association between the G1246A polymorphism of the hypocretin receptor 2 gene and cluster headache: a meta-analysis // J. Headache Pain. — 2007. — Vol. 8. — P. 152-156.
72. Rapoport A.M., Bigal M.E. Hemicrania continua: clinical and nosographic update // Neurol. Sci. — 2003. — Vol. 24. — P. 118-121.
73. Rapoport A.M., Mathew N.T., Silberstein S.D. et al. Zolmitriptan nasal spray in the acute treatment of cluster headache: a double-blind study // Neurology. — 2007. — Vol. 69. — P. 821-826.
74. Pascual J., Lainez M.J., Dodick D., Hering-Hanit R. Antiepileptic drugs for the treatment of chronic and episodic cluster headache: a review // Headache. — 2007. — Vol. 47. — P. 81-89.
75. Reilly D. Lithium vs placebo in cluster headache // Cephalalgia. — 1998. — Vol. 18. — P. 1.
76. Rigamonti A., Iurlaro S., Reganati P. et al. Cluster headache and internal carotid artery dissection: two cases and review of the literature // Headache. — 2008. — Vol. 48. — P. 467-470.
77. Roberge C., Bouchard J.P., Simard D. et al. Cluster headache in twins // Neurology. — 1992. — Vol. 42. — P. 1255-1256.
78. Russell M.B. Cluster headache sine headache: two new cases in one family // Cephalalgia. — 2002. — Vol. 22. — P. 1.
79. Russell M.B. Genetics in primary headaches // J. Headache Pain. — 2007. — Vol. 8. — P. 190-195.
80. Russell M.B., Andersson P.G., Thomsen L.L. et al. Cluster headache is an autosomal dominantly inherited disorder in some families: a complex segregation analysis // J. Med. Genet. — 1995. — Vol. 32. — P. 954-956.
81. Salvesen R. Cluster headache sine headache: case report // Neurology. — 2000. — Vol. 55. — P. 451.
82. Schoenen J., Di Clemente L., Vandenheede M. et al. Hypothalamic stimulation in chronic cluster headache: a pilot study of efficacy and mode of action // Brain. — 2005. — Vol. 128. — P. 940-947.
83. Schuh-Hofer S., Israel H., Neeb L. et al. The use of gabapentin in chronic cluster headache patients refractory to first-line therapy // Eur. J. Neurol. — 2007. — Vol. 14. — P. 694-696.
84. Schuh-Hofer S., Reuter U., Kinze S. et al. Treatment of acute cluster headache with 20 mg sumatriptan nasal spray — an open pilot study // J. Neurol. — 2002. — P. 94-99.
85. Schwedt T.J., Dodick D.W., Trentman T.L. et al. Occipital nerve stimulation for chronic cluster headache and hemicrania continua: pain relief and persistence of autonomic features // Cephalalgia. — 2006. — Vol. 26. — P. 1025-1027.
86. Silberstein S.D., Peres M.F. Hemicrania continua // Arch. Neurol. — 2002. — Vol. 59. — P. 1029-1030.
87. Sjaastad O., Bakketeig L.S. Cluster headache prevalence. Vaga study of headache epidemiology // Cephalalgia. — 2003. — Vol. 23. — P. 528-533.
88. Sjaastad O., Shen J.M., Stovner L.J. et al. Cluster headache in identical twins // Headache. — 1993. — Vol. 33. — P. 214–217.
89. Steiner T., Hering R., Couturier E. et al. Double-blind placebo-controlled trial of lithium in episodic cluster headache // Cephalalgia. — 1997. — P. 673-675.
90. Svensson D., Ekbom K., Pedersen N.L. et al. A note on cluster headache in a population-based twin register // Cephalalgia. — 2003. — Vol. 23. — P. 376-380.
91. Swanson J.W., Yanagihara T., Stang P.E. et al. Incidence of cluster headaches: a population-based study in Olmsted County, Minnesota // Neurology. — 1994. — Vol. 44. — P. 433-437.
92. The International Classification of Headache Disorders // Cephalalgia. — 2004. — Vol. 24. — P. 9-160.
93. Tonon C., Guttmann S., Volpini M. et al. Prevalence and incidence of cluster headache in the Republic of San Marino // Neurology. — 2002. — Vol. 58. — P. 1407-1409.
94. Torelli P., Beghi E., Manzoni G.C. Cluster headache prevalence in the Italian general population // Neurology. — 2005. — Vol. 64. — P. 469-474.
95. Torelli P., Castellini P., Cucurachi L. et al. Cluster headache prevalence: methodological considerations. A review of the literature // Acta Biomed. — 2006. — Vol. 77. — P. 4-9.
96. Torelli P., Manzoni G.C. Clinical observations on familial cluster headache // Neurol. Sci. — 2003. — Vol. 24. — P. 61-64.
97. Torelli P., Manzoni G.C. Pain and behaviour in cluster headache. A prospective study and review of the literature // Funct. Neurol. — 2003. — Vol. 18. — P. 205-210.
98. Treatment of acute cluster headache with sumatriptan. The Sumatriptan Cluster Headache Study Group // N. Engl. J. Med. — 1991. — P. 322-326.
99. Van Vliet J.A., Bahra A., Martin V. et al. Intranasal sumatriptan in cluster headache: randomized placebo-controlled double-blind study // Neurology. — 2003. — Vol. 60. — P. 630-633.
100. Van Vliet J.A., Eekers P.J., Haan J. Features involved in the diagnostic delay of cluster headache // J. Neurol. Neurosurg. Psychiatry. — 2003. — Vol. 74. — P. 1123-1125.
101. Williams M.H., Broadley S.A. SUNCT and SUNA: clinical features and medical treatment // J. Clin. Neurosci. — 2008. — Vol. 15. — P. 526-534.
