Газета «Новости медицины и фармации» Гастроэнтерология (304) 2009 (тематический номер)
Вернуться к номеру
Болезнь Крона: практические аспекты проблемы
Авторы: Ю.В. Линевский, д.м.н., профессор, К.Ю. Линевская, к.м.н., доцент, К.А. Воронин
Донецкий национальный медицинский университет им. М. Горького, Кафедра внутренней медицины им. А.Я. Губергрица,
кафедра внутренней медицины № 2
Версия для печати
Болезнь Крона (БК) — генетически детерминированное, хроническое рецидивирующее заболевание, которое характеризуется патологическим иммунным ответом на бактериальные антигены с формированием хронического воспалительно-деструктивного процесса, протекающего с сегментарным трансмуральным гранулематозным поражением стенки пищеварительного канала, образованием изъязвлений, связанных с ним осложнений (спаечный процесс, инфильтраты, абсцессы, свищи, кровотечения, стенозирования и др.) и внекишечными проявлениями.
Заболевание описано B.B. Crohn, L. Ginsburg и G.D. Oppenheimer в 1932 году в виде гранулематозного терминального илеита.
Распространенность БК в разных странах колеблется в пределах 9–199 на 100 000 населения. Она чаще встречается у жителей Скандинавских стран, Северной Америки, Канады, Израиля [19, 22]. Заболеваемость (ежегодное число заболевших) составляет 5–15 случаев на 100 000 населения [16]. Отмечается неуклонный рост этой патологии во всех странах. Более высокий он в северных географических регионах и убывает в южном направлении.
БК чаще встречается у женщин, в промышленно развитых регионах, у городского населения.
Смертность при БК составляет 6 случаев на 1 млн населения [24].
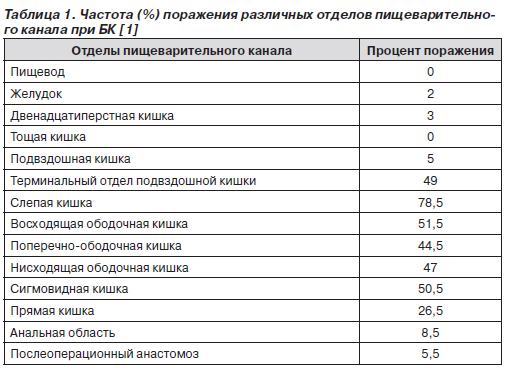
Как видно из табл.1, наиболее часто при БК в процесс вовлекается илеоцекальный отдел. Реже поражаются желудок и двенадцатиперстная кишка. В желудке процесс обычно локализуется в антральном отделе и сочетается с вовлечением двенадцатиперстной кишки [20].
Этиология
Этиология БК не известна. Доминирующей является точка зрения о связи БК с генетически детерминированными нарушениями барьерной функции кишечника и иммунного ответа на агрессию антигенов микробного происхождения.
Накоплены доказательства значения наследственного происхождения генетических особенностей, определяющих предрасположенность к развитию БК. В их числе встречаемость гранулематозного илеита в 20 раз чаще у близких родственников страдающих БК, нежели в популяции, наличие БК в 45 % у монозиготных близнецов. При наличии БК у обоих родителей 50 % детей заболевают ею в возрасте до 20 лет.
Обнаружена ассоциация БК с геномом NOD2, расположенным на длинном плече 16-й хромосомы в пределах локуса IBD1 [17, 25]. Указанный ген локализуется в макрофагах и принимает участие в регуляции иммунного ответа и проницаемости кишечного барьера в отношении бактериальных полисахаридов. Установлена также роль гена TNF-α в локусе IBD3 на коротком плече 6-й хромосомы в развитии и прогрессировании БК [14,15].
Обсуждается возможная роль дисбиоза кишечника в развитии БК за счет микобактерий, псевдомонад, иерсиний, некоторых штаммов эшерихий, бесконтрольного применения медикаментов (особенно антибиотиков и противозачаточных средств), фактора курения (повышается риск БК более чем в 2 раза).
В пользу возможной роли инфекционных начал в развитии БК свидетельствует обнаружение у этих больных антител к Saccharomyces cerevisiae — ASCA (к пекарским и пивным дрожжам) в 69–83 % [27], внутриклеточных патогенов (микобактерий туберкулеза, вирусов кори), редкое вовлечение в процесс тонкой кишки в норме почти стерильной или малозаселенной микробной флорой (за исключением терминального отдела подвздошной кишки).
Придается значение в манифестации БК и ее обострений психоэмоциональному стрессу.
Патогенез
Нарушение проницаемости кишечного барьера к макромолекулам на почве генетических особенностей организма, воздействие продуктов жизнедеятельности условно патогенной микрофлоры кишечника и других экзогенных вредоносных факторов способствуют поступлению во внутреннюю среду антигенов бактериального или иного происхождения, которые способствуют включению генетически обусловленных иммунопатологических механизмов, протекающих с активацией Th-1 клеток CD4+, которые высвобождают провоспалительные цитокины ИФН-γ, ИЛ-2, ФНО-α, активируют макрофаги. Последние продуцируют провоспалительные цитокины ИЛ-1, ИЛ-6, ИЛ-12, ИЛ-18, ТФП и ФНО-α. Таким образом запускаются молекулярные механизмы воспалительно-деструктивного процесса, характерные для БК, протекающие с выработкой разнообразных посредников (цитокины, хемокины, факторы роста, метаболиты арахидоновой кислоты — простагландины и лейкотриены, метаболиты реактивного воспаления типа оксида азота). Этот процесс характеризуется стимуляцией реакции клеточного иммунитета (гиперчувствительность замедленного типа, гранулематозное воспаление). Активируются, хотя и менее выраженно, механизмы гуморального иммунитета. Об этом свидетельствует увеличение содержания в крови у больных с внекишечными проявлениями IgG, IgA, циркулирующих антител к эндотелиальным клеткам [11], ЦИК [8, 12].
Последовательность основных патогенетических этапов становления БК может быть представлена схематически следующим образом: генетические факторы (NOD2) — неполноценность кишечного барьера + микробная флора (эндотоксины) → проникновение бактериальных антигенов через кишечный эпителиальный барьер → неадекватный ответ иммунной системы на антигены → активация эндотелиальных клеток и центральной популяции иммунных клеток → иммунное воспаление в слизистой кишечника → появление антител к структурам собственных клеток → аутоиммунное заболевание (присоединение внекишечных проявлений).
Патоморфология
Патоморфология БК характеризуется прерывистым (дискретным) сегментарным поражением, которое может захватывать любые отделы пищеварительного канала изолированно или сочетанно. В участках поражения могут выявляться продольные или поперечные глубокие щелевидные язвы с ровными краями или мелкие афтозные язвы на фоне слизистой оболочки в виде «булыжной мостовой» или имеющей обычный вид. В участках поражения возможно сужение кишки. Часто отмечаются межкишечные спайки и спайки с соседними органами. Возможно формирование свищей, соединяющих просвет пораженного участка пищеварительного канала с соседними органами (матка, мочевой пузырь, влагалище, маточные трубы, желчный пузырь, близлежащие отделы кишок) и кожными покровами.
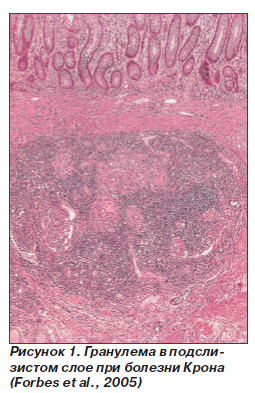 В пораженном участке пищеварительного канала отмечается трансмуральный воспалительный процесс, при котором наблюдается выраженная лимфоцитарная инфильтрация. Реже определяются плазматические клетки, эозинофилы, сегментоядерные лейкоциты. Между базальными отделами крипт могут выявляться скопления лимфоцитов. Характерным для БК является обнаружение в подслизистом слое гранулем, состоящих из эпителиальных и гигантских клеток типа Пирогова — Лангханса, окруженных поясом из лимфоцитов [2] (рис. 1). В отличие от туберкулезных гранулем в них отсутствует казеозный распад. Отмечается увеличение регионарных лимфатических узлов брыжейки. В них выявляются признаки хронического воспаления с возможным обнаружением указанных выше гранулем.
В пораженном участке пищеварительного канала отмечается трансмуральный воспалительный процесс, при котором наблюдается выраженная лимфоцитарная инфильтрация. Реже определяются плазматические клетки, эозинофилы, сегментоядерные лейкоциты. Между базальными отделами крипт могут выявляться скопления лимфоцитов. Характерным для БК является обнаружение в подслизистом слое гранулем, состоящих из эпителиальных и гигантских клеток типа Пирогова — Лангханса, окруженных поясом из лимфоцитов [2] (рис. 1). В отличие от туберкулезных гранулем в них отсутствует казеозный распад. Отмечается увеличение регионарных лимфатических узлов брыжейки. В них выявляются признаки хронического воспаления с возможным обнаружением указанных выше гранулем.
Клиника
Клиника БК весьма вариабельна. Она зависит от локализации, протяженности процесса, стадии заболевания, его активности, наличия осложнений.
Различают местные симптомы со стороны пищеварительного канала, внекишечные проявления и признаки нарушенного общего состояния.
В числе местных симптомов — боль, чаще периодическая, умеренной интенсивности, реже — схваткообразная, с локализацией, соответствующей топике поражения пищеварительного канала. Она может усиливаться при вовлечении в процесс верхних отделов желудочно-кишечного тракта в связи с приемом грубой, острой пищи.
Могут отмечаться дискомфорт в животе, метеоризм и чувство тяжести в нем, тошнота.
Более характерно нарушение стула в виде поноса. Реже отмечаются запоры.
Наличие эрозивно-язвенных изменений может манифестировать появлением крови в кале. Если источник кровотечения расположен высоко — наблюдается мелена.
Внекишечные проявления встречаются в 5–20 % случаев. Они могут быть связанными и не связанными с активностью БК.
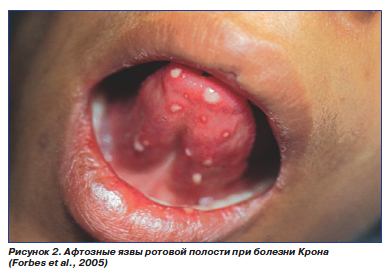
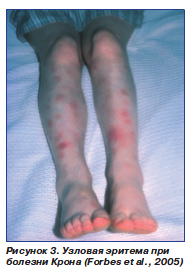
В числе проявлений, связанных с активностью процесса, — афтозные язвы во рту (рис. 2), узловая эритема (рис. 3), поражение глаз (конъюнктивит, эписклерит, ирит, увеит), артриты, гангренозная пиодермия.
 К числу симптомов, не связанных с активностью заболевания, относятся артралгии, сакроилеит, псориаз, первичный склерозирующий холангит, ревматоидный артрит, анкилозирующий спондилоартрит, жировой гепатоз, стеатогепатит, желчнокаменная болезнь (на почве повышения литогенности желчи, связанной с мальабсорбцией желчных кислот при илеите), образование оксалатных камней в почках (в связи со всасыванием оксалатов и развитием гипероксалемии при илеитах, обусловленной соединением жирных кислот в просвете кишки в условиях дефицита желчных кислот не с оксалатами, а с кальцием), остеопороз и другие проявления синдрома нарушенного всасывания (СНВ) (см. ниже).
К числу симптомов, не связанных с активностью заболевания, относятся артралгии, сакроилеит, псориаз, первичный склерозирующий холангит, ревматоидный артрит, анкилозирующий спондилоартрит, жировой гепатоз, стеатогепатит, желчнокаменная болезнь (на почве повышения литогенности желчи, связанной с мальабсорбцией желчных кислот при илеите), образование оксалатных камней в почках (в связи со всасыванием оксалатов и развитием гипероксалемии при илеитах, обусловленной соединением жирных кислот в просвете кишки в условиях дефицита желчных кислот не с оксалатами, а с кальцием), остеопороз и другие проявления синдрома нарушенного всасывания (СНВ) (см. ниже).
Симптомы нарушенного общего состояния: общая слабость, снижение аппетита, похудание. Возможны эпизоды повышения температуры тела. При значительной протяженности поражения тонкой кишки могут выявляться признаки синдрома нарушенного переваривания и всасывания пищи.
Синдром нарушенного переваривания пищи проявляется вздутием и урчанием в животе, наличием в кале остатков непереваренной пищи (лиентерея), нейтрального жира (стеаторея), крахмала (амилорея), непереваренных мышечных волокон (креаторея).
Синдром нарушенного всасывания пищи характеризуется дефицитом массы тела, гиповитаминозными проявлениями (трещинки в углах рта, кровоточивость десен, дерматит на лице, глоссит, парестезии в руках и ногах и др.), трофическими нарушениями (снижение тургора, сухость и шелушение кожи, ломкость и выпадение волос, ломкость ногтей, отеки на ногах и др.), снижением потенции, нарушением месячных и др.
В числе лабораторных проявлений СНВ — анемия, гипопротеинемия, гипокальцемия, гипомагниемия, стеаторея с наличием в избытке в кале жирных кислот и мыл.
 Местные симптомы и признаки нарушенного общего состояния организма могут дополняться клиникой присоединяющихся осложнений. В их числе парапроктит, анальные трещины, пенетрации и перфорации язв с развитием перитонита, инфильтратов, абсцессов, свищей: внутренних (межкишечных, кишечно-вагинальных, кишечно-пузырных и др.), наружных (на брюшной стенке), параректальных; массивные кишечные кровотечения, токсическая дилатация кишечника, частичная или полная кишечная непроходимость, септицемия и сепсис.
Местные симптомы и признаки нарушенного общего состояния организма могут дополняться клиникой присоединяющихся осложнений. В их числе парапроктит, анальные трещины, пенетрации и перфорации язв с развитием перитонита, инфильтратов, абсцессов, свищей: внутренних (межкишечных, кишечно-вагинальных, кишечно-пузырных и др.), наружных (на брюшной стенке), параректальных; массивные кишечные кровотечения, токсическая дилатация кишечника, частичная или полная кишечная непроходимость, септицемия и сепсис.
Формирующиеся инфильтраты в брюшной полости могут пальпироваться в виде опухолевидных образований. При их абсцедировании повышается температура тела, возможны ознобы, в крови — лейкоцитоз.
Острую форму терминального илеита следует дифференцировать с острым аппендицитом, аднекситом, тазовым перитонитом генитальной этиологии, дивертикулом и другими заболеваниями.
БК характеризуется волнообразным течением, с чередованием периодов обострений и бессимптомных или малосимптомных ремиссий.
Инструментальная диагностика
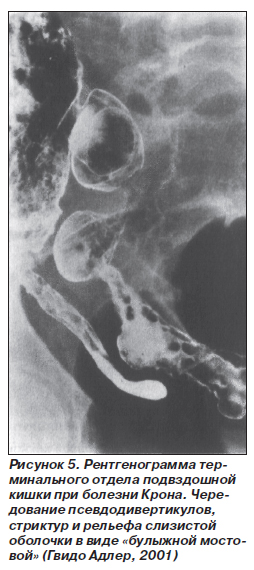 Рентгеновскими признаками БК являются сегментарное поражение кишки в виде ригидности стенок, выявление рельефа в виде «булыжной мостовой», ячеистости при наличии изъязвлений, участков сужения (рис. 5). Возможно выявление фистул и свищей.
Рентгеновскими признаками БК являются сегментарное поражение кишки в виде ригидности стенок, выявление рельефа в виде «булыжной мостовой», ячеистости при наличии изъязвлений, участков сужения (рис. 5). Возможно выявление фистул и свищей.
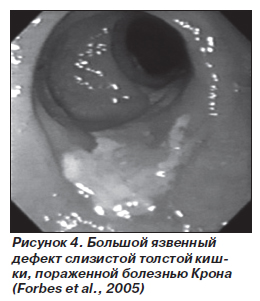
Эндоскопия (в том числе видеокапсульная) выявляет прерывистый характер патологических изменений, которые характеризуются наличием афт или афтоподобных изъязвлений, язв-трещин на фоне малоизмененной слизистой. Слизистая может иметь вид «булыжной мостовой». Возможно выявление псевдополипов, стриктур и свищей.
Важно выполнение биопсии участков измененной слизистой с последующим гистологическим исследованием (см. «Патоморфологию»). Однако по данным исследования биоптатов диагноз БК возможен не чаще чем в 25–30 % случаев [18]. Частота выявления типичных для БК гранулем составляет 14–19 %. Это связано с тем, что они располагаются в подслизистой, попадание которой в биопсионный материал проблематично. Во многих случаях выявляются лишь признаки неспецифического воспаления [6].
Трансабдоминальное УЗИ позволяет установить утолщение стенки кишки (симптом кокарды), изъязвления, воспалительные инфильтраты и абсцессы, гипоэхогенные свищевые ходы, спаяние кишок с близлежащими органами. Прямая кишка лучше видна при заполненном мочевом пузыре [11].
Лапароскопия может также выявлять признаки БК (гиперемия участка кишки, увеличение лимфатических узлов брыжейки, перфорация, абсцесс, стенозирование).
Случаи с невозможностью постановки диагноза по данным клинической картины и инструментальных исследований обычно относят к недифференцированным воспалительным поражениям [6].
Лабораторные исследования малоспецифичны. В крови возможно обнаружение гипохромной анемии, лейкоцитоза, увеличения СОЭ, гипопротеинемии, преимущественно за счет альбуминов, диспротеинемии с повышением α-2 и γ-фракций глобулинов, увеличение показателей С-реактивного белка, серомукоида, сиаловых кислот, дефицит железа, калия, магния, кальция, цинка.
Для исключения паразитарных заболеваний необходимо исследование кала на простейшие.
Учитывая возможную манифестацию иерсиниоза под маской БК, необходимо исследовать кал на иерсинии и провести соответствующие реакции агглютинации (РА) и непрямой гемагглютинации (РНГА). Диагностическим титром является РА ≥ 1 : 80 и РНГА ≥ 1 : 160.
Классификация
МКБ-X предусматривает следующие варианты БК:
Согласно унифицированной кли-нико-статистической классификации заболеваний органов пищеварения (ведомственная инструкция), утвержденной МЗ Украины (2004), предусмотрено использование приведенной ниже классификации БК.
I. По локализации процесса:
II. Фаза заболевания:
III. Степень тяжести:
IV. Осложнения:

В 2005 году рабочая группа по изучению воспалительных заболеваний кишечника на Всемирном конгрессе гастроэнтерологов в Монреале (Канада) сделала дополнение к предложенной в 1990 году Венской классификации БК.
Монреальская классификация БК:
1. Возраст к моменту установления диагноза:
2. Локализация процесса:
3. Характер течения:
Согласно этой классификации БК можно представить в виде А+L+B с указанием фазы и активности заболевания.
Лечение
Лечение направлено на купирование острых проявлений, достижение и пролонгирование ремиссии. Оно предусматривает использование средств, блокирующих патогенетические механизмы развития и поддержания процесса. В числе средств первой линии препараты 5-аминосалициловой кислоты (5-АСК) и глюкокортикоиды.
Препараты 5-АСК путем ингибирования циклооксигеназного и липоксигеназного пути метаболизма арахидоновой кислоты подавляют синтез и активность медиаторов воспаления (лейкотриены, провоспалительные цитокины: ИЛ-1, ИЛ-6, ФНО-6), выработку антител В-лимфоцитами, нейтрализуют свободные кислородные радикалы. Они показаны для лечения больных с легкой и средней тяжестью течения БК.
В числе препаратов 5-АСК сульфасалазин. Он содержит 5-АСК и инертную часть — сульфапиридин, который препятствует всасыванию препаратов в тощей кишке. В подвздошной кишке под влиянием азоредуктазы кишечных бактерий происходит отщепление сульфапиридина и освобождение 5-АСК, которая таким образом действует на патологический процесс, локализующийся в терминальных отделах подвздошной кишки и в толстой кишке. Показано использование сульфасалазина в случаях неосложненного течения при легкой форме БК до достижения клинико-эндоскопической ремиссии в дозе 4–8 г/сутки в течение 4–8 недель с последующим переходом на поддерживающие дозы (не менее 2–3 г/сутки) в течение 6 месяцев — 2 лет. При этом у 15–20 % больных могут наблюдаться нежелательные побочные эффекты в виде диспептических явлений, головной боли, токсико-аллергических кожных высыпаний, развития панкреатита, лейкопении с агранулоцитозом, нарушения функции почек, бесплодия у мужчин в связи с олигоспермией и др.
5-АСК в чистом виде представлена препаратами пентаса, салофальк, мезакол и др. Их назначают при легком течении БК не менее 4,5 г/сутки, а при течении средней тяжести — 6–8 г/сутки до наступления ремиссии (4–8 недель) с последующим переходом на поддерживающие дозы — не менее чем по 2,5–3 г/сутки.
Салофальк (аналоги асакол, клаверсан) имеет энтеросолюбильную L-эудрагидную оболочку, а месакол — акриловое покрытие. Высвобождение 5-АСК происходит при рН 6–7 в терминальных отделах подвздошной кишки и в толстой кишке, поэтому указанные препараты показаны при поражении этих отделов кишечника.
Пентаса состоит из микрогранул, покрытых полупроницаемой осмотически активной этил-целлюлозной оболочкой. Высвобождение 5-АСК не зависит от уровня рН-среды, скорости транзита по кишечнику, интенсивности диареи и поэтому происходит постепенно, равномерно во всех отделах пищеварительного канала по мере продвижения по ним препарата, что обеспечивает возможность его использования при любой локализации процесса, не дает резких скачков концентрации активного вещества в крови, ответственного за развитие побочных эффектов при приеме других препаратов АСК с рН-зависимым высвобождением.
При поражении дистальных отделов толстой кишки могут использоваться ректальные формы месалазина — свечи (250, 500 мг и
Сульфасалазин и месалазин противопоказаны при непереносимости салицилатов, пептической язве желудка и двенадцатиперстной кишки. При использовании месалазина имеется риск развития интерстициального нефрита, лекарственного гепатита, панкреатита.
При неэффективности препаратов 5-АСК, среднем по тяжести и тяжелом течении БК, наличии внекишечных проявлений, непереносимости 5-АСК показано использование глюкокортикоидных препаратов (преднизолон, метилпреднизолон и др.). Они противодействуют образованию медиаторов воспаления за счет блокирования фосфолипазы А, способствующей высвобождению арахидоновой кислоты из клеточных мембран и ее метаболитов (цитокинов, NFкр. и др.). Указанные глюкокортикоидные препараты назначаются при обострении БК в случаях среднетяжелого течения из расчета 0,7–1,0 мг/кг массы тела в сутки. А при тяжелом течении — начиная с 1–1,5 мг/кг/сутки до наступления клинической ремиссии (не ранее чем через 3–4 недели) с последующим снижением дозы на 5–10 мг в течение 5–7 дней до 20 мг, далее на 2,5–5 мг/неделю до полного прекращения. Более 50 % больных, получавших глюкокортикоидные препараты в фазе обострения БК, становятся стероидозависимыми или стероидорезистентными. Глюкокортикоидные препараты не используются для поддерживающего лечения. Использование стероидных препаратов для поддерживающего лечения допустимо лишь в случаях неэффективности или непереносимости других средств, обеспечивающих возможность достижения ремиссии. В этом случае преднизолон целесообразно назначать внутрь через день.
При необходимости применения глюкокортикоидных препаратов следует отдавать предпочтение местнодействующим (топическим) формам. Их преимущество обеспечивается за счет более высокой афинности (сродства) к глюкокортикоидным рецепторам, минимальной способности всасываться из ЖКТ, более высокой биодоступности (быстрого метаболизма при прохождении через печень), что создает более высокую концентрацию препарата в кишке. Указанные средства лишены побочных эффектов, свойственных стероидам системного действия (артериальная гипертензия, гипергликемия, эрозивно-язвенные поражения гастродуоденальной зоны, остеопороз, психические расстройства, вторичные инфекции и др.). В числе топических глюкокортикоидных препаратов будесонид (буденофальк). При среднетяжелой форме БК рекомендуется его применение внутрь в дозе 9–18 мг/сутки. Возможно использование этого препарата и при легкой форме БК — по 9 мг/сутки.
Будесонид (буденофальк) следует применять в указанных дозах до наступления клинической ремиссии (до 2 месяцев), далее по 3 мг/сутки 2 недели с постепенным переходом на постоянный прием поддерживающих доз других средств базисной терапии (иммуносупрессанты).
При поражении дистальных отделов толстой кишки достаточно назначения будесонида (буденофалька) в виде ректальной пены (2–4 мг/сут).
Будесонид (буденофальк) высвобождается и становится активным в дистальных отделах тонкой кишки. Наиболее оптимальным является его назначение при локализации процесса в терминальном отделе подвздошной кишки и правой половины толстой кишки. Следует иметь в виду, что эффективность будесонида (буденофалька) несколько уступает глюкокортикоидам системного действия, поэтому последним отдается предпочтение при тяжелом течении БК.
Сочетание глюкокортикоидных средств с препаратами 5-АСК не сопровождается повышением ответа на лечение.
В случаях отсутствия эффекта от препаратов 5-АСК и глюкокортикоидных препаратов, наличия свищей и перианальных поражений, при стероидозависимых формах БК без острых гнойных осложнений показано использование иммуносупрессантов (препараты резерва), что позволяет снизить дозу и отменить стероидные препараты.
Следует отдавать предпочтение азатиоприну (2–2,5 мг/кг/сутки) или 6-меркаптопурину (по 1,5 мг/кг/сутки). Они применяются длительно, до 3–4 лет, с последующим снижением дозы в течение 1–2 лет для поддержания ремиссии. В числе относительно редких осложнений от использования этих препаратов возможны гепатотоксичность (синдром цитолиза, холестаза), тошнота, рвота, диарея, гриппоподобный синдром, лейкопения, нейтропения, тромбоцитопения, полиневрит.
При отсутствии эффекта от этого препарата возможно использование антиметаболитов фолиевой кислоты — метотрексата по 25 мг внутримышечно или внутрь 1 раз в неделю в течение 6–8 недель и более с последующим снижением дозы до 7,5–15 мг или по 5 мг внутрь через день и дальнейшим использованием до 12 месяцев. При применении этого препарата также возможны побочные эффекты, аналогичные тем, которые могут наблюдаться от использования азатиоприна. Поэтому в процессе лечения иммуносупрессантами показано периодическое проведение анализа крови, исследование печеночных ферментов (вначале 1 раз в неделю, далее 1 раз в месяц).
К категории базисных средств, которые следует использовать при активной БК, относятся антибактериальные препараты. Весьма эффективны при легкой и средней по тяжести БК метронидозол (по 10–20 мг/кг/сутки) или комбинация метронидозола перорально в указанной дозе (не эффективен при илеитах) с ципрофлоксацином внутрь по 500 мг 2 раза в сутки длительно (до 2–3 месяцев). При этом следует иметь в виду, что при длительном применении метронидозола имеется риск развития периферической полинейропатии. Альтернативой может быть использование ципрофлоксацина — 3–4 г/сутки.
При перианальной локализации БК показано использование метронидозола (400 мг 3 раза в день) и свечей со стероидами (2 раза в сутки).
Эффективность препартов 5-АСК оценивается на 14–21-й день, кортикостероидов — на 7–21-й день, азатиоприна и других иммуносупрессантов — через 2–3 месяца.
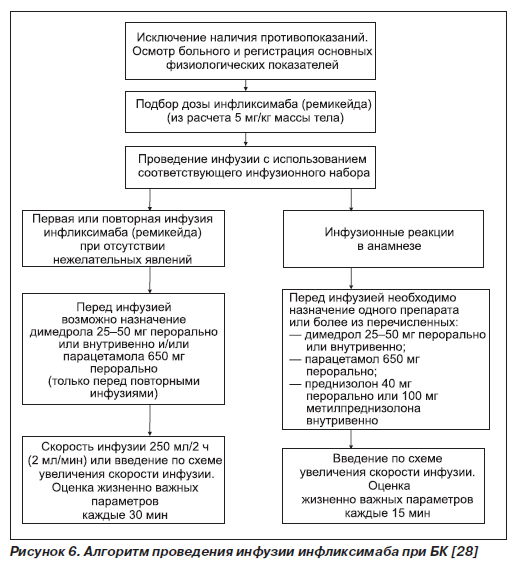
При свищевой форме, тяжелом течении и резистентных к лечению формах БК показано использование моноклональных IgG1-антител к ФНО-α — инфликсимаба (ремикейда) внутривенно из расчета 5 мг/кг массы тела трехкратно с интервалом 2 и 4 недели (недели 0, 2, 6) [26]. При наличии эффекта следует переходить к поддерживающему лечению введением препарата через каждые 2 месяца. В случае тяжелого течения БК при отсутствии эффекта в течение 2 недель после введения первой дозы дальнейшее введение инфликсимаба нецелесообразно. Инфликсимаб вызывает лизис воспалительных клеток, продуцирующих ФНО-α. Он обладает пролонгированным действием. В числе относительно редких побочных эффектов лихорадка, головная боль, уртикарная сыпь, активация туберкулезного процесса, развитие лимфомы.
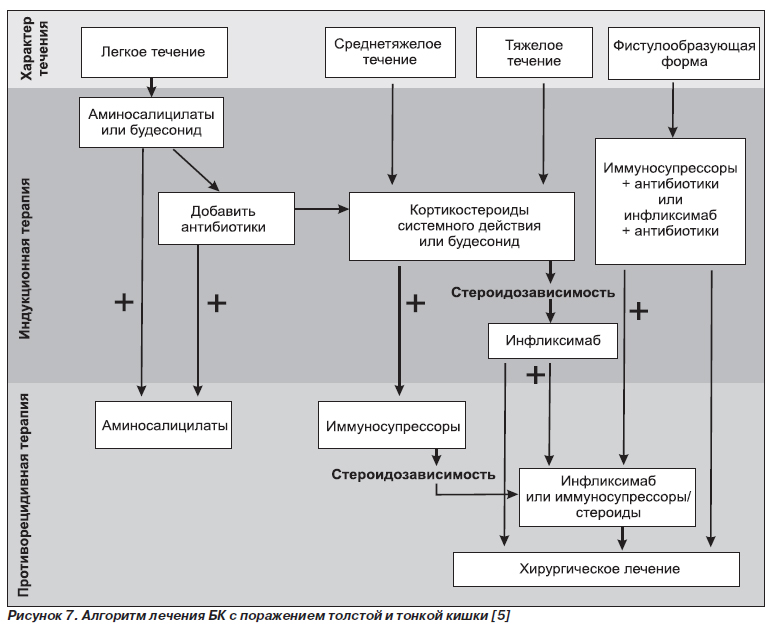
Утвержденные и потенциальные показания к терапии инфликсимабом (ремикейдом) при воспалительных заболеваниях кишечника в странах Западной Европы и США [5]
Утвержденные показания к индукционной терапии инфликсимабом:
Потенциальные показания к индукционной терапии инфликсимабом:
Утвержденные показания к поддерживающей терапии инфликсимабом:
Потенциальные показания к поддерживающей терапии инфликсимабом: нарушения нутритивного статуса на почве БК; задержка роста и развития у детей.
При тяжелом течении БК возможно использование комбинации преднизолона или метилпреднизолона (1 мг/кг/сутки внутривенно) с азатиоприном (2,5 мг/кг/сутки) или инфликсимабом (5 мг/кг внутривенно однократно).
Отмечен положительный эффект от использования рыбьего жира и его препаратов (омега-3), что связано со способностью последнего конкурентно подавлять активность липоксигеназы и изменять метаболизм арахидоновой кислоты в направлении образования неактивных в отношении воспаления веществ (лейкотриенов В5) вместо активных в отношении поддержания воспаления медиаторов (особенно лейкотриена В4). С указанной целью возможно использование препарата эйконол по
При стероидозависимых формах и угрозе тромбообразования могут использоваться гепарин (1000 ЕД 4 раза или 5000 ЕД 2 раза в день подкожно) или фраксипарин (по 0,3 мл в день). Указанные препараты обладают неспецифическим противовоспалительным действием за счет улучшения сосудистой проницаемости и уменьшения миграции лейкоцитов из сосудистого русла в очаг воспаления.
Улучшают микроциркуляцию и оказывают противовоспалительное действие (блокада ФНО) антиагреганты (пентоксифиллин).
Для коррекции метаболических нарушений показано парентеральное введение белковых препаратов (плазма, альбумин, смесь аминокислот), препаратов анаболических гормонов, жировых эмульсий, растворов электролитов, витаминов, гемотрансфузий (при анемиях).
Уместна при тяжелом течении дезинтоксикационная терапия (внутривенно инфузии соляных растворов, гемодеза, использование энтеросорбентов, плазмаферез, гемосорбция).
При выраженных поносах могут использоваться смекта, сандостатин (по 100 мкг 2–3 раза в день в течение 3–5 дней), вяжущие средства (отвар коры дуба, корня лапчатки, ольховых шишек, корки граната). Диарея, обусловленная поражением дистального отдела подвздошной кишки или его резекцией, поддается коррекции холестирамином (
При правильно подобранном лечении БК переходит в хроническую или интермиттирующую форму. Однако со временем эффективность лечения у большинства больных снижается и более чем у 70 % в связи с развитием осложнений (перфорация язв, перитонит, тяжелое кишечное кровотечение, кишечная непроходимость, образование абсцессов, свищей, развитие лимфомы, рака кишечника) возникает необходимость в оперативном лечении.
В числе основных видов операций — резекция пораженных отделов кишечника, стриктуропластика, дренирование абсцесса, иссечение фистул. Питание больных в период обострения заболевания должно осуществляться согласно диете № 4 по М. Певзнеру. Для профилактики развития мочекаменной болезни, обусловленной оксалурией, показано ограничение в рационе продуктов, богатых оксалатами (чай, какао, шоколад, лук, крыжовник, слива, шпинат).
Беременность при БК противопоказана в период обострения заболевания. В период ремиссии она протекает с минимальным риском для плода и в отношении развития рецидива. При активном течении БК у беременных возможно использование глюкокортикоидов и препаратов 5-АСК. Однако при этом заболевание плохо поддается лечению. Более эффективно использование азотиоприна. Инфликсимаб во время беременности противопоказан.
В случае острого процесса в перианальной области и предшествующих пластических операций по поводу свищей показано родоразрешение путем кесарева сечения.
Прогноз
При БК с легким и средним по тяжести течением в случаях с эффективной поддерживающей терапией прогноз благоприятный. При развитии осложнений, тяжелой и фульминантной форме возможен неблагоприятный прогноз. Среди критериев, не исключающих его возможность, возраст больных до 25 лет, период от появления первых симптомов более 5 лет и после последнего рецидива менее 6 месяцев, локализация процесса в толстой кишке.
Через год после установления диагноза вероятность обострения легкой степени — у 25 % и с высокой активностью — также у 25 % пациентов. При локализации процесса в тонкой кишке рецидивы БК возникают чаще, чем при локализации в толстой кишке.
В течение первых 10 лет заболевания оперативному лечению подвергается около 60 % больных. Через 15 лет 1/3 больных оперируется однократно, а еще 1/3 — 2 и более раза. Показания к хирургическим вмешательствам в течение первых пяти лет после установления диагноза чаще возникают при поражении тонкой кишки (80 %), нежели при вовлечении в процесс толстой кишки и при других локализациях процесса (40 %). 50 % оперативных вмешательств проводится по экстренным показаниям.
После оперативных вмешательств рецидивы возникают в течение 5 лет у 30 % и в течение 10 лет — у 50 % больных. Причем необходимость повторных оперативных вмешательств возникает у половины из них. Рецидивы БК чаще развиваются у детей. Существенно реже они возникают у пожилых людей и при поражении толстой кишки.
Через 5–10 лет после начала БК 15 % больных становятся нетрудоспособными.
1. Адлер Г. Болезнь Крона и язвенный колит. — М.: ГЭОТАР-МЕД, 2001. — 500 с.
2. Аруин Л.И., Капуллер Л.Л., Исаков В.А. Морфологическая диагностика болезней желудка и кишечника. — М.: Триада-Х, 1998. — 483 с.
3. Белоусова Е.А. Язвенный колит и болезнь Крона. — Тверь: ООО «Изд-во «Триада», 2002. — 128 с.
4. Воробьев Г.И., Костенко Н.В. Хирургическое лечение язвенного колита и болезни Крона // Неспецифические воспалительные заболевания кишечника / Под ред. Г.И. Воробьева, И.Л. Халифа. — М.: Миклош, 2008. — С. 258-313.
5. Ивашкин В.Г., Шульпекова Ю.О. Рекомендации для практических врачей по лечению болезни Крона. — 27 с.
6. Капуллер Л.Л. Патологоанатомические изменения толстой кишки при неспецифических воспалительных заболеваниях кишечника // Неспецифические воспалительные заболевания кишечника / Под ред. Г.И. Воробьева, И.А. Халифа. — М.: Миклош, 2008. — С. 71-105.
7. Киркин Б.Д. Лечебная тактика при неспецифическом язвенном колите и болезни Крона: Дис... д-ра мед. наук. — М., 1989.
8. Конович Е.А. Роль местного и системного иммунитета в этиопатогенезе и лечении деструктивных процессов толстой кишки (неспецифический язвенный колит и болезнь Крона): Дис... д-ра мед. наук. — М., 1997.
9. Левитан М.Х., Абасов И.Г., Капуллер Л.Л. Болезнь Крона. — Баку: Азернешр, 1974. — 238 с.
10. Орлова Л.П. Ультразвуковое исследование при язвенном колите и болезни Крона // Неспецифические воспалительные заболевания кишечника / Под ред. Г.И. Воробьева, И.Л. Халифа. — М.: Миклош, 2008. — С. 201-213.
11. Aldbert D., Nottenghem B., Reumaux D., Lassale P. Anti-endothelial cell antibodies in sera from patients with inflammatory bowel disease // Gastroenterol.clinique et biologique. — 1995. — V. 11. — P. 867-870.
12. Bernstein C.N., Blanchard J.F., Rawsthorne P., Wajda A. Epidemiology of Crohn''s disease and ulcerative colitis in the central Canadian province: a population-based study // Am. J. Epidemiol. — 1999. — V. 149(10). — P. 916-924.
13. Best W.R., Becktel J.M., Singleton J.W. et al. Development of Crohn''s disease activity index. National Cooperative Crohn''s disease Study // Gastroenterology. — 1976. — V. 70. — P. 439-444.
14. Farmer R.G. Study of family history among patients with inflammatory bowel disease // Scand. J. Gastroent. — 1989. — V. 24 (suppl. 170). — P. 64-65.
15. Helits T., Halme L., Lappalaihen M. et al. CARD 15/NOD2 gene variants are associated with familially occurring and complicated forms of Crohn''s disease // Gut. — 2003. — V. 52. — P. 558-562.
16. Hugot J.P., Laurent-Puig P., Gower-Roussean C. et al. Mapping of a susceptibi-lity locus for Crohn''s disease on chromosome 16 // Nature. — 1966. — V. 379. — P. 821-822.
17. IBD International Genetics Consortium. International collaboration provides convincing linkage replication in complex disease through analysys of a large pooled data set: Crohn disease and chromoso-me 16 // Am. J. Hum. Genet. — 2001. — V. 68. — P. 1165-1171.
18. Jliffe G.D., Owen D.A. Rectal biopsy in Crohn''s disease // Dig. Dis. Sci. — 1981. — V. 26. — P. 321-324.
19.
20. Karetitz B. Carcinoma of the intestinal tract in Crohn''s disease // Amer. J. Gastroenterol. — 1983. — V. 78. — P. 44-48.
21. Langholz E. Epidemiology of IBD and colorectal cancer in IBD // International meeting «Prevention of colorectal cancer with 5-ASA». —
22. Loftus E. Crohn''s disease in Olmsted Country,
23. Malchow H., Ewe K., Brand J.W. et al. European Cooperative Crohn''s disease study (ECCDS): results of drug treatment // Gastroenterology. — 1984. — V. 86. — P. 249-266.
24. Mendelof A.J. The epidemiology of Crohnic inflammatory bowel disease // Inflammatory bowel disease / Ed. by G. Jarnerot. — 1992. — P. 15-34.
25. Peeters M., Geypen B., Claus D. et al. Clustering of increased small intestinal permeability in families with Crohn''s disease // Gastroenterology. — 1997. — V. 113(3). — P. 802-807.
26. Present G.H., Rutgeerts P., Targan S., Hanauer et al. Infliximab for the treatment of fistulas in patients with Crohn''s disease // N. Engl. J. Med. — 1999. — V. 340. — P. 1398-1405.
27. Quinton J.F., Sendid B., Reumax D. et al. Anti-saccharomyces cerevisiae mannan antibodies combined with antineutrophil cytoplasmic autoantibodies in inflammatory bowel disease: prevalence and diagnostic role // Gut. — 1998. — V. 42. — P. 788-791.
28. William J., Sandborn D., Stephen B. Infliximab in the treatment of Crohn''s Disease: A User''s Guide for Clinicans // Am. J. Gastroenterol. — 2002. — V. 97, № 12.