Газета «Новости медицины и фармации» 3(308) 2010
Вернуться к номеру
Лучевая диагностика при синдроме тазовых болей
Продолжение. Начало в № 2, 2010
Распространенность этого синдрома тесно связана с варикозным расширением вен яичников, которое наблюдается у 10 % общей популяции женщин. В этой группе синдром недостаточности вен таза развивается в 60 % случаев [32]. Патогенез этого синдрома является мультифакториальным, риск развития повышают оперативные вмешательства на полости таза, многочисленные беременности и гормональные расстройства.
 Синдром застоя в тазовых венах может быть обусловлен анатомическими аномалиями, например ретроаортальным расположением левой почечной вены или правой общей подвздошной вены с их компрессией [30]. Кроме того, он может сочетаться с бессимптомной гематурией при синдроме «щелкунчика», который наблюдается при сдавлении левой почечной вены верхней брыжеечной артерией с вторичным застоем в левой яичниковой вене. Помимо вен яичникового сплетения нередко расширяются вены широкой связки матки и стенок таза, на этом фоне может наблюдаться варикозное расширение вен паравагинального сплетения, влагалища и нижних конечностей. Примерно в 40 % случаев эти изменения сочетаются с синдромом поликистоза яичников [36].
Синдром застоя в тазовых венах может быть обусловлен анатомическими аномалиями, например ретроаортальным расположением левой почечной вены или правой общей подвздошной вены с их компрессией [30]. Кроме того, он может сочетаться с бессимптомной гематурией при синдроме «щелкунчика», который наблюдается при сдавлении левой почечной вены верхней брыжеечной артерией с вторичным застоем в левой яичниковой вене. Помимо вен яичникового сплетения нередко расширяются вены широкой связки матки и стенок таза, на этом фоне может наблюдаться варикозное расширение вен паравагинального сплетения, влагалища и нижних конечностей. Примерно в 40 % случаев эти изменения сочетаются с синдромом поликистоза яичников [36].
Лучевая диагностика
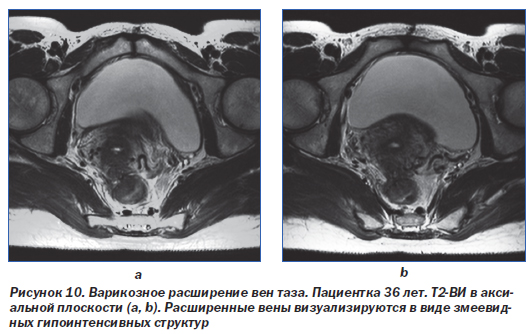
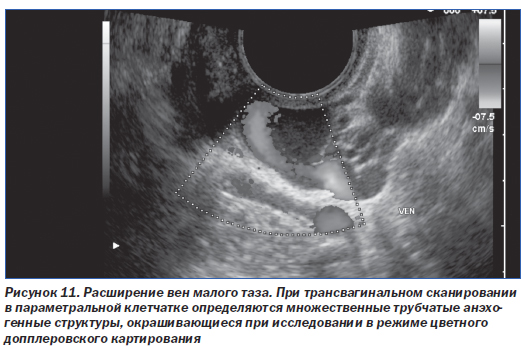
Для данного синдрома типично наличие расширенных извитых сосудов, окутывающих матку и яичники, иногда с распространением на стенки таза или влагалище (рис. 10, 11). И КТ, и МРТ позволяют неинвазивно установить диагноз варикозного расширения вен таза. Диагностическими критериями при КТ являются расширение не менее 4 околоматочных вен с одной стороны при диаметре хотя бы одной из них более 4 мм или диаметре яичниковой вены более 8 мм [41]. При МРТ на Т1-ВИ варикозно расширенные вены выглядят гипоинтенсивными за счет феномена пустоты потока. На Т2-ВИ интенсивность МР-сигнала от них зависит от скорости кровотока. МР-ангиография с контрастным усилением позволяет выявить варикозно расширенные сосуды в венозной фазе. На изображениях в последовательности «градиентное эхо» расширенные вены, как правило, дают сигнал высокой интенсивности.
 Дифференциальная диагностика
Дифференциальная диагностика
Расширение и недостаточность клапанов яичниковых вен может протекать бессимптомно и нередко выявляется при КТ у рожавших женщин [41]. Порой данные изменения приходится дифференцировать с врожденными или приобретенными мальформациями сосудов таза. При КТ или МРТ с контрастным усилением мальформации, как правило, рано накапливают контрастный препарат, тогда как варикозно расширенные вены демонстрируют отсроченное усиление. Вокруг яичника при его перекруте, а также вокруг редких опухолей матки, особенно хориокарцином, также могут выявляться расширенные извитые сосуды, интенсивно накапливающие контрастный препарат. Установить правильный диагноз при этом позволяют клинические проявления и данные анамнеза.
Значение методов лучевой диагностики
В основном для установления диагноза варикозного расширения вен таза достаточно УЗИ. МРТ и КТ используются для подтверждения диагноза и мониторинга эффективности лечения. Однако необходимо помнить, что томография может выполняться только в положении лежа и, следовательно, патологические изменения вен при ней часто недооценивают.
На сегодняшний день активно исследуются различные методы лечения варикозного расширения вен таза, в том числе лапароскопическое трансперитонеальное лигирование яичниковых вен. Безопасно и эффективно снять болевой синдром позволяет чрескожная эмболизация вен таза [32].
Тромбоз яичниковых вен
Тромбоз яичниковых вен относится к осложнениям послеродового периода и чаще наблюдается после родоразрешения через кесарево сечение. В основе тромбоза лежат венозный застой и повышение свертываемости крови. Частота встречаемости данного осложнения составляет 1 случай на 2000 родов [16]. Инфекционные заболевания, злокачественные опухоли, недавние оперативные вмешательства, болезнь Крона и некоторые другие патологические состояния повышают риск развития тромбоза яичниковых вен [16]. Несмотря на небольшую распространенность, данное осложнение представляет трудности в диагностике, так как протекает с неспецифической симптоматикой, включая повышение температуры. Фатальными осложнениями тромбоза яичниковых вен являются некроз матки и сепсис [16]. В большинстве случаев (80–90 %) наблюдается тромбоз вен правого яичника, соответственно, боли при этом локализуются преимущественно в правой половине таза.
Лучевая диагностика
При тромбозе яичниковых вен выявляется расширенная тубулярная структура, идущая от яичника к аорте в области ворот почек. При КТ с контрастным усилением тромб удается увидеть напрямую, как центральный дефект контрастирования. При МРТ тромб характеризуется гиперинтенсивным сигналом на Т1- и Т2-ВИ. Дифференцировать его от потоковых артефактов помогают изображения в последовательности «градиентное эхо» в аксиальной плоскости и постконтрастные Т1-ВИ. Оценить протяженность тромба удается на изображениях во фронтальной плоскости.
Дифференциальная диагностика
Дифференциальный диагноз включает заболевания, которые могут проявляться болями в правой половине таза, в том числе аппендицит, перекрут яичника, абсцесс, пиелонефрит и эндометриоз [29].
 Значение методов лучевой диагностики
Значение методов лучевой диагностики
Основным методом первичной диагностики при подозрении на тромбоз вен яичника является УЗИ с цветным допплеровским сканированием. Его эффективность может быть ограничена при увеличении матки (особенно в послеродовом периоде), послеоперационных изменениях и избыточной массе тела, в связи с чем приходится выполнять КТ или МРТ.
Аппендицит
Острый аппендицит может развиться в любом возрасте, заболеваемость достигает пика в возрасте 20–25 лет, а затем постепенно снижается; мужчины болеют в 1,4 раза чаще, чем женщины. В большинстве случаев воспаление червеобразного отростка происходит в результате его обструкции кишечным содержимым, гиперплазированной лимфоидной тканью, инородными телами и новообразованиями. Различные варианты расположения отростка нередко затрудняют клиническую диагностику аппендицита. Примерно в 30 % случаев он располагается ретроперитонеально; интраперитонеальные варианты локализации включают ретроцекальное, ретроилеальное, глубокое тазовое расположение, реже червеобразный отросток достигает правого верхнего квадранта живота.
Острый аппендицит является наиболее частой причиной синдрома острого живота и, соответственно, неотложных оперативных вмешательств. Ввиду сложностей клинической диагностики ложноположительный диагноз влечет за собой выполнение аппендэктомии в 20 % случаев [38].
У женщин репродуктивного возраста этот показатель возрастает до 40 %, так как острые гинекологические состояния очень часто клинически имитируют острый аппендицит [10].
По сравнению с другими причинами тазовых болей для острого аппендицита нехарактерны продолжительные боли.
В 38–55 % случаев острый аппендицит осложняется перфорацией и формированием абсцесса, наиболее часто осложнения развиваются в детском и пожилом возрасте.
Лучевая диагностика
При КТ нормальный червеобразный отросток имеет вид цилиндрической структуры диаметром менее 6 мм, в которой может содержаться воздух и куда нередко попадает введенный per os контрастный препарат. При остром аппендиците размеры отростка увеличиваются (внешний диаметр > 6 мм), стенка становится более толстой и накапливает контрастный препарат, а периаппендикулярная клетчатка отекает [40]. На перфорацию отростка указывает появление воздуха вне просвета кишки, дефект в стенке отростка, накапливающей контрастное вещество, а также наличие абсцесса или флегмоны. Флегмона представляет собой диффузное воспаление периаппендикулярной клетчатки при отсутствии ограниченного скопления жидкости или небольшом его объеме. Абсцесс имеет вид ограниченного скопления жидкости с периферическим накоплением контрастного препарата [40]. Дополнительно может выявляться локальное утолщение стенки слепой кишки за счет ее воспаления — симптом стрелки. МР-признаки острого аппендицита не отличаются от КТ-семиотики, к ним относятся утолщение стенки червеобразного отростка, его расширение за счет скопления жидкости, а также усиление интенсивности МР-сигнала от прилежащей жировой клетчатки на Т2-ВИ и постконтрастных Т1-ВИ. Если рядом с червеобразным отростком на Т2-ВИ выявляется округлое жидкостное образование с гипоинтенсивной стенкой, накапливающей контрастный препарат, следует думать о формировании абсцесса. Патогномоничным признаком считается наличие внутри такого образования пузырьков газа [34, 35].
Значение методов лучевой диагностики
В детском и репродуктивном возрасте при подозрении на острый аппендицит первичным методом лучевой диагностики является УЗИ. Однако данный метод не позволяет визуализировать неизмененный червеобразный отросток, выявить его при атипичном анатомическом расположении данным методом бывает весьма затруднительно, в связи с этим при отрицательных результатах УЗИ рекомендуется выполнение КТ. Компьютерная томография является методом выбора в диагностике сложных случаев аппендицита, ее чувствительность при этом достигает 90–95 %, а специфичность — 95–100 %. Альтернативным методом остается МРТ, которая благодаря отсутствию ионизирующего излучения получила широкое распространение в установлении причин болей в правом нижнем квадранте живота у детей и беременных женщин [12, 35].
Дивертикулит
В общей популяции дивертикулез толстой кишки встречается достаточно часто, выявляясь примерно у 5–10 % населения старше 45 лет и 80 % старше 85 лет [25].
Дивертикулы представляют собой небольшие мешковидные выпячивания слизистого и подслизистого слоя стенки толстой кишки. Как правило, они возникают в местах пенетрации кишечной стенки нервами и сосудами между брыжейкой и мышечными лентами [24]. Наиболее часто дивертикулы встречаются в сигмовидной кишке. Острый дивертикулит развивается при обтурации шейки дивертикула частицами пищи, кишечным содержимым или при отеке стенки кишки. В результате происходит микроперфорация стенки дивертикула с развитием перифокального воспаления клетчатки и брыжейки кишки. Этот процесс может осложняться формированием абсцесса или свища; более грозным осложнением дивертикулита является неприкрытая перфорация, приводящая к развитию перитонита [25]. Клинически дивертикулит проявляется болями и болезненностью при пальпации (чаще в левом нижнем квадранте живота), которые могут нарастать в течение нескольких дней, прежде чем пациентка обратится за медицинской помощью. Нередко развивается субфебрильная лихорадка и умеренный лейкоцитоз, однако их отсутствие не исключает диагноз.
В западноевропейской популяции правосторонний дивертикулит наблюдается только в 1,5 % случаев, однако в странах Азии встречается чаще; преимущественно такая локализация характерна для молодого возраста [25]. Дивертикулит тонкой и поперечно-ободочной кишки встречается крайне редко [24].
Лучевая диагностика
При КТ дивертикул представляет собой небольшое выпячивание стенки кишки (чаще сигмовидной), содержащее газ. При МРТ на Т1-ВИ дивертикул выглядит гипоинтенсивным на фоне яркого МР-сигнала от околокишечной клетчатки. Отек прилежащей клетчатки является более характерным признаком дивертикулита, чем утолщение стенки кишки. Дифференцировать дивертикулит от прочих воспалительных заболеваний толстой кишки позволяет выявление в пораженном сегменте дивертикула. Лучше оценить утолщение стенки кишки и воспалительный отек прилежащей клетчатки удается на постконтрастных Т1-ВИ и при КТ с контрастным усилением. К дополнительным симптомам дивертикулита относят утолщение латеральной фасции и наличие небольшого выпота в маточно-прямокишечном пространстве. Скопление жидкости в корне брыжейки сигмовидной кишки называется симптомом «запятой», а извитость брыжеечных сосудов — симптомом «сороконожки» [25].
К осложнениям дивертикулита относят абсцедирование, формирование кишечно-пузырных фистул и перфорацию. Образование абсцесса дивертикула наблюдается в 30 % случаев, при этом выявляется округлое жидкостное образование с толстой стенкой, накапливающей контрастный препарат с признаками перифокального воспаления; нередко в нем содержится газ с наличием уровня жидкости [24]. Признаками кишечно-пузырного свища являются утолщение стенки мочевого пузыря, прилежащей к пораженной петле кишки, а также появление в его просвете пузырьков газа. Еще одним осложнением дивертикулита является прикрытая перфорация, которая проявляется скоплением вне просвета кишки газа или контрастного препарата, введенного per os. Пневмоперитонеум на фоне дивертикулита наблюдается достаточно редко [24].
Дифференциальная диагностика
Наиболее важно дифференцировать дивертикулит и рак толстой кишки. Длина пораженного сегмента кишки более 10 см, извитие сосудов брыжейки и скопление в ней жидкости более характерны для дивертикулита [15], тогда как увеличение регионарных лимфатических узлов чаще свидетельствует о развитии злокачественного процесса [14]. Однако в ряде случаев дифференцировать данные заболевания не представляется возможным, а в 3–18 % случаев (по разным данным) они могут протекать синхронно [15].
Значение методов визуализации
Лучевая диагностика при дивертикулите, как правило, используется для исключения его осложнений и решения вопроса о необходимости экстренного оперативного вмешательства. Преимущество КТ состоит в том, что данный метод позволяет сразу же провести прицельное дренирование. МРТ может применяться для диагностики дивертикулита правых отделов толстой кишки у детей и беременных женщин с подозрением на аппендицит.
Воспаление жирового привеска толстой кишки
Жировой привесок свисает в брюшную полость с наружной поверхности стенки толстой кишки. Размер, форма и контуры привесков значительно варьируют, максимальных размеров они достигают при ожирении и у пациентов, быстро потерявших вес. Средняя длина подвеска составляет 3 см, однако может достигать 15 см и более [20]. Эти анатомические образования призваны выполнять защитную функцию при перистальтике. Воспаление жирового подвеска развивается вследствие его перекрута или тромбоза дренирующей вены. Наиболее часто это происходит в возрасте от 10 до 40 лет, женщины и мужчины болеют одинаково часто [20].
Клинически это проявляется внезапным возникновением острых болей в животе без лейкоцитоза и подъема температуры [20].
Лучевая диагностика
В норме жировые привески толстой кишки не визуализируются при МРТ и КТ, исключение составляют случаи, когда они окружены скоплением геморрагической или асцитической жидкости. При их воспалении на изображениях выявляются пальцевидные объемные образования, связанные с кишечной стенкой, плотность которых соответствует плотности жира; прилежащая околокишечная клетчатка может быть отечна [38].
При КТ плотность таких образований, как правило, выше, чем у интактной клетчатки. Типичным признаком является наличие вокруг таких структур четкого гиперденсного кольца, которое соответствует воспаленной висцеральной брюшине. Прилежащая стенка кишки также может быть утолщена и компремирована. Иногда в центре подвеска удается визуализировать гиперденсную центральную точку (тромбированный сосуд) или кровоизлияние. В редких случаях в области перенесенного инфаркта в привесках остаются дистрофические кальцинаты [38].
Дифференциальная диагностика
Сегментарный инфаркт сальника (как правило, правосторонний) развивается вследствие тех же причин, что и воспаление жирового привеска кишки, — при перекруте или спонтанном венозном тромбозе. На изображениях при этом может выявляться отечность и инфильтрация ткани сальника либо его псевдотуморозное воспаление, при этом пораженный участок не всегда прилежит к кишке. Так как инфаркт сальника по семиотике может не отличаться от воспаления жирового подвеска кишки, некоторые авторы предлагают объединять эти нозологические единицы в «локальный инфаркт клетчатки» [38].
Значение методов визуализации
Инфаркт сальника и воспаление жирового подвеска кишки проявляются острыми болями в животе и нередко интерпретируются как острый аппендицит или дивертикулит. Методы медицинской визуализации (в частности, КТ) позволяют установить правильный диагноз и избежать необходимости диагностического оперативного вмешательства.
Болезнь Крона
Болезнь Крона представляет собой хроническое гранулематозное воспаление желудочно-кишечного тракта, при котором может поражаться любой его отдел от ротовой полости до анального отверстия, нередко изменения носят мультифокальный характер. Чаще заболевание развивается в возрасте 20–30 лет. В 80 % случаев поражается тонкая кишка, в частности терминальный отдел подвздошной кишки. Поражение толстой кишки может протекать изолированно или одновременно с поражением тонкой кишки [19]. Клиника болезни Крона складывается из продолжительной диареи, болей в животе, лихорадки и потери массы тела. В связи с воспалением всей толщи кишечной стенки нередко развивается спаечный процесс, формирование псевдоопухолевых конглометратов, фистул и кишечной непроходимости. Развитие синусовых ходов может приводить к пенетрации серозной оболочки и перфорации кишечной стенки. Данное осложнение нередко сопровождается развитием перитонита, который проявляется острыми болями в животе, лихорадкой и болезненностью при пальпации. В 22 % случаев болезнь Крона поражает перианальный отдел, с формированием трещин, фистул и абсцессов, нередко такие изменения являются первыми симптомами заболевания [19].
Лучевая диагностика
Наиболее типичным изменением при болезни Крона является утолщение стенки кишки до 1–2 см, хорошо выявляемое при КТ и МРТ [61]. Активное воспаление проявляется типичным накоплением контрастного вещества пораженной стенкой по типу мишени. Степень накопления пораженной стенкой контрастного препарата пропорциональна выраженности воспалительного процесса [19]. Дополнительными признаками заболевания являются сужение просвета кишки с престенотическим расширением, фиброзно-жировая пролиферация брыжейки и увеличение брыжеечных лимфатических узлов до 3–8 мм. При КТ область фиброзно-жировой пролиферации характеризуется более высокой плотностью, чем нормальная клетчатка. При МРТ эти участки дают МР-сигнал пониженной интенсивности. В брыжейке тонкой кишки, брюшной стенке, поясничной мышце и перианальных тканях могут формироваться абсцессы и флегмоны, которые отчетливо визуализируются при КТ и на Т1-ВИ с подавлением сигнала жира. Перечисленные методы также позволяют дифференцировать фистулы и синусовые ходы, однако, по данным литературы, чувствительность МРТ в диагностике синусовых ходов по сравнению с ирригоскопией составляет всего 50–75 % [22].
Дифференциальная диагностика
Неспецифический язвенный колит характеризуется изъязвлением слизистой оболочки кишки и преимущественно поражает прямую кишку. Для него характерно диффузное или левостороннее поражение толстой кишки, изолированное изменение ее правых отделов наблюдается редко [37]. При болезни Крона утолщение кишечной стенки обычно выражено в большей степени, чем при язвенном колите. Для последнего характерно наличие в стенке гиподенсного кольца (симптом обруча) — скопления жира в подслизистом слое. Пролиферация жировой клетчатки в брыжейке кишки встречается только при болезни Крона, тогда как пролиферация периректальной клетчатки представляет собой неспецифический симптом, который встречается при болезни Крона, неспецифическом язвенном колите, лучевом и псевдомембранозном колитах [37]. Формирование абсцессов часто наблюдается при болезни Крона и фактически никогда — при язвенном колите [22].
Значение методов визуализации
КТ и МРТ позволяют определить глубину поражения стенки кишки, выявить престенотические изменения, а также исключить наличие внекишечных осложнений (абсцессы клетчатки и др.). Однако диагностические возможности данных методов в выявлении ранних изменений, свищей и синусовых ходов уступают ирригоскопии [19].
Гематома прямой мышцы живота
Подоболочечная гематома прямой мышцы живота образуется вследствие разрыва эпигастральных сосудов или надрывов самой мышцы, данное патологическое состояние встречается редко и зачастую трактуется как проявление другого заболевания. Причинами формирования гематомы могут быть коагулопатии, травма или антикоагуляционная терапия [46]. Клинически гематома проявляется острыми болями в животе, появлением в околопупковой области пальпируемого мягкотканого образования и анемией. У некоторых пациентов гематома формируется на фоне надсадного кашля.
Лучевая диагностика
Форма гематомы зависит от ее расположения по отношению к дугообразной линии, которая проходит на 3–3,5 см ниже пупка [46]. Гематомы, расположенные выше этого уровня, обычно имеют веретеновидную форму, так как их ограничивают плотные волокна апоневроза. Ниже дугообразной линии гематомы чаще имеют форму сферы и могут сообщаться с экстраперитонеальным и параваскулярными пространствами таза. При КТ гематомы имеют вид гомогенных гиперденсных образований, окруженных тонким гиподенсным кольцом. По мере лизиса тромба плотность гематомы снижается, в ее структуре выпадает осадок и может появляться граница раздела сред [18, 46]. Дополнительно повышается плотность прилежащей к области гематомы подкожной клетчатки и формируется отек переднебоковых мышц брюшной стенки. При МРТ гематома прямой мышцы живота имеет негомогенную структуру с наличием гиперинтенсивных включений на Т1- и Т2-ВИ; дополнительно в ней может появляться граница раздела сред и периферическая капсула.
Дифференциальная диагностика
Для гематом прямой мышцы живота типично острое развитие на фоне антикоагулянтной терапии. МРТ позволяет дифференцировать хронические гематомы от других объемных образований передней брюшной стенки, таких как липома, гемангиома, нейрофиброма, десмоидная опухоль, саркома, лимфома и метастаз. В опухолях редко выявляются участки гиперинтенсивного МР-сигнала, хотя в структуре могут возникать кровоизлияния [18].
При клиническом подозрении на формирование гематомы прямой мышцы живота и неоднозначных данных УЗИ показано выполнение КТ. Данный метод, как правило, позволяет установить правильный диагноз и определить целесообразность хирургического вмешательства [46].
Под ред. Г.Е. Труфанова, В.О. Панова. — СПб.: ЭЛБИ-СПб, 2008
1. Бодяжина В.И., Сметник В.П., Тумилович Л.Г. Неоперативная гинекология. — М.: Медицина, 1990.
2. Бокачев В.Ю. Варикозная болезнь вен малого таза // Гинекология. — 2006. — Т. 8. — № 4.
3. Касабулатов Н.М., Орджоникидзе Н.В., Емельянова А.И. Диагностика, лечение и профилактика послеродового эндометрита // Акушерство и гинекология. — 2006. — № 5.
4. Мизандари М.Г., Мтварадзе А.С. Прогрессирующая внематочная беременность — возможности абдоминальной и вагинальной ультразвуковой диагностики // Медицинская визуализация. — 2004. — № 3. — С. 102-106.
5. Савельева И.С. Инфекционно-воспалительные поражения женских половых органов и дисменорея. Современные аспекты этиопатогенеза, диагностики и лечения хронических воспалительных заболеваний внутренних половых органов // РМЖ. — 1999. — С. 7(3).
6. Семендяев А.А, Коган А.С., Шантуров В.А. Эндоскопическая диагностика и органосохраняющее лечение при внематочной беременности // Медицинская визуализация. — 2001. — № 1. — C. 32-37.
7. Тодуа Ф., Джваршеишвили Л., Сванидзе Г., Надареишвили А. Радиологические методы исследования в диагностике синдрома острых тазовых болей, вызванных гинекологической патологией // Медицинская визуализация. — 2006. — № 6.
8. Хоменко Н.Е., Восканян Ю.Э., Гаспарян С.А. Варикозная болезнь вен малого таза: этиология, патогенез, диагностика, лечение // Акушерство и гинекология. — 2006. — № 6.
9. Яглов В.В. Воспалительные заболевания органов малого таза // Гинекология. — 2006. — T. 8. — № 4.
10. Andersson R.E., Hugander A., Thulin A.J. Diagnostic accuracy and perforation rate in appendicitis: association with age and sex of the patient and with appendectomy rate // Eur. J. Surg. — 1992. — Vol. 158. — 37-41.
11. Bennett G.L., Slywotzky C.M., Giovanniello G. et al. Gynecologic causes of acute pelvic pain: spectrum of CT findings // Radiographics. — 2002. — Vol. 22. — Р. 85-801.
12. Birchard K.R., Brown M.A., Hyslop W.B. et al. MRI of acute abdominal and pelvic pain in pregnant patients // AJR. — 2005. — Vol. 184. — Р. 452-458.
13. Bouyer J., Coste J., Fernandez H. et al. Sites of ectopic pregnancy: a 10 year population based study of 1,800 cases // Human. Reprod. — 2002. — Vol. 17. — Р. 3224-3230.
14. Cintapalli K.N., Chopra S., Ghiatas A.A. et al. Diverticulitis versus colon cancer: differentiation with helical CT findings // Radiology. — 1999. — Vol. 210. — Р. 429-435.
15. Cobben L.P., Groot I., Blickman J.G. et al. Right colonic diverticulitis: MR appearance // Abdom. Imaging. — 2003. — Vol. 28. — Р. 794-798.
16. Dunnihoo D.R., Gallaspy J.W., Wise R.B. et al. Post-partum ovarian vein thrombophlebitis: a review // Obstet. Gynecol. Surv. — 1991. — Vol. 46. — Р. 415-427.
17. Filhastre M., Dechaud H., Lesnik A. et al. Interstitial pregnancy: role of MRI // Eur. Radiol. — 2005. — Vol. 15. — Р. 93-95.
18. Fukuda T., Sakamoto I., Kohzaki S. et al. Spontaneous rectus sheath hematomas: clinical and radiological features // Abdom. Imaging. — 1996. — Vol. 21. — Р. 58-61.
19. Furukawa A., Saotome T., Yamasaki M. et al. Cross-sectional imaging in Crohn disease // Radiographics. — 2004. — Vol. 24. — Р. 689-702.
20. Gelrud A., Cardenas A., Chopra A. Epiploic appendagitis. www.uptodate.com // Cited. — 2005.
21. Ghiatas A.A. The spectrum of pelvic inflammatory disease // Eur. Radiol. — 2004. — Vol. 14. — Р. 184-192.
22. Gourtsoyiannis N., Papanikolaou N., Grammatikakis J. et al. MR enteroclysis: technical considerations and clinical applications // Eur. Radiol. — 2002. — Vol. 12. — Р. 2651-2658.
23. Graif M., Itzach Y. Sonographic evaluation of ovarian torsion in childhood and adolescence // AJR. — 1988. — Vol. 150. — Р. 647-649.
24. Horton K.M., Corl M.F., Fishman E.K. CT evaluation of the colon: inflammatory disease // Radiographics. — 2000. — Vol. 20. — Р. 399-418.
25. Kang J.Y., Melville D., Maxwell J.D. Epidemiology and management of diverticular disease of the colon // Drugs Aging. — 2004. — Vol. 21. — Р. 211-228.
26. Kawakami S., Togashi K., Kimura I. et al. Primary malignant tumor of the fallopian tube: appearance at CT and MR imaging // Radiology. — 1993. — Vol. 196. — Р. 503-508.
27. Kim S.H., Yang D.M. et al. Unusual causes of tubo-ovarian abscess. CT and MR imaging findings // Radiographics. — 2004. — Vol. 24. — Р. 1575-1589.
28. Koonings P.P., Grimes D.A. Adnexal torsion in post-menopausal women // Obstet. Gynecol. — 1989. — Vol. 73. — Р. 11-12.
29. Kubik-Huch R.A., Hebisch G., Huch R. et al. Role of duplex color Doppler ultrasound, computed tomography, and MR angiography in the diagnosis of septic puerperal ovarian vein thrombosis // Abdom. Imaging. — 1999. — Vol. 24. — Р. 85-91.
30. Kuligowska E., Deeds L. Pelvic pain: over-looked and underdiagnosed gynaecologic conditions // Radiographics. — 2005. — Vol. 25. — Р. 3-20.
31. Lee E.J., Kwon H.C., Joo H.J. et al. Diagnosis of ovarian torsion with color Doppler sonography: depiction of twisted vascular pedicle // J. Ultrasound. Med. — 1998. — Vol. 17. — Р. 83-89.
32. Mathias S.D., Kuppermann M., Liberman R.F. et al. Chronic pelvic pain: prevalence, health-related quality of life, and economic correlates // Obstet. Gynecol. — 1996. — Vol. 87. — Р. 321-327.
33. Nishino M., Hayakawa K., Kawamata K. et al. MRI of early unruptured pregnancy: detection of gestational sac // J. Comput. Assist. Tomogr. — 2002. — Vol. 26. — Р. 134-137.
34. Nitta N., Takahashi M., Furukawa A. et al. MR imaging of the normal appendix and acute appendicitis // J. Magn. Reson. Imaging. — 2005. — Vol. 21. — Р. 156-165.
35. Oto A., Ernst R., Shah R. et al. Right-lower-quadrant pain and suspected appendicitis in pregnant women: evaluation with MR imaging — initial experience // Radiology. — 2005. — Vol. 234. — Р. 445-451.
36. Park S.J., Lim J.W., Ko Y.T. et al. Diagnosis of pelvic congestion syndrome using transabdominal and trans-vaginal sonography // AJR. — 2004. — Vol. 182. — Р. 683-688.
37. Philpotts L.E., Heiken J.P., Westcott M.A. et al. Colitis: use of CT findings in differential diagnosis // Radiology. — 1994. — Vol. 190. — Р. 445-449.
38. Pereira J.M., Sirlin C.B., Pinto P. et al. CT and MR imaging of extrahepatic fatty masses of the abdomen and pelvis: techniques, diagnosis, differential diagnosis and pitfalls // Radiographics. — 2005. — Vol. 25. — Р. 69-85.
39. Protopapas A.G., Diakomanolis E.S., Milingos S.D. et al. Tubo-ovarian abscesses in postmenopausal women: gynaecological malignancy until proven otherwise? // Eur. J. Obstet. Gynecol. Reprod. Biol. — 2004. — Vol. 15. — Р. 203-209.
40. Rao P.M., Rhea J.T., Novelline R.A. Sensitivity and specificity of the individual CT signs: experience with 200 helical appendiceal CT examinations // J. Comput. Assist. Tomogr. — 1997. — Vol. 21. — Р. 686-692.
41. Rozenblit A.M., Ricci Z.J., Tuvia J. et al. Incompetent and dilated ovarian veins: a common CT finding in asymptomatic parous women // AJR. — 2001. — Vol. 176. — Р. 119-122.
42. Sam J.W., Jacobs J.E., Birnbaum B.A. Spectrum of CT findings in acute pyogenic pelvic inflammatory disease // Radiographics. — 2002. — Vol. 22. — Р. 1327-1334.
43. Sherard G.B., Hodson C.A., Williams H.J. et al. Adnexal masses and pregnancy: a 12-year experience // Am. J. Obstet. Gynecol. — 2003. — Vol. 189. — Р. 358-362.
44. Tukeva T.A., Aronen H.J., Karjalainen P.T. et al. MR imaging in pelvic inflammatory disease: comparison with laparoscopy and US // Radiology. — 2003. — Vol. 210. — Р. 209-216.
45. Ushakov F.B., Elchalal U., Aceman P.J. et al. Cervical pregnancy: past and future // Obstet. Gynecol. Surv. — 1997. — Vol. 52. — Р. 45-59.
46. Wolverson M.K., Crepps L.F., Sundaram M. et al. Hyperdensity of recent hemorrhage at body computed tomography: incidence and morphologic variation // Radiology. — 1983. — Vol. 148. — Р. 779-784.
