Газета «Новости медицины и фармации» Кардиология (327) 2010 (тематический номер)
Вернуться к номеру
Особливості клінічного перебігу та лікування серцево-судинних змін у хворих на тиреотоксичний зоб: погляд хірурга-ендокринолога
Авторы: Б.Б. Гуда, Інститут ендокринології та обміну речовин ім. В.П. Комісаренка
Версия для печати
Никогда не следует забывать, что больной тиреотоксикозом — это прежде всего больной с заболеванием сердца, и забота о его сердце является основной задачей.
Н.А. Шерешевский
Дифузний токсичний зоб (ДТЗ) (базедова хвороба, хвороба Грейвса, хвороба Флаяні, тиреотоксикоз) — автоімунне та нейроендокринне захворювання, що зумовлене підвищеною секрецією тиреоїдних гормонів із ураженням усіх органів і систем організму.
У дітей, як і в дорослих, порушення діяльності серцево-судинної системи є обов''язковим симтомом тиреотоксикозу.
Зміни, що виникають в органах серцево-судинної системи, можуть проявлятися тахікардією, болем у ділянці серця, підвищенням систолічного й зниженням діастолічного тиску, збільшенням пульсового тиску, порушеннями серцевого ритму й розвитком серцевої недостатності.
У клініці Інституту ендокринології та обміну речовин ім. В.П. Комісаренка протягом 1991–2005 років проведено 1654 оперативних втручання у дорослих та 189 у дітей та підлітків із приводу тиреотоксичного зоба. У роботі розглянуто кардіологічну симптоматику та результати лікування 149 хворих: 61 дитина віком від 6 до 14 років (40,9 %) і 88 підлітків віком від 15 до18 років (59,1 %). До загальної групи з 149 дітей та підлітків, які були оперовані в клініці Інституту, входили 126 (84,5 %) дівчат та 23 (15,5 %) хлопчики. З метою порівняння характеру клінічного перебігу тиреотоксичного зоба в дітей і підлітків та дорослих проведено аналіз 115 історій осіб, які хворіли на ДТЗ у віці від 20 до 75 років, що були відібрані методом випадкової вибірки. Усі хворі були обстежені: загальний статус, пальпація щитоподібної залози, лабораторні методи (визначення гормонів у крові, загальний аналіз крові та сечі, біохімічний аналіз крові), інструментальні (УЗД щитоподібної залози до та після операції, ЕКГ, рентгенографія грудної клітки).
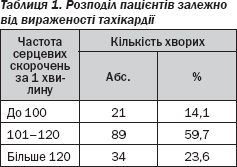
У дітей та підлітків, як і в дорослих, порушення діяльності серцево-судинної системи у випадку дифузного тиреотоксичного зоба є клінічним синдромом, що зустрічається найчастіше. Тахікардія — найбільш частий та ранній симптом захворювання. Вона спостерігалася у 144 (96,6 %) хворих. Тахікардія часто передувала іншим проявам тиреотоксичного зоба (збільшенню щитоподібної залози, екзофтальму).
Прискорене серцебиття в випадках тиреотоксикозу має деякі особливості. По-перше, воно зберігається й під час сну, а це є важливою диференційно-діагностичною ознакою, що дозволяє розрізнити тахікардію тиреотоксично го та нервово-психічного походження. По-друге, навіть незначні фізичні навантаження різко прискорюють ЧСС. Причо му відновлення вихідного ритму відбувається значно повільніше, ніж у здорових осіб. У більшості випадків ступінь тахікардії при тиреотоксикозі наростає паралельно тяжкості захворювання.
Безумовно, велике значення в таких випадках має не тільки знання вікових показників частоти серцевих скорочень за хвилину, але й відносне прискорення пульсу в даній ситуації, і навіть лабільність пульсу, а також більш різкі зміни пульсу при фізичному навантаженні (табл. 1).
Пульсова хвиля при тиреотоксикозі нагадує pulsus celer, тобто за характером близька до такої, як у випадку аортальної недостатності. Практично у всіх випадках (141 хворий; 93,9 %) вислуховувався неорганічний систолічний шум на верхівці серця. Тони серця були звучними.
Серцеві зміни у випадках тиреотоксичного зоба досить чітко виявляються під час електрокардіографічного дослідження. Патологічні відхилення електрокардіограми було розділено на кілька груп за найбільш типовими ознаками: ритм серця, гіпертрофічні зміни, порушення провідності (атріовентрикулярної, провідними шляхами пучка Гіса), ішемічні прояви, метаболічні порушення (незначного характеру, помірні, виражені) (табл. 2).
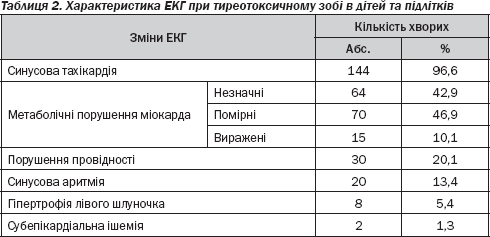
Як бачимо, у всіх дітей та підлітків виявлені метаболічні порушення міокарда різного ступеня вираженості. Проте в даній когорті значно превалюють незначні або помірні зміни (134 хворі; 89,9 %) над вираженими (15 пацієнтів; 10,1 %).
Дані ЕКГ-досліджень у випадку дифузного токсичного зоба в дітей та підлітків показують окрім синусової тахікардії наявність порушень атріовентрикулярної провідності, блокади пучка Гіса, що мали місце практично у кожного 5-го хворого. Синусові аритмії виявлялися у 20 дітей (13,4 %), приблизно у 5 % (8 пацієнтів) була виявлена гіпертрофія лівого шлуночка (табл. 2), явище недостатності кровообігу не спостерігалося.
Аналіз гемодинамічних порушень при тиреотоксичному зобі показує, що умов для виникнення вираженої гіпертрофії лівого шлуночка немає. Збільшення маси циркулюючої крові та хвилинного об''єму серця може викликати невелику гіпертрофію лівого шлуночка, але в основі її виникнення лежить розширення порожнини лівого шлуночка. Після оперативного лікування ознаки гіпертрофії за даними ЕКГ зникали. Таким чином, установлено, що збільшення лівого шлуночка викликано функціональним перевантаженням міокарда.
Порушення, що були виявлені на ЕКГ у дорослих, хворих на тиреотоксичний зоб, подані в табл. 3.
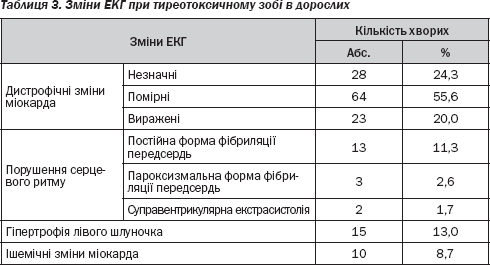
Отже, серед отриманих даних у 18 (15,7 %) хворих були виявлені аритмії, а саме фібриляція передсердь або те, що може їй передувати (транзиторна форма фібриляції передсердь чи часта суправентрикулярна екстрасистолія). Даного клінічного симптому в групі дітей та підлітків, хворих на ДТЗ, не було виявлено жодного разу. Тахікардія, особливо тахіаритмія у поєднанні з дистрофічними змінами міокарда та порушеннями гемодинаміки, що властиві тиреотоксикозу, можуть призвести до серцевої недостатності. Таких пацієнтів було 16 (13,9 %) віком від 38 до 74 років. У таких випадках до антитиреоїдної терапії були додані серцеві глікозиди.
При тяжких формах токсичного зоба порушується серцевий ритм та розвивається тахісистолічна форма фібриляції передсердь. Спочатку фібриляція передсердь може мати пароксизмальний характер, а потім переходить у стійку форму, формується симтомокомплекс «тиреотоксичне серце».
Особливості лікування
При лікуванні фібриляції передсердь найбільш ефективним із антиаритмічних препаратів є аміодарон. Ми його використовували практично у всіх хворих із фібриляцією передсердь і призначали за схемою: 200 мг 3 р/день — 7 днів, 200 мг 2р/день — 7 днів, а потім по 200 мг/день протягом 10–15 днів на тлі антикоагулянтної та антитромбоцитарної терапії. У результаті лікування спостерігалося відновлення ритму або перехід тахісистолічної форми в нормосистолічну. Після оперативного лікування тиреотоксичного зоба відновлювався синусовий ритм у термін від 3 діб до 3 міс. на тлі замісної терапії левотироксином, прийому аміодарону 200 мг/день та засобів, що покращують метаболізм у міокарді (триметазидин, панагін, полівітаміни та ін.)
Крім того, у дітей та підлітків ішемічні зміни були виявлені в 2 (1,3 %) випадках, тоді як у дорослих цей показник становив 10 випадків (8,7 %). Частіше в дорослих зустрічалася й гіпертрофія лівого шлуночка — 15 пацієнтів (13,0 %). У дітей і підлітків така ознака була виявлена у 5,4 % (8 хворих).
Висновки
1. Перебіг дифузного тиреотоксичного зоба в дітей та підлітків має певні відмінності порівняно з дорослими. Вони полягають у менш тяжких ураженнях серцево-судинної системи.
2. У випадках фібриляції передсердь, що виникла внаслідок тиреотоксикозу, препаратом вибору є аміодарон.
3. Наявність фібриляції передсердь, що спричинена тиреотоксичним зобом, є абсолютним показанням до хірургічного лікування патології щитоподібної залози.
