Газета «Новости медицины и фармации» Гастроэнтерология (337) 2010 (тематический номер)
Вернуться к номеру
Досвід застосування нової класифікації хронічного атрофічного гастриту
Авторы: Ю.О. ФІЛІППОВ, чл.-кор. АМН України, проф., директор інституту, Ю.А. ГАЙДАР, д.м.н., завідувач лабораторії патоморфології, М.С. ОПИХАЙЛО, м.н.с. лабораторії патоморфології, ДУ «Інститут гастроентерології АМН України», м. Дніпропетровськ
Версия для печати
«Хронічний гастрит» — виключно морфологічне поняття, що висвітлює процеси запалення, атрофії, порушення клітинного оновлення у вигляді метаплазій і дисплазій слизової оболонки шлунка (СОШ). «Запалення — атрофія — метаплазія (тонкокишкова, товстокишкова) — дисплазія — рак» — відомий патогенетичний ланцюг перебігу хронічного атрофічного гастриту, що обумовлює підвищений науковий інтерес до даної патології.
Вираженість запальної реакції при хронічному гастриті (ХГ) визначає ступінь активності процесу. При першому ступені визначається помірна лейкоцитарна інфільтрація власної пластинки СОШ, при другому — вона більш виражена і захоплює, крім власної пластинки, епітелій, як поверхневий, так і ямковий. При третій стадії, разом із вираженою інфільтрацією власної пластинки і епітелію, можуть спостерігатися «внутрішньоямкові» абсцеси, що, розкриваючись, утворюють мікроерозії з можливою трансформацією в ерозії [1]. Дрібні лімфоїдні інфільтрати без гермінативних центрів у базальній частині СОШ можуть зустрічатися в нормі, проте наявність гермінативних центрів завжди свідчить про патологію, і перш за все Helicobacter pylori-асоційований гастрит [2, 3]. Повна метаплазія (тонкокишкова) характеризується наявністю всіх клітин, властивих тонкій кишці, — каймистих, безкаймистих і бокалоподібних ентероцитів, а також клітин з апікальною зернистістю (Панета) і ендокринних. Саме наявність клітин Панета — найбільш важлива ознака повної кишкової метаплазії. При неповній метаплазії (товстокишкова метаплазія) бокалоподібні клітини, які розташовані серед високих призматичних клітин (колоноцити), що нагадують клітини Панета, не виявляються. Неповну метаплазію знаходять усього в 11 % хворих на доброякісні захворювання шлунка, у той самий час при раку шлунка вона спостерігається у 94 % хворих, що дає можливість зарахувати її до передракових змін [2, 4]. Дисплазія, як передрак, завершує розвиток кишкової метаплазії.
Розрізняють два ступені дисплазії:
1. Дисплазія низького ступеня характеризується подовженням ямок, збільшенням діаметра і гіперхроматозом ядер, збільшенням ядерно-цитоплазматичного відношення, переважанням диплоїдних клітин.
2. При дисплазії високого ступеня СОШ товщає, і фокуси дисплазії можуть підноситися над поверхнею СОШ. Спостерігається клітинна атипія з анізокаріозом, гіперхроматозом ядер. Середній уміст ДНК і кількість клітин у фазі синтезу ДНК різко підвищені. Значна клітинна анаплазія може ускладнювати диференціальну діагностику з карциномою.
Передові наукові відкриття визначають нове розуміння патогенезу захворювань, що також знаходить своє відображення в появі більш довершених і універсальних класифікацій.
Зважаючи на повноту і докладну характеристику проявів хронічного гастриту, для багатьох лікарів до цих пір залишається актуальною класифікація хронічних гастритів, запропонована С.М. Риссом (1966), в якій ураховуються такі ознаки: етіологічні (екзогенні й ендогенні гастрити), морфологічні (поверхневий гастрит, гастрит з ураженням залоз без атрофії епітелію, атрофічний, гіпертрофічний, антральний, ерозивний гастрити), функціональні (з нормальною, помірно і значно вираженою секреторною функцією), клінічні (компенсований гастрит (ремісія) і декомпенсований гастрит (загострення), спеціальні форми хронічних гастритів (ригідний, поліпозний, гігантський гіпертрофічний гастрити (хвороба Менетріє)), хронічний гастрит при інших захворюваннях. Поширеною також є класифікація хронічного гастриту, запропонована R.G. Strickland і I.R. Mackay (1973), що передбачає виділення двох форм захворювання: хронічного гастриту типу А, обумовленого імунними порушеннями і переважним ураженням фундального відділу з інтактним антральним, і хронічного гастриту типу В (неімунний), при якому первинно уражується антральний відділ з подальшою антракардіальною експансією. Пізніше G.У.J. Glass і S. Pitchumoni (1975) описали проміжну форму хронічного гастриту (тип АВ), що поєднує ураження слизової оболонки антрального і фундального відділів шлунка. Н. Steiniger і V. Becker (1987) доповнили дану класифікацію хронічним гастритом (тип С), що є поверхневим гастритом фундального відділу шлунка у хворих із грижами стравохідного отвору діафрагми. Також нерідко можна зустріти класифікації, розроблені Ц.Г. Масевичем (1967), Б.Г. Лісочкіним (1974), R. Whitehead (1982), W. Remmele (1984), що засновані на морфологічних змінах слизової оболонки шлунка, відображають такі явища, як кишкова і пілорична метаплазія і різні варіанти гіперплазії й атрофії слизової оболонки. У 1990 р. на Міжнародному конгресі гастроентерологів (Австралія) групою вчених із різних країн була запропонована Сіднейська класифікація хронічного гастриту (P. Sipponen, 1990), згідно з якою при формулюванні діагнозу хронічного гастриту враховувалися топографія ураження (антральний, фундальний гастрит, пангастрит), етіологія (ідіопатичний гастрит, гастрит, що асоціюється з Helicobacter pylori; автоімунний і медикаментозний гастрити), із зазначенням морфологічного варіанта (гострий гастрит, хронічний гастрит або особливі форми гастриту: гранулематозний гастрит (зокрема при хворобі Крона, туберкульозі, саркоїдозі), еозинофільний, лімфоцитарний і реактивний гастрити). З метою досягнення міжнародного консенсусу в гістологічних критеріях при встановленні діагнозу хронічного атрофічного гастриту був створений проект перегляду Сіднейської класифікації хронічних гастритів 1990 року. З мінімальними кадровими коливаннями були привернуті до роботи з жовтня 1997 року по травень 2000 року провідні світові патологи, що спеціалізувалися на атрофічних процесах у шлунку і метаплазіях. Протягом цього періоду групи зустрічалися тричі: у Х’юстоні (лютий, 1998), в Орландо (травень, 1999) і Новому Орлеані (травень, 2000). Після обговорення теоретичних питань був сформований набір із 46 зразків шлункових біопсій на склі (33 з антрума і 13 з тіла шлунка), приготованих забарвленням гематоксилін-еозином. Цей набір біопсій був незалежно класифікований кожним патологом групи — так було створено остаточні критерії нової класифікації хронічних атрофічних гастритів [5]. У 2005 році M. Rugge та R.V. Genta запропонували використовувати для класифікації гастриту оцінку ступеня і стадії гастриту. Під ступенем 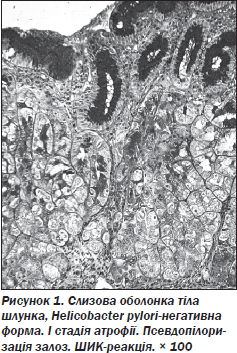 гастриту розуміли вираженість сумарної запальної інфільтрації (мононуклеарними клітинами і нейтрофільними лейкоцитами), під стадією — вираженість атрофії. Така система повинна була дати достатньо повну характеристику гастриту і відобразити його динаміку: від оборотного запалення, наприклад в антрумі, до вираженої атрофії, асоційованої з високим ризиком раку шлунка в його фундальному відділі. У 2005 році була розроблена система визначення стадій гастриту, що отримала назву OLGA (Operative Link for Gastritis Assessment) [6]. У цій системі враховується оцінка ступеня атрофії і запалення в антральному відділі і в тілі шлунка з подальшою детермінацією інтегральних показників — стадії і ступеня хронічного гастриту. Береться до уваги, що ризик раку тим вищий, чим більша атрофія і чим більший об’єм ураження. У цій роботі була запропонована нова візуально-аналогова шкала визначення стадії гастриту. Атрофію виражають у балах: відсутність атрофії — 0 балів, легка атрофія (за відсутності 30 % залоз) — 1 бал, помірна атрофія (відсутність 31–60 % залоз) — 2 бали, тяжка атрофія (понад 60 %) — 3 бали. У новій класифікації атрофію термінували не тільки як зменшення кількості залоз, а і як зменшення залоз, генетично детермінованих для даної зони слизової оболонки, тобто за наявності в біоптаті кишкової або пілоричної метаплазії патолог повинен діагностувати безумовну атрофію [10] (рис. 1–3).
гастриту розуміли вираженість сумарної запальної інфільтрації (мононуклеарними клітинами і нейтрофільними лейкоцитами), під стадією — вираженість атрофії. Така система повинна була дати достатньо повну характеристику гастриту і відобразити його динаміку: від оборотного запалення, наприклад в антрумі, до вираженої атрофії, асоційованої з високим ризиком раку шлунка в його фундальному відділі. У 2005 році була розроблена система визначення стадій гастриту, що отримала назву OLGA (Operative Link for Gastritis Assessment) [6]. У цій системі враховується оцінка ступеня атрофії і запалення в антральному відділі і в тілі шлунка з подальшою детермінацією інтегральних показників — стадії і ступеня хронічного гастриту. Береться до уваги, що ризик раку тим вищий, чим більша атрофія і чим більший об’єм ураження. У цій роботі була запропонована нова візуально-аналогова шкала визначення стадії гастриту. Атрофію виражають у балах: відсутність атрофії — 0 балів, легка атрофія (за відсутності 30 % залоз) — 1 бал, помірна атрофія (відсутність 31–60 % залоз) — 2 бали, тяжка атрофія (понад 60 %) — 3 бали. У новій класифікації атрофію термінували не тільки як зменшення кількості залоз, а і як зменшення залоз, генетично детермінованих для даної зони слизової оболонки, тобто за наявності в біоптаті кишкової або пілоричної метаплазії патолог повинен діагностувати безумовну атрофію [10] (рис. 1–3).
 На з’їзді Російського товариства патологоанатомів (Самара, 2009) була затверджена нова класифікація хронічного гастриту на основі поєднання принципу зручної візуально-аналогової шкали Модифікованої сіднейської системи і табличної оцінки ступеня та стадії хронічного гастриту [9].
На з’їзді Російського товариства патологоанатомів (Самара, 2009) була затверджена нова класифікація хронічного гастриту на основі поєднання принципу зручної візуально-аналогової шкали Модифікованої сіднейської системи і табличної оцінки ступеня та стадії хронічного гастриту [9].
Однією з переваг нової класифікації є облік топографії патологічного процесу, що істотно впливає на клінічні особливості ХГ, і головне, дозволяє передбачати його наслідки. Антральний гастрит супроводжується гіперсекрецією кислоти і значно підвищує ризик розвитку дуоденальної виразки, гастроезофагеальної рефлюксної хвороби і аденокарциноми стравоходу. При фундальному гастриті з атрофією низька секреція кислоти підвищує ризик виникнення виразки шлунка і дистального раку шлунка [7].
Переважним місцем локалізації Helicobacter pylori в шлунку є антральний відділ, у свою чергу, хронічний антральний гастрит клінічно має перебіг з гіперсекрецією кислоти і відповідним симптомокомплексом, для запобігання чому зазвичай призначають інгібітори протонної помпи. Проте, згідно з дослідженнями американських хелікобактеріологов, ігнорування наявності Helicobacter pylori при призначенні антисекреторної терапії призводить до поширення запалення з антрального відділу шлунка на слизову оболонку тіла шлунка [8]. Хронічний запальний процес у цьому відділі через 10–15 років призводить до розвитку атрофії головних залоз, що істотно підвищує ризик розвитку раку шлунка.
 У класифікації виділено три категорії змін СОШ.
У класифікації виділено три категорії змін СОШ.
Нова класифікація атрофічного гастриту (за M. Rugge та R.V. Genta) [11]:
1. Атрофія відсутня.
2. Невизначена (непідтверджена) атрофія.
3. Підтверджена (визначена) атрофія.
3.1. З метаплазією:
3.1.1. Легка.
3.1.2. Помірна.
3.1.3. Тяжка.
3.2. Без метаплазії:
3.2.1. Легка.
3.2.2. Помірна.
3.2.3. Тяжка.
За відсутності атрофії в антральному відділі розташовані пілоричні залози, а в слизовій оболонці тіла шлунка — головні залози з великою кількістю парієтальних і головних клітин. Серед клітин ямкового епітелію зустрічаються дрібні вогнища кишкової метаплазії у вигляді поодиноких бокалоподібних клітин — «часткова кишкова метаплазія». При невизначеній атрофії інтерпретація гістологічних змін буває складною: запальний інфільтрат, лімфоїдні фолікули або тканинна рідина розсовують нормальні залози, що може створювати помилкове враження зменшення кількості залоз, крім того, з одного боку, зміна форми ямок, що вистлані гіпер-хромним проліферуючим епітелієм з фігурами апоптозу, дозволяє припустити, що атрофія істинна, з іншого — відсутність метаплазії і розростання сполучної тканини примушують у цьому засумніватися, і якщо морфолог не бачить переконливих ознак атрофії, то він має право віднести такий випадок до категорії невизначеної атрофії. Атрофія шлункових залоз розподіляється на метапластичну і неметапластичну. Метапластичний тип атрофії характеризується втратою шлункових залоз, властивих даному відділу, із заміщенням їх кишковими, а у фундальному відділі шлунка — пілоричними залозами. При неметапластичному типі атрофії у слизовій оболонці зберігаються залози, характерні для відповідного відділу шлунка, але спостерігається зменшення об’єму залозистої тканини, залози стають рідкісними, неглибокими, спостерігаються фіброз і фібромускулярна проліферація власної пластинки СОШ. У даній класифікації збережена напівкількісна оцінка ступеня тяжкості атрофії: легка, помірна і тяжка. Практичне використання цієї класифікації показало дуже високий (78%) рівень узгодженості в інтерпретації гістологічної картини. При слабкій неметапластичній атрофії в антральному відділі зменшується кількість і глибина пілорічних залоз, розділених фіброзною тканиною, а при тяжкій — пілоричні залози практично повністю заміщені фіброзною тканиною. Помірна неметапластична атрофія слизової оболонки тіла шлунка супроводжується зменшенням кількості головних залоз, поглибленням шлункових ямок і розростанням сполучної тканини у власній пластинці СОШ. При тяжкій неметапластичній атрофії слизової оболонки тіла шлунка головні залози повністю відсутні. При тяжкій метапластичній атрофії в антральному відділі пілоричні залози, а в слизовій оболонці тіла шлунка — головні залози повністю заміщені залозами кишкового типу. Запропонована система є інструментом для оцінки ефективності лікування, зокрема для порівняння ступеня ХГ до і після курсу лікування, складання прогнозу перебігу захворювання; виділення стадій атрофії дозволяє формувати групи ризику розвитку раку шлунка, що безпосередньо впливає на об’єм і частоту діагностичних заходів.
Нами були проаналізовані дані 119 хворих віком від 18 до 72 років. За результатами гістологічного дослідження були сформовані такі групи хворих:
1) група порівняння (n = 21) сформована із хворих, у яких гістоструктура СОШ не змінена або присутній лише незначний запальний компонент;
2) група з атрофічними змінами СОШ (n = 56);
3) група з метапластичними змінами в епітелію СОШ (n = 31);
4) група з диспластичними змінами в епітелію СОШ (n = 11).
Результати виконаної роботи дозволили зробити такі висновки:
1. Атрофія СОШ у 41,7 % cупро-воджується інфікуванням мікроорганізмами Helicobacter pylori.
2. Розвиток атрофічного гастриту за відсутності інфікування мікроорганізмами Helicobacter pylori свідчить про важливу роль неінфекційних факторів у розвитку атрофії СОШ.
3. Темп розвитку атрофії і рівень запалення слизової оболонки шлунка при інфікуванні мікроорганізмами Helicobacter pylori вірогідно менші, ніж при дії неінфекційних факторів.
4. При інфікуванні мікроорганізмами Helicobacter pylori дисплазія СОШ розвивається при менш вираженій атрофії, ніж за відсутності інфікування (1,63 ± 0,3 проти 4,0 ± 0,1; р ≤ 0,05).
5. В умовах атрофії СОШ псевдопілоризація (рис. 1), як ознака безумовної атрофії, спостерігається практично у кожного 5-го хворого (26,5 %).
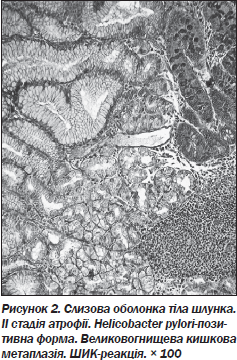
6. При атрофічному гастриті 29,0 % випадків псевдопілоризації супроводжуються кишковою метаплазією (рис. 2).
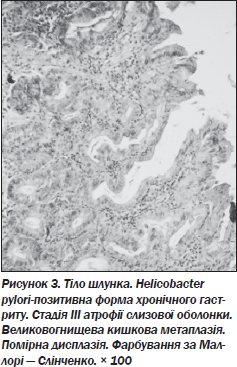
7. Дисплазія СОШ спостерігається практично у кожного 10-го хворого з атрофією (11,2 %) (рис. 3).
8. У 72,7 % випадків дисплазія слизової оболонки розвивається на фоні кишкової та псевдопілоричної метаплазії, при цьому кишкова метаплазія спостерігається у 100 % випадків.
1. Минушкин О.Н., Зверков И.В. Хронический гастрит // Лечащий врач. — 2003. — № 5. — С. 24-31.
2. Аруин Л.И., Капуллер Л.Л., Исаков В.А. Морфологическая диагностика болезней желудка и кишечника. — М.: Триада-Х, 1998. — 483 с.
3. Аруин Л.И. Новая международная классификация дисплазий слизистой оболочки желудка // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2002. — № 3. — С. 15-17.
4. Гончарик И.И. Клиническая гастроэнтерология (болезни пищевода, желудка, кишечника): Практ. пособие. — Минск: Уражай.
5. Rugge M., Correa P., Dixon M.F., Fiocca R., Hattori T., Lechago J., Leandro G., Price A.B., Sipponen P., Solcia E., Watana- be H. & Genta R.M. Gastric mucosal atrophy: interobserver consistency using new criteria for classification and grading // Aliment. Pharmacol. Ther. — 2002. — 16. — 1249-1259.
6. Rugge M., Meggio A., Pennelli G. et al. Gastritis staging in clinical practice: the OLGA staging system // Gut. — 2007. — 56. — 631-636.
7. Ahmed N., Sechi L.A. Helicobacter pylori and gastroduodenal pathology: new threats of the old friend // Ann. Clin. Microbiol. Antimicrob. — 2005. — 4. — 1.
8. Graham D.Y., Opekun A.R., Yamaoka Y. et al. Early events in proton pump inhibitor-associated exacerbation of corpus gastritis // Aliment. Pharmacol. Ther. — 2007. — 56. — 631-636.
9. Аруин Л.И., Кононов А.В., Мозговой С.И. Новая классификация хронического гастрита // Актуальные вопросы патологической анатомии: Мат-лы III съезда Российского общества патологоанатомов. — Самара, 2009.
10. Correa P. Chronic gastritis: a clinico-pathological classification // Am. J. Gastroenterol. — 1988. — 83. — 504-9.
11. Rugge M., Genta R.M. Staging and grading of chronic gastritis // Human. Patho-logy. — 2005. — 36. — 228-33.
