Газета «Новости медицины и фармации» Гастроэнтерология (337) 2010 (тематический номер)
Вернуться к номеру
Функциональное состояние печени и липидный обмен у больных с неалкогольным жировым гепатозом
Авторы: В.Б. Ягмур, к.м.н., старший научный сотрудник, С.Л. Меланич, к.м.н., старший научный сотрудник , С.С. Ягмур, к.м.н., старший научный сотрудник, Л.Я. Мельниченко, д.м.н., главный научный сотрудник, отделения заболеваний печени и поджелудочной железы, ГУ «Институт гастроэнтерологии АМНУ», г. Днепропетровск
Версия для печати
Неалкогольная жировая дистрофия — самая распространенная патология печени, которая выявляется почти у трети населения земного шара [1]. Ее развитие обусловлено накоплением в печеночной ткани липидов — преимущественно в виде три- глицеридов, масса которых превышает 5 % от общей массы печени. Жировой гепатоз является морфологическим проявлением многих печеночных проблем. При микроскопическом исследовании печеночной ткани более чем в 5 % гепатоцитов обнаруживают жировые вакуоли [2].
Механизмы, ответственные за накопление и удержание избыточного количества внутрипеченочного жира, еще не совсем ясны. Очевидно, причина состоит в дисбалансе между внутрипеченочной продукцией три-глицеридов, получаемых преимущественно из плазменных жирных кислот, поставляемых в печень, и удалением внутрипеченочных триглицеридов в составе липопротеидов очень низкой плотности [3]. Избыточный синтез триглицеридов печенью является наиболее частой реакцией на действие патологических факторов: гепатотоксинов, вирусов, аутоаллергенов и происходит при повышении активности триглицеридсинтетазы на фоне ослабления действия митохондриальных окислительных ферментов [4–6]. Помимо этого избыточное накопление жира в печени может приводить к увеличению синтеза ею жирных кислот — образуется порочный круг [7]. Нарушение выведения триглицеридов обусловлено несбалансированным питанием: дефицитом белка и избытком липидов; действием различных гепатотропных ядов, редкими генетическими аномалиями [2, 8–10]. Усиленное поглощение жира печенью является также следствием избыточного периферического липолиза на фоне сахарного диабета [11, 12], инсулинорезистентности и часто сопутствует ожирению и метаболическому синдрому [6, 13–16].
Опасность избыточного накопления жира в печени состоит в дальнейшем окислении уже накопившихся триглицеридов и вторичном повреждении продуктами перекисного окисления печеночных клеток. Широко распространена так называемая теория «двух ударов»: первый удар — развитие стеатоза, второй — оксидативные повреждения [17–19]. Этим объясняются случаи трансформации стеатоза (в 20–30 % случаев) в стеатогепатит, фиброз и цирроз печени [20–22].
Частота выявления стеатоза печени растет во всем мире, и если в слаборазвитых странах это обусловлено белковым голоданием, действием гепатотропных ядов, то в экономически развитых странах причиной патологии чаще всего является ожирение, увеличение случаев метаболического синдрома и диабета не только среди взрослых, но даже среди детей и подростков [23].
В Украине причиной жировой дистрофии печени (исключая вирусные гепатиты) чаще всего являются несбалансированное питание, метаболический синдром и употребление алкоголя. Особый интерес представляют случаи неалкогольного стеатоза при отсутствии метаболического синдрома и сахарного диабета.
Целью данного исследования было изучение изменения показателей функционального состояния печени и липидного обмена у больных со стеатозом печени на фоне хронического бескаменного холецистита.
Объект и методы исследования
В исследовании приняли участие 102 пациента с хроническим бескаменным холециститом, которые были распределены на группы в зависимости от наличия у них стеатоза печени: 32 пациента со стеатозом (І группа) и 70 больных (ІІ группа) — без стеатоза печени. Наличие жировой дистрофии печени определяли при ультрасоно-графическом исследовании, чувствительность и специфичность которого для выявления этой патологии (по данным P. Angulo) составляет соответственно 89 и 93 % [24]. Диагноз неалкогольного стеатоза жировой болезни печени помимо данных УЗИ базировался на отсутствии других причин развития патологии — лекарственно-индуцированного гепатита, инфицированности вирусами гепатитов В и С, аутоиммунного гепатита, болезни Вильсона, гемохроматоза, клинически значимого употребления алкоголя (более 20 г в сутки).
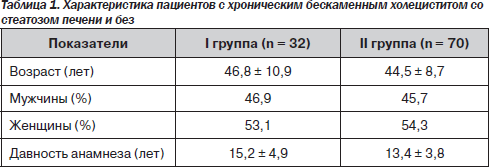
Пациенты разных групп были сопоставимы по возрасту, полу и давности анамнеза бескаменного холецистита (табл. 1).
Для характеристики функционального состояния печени и обмена липидов в сыворотке крови определяли: общий белок, билирубин и его фракции, активность аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы, концентрацию холестерола, триацил-глицеридов, липопротеидов низкой плотности (β-ЛП), патологического Х-липопротеида, желчных кислот [25, 26]. Факторы антиоксидантной защиты оценивали по активности церулоплазмина и содержанию меди [26]. Определяли также концентрацию глюкозы в сыворотке крови [26].
Наличие и степень ожирения у всех обследованных оценивали по индексу массы тела (ИМТ), который вычисляли как отношение массы тела к квадрату роста [27].
Статистическая обработка результатов исследований осуществлялась методами вариационной статистики, реализованными стандартным пакетом прикладных программ Statistica for Windows 6.0. Для описания показателей в случае нормального распределения данных использовали среднее и стандартное отклонение, при отсутствии нормального распределения — медиану и размах. Для сравнения средних значений в случае нормального распределения данных использовали t-критерий Стьюдента, в случае отсутствия нормального распределения — непараметрическую альтернативу t-критерия — критерий Манна — Уитни [28].
Результаты исследования
При оценке трофологического статуса (табл. 2) нарушение массы тела наблюдалось практически у всех больных І группы. Количество пациентов с ожирением преобладало над количеством больных с избыточной массой тела, при этом ожирение 1-й степени наблюдалось значительно (в 6,4 раза) чаще, чем 2-й степени.
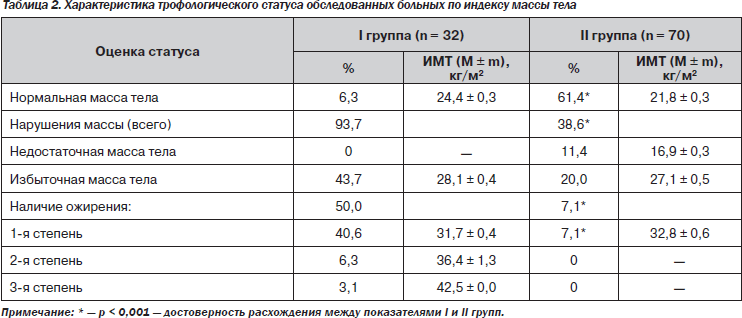
В І группе доля больных с нормальной массой тела была в 9,7 раза меньшей, чем во ІІ группе (p < 0,001). Во ІІ группе нарушения массы тела наблюдались в 2,4 раза реже, чем у пациентов І группы (p < 0,001), у каждого пятого больного — за счет избыточной массы тела. Ожирение 1-й степени установлено в единичных случаях.
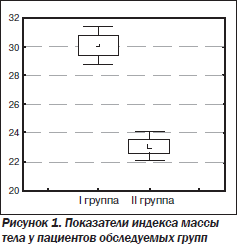
Достоверная разница в ИМТ и в уровне глюкозы между двумя группами согласуется с данными большой частоте неалкогольного стеатоза печени у пациентов с лишним весом. В этом случае в печень поступает избыточное количество жиров и углеводов. Они преобразуются в жирные кислоты, являющиеся субстратом для синтеза триглицеридов, которые и накапливаются в гепатоцитах [3]. Это согласуется с данными Liang Zhong, Jie Jun Chen, согласно которым существует слабая, но достоверная корреляция уровня ИМТ с содержанием жира в печени, измеренного при помощи протонной магнитно-резонансной спектроскопии [29]. Избыточный вес также является одной из причин развития инсулинорезистентности, и, следовательно, тенденцию к более высокому уровню глюкозы у больных со стеатозом можно объяснить большей частотой у них избыточной массы тела (рис. 1).
При изучении биохимических показателей крови (табл. 3) средние показатели содержания общего белка, активности АСТ существенно не отличались между группами. Повышение общего билирубина до 29,6 ±2,9 мкмоль/л выявлялось у 18,8 % больных І группы и до 34,1 ± 2,1 мкмоль/л у 10,0 % ІІ группы за счет непрямой фракции.
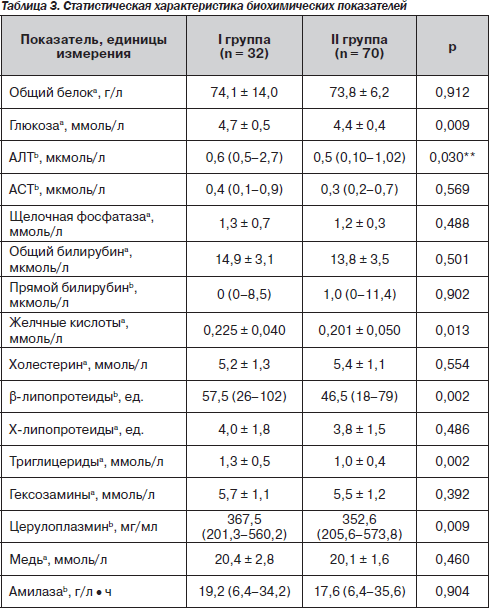
Активность АЛТ у пациентов І группы была выше, чем у больных ІІ (р < 0,05), за счет повышения этого показателя преимущественно в пределах минимальной активности до 1,23 ± 0,16 мкмоль/л у 37,6 % больных.
В нашем исследовании мы подтвердили связь стеатоза печени с повышением уровня печеночных ферментов (рис. 2), уже описанным в работах А. Ahmed, Р. Tarugi et al. [30, 31]. Причина этого — усиление процессов перекисного окисления липидов, происходящих в мембранах гепатоцита, содержащего жировые вакуоли. Как следствие развившегося цитолиза — повышение активности трансаминаз.
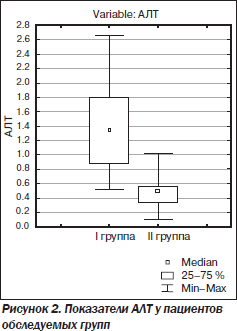
Среднее содержание щелочной фосфатазы в обеих группах не превышало нормальных значений. Несмотря на то что средние показатели концентрации глюкозы и желчных кислот в обеих группах не выходили за пределы нормы, они достоверно различались между собой (р < 0,01). У 51,2 % больных І группы отмечалось незначительное повышение содержания желчных кислот до 0,26 ± 0,03 ммоль/л, во ІІ группе такие же изменения наблюдались менее чем у трети пациентов (27,7 %).
При анализе показателей липидного обмена было установлено, что значения холестерина, триглицеридов в обеих группах не превышали норму. Уровень β-липопротеидов в І группе достоверно превышал (р < 0,01) таковой у пациентов ІІ группы за счет повышения его содержания до 68,0 ± 2,7 ед. у 58,1 % обследованных. Уровни триглицеридов и β-липопротеидов были достоверно выше (р = 0,002) у больных І группы. Вероятно, это происходит в связи с развитием так называемого порочного круга, когда жировая печень усиленно синтезирует триглицериды и липопротеиды очень низкой плотности. Из последних — благодаря повышению активности триглицеридсинтетазы и три-глицеридлипазы — синтезируются β-липопротеиды [7].
Изменения уровня Х-липопротеидов имели однонаправленную тенденцию у пациентов обеих групп. Повышение содержания Х-липопротеидов отмечалось у 55,2 % І группы и 52,3 % — ІІ группы, более выраженное у пациентов І группы, превышая нормальные показатели более чем в 2 раза (р < 0,05).
Повышенное содержание Х-липопротеидов сочеталось с повышенным уровнем желчных кислот у 46,9 % пациентов І группы и 18,6 % — ІІ группы, что свидетельствовало о более выраженных проявлених холестаза у больных І группы.
При изучении показателей антиоксидантной защиты повышение уровня церулоплазмина в 1,4 раза установлено у 77,8 % пациентов І группы и 47,7 % больных ІІ группы, что свидетельствовало о проявлении компенсаторной реакции со стороны антиоксидантной системы. Подобные изменения были установлены и при определении содержания меди в сыворотке крови. Содержание церулоплазмина у больных с жировой дистрофией печени достоверно отличалось от группы без стеатоза и также может быть обусловлено компенсаторным увеличением его содержания в качестве белка, участвующего в выведении избыточных продуктов перекисного окисления липидов.
Выводы
Стеатоз печени ассоциирован с более высоким содержанием три-глицеридов, липопротеидов низкой плотности (β-липопротеидов) и глюкозы у больных хроническим бескаменным холециститом в сравнении с пациентами без морфологических изменений в печени. По-видимому, это связано с негативным влиянием избыточного веса на статус инсулинорезистентости у пациентов со стеатозом и влиянием повышенной массы тела на продукцию протеинов, индуцирующих синтез жирных кислот печенью. Повышение уровня аланиновой трансаминазы в крови больных хроническим бескаменным холециститом со стеатозом печени связано с усилением процессов перекисного окисления липидов, что подтверждается увеличением у этой категории пациентов продукции церулоплазмина, который принимает участие в антиоксидантной защите.
1. De Alwis N.M., Day C.P. Non-alcoholic fatty liver disease: the mist gradually clears // J. Hepatol. — 2008. — № 48 (Suppl. 1). — S104-1012.
2. Didem Sen M.D., Selcuk Dagdelen M.D., Tomris Erbas. Hepatosteatosis with hypobetalipoproteinemia // Journal of the national medical. — 2007. — Vol. 99, №. 3.
3. Goldberg I.J., Ginsberg H.N. Ins and outs modulating hepatic triglyceride and development of nonalcoholic fatty liver disease // Gastroenterology. — 2006. — № 130. — Р. 1343-1346.
4. Chan D.C., Watts G.F., Gan S. et al. Nonalcoholic fatty liver disease as the transducer of hepatic oversecretion of very-low-density lipoprotein-apolipoprotein B-100 in obesity // Arterioscler Thromb Vasc. Biol. — 2010. — № 30(5). — P. 1043-1050.
5. Videla L.A., Rodrigo R., Araya J., Poniachik J. Oxidative stress and depletion of hepatic long-chain polyunsaturated fatty acids may contribute to non-alcoholic fatty liver disease // Free Radic. Biol. Med. — 2004. — № 37. — P. 1499-1507.
6. Araya J., Rodrigo R., Videla L.A. et al. Increase in long-chain polyunsaturated fatty acid n-6/n-3 ratio in relation to hepatic steatosis in patients with non-alcoholic fatty liver disease // Clin. Sci. (Lond). — 2004. — № 106. — P. 635-643.
7. Ann N.Y., Glimcher L.H., Lee A.H. From sugar to fat: How the transcription factor XBP1 regulates hepatic lipogenesis // Acad. Sci. — 2009, Sep. — № 1173 (Suppl. 1). — Р. E2-9.
8. Van Dijk K.W., Rensen P.C., Voshol P.J., Havekes L.M. The role and mode of action of apolipoproteins CIII and AV: synergistic actors in triglyceride metabolism? // Curr. Opin. Lipidol. — 2004. — № 15. — P. 239-246.
9. Olivieri O., Bassi A., Stranieri C. et al. Apolipoprotein C-III, metabolic syndrome, and risk of coronary artery disease // J. Lipid. Res. — 2003. — № 44. — P. 2374-2381.
10. Miller M., Rhyne J., Chen H. et al. APOC3 promoter polymorphisms C-482T and T-455C are associated with the metabolic syndrome // Arch. Med. Res. — 2007. — № 38. — P. 444-451.
11. Adiels M., Boren J., Caslake M.J. et al. Overproduction of VLDL1 driven by hyperglycemia is a dominant feature of diabetic dyslipidemia // Arterioscler Thromb Vasc Biol. — 2005. — № 25. — P. 1697-1703.
12. Petersen K.F., Dufour S., Befroy D. et al. Reversal of nonalcoholic hepatic steatosis, hepatic insulin resistance, and hyperglycemia by moderate weight reduction in patients with type 2 diabetes // Diabetes. — 2005. — № 54. — P. 603-608.
13. Charlton M., Sreekumar R., Rasmussen D. et al. Apolipoprotein synthesis in nonalcoholic steatohepatitis // Hepatology. — 2002. — № 35. — P. 898-904.
14. Diraison F., Moulin P., Beylot M. Contribution of hepatic de novo lipogenesis and reesterification of plasma non esterified fatty acids to plasma triglyceride synthesis during non-alcoholic fatty liver disease // Diabetes Metab. — 2003. — № 29. — P. 478-485.
15. Petersen K.F., Oral E.A., Dufour S. et al. Leptin reverses insulin resistance and hepatic steatosis in patients with severe lipodystrophy // J. Clin. Invest. — 2002. — № 109. — P. 1345-1350.
16. Sepp-Lindroos A., Vehkavaara S., Hаkkinen A.M. et al. Fat accumulation in the liver is associated with defects in insulin suppression of glucose production and serum free fatty acids independent of obesity in normal men // J. Clin. Endocrinol. Metab. — 2002. — № 87. — P. 3023-3028.
17. Hideky F., Yoshihiro I., Junko A. et al. Expression of perilipin and adipophilin in nonalcoholic fatty liver disease; Relevance to oxidative injury and hepatocyte ballooning // Journal of Atherosclirosis and Thrombosis. — 2009. — Vol. 16, № 6. — P. 893-901.
18. Day C.P., James O.F: Steatohepatitis: a tale of two “hits”? // Gastroentero-logy. — 1998. — № 114. — P. 842-845.
19. Lalor P.F., Faint J., Aarboden Y. et al. The role of cytokines and chemokines in the development of steatohepatitis // Semin. Liver. Dis. — 2007. — № 27. — P. 173-193.
20. Angulo P. Nonalcoholic fatty liver disease // N. Engl. J. Med. — 2002. — № 346. — P. 1221-1231.
21. Neuschwander-Tetry B.A., Caldwell S.H. Nonalcoholic steatohepatitis: summary of an AASLD Single Topic Conference // Hepatology. — 2003. — № 37. — P. 1202-1219.
22. Farrell G.C., Larter C.Z. Nonalcoholic fatty liver disease: from steatosis to cirrhosis // Hepatology. — 2006. — № 43. — P. S99-112.
23. Schwimmer J.B., Deutsch R., Rauch J.B. et al. Obesity, insulin resistance, and other clinicopathological correlates of pediatric nonalcoholic fatty liver disease // J. Pediatr. — 2003. — № 143. — P. 500-505.
24. Angulo P. Nonalcoholic Fatty Liver Disease // N. Engl. J. Med. — 2002. — № 346(16). — Р. 1221-1231.
25. Колб В.Г., Камышников В.С. Справочник по клинической химии. — Минск: Беларусь, 1982. — 366 с.
26. Камышников В.С. Справоч-ник по клинико-биохимической лабораторной диагностике: В 2 т. / В.С. Камышников. — Минск: Беларусь, 2000. — Т. 2. — 465 с.
27. Бессесен Д.Г., Кушнер Р. Избыточный вес и ожирение / Под общ. ред. Н.А. Мухина. — М.: Бином, 2004. — 239 с.
28. Петри А. Наглядная статистика в медицине / А. Петри, К. Сэбин. — М.: ГОЭТАР-мед, 2003. — 143 с.
29. Liang Zhong, Jie Jun Chen, Jie Chen et al. Nonalcoholic fatty liver disease: Quantitative assessment of liver fat content by computed tomography, magnetic resonance imaging and proton magnetic resonance spectroscopy // J. Dig. Dis. — 2009, Nov. — № 10(4). — P. 315-320.
30. Ahmed A., Keeffe E.B. Asymptomatic elevation of aminotransferase levels and fatty liver secondary to heterozygous hypobetalipoproteinemia // Am. J. Gastroenterol. — 1998. — № 93(12). — P. 2598-2599.
31. Tarugi P., Lonardo A., Ballarini G. et al. Fatty liver in heterozygous caused by a novel truncated form of apolipoprotein B // Gastroenterology. — 1996. — № 1111(4). — P. 1125-1133.
