Газета «Новости медицины и фармации» Гастроэнтерология (337) 2010 (тематический номер)
Вернуться к номеру
Вибір лікувальної тактики у хворих з ускладненими формами хронічного панкреатиту
Авторы: В.М. Ратчик, д.м.н., головний науковий співробітник відділення хірургії органів травлення, Б.Ф. Шевченко, професор, д.м.н., керівник відділення хірургії органів травлення, Н.Г. Гравіровська, к.м.н., керівник відділу інформаційних технологій та патентознавства, О.О. Крилова, к.м.н., учений секретар, ДУ «Інститут гастроентерології АМН України», м. Дніпропетровськ
Версия для печати
Протягом останніх років визначилась чітка тенденція до зростання кількості хворих на ускладнені форми ХП [1–4].
Поширеність ХП за останні 5 років збільшилась у 3 рази, при цьому частіше хворіють особи молодого і працездатного віку, що є причиною інвалідизації 15 % хворих, яка приводить до економічних витрат як на підприємствах, так і в країні в цілому [5]. Проблема хірургічного лікування фіброзних та фіброзно-дегенеративних змін, кальцинозу і кістозних уражень підшлункової залози (ПЗ) стала надто актуальною в сучасній панкреатології [6–8].
ХП — захворювання, що прогресує та супроводжується ускладненнями, які ведуть до підвищення смертності, соціальних і професійних проблем, та характеризується епізодами запалення та зниженням екзокринної й ендо-кринної функцій ПЗ [9, 10].
Незважаючи на можливості діагностичного обладнання та їх удосконалення, не досягнутий консенсус у номенклатурі захворювання, класифікації, уявленнях про патомеханізми больового синдрому, не визначені конкретні діагностичні критерії оцінки стану паренхіми й протокової системи ПЗ, позапечінкових жовчних шляхів, суміжних органів для розробки оптимальної тактики лікування [11].
Патогенез ХП — це каскадний процес, який характеризується прогресуючим ушкодженням тканини ПЗ, вираженими порушеннями екзо- і ендокринної функцій органу [12].
Серед етіологічних факторів ХП визначаються такі: 52 % — зловживання алкоголем, 28 % — ідіопатичний ХП, 13 % — біліарний ХП і 7 % — спадкові чинники [13].
У 7,5–60 % пацієнтів розвиваються асоційовані з даною патологією ускладнення — стійкий біль, стриктури протокової системи, фібротичні процеси, конкременти панкреатобіліарних протоків, що потребують хірургічного лікування [14, 15]. Діагноз найбільш вірогідно асоціюється з даними ультрасонографії, комп’ютер-ної томографії, ендоскопічної ретроградної панкреатохолангіографії (ЕРПХГ), що мають високу чутливість та специфічність [16].
Для інтерпретації панкреатограми розроблено Кембриджську класифікацію, згідно з якою виділяють 5 типів змін, характерних для хронічного панкреатиту [17]. Дана класифікація допомагає у виборі методу лікування (консервативне, ендоскопічне або хірургічне) у конкретного хворого.
Ендоскопічно при ускладненому панкреатиті дистальна стриктура вірсунгової протоки відмічається у 37 % хворих, проксимальна — у 36 %, псевдокісти — у 30 %, «ланцюг озер» — у 15 % пацієнтів, кальцифікати — у 19 % та стриктури жовчних проток — у 8 % хворих [18].
Крім відсутності єдності у поглядах на етіопатогенез, діагностику, питання класифікації, залишаються ще суперечливими аспекти тактики ведення хворих з ускладненнями ХП та об’ємів їх оперативного лікування. Близько 50 % пацієнтів, які страждають на ХП, потребують хірургічного лікування, показаннями для якого є стійкий біль, інтра- та екстра панкреатичні ускладнення та підозра на пухлину [19, 20].
Основною стратегією корекції порушень патології паренхіми й протокової системи ПЗ є декомпресивні втручання [21]. При цьому базовими принципами хірургії ПЗ вважається виконання резекційних і дренуючих операцій [3].
З урахуванням вищенаведеного метою нашого дослідження булао оптимізація тактики й методів хірургічного лікування хворих з ускладненими формами хронічного панкреатиту.
Матеріал і методи дослідження
Обстежено 71 хворого на ХП, які знаходилися на обстеженні та лікуванні у відділенні хірургії органів травлення Державної установи «Інститут гастроентерології АМН України» з 2007 по 2009 р.
Для вирішення поставлених завдань хворих було розподілено на дві групи. У І групу увійшли 42 (59,2 %) пацієнти з кістою ПЗ, серед яких 14 (33,3 %) жінок та 28 (66,7 %) чоловіків; у ІІ увійшло 29 (40,8 %) пацієнтів із тяжким перебігом хронічного панкреатиту, з яких 2 (6,9 %) — жінки та 27 (93,1 %) — чоловіки. В обстежених хворих клінічна картина характеризувалася больовим синдромом, диспептичними розладами травлення, тяжкість яких залежала від тривалості захворювання, механічною жовтяницею (МЖ) (постійна чи переміжна — у хворих із збільшенням голівки підшлункової залози за рахунок запалення чи кісти) і гіпертермією.
Пункційне лікування під ультразвуковим контролем (УЗ) проводили за допомогою голок Chiba (G18-22). ЕРПХГ виконували в рентгенопераційній за допомогою фібродуоденоскопа з боковою оптикою JF-1T30 Olympus (Японія) та рентген-установки Radius (Італія), використовували електрохірургічний блок PCD-2; папілотоми струнного типу KD-19-21Q (довжина струни 25–35 мм) та голчатого типу KD-10Q; кошик Дорміа FG-22Q; коагулятор CD-3L.
Результати дослідження
Значна травматичність відкритих оперативних втручань, високий ризик виникнення небезпечних для життя хворого інтра- і післяопераційних ускладнень спонукали нас до застосування малотравматичних і в той же час ефективних методів лікування.
Показаннями до оперативного втручання при ускладнених формах ХП були: порушення відтоку соку ПЗ із розвитком протокової та паренхіматозної панкреатичної гіпертензії, яка клінічно проявлялась вираженим больовим синдромом, рефрактерним до дії консервативних заходів, недостатністю зовнішньосекреторної функції ПЗ, кістами ПЗ, стійкими зовнішніми панкреатичними норицями, порушенням функції суміжних органів: дванадцятипалої кишки (ДПК), загальної жовчної протоки (ЗЖП), системи воротної вени.
Об’єм оперативного втручання залежав від наявності протокової й паренхіматозної гіпертензії, зв’язку кістозних утворень із протоковою системою ПЗ та визначався порушенням відтоку на рівні сфінктера Одді і порушенням відтоку панкреатичного вмісту по ходу панкреатичних протоків.
Хворим I групи диференційовано виставлялись показання до використання різних методів оперативного лікування залежно від ускладнень кіст, локалізації, розмірів, ступеня зрілості стінок кіст, зв’язку з головною панкреатичною протокою (ГПП).
Ступінь зрілості кісти, строки від моменту інтенсивної атаки панкреатиту впливали на вибір лікувальної тактики. Вважаємо, що несформована післянекротична кіста ПЗ — це показання до застосування пункційного методу лікування під контролем УЗД, що проводили за допомогою голок (G18-22) з аспірацією її вмісту 5 хворим (13,5 %).
У хірургічному лікуванні кіст ПЗ розрізняємо тактику непрямих втручань на органах навколопанкреатичної зони та прямих операцій із впливом на псевдокісту або при вільному широкому з’єднанні з протоковою системою дренуванням кіст, яке проводилось через магістральну протоку.
Прикладом непрямих втручань є виконання у 2 хворих (5,4 %) ендоскопічної папілосфінктеротомії (ЕПСТ), стентування ЗЖП із наступним черезшкірним дренуванням кісти голівки ПЗ, яка порушувала прохідність позапечінкових жовчних проток, що супроводжувалося МЖ (рис. 1).
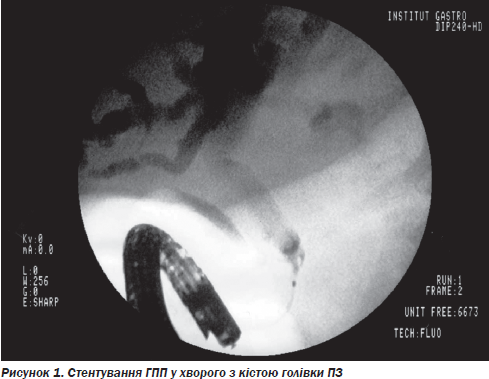
При псевдокістах ПЗ невеликих розмірів (2,5–4,0 см у діаметрі), протоковій формі ХП із порушенням відтоку панкреатичного соку на рівні сфінктера Одді з розширенням ГПП до 4 мм у 3 пацієнтів (8,1 %) здійснювалася ендоскопічна папілосфінктеротомія, яка в 2 випадках була доповнена вірсунготомією. Відновлення адекватного відтоку панкреатичного вмісту в ДПК сприяло купіруванню больового синдрому.
При псевдокістах, збільшення яких супроводжувалося деформацією шлункової або дуоденальної стінок, розглядали 2 ендоскопічних підходи: ендоскопічне трансмуральне та транспапілярне дренування.
Трансмуральне дренування застосовано 3 хворим (8,1 %). У 2 випадках дренування здійснювалося через ДПК, в одному — через шлунок, при цьому під контролем УЗ через ДПК або шлунок виконували пункцію кісти з максимальною аспірацією порожнини, за Сельдингером проводили катетер Фогарті з роздуванням гідробалону. Після 5–7-ї доби, коли виникало склеювання між шлунком та кістою, катетер видаляли під контролем гастроскопа і в отвір проводили різного діаметра гідробалони, за допомогою яких розширяли створене співустя до 20 мм.
Транспапілярне дренування, що дозволило ендоскопічним шляхом зробити співустя з порожниною кісти голівки ПЗ, виконано в 1 хворого (2,7 %).
Лікування кіст, що загоюються, починали з малоінвазивних методик із контролем за ступенем інфікованості за даними прокальцитоніну та результатами мікробіологічних посівів. У цих хворих під УЗ-наведенням виконувалося дренування кіст із промиванням озонованим фізіологічним розчином (ОФР), що здійснювалось через зовнішній дренаж методом лаважу ОФР із концентрацією озону 6–12 мг/л тричі на добу впродовж 6 днів з експозицією 15 хвилин. Уведення в порожнину кісти озонованого фізіологічного розчину приводило до суттєвого зниження титру мікробних тіл у вмісті кісти до 7-ї доби до 103 в 1 мл жовчі, а до 11–12-ї доби досягнута повна елімінація мікробних тіл умісту кісти.
Черезшкірні пункції кіст підшлункової залози були ефективним методом лікування даної патології у 36,8 % хворих. Застосування методу дало можливість у частині випадків досягати одужання.
На нашу думку, за наявності невеликої кістозної порожнини (до 6 см у діаметрі), що не зв’язана з протоковою системою ПЗ, найбільш доцільним методом лікування є пункція чи декілька пункцій з аспірацією складу кісти і склерозуванням порожнини кісти 70º етиловим спиртом.
При кістах розмірами понад 6 см операцією вибору було черезшкірне тривале дренування стилет-катетером чи дренажами типу pig tail, які вводили за Сельдингером крізь отвір голки під УЗ-контролем. Постійна аспірація вмісту в поєднанні зі склеротерапією приводила до більш швидкої облітерації порожнини кісти. При цьому контроль за ефективністю лікування здійснювався не тільки методом УЗ, але і за допомогою фістулографії, що виконувалась у динаміці. Об’єктивні докази зменшення розмірів кісти (у 38,5 % пацієнтів) і поліпшення стану хворого дозволяли нам виписати його зі стаціонару на амбулаторне лікування з дренажем. Зниження рівня амілази у вмісті кісти було доброю прогностичною ознакою і вказувало на ефективність пункційно-дренувальних операцій. Дренаж видалявся після контрольної фістулографії і при підтвердженні ознак облітерації кісти. Рецидив із наповненням кісти рідиною після аспірації або дренування з використанням міні-інвазивних технологій визначав показання для відкритого методу з виконанням цисто- або цистопанкреатодигестивного дренування.
При локалізації кісти в голівці ПЗ, дистальній прохідності вірсунгової протоки за даними цистопанкреатографії операцією вибору вважаємо цистодуоденостомію (рис. 2).
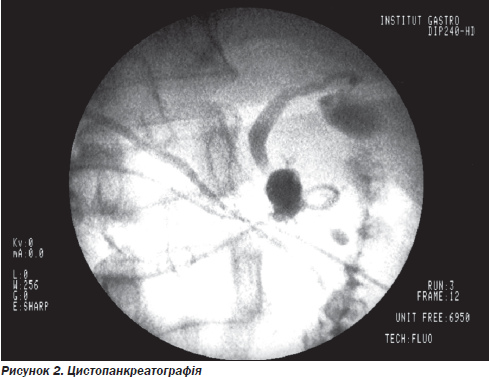
При псевдокістах і дилатації ГПП (понад 8 мм) показано декомпресивне цистопанкреатодигестивне втручання.
У 2,7 % хворих при локалізації кісти у хвості ПЗ, яка ускладнена кровотечею, операцією вибору вважаємо дистальну резекцію ПЗ разом із кістою.
При визначенні показань до операції у хворих II групи ми керувались загальновизнаним положенням, що головна мета хірургічного втручання полягає в усуванні патологічного процесу, клінічних проявів захворювання і створенні умов для максимального збереження функції ПЗ.
Показаннями були: постійний та інтермітуючий больовий синдром внаслідок обструкції на різних рівнях протокової системи ПЗ, розвиток ускладнень, що не можуть бути усунуті консервативними методами.
При виборі способу та об’єму операції оцінювали наслідки протокової та паренхіматозної гіпертензії, характер та локалізацію перешкоди відтоку панкреатичного вмісту при тяжкому перебігу ХП. За ступенем дилатації ГПП розрізняємо: 1-й ступінь дилатації — до 4,0 мм (3 хворі, 10,3 %); 2-й ступінь дилатації — від 4,0 до 8,0 мм у діаметрі (12 хворих, 41,4 %); 3-й ступінь дилатації — понад 8,0 мм у діаметрі (14 хворих, 48,3 %). Залежно від ступеня дилатації ГПП рекомендувалися види оперативних втручань. Дилатація ГПП 1-го ступеня — ЕПСТ, вірсунготомія, при дилатації 2-го ступеня при сегментарному стенозі голівки — панкреатодуоденостомія, при дилатації 3-го ступеня з діаметром ГПП > 0,8 мм — пакреатодигестивне дренування.
Якщо протягом місяця після ЕПСТ, вірсунготомії залишається больовий синдром, виставляються показання для дренуючої операції.
При фіброзному ХП із дилатацією протоки ПЗ 3-го ступеня показано виконання поздовжньої панкреатоєюностомії. При цьому протоку ПЗ належить розкривати широко з контролем прохідності її дистальних відділів; при наявності в ній конкрементів їх видаляли для відновлення протокової прохідності. Під час операції вважаємо обов’язковим видалення ділянок ПЗ з найбільш вираженою рубцевою деформацією панкреатичних проток, що ліквідує протокову гіпертензію та сприяє послабленню больового синдрому оперованих хворих. У зв’язку з цим сегментарна резекція підшлункової залози за Фреєм виконана 3 хворим (10,3 %). 2 хворим (6,9 %) з ізольованим кальцинозом хвостової частини ПЗ виконані резекційні способи операцій.
При сегментарному стенозі панкреатичної протоки в голівці на фоні холедохолітіазу і холангіту нами запроваджено спосіб спільного дренування панкреатичної і ЗЖП (Пат. № 36952 Україна А61 В 17/00), у якому після верхньосерединної лапаротомії виконують холецистектомію і крізь міхурову протоку (1) катетером Фогарті роблять ревізію позапечінкових жовчних проток, після чого катетер (провідник) проводиться через ВДС у ДПК (рис. 3). Формують задню стінку панкреатодуоденоанастомозу і в панкреатичну протоку (2) вводять дренаж (3) з двома боковими отворами на глибину 2,5 см. Дренаж є поліхлорвініловою трубкою довжиною 500,0 мм діаметром 3,0 мм з боковими отворами в проксимальному кінці для установки в панкреатичній протоці і в середині — для установки в ЗЖП. В отвір ДПК (4) виводять катетер Фогарті, до якого лігатурою фіксують дренаж. Після чого зворотною тракцією катетера Фогарті дренаж проводиться через ВДС в ЗЖП і через куксу міхурової протоки, де він фіксується вікриловою лігатурою (5). Формується передня стінка панкреатоєюноанастомозу (6).
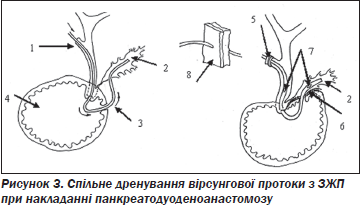
При установці дренажу необхідно, щоб отвори (7) в трубці не виходили за контур жовчної протоки. Дренаж виводиться через контрапертуру на передню черевну стінку (8). Через 14–15 діб дренаж видаляють.
Таким чином, залежно від тяжкості патологічного процесу, розмірів кістозних утворень, морфологічних даних, протокової гіпертензії, порушення функції суміжних органів виконували крізьшкіряне пункційне і катетерне дренування, ендоскопічні (трансмуральні та транспапілярні) операції, відкриті лапаротомні втручання. Трансмуральне та транспапілярне дренування застосовано 10,8 % хворим. Стентування ЗЖП при порушенні прохідності позапечінкових жовчних проток унаслідок кісти голівки ПЗ, що супроводжувалося МЖ, здійснено 5,4 % хворих. Черезшкірні пункції кіст ПЗ були ефективним методом лікування даної патології у 36,8 % хворих. Означена програма лікування дозволила значно поліпшити безпосередні й віддалені результати лікування ускладнених форм хронічного панкреатиту.
1. Русин В.І., Боліджар О.О. Вибір методу хірургічного лікування псевдокіст підшлункової залози залежно від структури її протокової системи // Клінічна хірургія. — 2007. — № 5–6. — С. 77-78.
2. Копчак В.М., Усенко А.Ю., Тодуров И.М., Хомяк И.В., Дувалко А.В., Копчак К.В. Современные тактические подходы в хирургическом лечении осложненных форм хронического панкреатита // Клінічна хірургія. — 2007. — № 2–3. — С. 96-97.
3. Э.И. Гальперин, Т.Г. Дюжева, Г.Г. Ахаладзе, Р.М. Нурутдинов. Хронический панкреатит, резекционные и дренирующие вмешательства // Хирургия. — 2006. — № 8. — С. 4
4. Aghdassi A., Mayerle J., Kraft M., Sielenkamer A.W., Heidecke C.D., Lerch M.M. Diagnosis and treatment of pancreatic pseudocysts in chronic pancreatitis // Pancreas. — 2008. — Vol. 36, № 2. — P. 105-12.
5. Makoto O. Symposium 3. Chronic pancreatitis: current problems of the diagnostic criteria // J. Gastroentero- logy. — 2007. — Vol. 42. — р. 52-54.
6. Ничитайло М.Ю., Кондратюк О.П., Огородник П.В. та ін. Пункційні, лапароскопічні та традиційні методи лікування псевдокіст підшлункової залози як ускладнення гострого панкреатиту // Шпитальна хірургія. — 2006. — № 4. — С. 17-19.
7. Costamagna G., Bulajic M., Tringali A., Pandolfi M., Gabbrielli A., Spada C., Petruzziello L., Familiari P., Mutignani M. Multiple stenting of refractory pancreatic duct strictures in severe chronic pancreatitis: long-term results // Endo- scopy. — 2006. — Vol. 38, № 3. — P. 254-9.
8. Schnelldorfer T., Lewin D.N., Adams D.B. Reoperative surgery for chronic pancreatitis: is it safe? // Journal World Surg. — 2006. — Vol. 30, № 7. — P. 1321-8.
9. Knoefel W.T., Hosch S.B., Peiper M. Chronic pancreatitis from losing heart to acting smart! // Eur. Journal Med. Res. — 2004. — Vol. 9, № 12. — P. 563-4.
10. Mayerle J., Stier A., Lerch M.M., Heidecke C.D. Chronic pancreatitis. Diagnosis and treatment // Chirurg. — 2004. — № 75(7). — P. 731-47
11. Schnelldorfer T., Lewin D.N., Adams D.B. Do preoperative pancreatic stents increase operative morbidity for chronic pancreatitis? // Hepatogastroenterology. — 2005. — Vol. 52, № 66. — P. 1878-82.
12. Witt H., Apte M.V., Keim V., Wilson J.S. Chronic pancreatitis: challenges and advances in pathogenesis, genetics, diagnosis, and therapy // Gastroentero- logy. — 2007. — Vol. 132, № 4. — P. 1557-73.
13. Kalady M.F., Broome A.H., Meyers W.C., Pappas T.N. Immediate and long-term outcomes after lateral pancreaticojejunostomy for chronic pancreatitis // Am. Surg. — 2001. — Vol. 67, № 5. — P. 478-83.
14. Mayerle J., Stier A., Lerch M.M., Heidecke C.D. Chronic pancreatitis. Diagnosis and treatment // Chirurg. — 2004. — Vol. 75, № 7. — P. 731-47
15. Caperan C., Heyries L., Barthet M., Sahel J. Evolution of lesions of the pancreatic duct following acute pancreatitis associated with a pseudocyst // Gastroenterol Clin. Biol. — 2006. — Vol. 30, № 8–9. — р. 949-53.
16. Aghdassi A., Mayerle J., Kraft M., Sielenkаmper A.W., Heidecke C.D., Lerch M.M. Diagnosis and treatment of pancreatic pseudocysts in chronic pancreatitis // Pancreas. — 2008. — Vol. 36, № 2. — P. 105-12.
17. Kinoshita H., Hara M., Hashimoto M. et al. Surgical treatment for chronic pancreatitis: results of pancreatic duct drainage operation and pancreatic resection // Kurume Med. J. — 2002. — Vol. 49, № 1–2. — P. 41-6.
18. Lucas C.E., McIntosh B., Paley D., Ledgerwood A.M., Vlahos A. Surgical decompression of ductal obstruction in patients with chronic pancreatitis // Surgery. — 1999. — Vol. 126, № 4. — P. 790-5.
19. Witzigmann H., Geissler F., Uhlmann D. et al. Surgery for complications of chronic pancreatitis // Zentralbl Chir. — 2001. — Vol. 126, № 11. — P. 889-96.
20. Koninger J., Friess H., Muller M., Buchler M.W. Duodenum preserving pancreatic head resection in the treatment of chronic pancreatitis // Rocz. Akad. Med. Bialymst. — 2004. — № 49. — P. 53-60.
21. Cahen D.L., Gouma D.J., Nio Y. et al. Endoscopic versus surgical drainage of the pancreatic duct in chronic pancreatitis // N. Engl. J. Med. — 2007. — Vol. 356, № 7. — P. 676-84.
