Газета «Новости медицины и фармации» 17(340) 2010
Вернуться к номеру
Остеоартроз как фактор риска кардиоваскулярных катастроф
Авторы: О.И. Мендель, А.В. Наумов, А.Л. Верткин, М.М. Шамуилова, Московский государственный медико-стоматологический университет, Л.И. Алексеева, НИИ ревматологии РАМН, г. Москва
Версия для печати
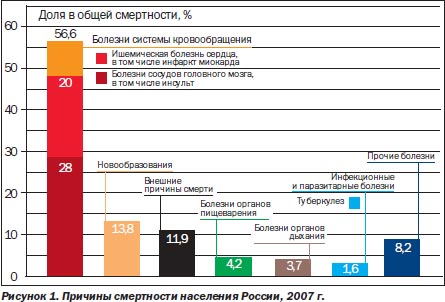
В структуре смертности населения РФ ведущее место занимают болезни системы органов кровообращения — 57 % (рис. 1).
Сердечно-сосудистые заболевания (ССЗ), в основе которых лежит атеросклероз, справедливо называют эпидемией ХХ–ХХI вв. Ежегодно от ССЗ в России погибают более 1 200 000 человек, в том числе и лица трудоспособного возраста. Болезни сердечно-сосудистой системы составляют более 50 % всех случаев инвалидизации. В то же время одной из лидирующих причин функциональной недостаточности и потери трудоспособности у взрослых является остеоартроз (ОА) — самое известное и часто встречающееся в мире заболевание суставов с возраст-ассоциированной распространенностью. Например, в США более чем у половины людей в возрасте старше 65 лет и практически у каждого старше 75 лет диагностируется ОА. Ряд исследователей считает, что к 2020 г. ОА будет страдать 71 % населения в возрасте старше 65 лет (S.A. Oliveria et al., 1995). В РФ также возрастает заболеваемость ОА. Об этом свидетельствуют данные статистики обращаемости в лечебно-профилактические учреждения (ЛПУ) по поводу клинических проявлений ОА. Так, в 1999 г. в ЛПУ обратились 1 400 000 больных ОА, а в 2007 г. — вдвое больше, 3 131 000 человек (В.А. Насонова, 2009). В медицинских публикациях последних лет все чаще появляются данные о том, что люди, страдающие ОА, имеют более высокий риск развития ССЗ и более высокий уровень общей смертности по сравнению с популяцией.
Повышенная специфическая смертность при ОА главным образом регистрировалась в исследованиях, включающих кардиоваскулярные и желудочно-кишечные заболевания. Первое исследование по изучению причин смертности у пациентов с ОА в США опубликовано Monson и Hall в 1976 г. В нем были проанализированы уровень и причины смерти у 617 пациентов с ОА в сравнении с белой популяцией аналогичного возраста и пола. Авторами установлено, что смертность пациентов с ОА в 40 % случаев была обусловлена атеросклерозом сосудов сердца (стандартизированный уровень смертности составил 156) и заболеваниями желудочно-кишечного тракта (ЖКТ) (6 % случаев смертности). При этом стандартизированный уровень смертности от заболеваний ЖКТ у пациентов с ОА был в два раза выше, чем в популяции, и составил 239. Lawrence et al., 1990 г., изучив смертность среди 2384 лиц в возрасте от 55 до 74 лет с рентгенологическими признаками ОА коленных суставов в сопоставлении с аналогичной группой лиц без рентгенологических изменений, установили, что уровень смертности у них был выше — 38,9 % у мужчин и 30 % у женщин, чем у лиц без рентгенологических признаков ОА — 31,6 и 17,7 % соответственно. Haara et al., 2003 г., определили, что ОА суставов кистей ассоциирован с повышенной смертностью от ССЗ у мужчин. Дальнейшие исследования в этой области позволили определить факторы риска смертности у пациентов с ОА: тяжесть заболевания, пожилой возраст и наличие коморбидных заболеваний (M.C. Hochberg, 2008). Более высокий уровень смертности у людей с ОА объясняют уменьшением физической активности пациентов на фоне поражения суставов нижних конечностей и наличием коморбидных заболеваний, в том числе обусловленных отрицательным действием лекарственных препаратов, направленных на симптоматическое лечение ОА. Под коморбидностью (полиморбидностью, мультиморбидностью) принято подразумевать наличие двух и/или более синдромов или заболеваний у одного и того же пациента, патогенетически взаимосвязанных между собой или совпадающих по времени. Установлено, что ОА относится к болезням с высокой коморбидностью (Schellevis et al., 1993; U.T. Kadam et al., 2004; R. Caporali et al., 2005). Как правило, у больного с ОА в возрасте старше 50 лет одновременно сосуществует более 5 болезней, и практически не встречаются лица с первичным ОА, не имеющие сопутствующих соматических заболеваний (Kadam et al., 2004). Коморбидность — достаточно частое состояние в общей популяции (30 %), однако изучение этой проблемы показало, что ревматические болезни в структуре коморбидности — не простое дополнение к другим заболеваниям. E. Loza et al., 2009 г., проведя анализ данных 2192 рандомизированно выбранных пациентов (всего изучено 972 545 человек населения Испании) с использованием краткой формы обзора здоровья (SF-12) и опросника качества жизни (HRQoL), установили, что у пациентов с коморбидностью, включающей ревматические болезни, отмечаются худшие показатели качества жизни и дневной функции, чем у пациентов без ревматических заболеваний. По имеющимся данным, ОА наиболее часто сочетается с артериальной гипертензией (АГ) и другими ССЗ (атеросклерозом, ИБС), ожирением, сахарным диабетом (CД), хроническими обструктивными заболеваниями легких, заболеваниями ЖКТ. ССЗ наблюдаются у более чем 50 % пациентов с ОА. Анализ публикаций в Medline с 1966 по 2004 г. показал, что сочетание ОА с АГ встречается у 48–65 % пациентов с ОА в популяции и у более 65 % пациентов с ОА в возрасте старше 80 лет, нуждающихся в артропластике коленных суставов (Loy и соавт., 2005).
Общие факторы риска ОА и ССЗ
Общие факторы риска для первичного ОА и ССЗ: возраст, избыточный вес, наследственность, метаболические нарушения (повышенный уровень холестерина, толерантность к глюкозе, сахарный диабет). Возраст — основное условие для развития первичного ОА и ССЗ, которые рассматриваются как возраст-ассоциированные заболевания. С возрастом в различных тканях человека происходит накопление гликолизированных продуктов коллагена, играющих немалую роль в патогенезе как атеросклероза, так и ОА (G.J. Gibson et al., D.M. Saudek et al., 2003). Внеклеточное накопление AGE-продуктов изменяет структуру и функциональные свойства как матрикса, так и матрикс-клеточных взаимодействий. Артериальные сосуды в первую очередь подвергаются воздействию AGE-продуктов, которые ковалентно взаимодействуют с коллагеном I типа, а он, в свою очередь, взаимодействует с растворимыми белками плазмы (липопротеинами низкой плотности — ЛПНП, иммуноглобулином G и др.). Образование AGE-продуктов на белках базальной мембраны сосудистой стенки (коллаген IV типа, ламинин, гепарансульфат протеогликан и др.) приводит к утолщению базальной мембраны, сужению просвета капилляров и нарушению их функции (снижение адгезии эндотелиальных клеток, снижение пролиферации ретинальных перицитов, повышение пролиферации ретинальных эндотелиальных клеток и др.). Эти нарушения внеклеточного матрикса изменяют структуру и функцию сосудов: снижение эластичности сосудистой стенки, изменение ответа на сосудорасширяющее действие NO и др. и способствуют ускоренному развитию атеросклеротического процесса. AGE-продукты также специфически накапливаются в хрящевой ткани человека. Они атакуют долгоживущие белки, преимущественно коллаген, связываются с ними и повреждают их, нарушая функциональные свойства. Более того, они являются триггерами воспаления — могут активировать клетки, стимулируя образование провоспалительных цитокинов и активных форм кислорода. AGE-продукты оказывают отрицательное воздействие на метаболизм хряща и его механические свойства, ставя под угрозу целостность матрикса. Предполагают, что AGE-продукты влияют на метаболическую активность хондроцитов и что сигнальные молекулы RAGE (рецепторы гликозилированных продуктов) хондроцита могут играть роль в патогенезе ОА. В норме суставные хондроциты экспрессируют функциональные RAGE. AGE-продукты вызывают быстрое увеличение RAGE на хондроцитах (экспериментально установлено, что в остеоартритическом хряще уровень RAGE намного выше, чем в контроле), которые усиливают свою метаболическую деятельность, приводя к деградации хряща. Лиганды RAGE стимулируют продукцию хондроцитами медиаторов воспаления и MMP-13. Ожирение — первичный фактор риска как для ОА, так и для ССЗ. К заболеваниям, ассоциированным с ожирением, относят сахарный диабет 2-го типа, дислипидемии, АГ, коронарную болезнь сердца, сердечную недостаточность, цереброваскулярные заболевания (повышенный риск инсультов), остеоартроз, респираторные заболевания (синдром апноэ во сне, астма), холелитиаз и неалкогольный цирроз печени (Malnick et Knobler, 2006). Установлено, что у людей с индексом массы тела (ИМТ) свыше 30 кг/м2 риск развития ОА коленных суставов в 4 раза выше, чем у лиц с ИМТ 25 кг/м2. Ожирение при варусном положении коленного сустава способствует перенесению оси тяжести тела и выраженному поражению медиальных тибиофеморальных сочленений (Sharma et al., 2000). Исследование Hart et al., 1992 г., включившее 1000 женщин, выявило, что относительный риск развития одностороннего и двустороннего ОА коленных суставов, по данным рентгенологического исследования, составлял 6,2 для ИМТ < < 23,4 кг/м2 и 18 для ИМТ > 26,4 кг/м2. Когда ИМТ < 23,4 кг/м2 сравнили с ИМТ 23,4–26,4 кг/м2, относительный риск ОА был выше в 2,9 раза для коленного сустава, в 1,7 раза для карпометакарпальных суставов и в 1,2 раза для проксимальных межфаланговых суставов. Двойное контролируемое исследование показало, что увеличение массы тела на каждый килограмм увеличивает риск рентгенологических признаков ОА коленных и карпометакарпальных суставов (F.M. Cicuttini et al., 1996). Установлено, что не только повышенный вес ассоциирован с увеличением риска развития ОА, но и снижение веса ассоциировано со снижением риска ОА. В исследовании, включившем 800 женщин, было продемонстрировано, что уменьшение ИМТ на 2 кг/м2 на протяжении 10 лет снизило риск развития ОА более чем на 50 % (D.T. Felson et al., 1992). Систематический обзор литературы, посвященной изучению лиц с ожирением и диагностированным ОА коленных суставов, установил, что нетрудоспособность, обусловленная ОА, может быть значительно снижена с уменьшением массы тела на 5,1 % (R. Christensen et al., 2007). Какова же взаимосвязь между ОА и ожирением? Современные научные данные позволяют оценивать роль ожирения как фактора риска ОА и других хронических состояний гораздо шире, чем просто увеличение ИМТ. Несомненно, сама по себе повышенная масса жировой ткани увеличивает нагрузку на скелет и приводит к повреждению костно-мышечной ткани. Эффект увеличенной нагрузки на суставной хрящ у людей с повышенным весом может объяснить возрастание риска ОА коленных суставов. Однако тот факт, что ОА часто развивается в суставах, не имеющих отношения к повышенному весу, позволяет предположить, что имеются какие-то другие механизмы, связанные с ожирением, способные изменить метаболизм хрящевой и костной ткани и привести к развитию заболевания. В последнее время показано, что жировая ткань не является пассивным накопителем энергии, и значимость жировой ткани как эндокринного органа не вызывает сегодня сомнений. Новые данные позволили выдвинуть гипотезу, что ОА — системное заболевание, при котором дисрегуляция липидного гомеостаза может быть одним из лидирующих патофизиологических механизмов, приводящих к развитию ОА (R. Aspden, 2001).
Роль воспаления в патогенезе ОА и ССЗ
По мнению ряда исследователей, связь ОА с ССЗ может быть обусловлена как общими патогенетическими механизмами, так и другими внешними факторами. В патогенезе атеросклероза и ОА немалую роль играет неспецифическое воспаление. Атеросклероз относят к воспалительным заболеваниям, при которых воспаление связано с дислипидемией и хронической иммунной дисрегуляцией. Предполагаемыми факторами риска и маркерами атеросклероза являются С-реактивный протеин (СРП), фибриноген, тканевой активатор плазминогена, фосфолипаза А2, цитокины (интерлейкины, α-фактор некроза опухоли) и внутриклеточные сигнальные полипептиды (I.J. Kullo et al., 2000; P.M. Ridker et al., 2001). Цитокины и сигнальные полипептиды, которые могут образовываться в сердце, сосудистых клетках, макрофагах и жировой ткани, стимулируют продукцию острофазных белков в печени как при острых, так и при хронических воспалительных процессах (C. Gabay, I. Kushner, 1999). Установлено, что одним из основных элементов атеротромбоза является увеличение синтеза провоспалительных цитокинов. Так, у больных ИБС по сравнению со здоровыми лицами обнаружено существенное повышение уровней таких интерлейкинов, как IL-2, IL-4, IL-6, IL-12 и IL-18, причем уровень IL-6 был выше у пациентов с инфарктом миокарда (ИМ) (T.B. Martins et al., 2006). Повышенные уровни матриксной металлопротеазы-9 (MMP-9) вносят значимый вклад в разрыв фиброзной капсулы атеросклеротической бляшки, а повышенные уровни ингибитора-1 активатора плазминогена (PAI-1) играют большую роль в процессах тромбообразования. Как установлено, ММР оказывают влияние на ремоделирование сосудов и снижение эластичности артерий с возрастом (A. Page-McCaw et al., 2007). ММР-3 ассоциирована с опасными гладкими, липидосодержащими структурами артериосклеротических бляшек. Генотип MMР-3 может быть важной детерминантой ремоделирования сосудов и ригидности артериальных сосудов, связанной с возрастом. Исследование, проведенное Berg et al., 2009 г., показало, что у пациентов с ИБС уровни ММР-2 и ММР-9 оказались достоверно выше по сравнению с пациентами, не страдающими ИБС. Кроме того, активность ММР-2 достоверно ассоциировалась с уровнями С-реактивного белка, а также с уровнями атерогенного аполипопротеина В. В патогенезе ОА также немалую роль играет неспецифическое воспаление (J.P. Pelletier et al., 2001). При ОА отсутствуют классические макроскопические признаки воспаления, нет выраженной инфильтрации воспалительными клетками тканей сустава, однако провоспалительные цитокины, такие как IL, в частности IL-1β, а также фактор некроза опухоли α (ФНО-α) выявляются в синовиальной жидкости больных ОА в повышенных количествах. Под воздействием IL-1 хондроциты резко усиливают синтез ММР, прекращают синтез протеогликанов и коллагенов хряща. В ответ на стимуляцию IL-1β хондроциты синтезируют ферменты, необходимые для образования оксида азота (NO) (индуцибельную синтазу NO — ИСОА) и простагландинов (ЦОГ-2). Сложная сеть взаимодействий цитокинов, ферментов, свободных радикалов и продуктов распада матрикса приводит к уменьшению содержания протеогликанов в хряще, нарушению архитектоники матрикса, появлению микротрещин и надрывам хряща. Обнаружено значимое увеличение уровня MMР-3 как в синовиальной жидкости, так и в крови пациентов с ОА коленных и тазобедренных суставов. Установлено, что ММР-3 продуцируется хондроцитами и клетками синовиальной мембраны (J.P. Pelletier et al., 2001). Содержание MMP-3 коррелирует с активностью болезни или тяжестью ОА: уровень сывороточных MMР-3 и MMР-9 значительно повышен у пациентов с деструктивным ОА бедра по сравнению с пациентами с менее тяжелым ОА бедра. Таким образом, уровень MMP может служить диагностическим маркером быстропрогрессирующего ОА (P. Garnero, 2007). Нельзя не учитывать роль хронического болевого синдрома в патогенезе кардиоваскулярных осложнений при ОА. Хронический болевой синдром, вызывая нейроэндокринный ответ, нередко является причиной развития осложнений имеющихся у пациента ССЗ. Pincus et al. (2005) выявлено, что сокращение продолжительности жизни пожилых людей в немалой степени зависит от выраженности болевого синдрома. Проведенная ими оценка выживаемости 1525 пациентов, среди которых 370 человек (24 %) страдали ОА, 246 человек (16 %) — ССЗ и 109 — ССЗ и ОА, показала, что относительный риск смерти был выше у пациентов с ОА с интенсивностью боли ≥ 40 мм по ВАШ (по сравнению с теми, у кого интенсивность боли была < 40 мм при отсутствии различий по возрасту и полу). Помимо этого, важным фактором, усугубляющим течение ССЗ, является ограничение физической активности пациентов, страдающих ОА.
Особенности терапии ОА у пациентов с ССЗ
Тот факт, что у больного с ОА, как правило, одновременно имеют место несколько соматических заболеваний, в первую очередь ССЗ, диктует необходимость жесткой оценки предполагаемой пользы и возможного риска от назначаемой противоартрозной терапии. На фоне коморбидности избыточное и нерациональное назначение лекарств без учета особенностей их взаимодействия приводит к резкому возрастанию вероятности развития нежелательных эффектов терапии и усугублению течения заболеваний.
Немедикаментозные методы лечения
Для пациента с ОА и ССЗ в случае повышенного ИМТ или ожирения проведение мероприятий по снижению веса является первоочередной задачей. Грамотная коррекция веса позволит уменьшить интенсивность болевого синдрома в пораженных суставах (коленных), будет способствовать замедлению прогрессирования ОА, а также значительно снизит риск сердечно-сосудистых осложнений. Регулярные занятия лечебной физкультурой (ЛФК) и правильный двигательный режим являются обязательными компонентами немедикаментозной терапии ОА. Позитивное влияние занятий ЛФК на снижение болевого синдрома в суставах при ОА установлено в ряде исследований. Комплекс ЛФК должен подбираться индивидуально с учетом имеющейся ССП и ее степени тяжести.
Медикаментозные методы лечения
В международных рекомендациях по лечению ОА (EULAR, 2003; OARSI, 2008) НПВП указаны как препараты выбора для купирования болевого синдрома при ОА (в случае неэффективности парацетамола). НПВП, как неселективные, так и селективные, обладают выраженным противовоспалительным и обезболивающим эффектом, однако на пациентов с ОА и риском развития, а тем более страдающих ССЗ, они могут оказывать целый ряд побочных эффектов, отягощающих течение кардиоваскулярной патологии. Повышение риска кардиоваскулярных катастроф (инфаркта миокарда, инсульта и внезапной коронарной смерти) может рассматриваться как класс-специфический побочный эффект для всех НПВП (Е.Л. Насонов, А.Е. Каратеев, 2003, 2006; E.M. Antman et al., 2007). Прием НПВП может приводить к дестабилизации АГ и прогрессированию сердечной недостаточности (СН). Установлено, что прием НПВП пациентами с заболеваниями сердца в анамнезе увеличивает в 10 раз вероятность (OR = 10,5) госпитализации по поводу СН по сравнению с пациентами, не принимающими НПВП (OR = 1,6). Также следует иметь в виду, что НПВП способны снижать эффективность препаратов, использующихся в стандартной терапии ССЗ (β-блокаторов, диуретиков, ингибиторов АПФ и в меньшей степени — антагонистов кальция). Как основные лечебные свойства всех НПВП, так и вызываемые ими нежелательные эффекты напрямую связаны с их механизмом действия — подавлением активности фермента циклооксигеназы (ЦОГ), что в результате приводит к угнетению синтеза простагландинов (ПГ), простациклинов и тромбоксанов. Существуют две изоформы ЦОГ: структурный изофермент (ЦОГ-1), регулирующий продукцию ПГ, участвующих в обеспечении нормальной (физиологической) функциональной активности клеток, и индуцируемый изофермент (ЦОГ-2), экспрессия которого регулируется иммунными медиаторами (цитокинами), принимающими участие в развитии иммунного ответа и воспаления. Принято считать, что противовоспалительное, анальгетическое и жаропонижающее действие НПВП преимущественно связано с их способностью ингибировать ЦОГ-2, в то время как наиболее часто встречающиеся побочные эффекты (поражение ЖКТ, почек, нарушение агрегации тромбоцитов) связаны с подавлением активности ЦОГ-1. В настоящее время все более значимое место в терапии ОА занимают симптоматические препараты медленного действия с возможной структурно-модифицирующей активностью (SYSODOA). Они так же, как и НПВП, включены в рекомендации EULAR (2003, 2005, 2006) и OARSI (2008) по лечению ОА. К ним относят глюкозамин (ГА) и хондроитин сульфат (ХС), диацереин, препараты гиалуроновой кислоты для внутрисуставных инъекций и экстракты авокадо и сои. Больше всего доказательств в отношении эффективности при лечении ОА получено для ХС и ГА. Суммируя результаты клинических исследований, проведенных с препаратами ХС и ГА, можно сделать заключение, что характерными для них являются противовоспалительный эффект, сравнимый с НПВП и позволяющий снизить дозу последних, возможность сочетания с парацетамолом и НПВП, длительное сохранение лечебного эффекта, высокая безопасность и отсутствие серьезных побочных эффектов. При этом они способствуют замедлению прогрессирования ОА (по данным рентгенологических исследований).
Механизм лечебного действия ХС и ГА при ОА связан с их способностью подавлять катаболические (дегенеративные) и активировать анаболические (восстановительные) процессы в хрящевой ткани, оказывать собственное противовоспалительное и обезболивающее действие. При этом установлено, что ХС и ГА оказывают не совсем идентичное фармакологическое действие: они дополняют и усиливают эффекты друг друга, что определяет перспективность их совместного применения в лечении ОА. Так, ХС зависимым от дозы образом подавляет стимулированный IL-1 синтез ПГ синовиальными фибробластами, отменяет зависимую от IL-1 ингибицию синтеза гиалуроновой кислоты, ингибирует зависимый от IL-1 синтез коллагеназы и активность аггреканазы, что свидетельствует о способности ХС уменьшать коллагенолитическую активность и увеличивать продукцию компонентов матрикса, способен подавлять синтез агрессивных ММР и активировать синтез ингибиторов ММР, что помогает восстановлению равновесия между анаболическими и катаболическими процессами в матриксе хряща. Помимо этого, ХС подавляет NО-индуцированный апоптоз хондроцитов, улучшает микроциркуляцию субхондральной кости за счет ингибиции синтеза липидов, связывания Е-селектина, мобилизации фибрина, липидов и холестерина в кровеносных сосудах субхондральной кости. ГA купирует провоспалительное и сосудоразрушающее действие IL-1, подавляет активацию пути ядерного фактора (NF)-kB. Благодаря этому механизму ГА может подавлять экспрессию генов и синтез белков ЦОГ-2, избирательно через ЦОГ-1, таким образом предупреждая высвобождение простагландина PGE2 в питательной среде. Действие (NF)-kB подавляется ГA на уровне как хондроцитов, так и синовиоцитов, при этом обеспечивается параллельное снижение синтеза белков ЦОГ-2, высвобождение PGE2 и, в хондроцитах, высвобождение NO. Кроме того, ГА последовательно снижает обусловленный IL-1 синтез MМP в клетках обоих типов (M.A. Alvarez-Soria et al., 2001). В эксперименте подтверждено усиление и дополнение фармакологических эффектов ХС и ГА в случае их совместного применения. Так, комбинация ХС и ГА подавляла синтез некоторых медиаторов дегенерации хряща, в частности уменьшала желатинолитическую активность ММР-9, способствовала уменьшению концентрации протеина ММ-13 и уменьшению уровня кератан-сульфата в тканях. В другом исследовании комбинированная терапия ХС и ГА увеличивала продукцию гликозаминогликанов хондроцитами на 96,6 % по сравнению с 32 % при монотерапии, а поражение хряща было менее тяжелым (L. Lippielo et al., 1999). В недавнем двойном слепом плацебо-контролируемом исследовании Glucosamine/Chondroitin Arthritis Intervention Trial (GAIT) при оценке влияния различных схем лечения на боль (WOMAC) через 6 мес. терапии было установлено, что у больных ОА с сильными болями в коленных суставах (WOMAC 301–400 мм) эффективность терапии комбинацией ХС и ГА была достоверно выше (79,2 %, р = 0,002 против плацебо), чем в случае использования монотерапии ХС или ГГ (Clegg et al., 2006). Учитывая доказанную клиническую эффективность, высокую безопасность и хорошую переносимость препаратов ХС и ГА, можно рассматривать их в качестве наиболее предпочтительных средств для лечения клинических проявлений ОА у больных с ССЗ. Проведенное нами исследование подтвердило эффективность и высокую безопасность комбинированного препарата Артрон Комплекс®* (в 1 таблетке содержит 500 мг ХС и 500 мг глюкозамина гидрохлорида) в лечении ОА у больных с соматической патологией. В исследование были включены 60 больных в возрасте 62,3 ± 4,7 года с ОА коленных суставов ІІ–ІІI стадии и сопутствующей соматической патологией, из которых 60 % страдали АГ и 19 % — ИБС. Пациенты были рандомизированно разделены на 2 группы, сопоставимые по полу, возрасту, тяжести ОА (интенсивности болевого синдрома и степени функциональных ограничений) и сопутствующей терапевтической патологии (по 30 пациентов каждая). Пациенты основной группы получали Артрон Комплекс® совместно с НПВП, пациенты контрольной группы — только НПВП. По ходу лечения НПВП отменялись при отсутствии болевого синдрома и нерецидивировании последнего без терапии НПВП. Длительность терапии составила 6 мес., клиническая оценка эффективности проводилась через 3 и 6 мес., МРТ — через 9 мес. В динамике оценивались влияние терапии на боль (индексы ВАШ, WOMAC), отмену или снижение дозы принимаемых НПВП, функциональное состояние (WOMAC, быстрота ходьбы на 15 м), прогрессирование заболевания (МРТ коленных суставов), состояние сердечно-сосудистой системы и желудочно-кишечного тракта. Оценка динамики болевого синдрома (WOMAC боли) продемонстрировала, что у пациентов, принимавших Артрон Комплекс®, уже через 3 мес. от начала терапии наблюдался более выраженный регресс болевого синдрома по сравнению с группой контроля. Через 6 мес. терапии у пациентов основной группы уровень интенсивности болевого синдрома был достоверно ниже, чем у пациентов контрольной группы: 178,3 ± ± 37,2 против 287,4 ± 42,8 соответственно (р = 0,02). Оценка функциональной недостаточности по шкале WOMAC на старте исследования не выявила значимых различий между группами наблюдения. Через 6 мес. терапии в обеих группах мы наблюдали достоверное снижение функциональной недостаточности, однако в первой группе средний балл составил 427,3, во второй — 658,9 (р = 0,002). Таким образом, у пациентов, получающих Артрон Комплекс®, после окончания запланированного срока наблюдения отмечалась достоверно большая динамика нивелирования болевого синдрома и улучшения функциональной способности. Визуальная оценка состояния коленных суставов, проведенная врачом МРТ, до лечения и через 9 мес. терапии установила улучшение визуализации суставного хряща у 60 % пациентов основной группы, в то время как у 63,3 % пациентов контрольной группы отмечалась отрицательная динамика. Таким образом, больший положительный эффект терапии в группе пациентов, получавших Артрон Комплекс®, с точки зрения клинической картины подтвержден данными объективного метода исследования — МРТ. С целью изучения влияния терапии на состояние сердечно-сосудистой системы у пациентов с ОА и соматической патологией оценивались динамика САД (систолического АД) и частота БИ (болевой ишемии) и ББИ (безболевой ишемии) миокарда по данным холтеровского исследования (в начале и через 6 мес. исследования). Установлено, что на фоне лечения у пациентов, получавших Артрон Комплекс®, наблюдалась большая положительная динамика уровня САД. Разница среднесуточного САД до начала терапии и через 6 мес. наблюдения составила в основной группе 7,3 мм рт.ст. (р < 0,05), в то время как в контрольной группе — 3,6 мм рт.ст. (р > 0,05). По данным холтеровского мониторирования, у пациентов основной группы было отмечено меньшее число эпизодов как БИ, так и ББИ миокарда, чем у пациентов контрольной группы. Положительное влияние препарата Артрон Комплекс® у больных с ОА и соматической патологией на состояние сердечно-сосудистой системы обусловлено, по-видимому, более эффективным купированием болевого синдрома в суставах и улучшением функционального состояния, снижением дозы принимаемых больным НПВП и связанным с этим снижением риска развития вызываемых ими побочных эффектов. Исследование также продемонстрировало выгодность применения препаратов ХС и ГА в лечении пациентов с ОА и соматической патологией с фармакоэкономической точки зрения. На фоне лечения препаратом Артрон Комплекс® у больных ОА уменьшилось число повторных госпитализаций по поводу обострений соматических заболеваний: в основной группе, получавшей Артрон Комплекс®, в течение последующих 9 мес. наблюдения повторно госпитализировались 43 % пациентов (13 человек), тогда как во 2-й группе, получавшей только НПВП, повторные госпитализации были у 76 % пациентов (23 человека). Общее число госпитализаций на 1 больного составило 1,2 в 1-й группе и 1,7 во 2-й группе.
Заключение
Таким образом, терапия клинических проявлений ОА у больных с сердечно-сосудистой патологией (или ее высоким риском) должна быть тщательно продумана врачом. При формировании схемы лечения должны быть выявлены и по возможности устранены имеющиеся у больного факторы риска сердечно-сосудистых заболеваний. Большое внимание следует уделять немедикаментозным методам лечения — ЛФК, диете, направленной на снижение ИМТ, организации режима труда и отдыха. На протяжении всего курса лечения необходим жесткий контроль уровня АД, ЭКГ. Что касается медикаментозной терапии, то больным с АГ и высоким риском кардиоваскулярных осложнений НПВП следует назначать с большой осторожностью, соблюдая принятые рекомендации (в сочетании с низкими дозами аспирина). Больным с СН НПВП лучше не назначать. Учитывая доказанную клиническую эффективность, высокую безопасность (сопоставимую с плацебо) и хорошую переносимость препаратов ХС и ГА, их можно рассматривать в качестве наиболее предпочтительных для лечения клинических проявлений ОА у больных с ССЗ.
Впервые опубликовано в «Русском медицинском журнале», 2010, т. 18, № 4
