Журнал «Болезни и антибиотики» 1 (03) 2010
Вернуться к номеру
Электрокардиографические нарушения при инфекционных заболеваниях
Авторы: Богун Л.В., Харьковская медицинская академия последипломного образования
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
Электрокардиография (ЭКГ) является информативным, доступным и неинвазивным методом графического изображения электрической деятельности сердца, который традиционно используется для диагностики коронарной недостаточности, нарушений ритма и проводимости и некоторых других состояний. В ряде случаев ЭКГ может служить дополнительным критерием для оценки тяжести и прогноза при инфекционных заболеваниях как маркер вовлечения в патологический процесс сердечно-сосудистой системы (ССС) [1]. ЭКГ-изменения при инфекционных заболеваниях, как правило, незначительны и неспецифичны, однако в ряде случаев с высокой достоверностью указывают на развитие серьезных осложнений, например миокардиальных абсцессов при инфекционном эндокардите.
Причины, вызывающие поражение ССС и соответственно изменения ЭКГ, можно отнести к одной из трех категорий: 1) прямое (за счет повреждающего действия инфекционного агента или его токсинов) или непрямое (за счет иммунопатологических процессов) действие возбудителя; 2) нарушения метаболизма, электролитного баланса или функции автономной нервной системы, обусловленные особенностями инфекционного процесса; 3) нежелательные лекарственные явления (НЛЯ) антимикробных препаратов.
Вирусные инфекции
ВИЧ-инфекция. Вовлечение ССС наблюдается преимущественно на поздних стадиях ВИЧ-инфекции [2]. Наиболее значимым фактором риска развития кардиальных осложнений является снижение числа CD4+ T-лимфоцитов менее 100 клеток/л [2]. Наиболее частыми изменениями ЭКГ у ВИЧ-инфицированных являются синусовая тахикардия, снижение вольтажа комплекса QRS, неспецифические изменения сегмента ST и зубца Т, удлинение интервала QT. Причиной этих изменений могут быть пролапс митрального клапана, миокардит со снижением систолической функции левого желудочка, дилатацией полостей сердца, в том числе и правых его отделов, вплоть до клинической картины, характерной для дилатационной кардиомиопатии. Также может встречаться выпот в перикард, гораздо реже — инфекционный эндокардит.
Удлинение интервала QT, даже бессимптомное, в отсутствие желудочковых нарушений ритма, ассоциируется с повышенным риском смерти, и частота этого синдрома увеличивается по мере усугубления нарушений иммунного статуса [3].
Нарушения ритма у ВИЧ-инфицированных, и у детей и у взрослых, встречаются относительно редко и характеризуются доброкачественностью клинического течения. Наиболее типичными нарушениями ритма/проводимости являются синусовая тахикардия, атриовентрикулярная (АВ) блокада I степени, суправентрикулярные экстрасистолы, которые практически никогда не прогрессируют в суправентрикулярные или желудочковые тахикардии и АВ-блокады высоких степеней [4].
Довольно часто выявляются ЭКГ-признаки гипертрофии правого желудочка, отражающие легочную гипертензию, часто развивающуюся при ВИЧ-инфекции [5].
Краснуха. Острое вирусное заболевание преимущественно детского возраста, распространенность которого имеет стойкую тенденцию к снижению вследствие массовой вакцинации. Заболевание протекает с лихорадкой, лимфаденопатией и макулопапулезной сыпью с четкой этапностью высыпаний лицо — туловище. Поражение миокарда встречается крайне редко, но появление изменений на ЭКГ свидетельствует о более тяжелом течении краснухи [6]. Чаще всего на ЭКГ обнаруживаются изменения сегмента SТ и зубца Т. Отклонение электрической оси влево отражает преходящее или постоянное повреждение левой ножки пучка Гиса и часто сопровождается нарушениями гемодинамики [7].
Спирохетозы
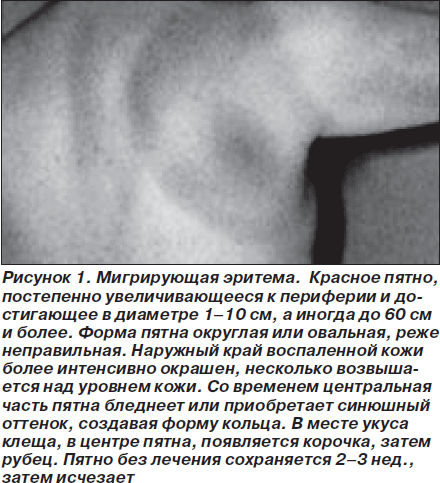
Болезнь Лайма. Системный клещевой боррелиоз (болезнь Лайма, хроническая мигрирующая эритема) — инфекционная природно-очаговая болезнь. Характеризуется трансмиссивным путем передачи (возбудитель — спирохета Borrelia burgdorferi, переносчиком которой является клещ Ixodes scapularis), полиморфизмом клинических проявлений (поражение кожи, нервной и сердечно-сосудистой системы, суставов), склонностью к затяжному рецидивирующему течению. Различают ранний и поздний периоды болезни. В раннем периоде выделяют 2 стадии. На 1-й стадии, развивающейся спустя несколько дней — 1 мес. после укуса клеща, в качестве наиболее постоянного симптома встречается мигрирующая кольцевидная эритема (erythema migrans) в месте укуса клеща, другие симптомы острого периода изменчивы и преходящи (рис. 1). Приблизительно в 20 % случаев поражение кожи является единственным проявлением 1-й стадии болезни Лайма. Изменения на ЭКГ при изолированной erythema migrans отмечаются редко, преимущественно в виде АВ-блокады I степени, увеличения амплитуды зубца S [8].
Во 2-й стадии болезни наряду с общей симптоматикой (слабость, головная боль, лихорадка с ознобами, лимфаденопатия) наблюдаются признаки поражения нервной системы (менингит, энцефалит, невриты черепно-мозговых и периферических нервов), у 4–10 % больных возникают кардиальные нарушения, чаще всего в виде миоперикардита с развитием дисфункции левого желудочка, кардиомегалии. Нарушения ритма возникают в виде синусовой аритмии, брадикардии, желудочковой экстрасистолии. Могут регистрироваться изменения конечной части желудочкового комплекса. Наиболее частый ЭКГ-симптом — нарушение проводимости по типу АВ-блокады, вплоть до полной поперечной блокады, которая является хотя и редким, но типичным проявлением системного клещевого боррелиоза. Зафиксировать транзиторную блокаду довольно трудно из-за ее преходящего характера, но регистрация ЭКГ желательна у всех пациентов с мигрирующей кольцевидной эритемой, поскольку полной поперечной блокаде обычно предшествуют менее выраженные нарушения ритма. Нарушения проводимости обычно проходят самостоятельно через 2–3 недели, но полная АВ-блокада требует вмешательства кардиологов и кардиохирургов [9, 10]. 3-я стадия формируется у 10 % больных через 6 месяцев — 2 года после острого периода. На этом этапе заболевания наиболее изученными являются поражения суставов (хронический Лайм-артрит), поражение кожи (атрофический акродерматит), а также хронические неврологические синдромы, напоминающие по срокам развития третичный период нейросифилиса. Появление каких-либо новых специфических ЭКГ-проявлений на данной стадии не характерно.
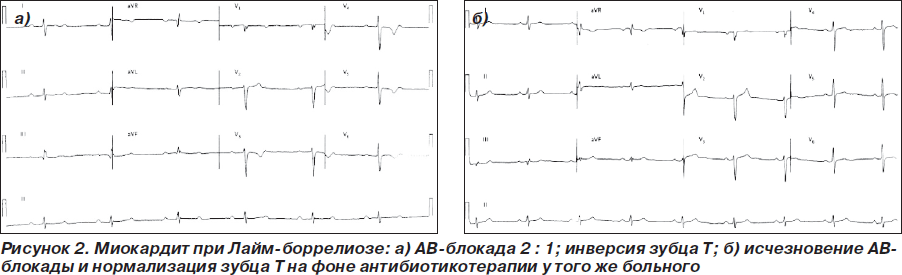
В среднем поражение ССС при болезни Лайма встречается у 8 % больных в возрасте старше 18 лет, наиболее типичными изменениями ЭКГ являются нарушения проводимости, которые характеризуются доброкачественным течением и склонны к самопроизвольному разрешению, необходимость в установке искусственного водителя ритма отмечается крайне редко [9]. Быстрое обратное развитие АВ-блокад отмечается на фоне парентерального назначения цефтриаксона (рис. 2) [10].
Регистрация ЭКГ является ценным методом скрининга при подозрении на Лайм-боррелиоз: согласно одному из исследований, у 3 из 10 детей с подозрением на боррелиоз отмечались изменения на ЭКГ [11].
Лептоспироз. Острое инфекционное заболевание, вызываемое различными серотипами лептоспир. Характеризуется общей интоксикацией, лихорадкой, поражением почек, печени, нервной системы и мышц. При тяжелых формах наблюдаются острая почечная недостаточность, желтуха и геморрагический синдром. Относится к зоонозам с природной очаговостью. Инфицирование человека происходит через зараженные водоемы, реже — через пищевые продукты или при контакте с инфицированными животными (свиньями и др.).
При лептоспирозе довольно часто на ЭКГ обнаруживают АВ-блокаду I степени, а также ЭКГ-признаки, характерные для острого перикардита [12]. Выявление изменений ЭКГ при лептоспирозе с высокой вероятностью свидетельствует о вовлечении ССС, чаще всего в виде миокардита, и вследствие этого — об ухудшении прогноза [13].
Эндемический (клещевой) возвратный тиф (синонимы: клещевой боррелиоз, клещевой спирохетоз, клещевая возвратная лихорадка) — инфекционная болезнь, протекающая в виде лихорадочных приступов, чередующихся с периодами нормальной температуры (апирексия — безлихорадочный период). В СССР к 1938 г. он в основном был ликвидирован. Очаги инфекции сохраняются в ряде стран Азии, Африки и Америки. Вызывается боррелиями B.hermsii и B.turicatae и характеризуется высокой возвратной лихорадкой с внезапным началом. Фебрильные эпизоды длятся от 3 до 6 дней и сопровождаются головной болью, артралгиями, миалгиями, тошнотой и напряжением затылочных мышц, невритами черепно-мозговых нервов. Миокардит развивается редко, типичным ЭКГ-проявлением миокардита является удлинение интервала QT [14].
Паразитарные заболевания
Болезнь Шагаса, возбудителем которой является Trypanosoma cruzi, встречается в странах Южной и Центральной Америки. Заболевание протекает с поражением ССС, нервной системы и пищеварительного тракта. ССС может вовлекаться в патологический процесс на любой стадии заболевания (острой, промежуточной и хронической) как следствие индуцируемых паразитами воспалительной реакции, гибели кардиомиоцитов с последующим развитием фиброза. Тяжесть поражения ССС варьирует от незначительных ЭКГ-нарушений до внезапной смерти. Чаще всего поражение ССС проявляется нарушениями проводимости: блокадой правой ножки пучка Гиса, блокадой передней ветви левой ножки пучка Гиса, нарушениями АВ-проводимости вплоть до полной АВ-блокады, для хронической стадии типично развитие кардиомегалии и сердечной недостаточности. Частота ЭКГ-изменений выше у больных старшего возраста и у больных с наличием антител к T.cruzi в сыворотке крови: так, изменения ЭКГ встречаются у 44 % серопозитивных больных и всего у 15,1 % серонегативных больных [15]. Внезапная смерть и серьезные нарушения проводимости в виде полной АВ-блокады более характерны для реинфекции T.cruzi в период острой фазы заболевания, чем для хронической стадии, подтверждением чему являются результаты экспериментальных исследований на животных [16–18]. У больных даже с незначительными изменениями ЭКГ отмечается более высокая смертность — например, инверсия зубца Т ассоциируется с увеличением смертности в 3 раза по сравнению с больными, не имеющими отклонений на ЭКГ [19]. О высоком риске летального исхода свидетельствуют и такие изменения на ЭКГ, как нарушение процессов реполяризации желудочков, удлинение и повышение дисперсии интервала QT [20].
Трихинеллез. Развивается вследствие употребления мяса, контаминированного личинками Trichinella larvae. Клинические проявления включают лихорадку, миалгии, головную боль, кожные высыпания, тошноту, рвоту, диарею, отеки ног, кашель, субконъюнктивальные и подногтевые геморрагии. Частота выявления изменений на ЭКГ, по данным разных авторов, различна: так, ранее сообщалось о выявлении ЭКГ-изменений у 21–75 % больных, по данным более поздних наблюдений, этот показатель составляет 13 % [21]. Наиболее часто на ЭКГ регистрируются транзиторные неспецифические нарушения процессов реполяризации желудочков в виде изменений сегмента ST и зубца Т. Реже выявляются ЭКГ-признаки, характерные для перикардита [21, 22].
Бактериальные инфекции
Дифтерия. Возбудитель — Corynebacterium diphtheriae, грамположительная палочка. Заражение происходит воздушно-капельным путем и при непосредственном контакте с секретом дыхательных путей, инфицированными предметами и через третьих лиц. К наиболее значимым факторам риска поражения ССС относятся пожилой возраст, низкий социально-экономический статус и тяжелое поражение дыхательных путей [23]. У 2/3 больных дифтерией выявляются признаки легкого миокардита, у 10–25 % — кардиальная дисфункция [24]. Для дифтерии характерно два типа ЭКГ-изменений: бессимптомные нарушения в виде удлинения интервала PQ и изменений зубца Т и отклонения, имеющие клинические проявления различной степени тяжести в случае развития АВ-блокад высоких степеней и внутрижелудочковых блокад [25]. ЭКГ-изменения при тяжелой дифтерии длятся несколько дней после исчезновения клинической симптоматики [25]. Отклонения на ЭКГ (изменения сегмента ST и зубца Т) отмечались у экспериментальных животных после вакцинации против дифтерии/столбняка/коклюша [26].
Поражение ССС является ведущей причиной смерти взрослых больных с дифтерией, составляя примерно 1/3 всех причин смерти при этой инфекции [27]. Дифтерийный токсин вызывает тяжелый острый миокардит [28]. Суточное мониторирование ЭКГ при поступлении больного в стационар позволяет более достоверно прогнозировать поражение сердца при дифтерии [29]. Риск вовлечения ССС выше у больных с лихорадкой, при токсической и мембранозной формах заболевания [33]. Об ухудшении прогноза свидетельствуют желудочковые нарушения ритма, повышение уровня АСТ выше 80 Ед/л, лейкоцитоз выше 25,0∙109/л и распространение фибринозных пленок более чем на 2 анатомические области [30].
Столбняк вызывается анаэробной грамположительной палочкой Clostridium tetani. Выделяют 4 формы столбняка: генерализованную, локализованную, неонатальную и цефалгическую. Вовлечение ССС отмечается чаще всего при генерализованной форме, характерными клиническими проявлениями которой являются тризм, «сардоническая улыбка» вследствие повышения тонуса круговой мышцы рта и генерализованные судороги. На ЭКГ выявляются синусовая тахикардия, удлинение интервала QT, неспецифические изменения сегмента ST и зубца T [31].
Коклюш. Возбудителем коклюша является Bordetella pertussis — мелкая, неподвижная, неспорообразующая, аэробная грамотрицательная коккобацилла [32]. Заболевание характеризуется острым катаром дыхательных путей и приступами спазматического кашля. Течение коклюша может осложниться присоединением вторичных инфекций, поражением центральной нервной и сердечно-сосудистой систем. Наиболее типичными изменениями ЭКГ при развитии кардиальных осложнений являются синоаурикулярные и атриовентрикулярные блокады [33, 34]. Эти изменения развиваются вследствие активации натриевых каналов проводящей системы сердца гуанин-нуклеотид-связывающим белком коклюшевого токсина [33, 34].
Стрептококковые инфекции. Поражение ССС происходит как вследствие развития воспалительных процессов, например при острой ревматической лихорадке (ОРЛ), вызываемой β-гемолитическими стрептококками группы А, так и за счет прямого повреждающего действия стрептококковых токсинов при других заболеваниях стрептококковой этиологии [35].
Наиболее характерными ЭКГ-изменениями при ОРЛ является АВ-блокада I степени, относящаяся к малым диагностическим критериям заболевания. Другие нарушения проводимости, в частности полная АВ-блокада и АВ-блокада II степени типа Мобитц I, при ОРЛ встречаются значительно реже [36]. Наиболее характерными изменениями ЭКГ при инвазивных стрептококковых инфекциях являются изменения сегмента ST — зубца T. Другие отклонения на ЭКГ при ОРЛ встречаются менее часто: синусовая тахикардия, изменения зубца Р, инверсия зубца Т, экстрасистолические нарушения ритма. К клиническим проявлениям ОРЛ относятся кардиомегалия, застойная сердечная недостаточность, развитие дисфункции митрального и/или аортального клапанов с соответствующей аускультативной картиной.
Миокардит, вызываемый стрептококками группы В, сопровождается снижением вольтажа ЭКГ в отведениях от конечностей, возможно также вовлечение перикарда с развитием миоперикардита.
Поражение перикарда в виде острого гнойного перикардита с элевацией (подъемом) сегмента ST на ЭКГ было описано при заболеваниях, вызванных стрептококками группы G [37].
ЭКГ-изменения при инвазивных стрептококковых инфекциях обычно исчезают на фоне адекватной антибиотикотерапии [38].
Брюшной тиф — острая, циклически протекающая кишечная инфекция, вызываемая сальмонеллой брюшного тифа, Salmonella typhi, с фекально-оральным механизмом передачи, характеризующаяся лихорадкой, явлениями общей интоксикации с развитием тифозного статуса, розеолезными высыпаниями на коже, гепатоспленомегалией и поражением лимфатической системы тонкой кишки. Ежегодно во всем мире регистрируется около 16 миллионов случаев заболевания, из них около 600 000 — с летальным исходом.
Осложнения в виде кишечной непроходимости, ульцерации и перфорации развиваются обычно на 4-й неделе заболевания. Изменения на ЭКГ регистрируются как в острый период заболевания, длящийся до 4 недель, так и в период реконвалесценции, длительность которого достигает 2 месяцев. Поражение ССС развивается в результате прямого воздействия на миокард вследствие инвазии Salmonella typhi или под действием токсинов (эндотоксин, энтеротоксин, цитотоксин), продуцируемых сальмонеллами. Уровень кардиоспецифических ферментов повышается только в острый период [39]. Тяжесть миокардита при брюшном тифе зависит от предшествующего состояния здоровья пациента, наибольшее негативное влияние оказывают анемия, кардиоваскулярная патология и алиментарный дефицит [40].
Типичные изменения на ЭКГ при брюшном тифе включают ЭКГ-признаки миокардита: удлинение интервала PQ, удлинение интервала QT, депрессию сегмента ST и инверсию зубца Т. В ряде случаев изменения на ЭКГ при тифозном миокардите напоминают таковые при остром инфаркте миокарда задненижней локализации, особенно у больных с сопутствующим синдромом Вольфа — Паркинсона — Уайта [41, 42].
Хотя для брюшного тифа характерна относительная брадикардия, то есть частота сердечных сокращений, не соответствующая высоте лихорадки, тем не менее синусовая брадикардия как таковая встречается при брюшном тифе очень редко. Имеется всего несколько сообщений о синусовой брадикардии, обусловленной синдромом слабости синусового узла, развившимся на фоне брюшного тифа [43, 44]. Синусовая брадикардия при брюшном тифе рефрактерна к атропину, но в большинстве случаев исчезает самостоятельно при выздоровлении больного [43, 44].
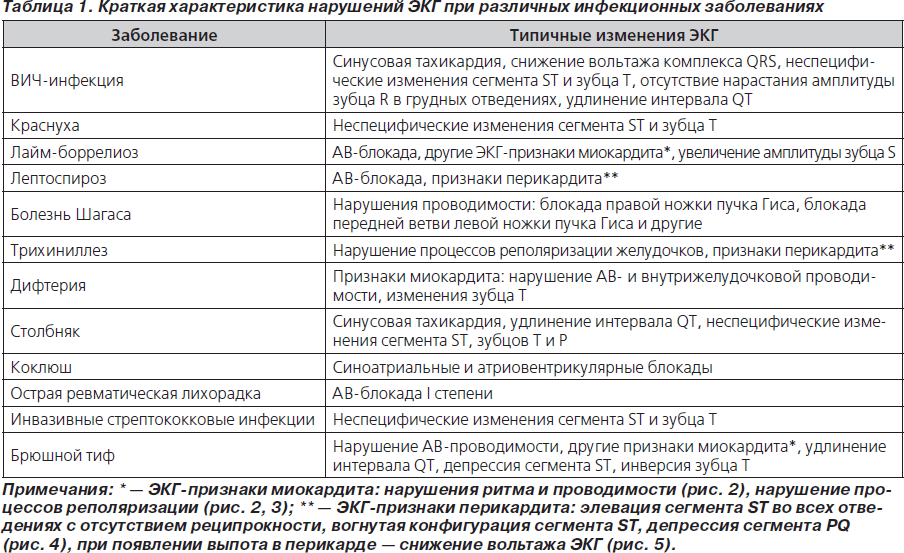
Краткая характеристика нарушений ЭКГ при различных инфекционных заболеваниях представлена в табл. 1.
Инфекционные заболевания сердца
Миокардит. Миокардит — поражение мышцы сердца воспалительного характера, обусловленное непосредственным или опосредованным через иммунные механизмы действием инфекции, паразитарной или протозойной инвазии, химических и физических факторов, возникающее при аллергических, аутоиммунных заболеваниях или трансплантации сердца [45].
Изменения на ЭКГ при миокардите могут быть следствием собственно миокардита, обусловленного тем или иным инфекционным агентом, либо иметь вторичный характер, отражая влияние лихорадки, гипокалиемии, дефицита витаминов или нежелательные лекарственные явления при приеме препаратов, для лечения миокардита, в первую очередь антимикробных средств.
Миокардит может развиваться на фоне многих инфекционных заболеваний, хотя самыми частыми его возбудителями являются вирусы, особенно энтеровирусы (Коксаки).
Возбудители, вызывающие острый миокардит:
1. Бактерии: Borrelia burgdorferi, Brucella spp., Campylobacter spp., Chlamydophila pneumoniae, Chlamydia psittaci, Clostridium perfringens, Corynebacterium diphtheriae, Coxiella burnetii, Ehrlichia spp., Legionella pneumophila, Listeria monocytogenes, Mycobacterium tuberculosis, Mycoplasma pneumoniae, Neisseria meningitidis, Rickettsia spp., Salmonella spp., Shigella spp., Staphylococcus aureus, Streptococcus pyogenes, Vibrio cholerae.
2. Грибы: Aspergillus spp., Blastomyces spp., Candida spp., Coccidioides immitis, Cryptococcus spp., Histoplasma capsulatum.
3. Паразиты: Trypanosoma cruzi, Trypanosoma gambiense, Trypanosoma rhodesiense, Toxoplasma gondii.
4. Вирусы: вирусы Коксаки A и B, цитомегаловирус, эховирус, вирус Эпштейна — Барр, вирус гепатита B и C, вирус иммунодефицита человека, парамиксовирус.
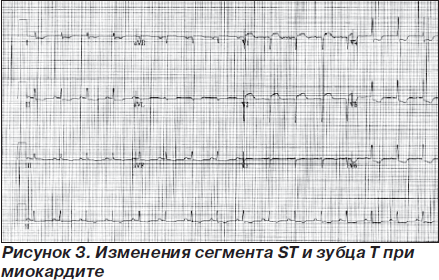
Поскольку патологический очаг при вирусной инфекции локализуется в ишемизированных участках, то такие очаги, как правило, располагаются в субэндокардиальном слое миокарда. Проявления вирусного миокардита зависят от вирулентности инфекционного агента и от гормонального и иммунологического статуса макроорганизма. Инфицирование плода вирусом краснухи, парамиксовирусом и коксакивирусом может вызвать врожденные аномалии развития [46]. Миокардит сопровождается различными изменениями на ЭКГ, чаще всего — АВ-блокадами различной степени, другими нарушениями проводимости, изменениями сегмента ST и зубца T, иногда симулирующими острый коронарный синдром, и желудочковыми нарушениями ритма (рис. 3) [47].
Перикардит — воспалительное заболевание перикарда, вызываемое многими инфекционными агентами, причем в ряде случаев возможно одновременное поражение пери- и миокарда.
Типичные возбудители острого перикардита:
1. Бактерии: Haemophilus influenzae, Mycobacterium spp., Neisseria gonorrhoeae, Neisseria meningitidis, Salmonella spp., Staphylococcus aureus, Streptococcus pneumoniae.
2. Грибы: Aspergillus spp., Blastomyces spp., Candida spp., Coccidioides immitis, Cryptococcus neoformans, Histoplasma capsulatum.
3. Вирусы: вирусы Коксаки A и B, эховирус, вирус Эпштейна — Барр, ВИЧ, вирус гриппа, парамиксовирус, парвовирус B19.
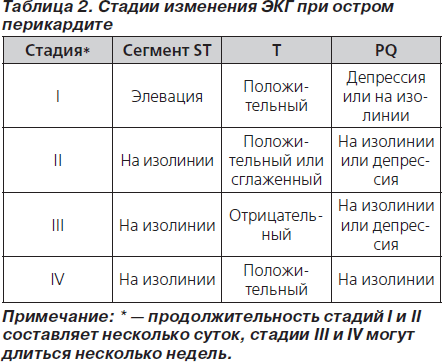
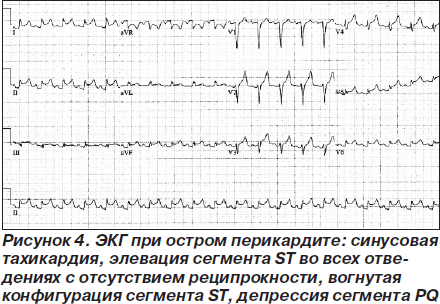
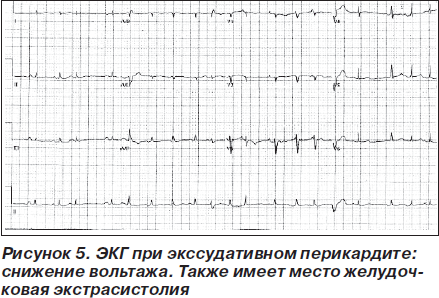
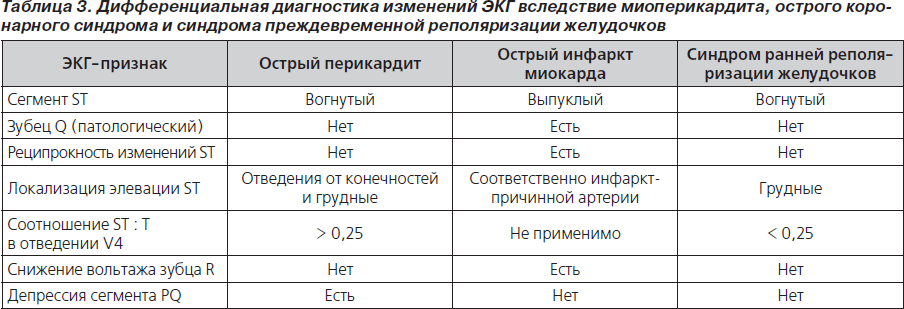
В ранней стадии перикардита на ЭКГ регистрируется депрессия сегмента PQ, затем следует элевация сегмента ST, нормализация сегмента ST, инверсия зубца Т и нормализация ЭКГ (рис. 4; табл. 2) [48, 49]. При перикардите ЭКГ может напоминать ЭКГ при остром коронарном синдроме [49]. Дифференциальная диагностика изменений ЭКГ вследствие миоперикардита, острого коронарного синдрома и синдрома преждевременной реполяризации желудочков представлена в табл. 3 [50]. Эволюция ЭКГ-изменений может длиться от нескольких дней до нескольких недель [51]. При образовании выпота в перикарде отмечается снижение вольтажа зубцов ЭКГ (рис. 5).
Эндокардит. При эндокардите часто развиваются ЭКГ-изменения, появление которых свидетельствует об инвазивной форме инфекции, высоком риске осложнений и фатального исхода [52]. Нарушение проводимости указывает на распространение инфекционного процесса на перивальвулярную область [53]. Изменения ЭКГ очень часто регистрируются у больных с искусственными клапанами. К сожалению, не было проведено ни одного проспективного исследования изменений ЭКГ при инфекционном эндокардите. Аутопсийные исследования подтверждают, что наиболее частым изменением на ЭКГ является синусовая тахикардия, регистрировавшаяся у 53 % больных с верифицированным инфекционным эндокардитом [54]. Реже на ЭКГ выявлялись другие изменения: снижение вольтажа комплекса QRS (44 %), АВ-блокады различной степени (9 %), элевация сегмента ST, фибрилляция предсердий, желудочковая тахикардия и суправентрикулярная тахикардия (рис. 6).
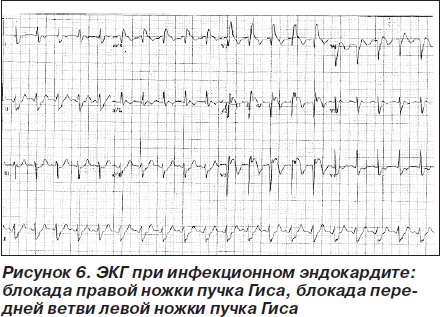

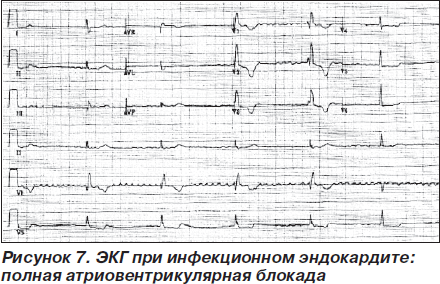
У больных инфекционным эндокардитом, у которых на фоне адекватной антимикробной терапии длительное время сохраняется лихорадка и появились боль в груди и одышка, выявление АВ-блокад на ЭКГ свидетельствует о развитии перивальвулярного абсцесса и требует хирургического лечения (рис. 7) [54].
Микоплазмоз. Mycoplasma pneumoniae вызывают заболевания верхних и нижних дыхательных путей примерно у 70 % инфицированных, у 20 % протекают бессимптомно. В закрытых коллективах (армия, тюрьмы) отмечаются эпидемиологические вспышки [55]. Вовлечение ССС отмечается редко и в подавляющем большинстве случаев — у лиц, имеющих клинически манифестные формы микоплазменной инфекции. Самыми частыми отклонениями на ЭКГ являются изменения конечной части желудочкового комплекса в виде инверсии зубца Т. Также могут регистрироваться брадикардия, удлинение интервала PQ и узкий комплекс QRS [56, 57]. В отсутствие симптомов поражения ССС изменения на ЭКГ встречаются редко и носят неспецифический характер. Предшествующая кардиальная патология не влияет на риск развития и степень выраженности ЭКГ-нарушений [58, 59].
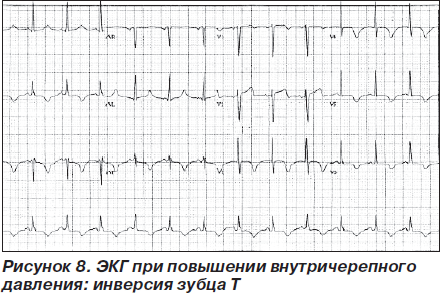
Повышение внутричерепного давления инфекционного генеза вследствие менингита (как, впрочем, и при неинфекционных заболеваниях, например при субарахноидальном кровоизлиянии, опухолях мозга) также может вызывать отклонения на ЭКГ. Механизм развития ЭКГ-изменений у больных с повышенным внутричерепным давлением зависит от этиологии заболевания и реализуется через повышение тонуса симпатической и парасимпатической нервной системы в острый период субарахноидального кровоизлияния [60]; высвобождение большого количества норэпинефрина и эпинефрина из опухолей головного мозга [61]; электролитные нарушения при менингитах и аритмогенный эффект при опухолевом повреждении лимбических структур головного мозга [62]. Гипокалиемия, развивающаяся при опухолях головного мозга, геморрагиях и при повышении активности автономной нервной системы, также способствует развитию ЭКГ-нарушений [63]. К характерным изменениям на ЭКГ при повышении внутричерепного давления относятся высокий зубец Р, высокий зубец U, инвертированный зубец U, изменения сегмента ST и зубца Т, зазубренность зубца Т, синусовая тахикардия (рис. 8) [61, 63].
Антимикробные препараты
Антимикробные препараты могут блокировать натриевые каналы, приводя к удлинению реполяризации и удлинению интервала QT [64]. Подобным проаритмическим эффектом обладают фторхинолоны, удлиняющие интервал QT и повышающие риск развития тахикардии типа «пируэт» (torsades de pointes) (рис. 9) [65]. Проаритмический эффект фторхинолонов существенно возрастает при наличии электролитных нарушений (гипомагниемия, гипокалиемия, гипокальциемия), при алкоголизме, на фоне сопутствующего приема антиаритмических препаратов I класса, особенно хинидина, и III класса. Аритмогенный эффект исчезает после прекращения приема фторхинолонов [66]. Чаще всего удлинение интервала QT возникает на фоне применения спарфлоксацина (14,5 случая на 1 миллион назначений), ципрофлоксацин вызывает удлинение интервала QT значительно реже (1 случай на 1 миллион назначений). Антигрибковые препараты класса азолов также обладают свойством удлинять интервал QT [67]. Особенно часто проаритмический эффект азолов реализуется при совместном назначении с антигистаминными препаратами (лоратадин, терфенадин, эбастин) [68]. Такое же действие оказывают и антимикробные препараты класса макролидов. Наиболее мощным проаритмическим эффектом среди макролидов обладает эритромицин, за ним следуют кларитромицин, рокситромицин и азитромицин. Например, кларитромицин вызывает удлинение интервала QT в 3 случаях на 1 миллион назначений [69].
2010/73/3.png)
Заключение
Основные положения, касающиеся роли ЭКГ при инфекционных заболеваниях, представлены в табл. 4. ЭКГ-изменения при различных инфекционных заболеваниях развиваются в силу разных причин: под влиянием собственно инфекционного процесса, а также вследствие вызванных этим процессом метаболических нарушений или дисфункции автономной нервной системы. В ряде случаев выявление изменений на ЭКГ облегчает дифференциальную диагностику основного заболевания, например при Лайм-боррелиозе или ОРЛ. Однако гораздо чаще оценка изменений на ЭКГ, не неся дополнительной диагностической ценности, предоставляет важную информацию для оценки тяжести инфекционного заболевания, его прогноза, а также эффективности и безопасности лечения. Многие антимикробные препараты обладают проаритмическим эффектом, и своевременное выявление ЭКГ-признаков высокого риска развития нарушений ритма позволяет существенно снизить частоту тяжелых НЛЯ.
1. Berul C.I., Aronovitz M.J., Wang P.J., Mendelsohn M.E. In vivo cardiac electrophysiology studies in the mouse // Circulation. 1996; 94: 2641-8.
2. Steffen H.M., Schrappe-Bacher M., Muller R. et al. Cardiac involvement within the scope of HIV-1 infection: preliminary results of echocardiography study [Article in German] // Z. Kardiol. 1990; 79: 83-8.
3. Sani M.U., Okeahialam B.N. QTc interval prolongation in patients with HIV and AIDS // J. Natl Med. Assoc. 2005; 97: 1657-61.
4. Kocheril A.G., Bokhari S.A., Batsford W.P., Sinusas A.J. Long QTc and torsades de pointes in human immunodeficiency virus disease // Pacing Clin. Electrophysiol. 1997; 20: 2810-6.
5. Mehta N.J., Khan I.A., Mehta R.N., Sepkowitz D.A. HIV Related pulmonary hypertension: analytic review of 131 cases // Chest. 2000; 118: 1133-41.
6. Rowe R.D. Cardiovascular disease in the rubella syndrome // Cardiovasc. Clin. 1973; 5: 61-80.
7. Halloran K.H., Sanyal S.K., Gardner T.H. Superiorly oriented electrocardiographic axis in infants with the rubella syndrome // Am. Heart J. 1966; 72: 600-6.
8. Pikelj-Pecnik A., Lotric-Furlan S., Maraspin V. et al. Electrocardiographic findings in patients with erythema migrans // Wien Klin. Wochenschr. 2002; 114: 510-4.
9. Horowitz H.W., Belkin R.N. Acute myopericarditis resulting from Lyme disease // Am. Heart J. 1995; 130: 176-8.
10. Rosenberg R. Medical mystery: bradycardia-the answer [letter] // N. Engl. J. Med. 2005; 353: 430-2.
11. Woolf P.K., Lorsung E.M., Edwards K.S. et al. Electrocardiographic findings in children with Lyme disease // Pediatr. Emerg. Care. 1991; 7: 334-6.
12. Watt G., Padre L.P., Tuazon M., Calubaquib C. Skeletal and cardiac muscle involvement in severe, late leptospirosis // J. Infect. Dis. 1990; 162: 266-9.
13. Ramachandran S., Perera M.V. Cardiac and pulmonary involvement in leptospirosis // Trans. R. Soc. Trop. Med. Hyg. 1977; 71: 56-9.
14. Wengrower D., Knobler H., Gillis S., Chajek-Shaul T. Myocarditis in tick-borne relapsing fever // J. Infect. Dis. 1984; 149: 1033.
15. Zicker F., Netto J.C., Zicker E.M. et al. Trypanosoma cruzi infection and electrocardiographic findings among active // Int. J. Epidemiol. 1990; 19: 182-6.
16. Bustamante J.M., Rivarola H.W., Palma J.A., Paglini-Oliva P.A. Electrocardiographic characterization in Trypanosoma cruzi reinfected mice // Parasitology 2004; 128(Pt 4): 415-9.
17. El Munzer B.J., Sallach S.M., McGuire D.K. Cardiac chagas disease masquerading as an acute myocardial infarction // Cardiol. Rev. 2004; 12: 69-72.
18. Maguire J.H., Hoff R., Sherlock I. et al. Cardiac morbidity and mortality due to Chagas’ disease: prospective electrocardiographic study of a Brazilian community // Circulation. 1987; 75: 1140-5.
19. Salles G.F., Xavier S.S., Sousa A.S. et al. T-wave axis deviation as an independent predictor of mortality in chronic Chagas disease // Am. J. Cardiol. 2004; 93: 1136-40.
20. Salles G., Xavier S., Sousa A. et al. Prognostic value of QT interval parameters for mortality risk stratification in Chagas disease: results of a long-term follow-up study // Circulation. 2003; 108: 305-12.
21. Lazarevic A.M., Neskovic A.N., Goronja M. et al. Low incidence of cardiac abnormalities in treated trichinosis: a prospective study of 62 patients from a single-source outbreak // Am. J. Med. 1999; 107: 18-23.
22. Puljiz I., Beus A., Kuzman I., Seiwerth S. Electrocardiographic changes and myocarditis in trichinellosis: a retrospective study of 154 patients // Ann. Trop. Med. Parasitol. 2005; 99: 403-11.
23. Lumio J.T., Groundstroem K.W., Melnick O.B. et al. Electrocardiographic abnormalities in patients with diphtheria: a prospective study // Am. J. Med. 2004; 116: 78-83.
24. Boyer N.H., Weinstein L. Diphtheritic myocarditis // N. Engl. J. Med. 1948; 239: 913-9.
25. Ledbetter M.K., Cannon A.B. II, Costa A.F. The electro-electrocardiogram in diphtheritic myocarditis // Am. Heart J. 1964; 68: 599-611.
26. Dymnicka S., Zoltowska A. Myocardial changes after chronic immunization of guinea pigs with diphtheria-tetanus-pertussis (DTP) vaccine // Cor Vasa. 1977; 19: 458-64.
27. Rakhmanova A.G., Lumio J., Groundstroem K. et al. Diphtheria outbreak in St. Petersburg: clinical characteristics of 1860 adult patients // Scand. J. Infect. Dis. 1996; 28: 37-40.
28. Gore I. Myocardial changes in fatal diphtheria. A summary of observations in 221 cases // Am. J. Med. Sci. 1948; 215: 257-66.
29. Kneen R., Nguyen M.D., Solomon T. et al. Clinical features and predictors of diphtheritic cardiomyopathy in Vietnamese children // Clin. Infect. Dis. 2004; 39: 1591-8.
30. Havaldar P.V., Sankpal M.N., Doddannavar R.P. Diphtheritic myocarditis: clinical and laboratory parameters of prognosis and fatal outcome // Ann. Trop. Paediatr. 2000; 20: 209-15.
31. Mitra R.C., Gupta R.D., Sack R.B. Electrocardiographic changes in tetanus: a serial study // J. Indian Med. Assoc. 1991; 89: 164-7.
32. Centers for Disease Control and Prevention. Pertussis in United States, 2001–2003 // Morb. Mortal Wkly Rep. 2005; 54: 1283-6.
33. Adamis D., Boyer N.H., Weinstein L. An electrocardiograph-electrocardiographic study of uncomplicated pertussis // J. Pediatr. 1956; 49: 567-9.
34. Bohm M., Schmitz W., Scholz H., Wilken A. Pertussis toxin prevents adenosine receptor- and m-cholinoceptormediated sinus rate slowing and AV conduction block in the guinea-pig heart // Naunyn-Schmiedeberg’s Arch. Pharmacol. 1989; 339: 152-8.
35. Putterman C., Caraco Y., Shalit M. Acute nonrheumatic perimyocarditis complicating streptococcal tonsillitis // Cardiology. 1991; 78: 156-60.
36. Mohindra R., Pannu H.S., Mohan B. et al. Syncope in a middle aged male due to acute rheumatic fever // Indian Heart J. 2004; 56: 668-9.
37. Kim N.H., Park J.P., Jeon S.H. et al. Purulent pericarditis caused by group G streptococcus as an initial presentation of colon cancer // J. Korean Med. Sci. 2002; 17: 571-3.
38. Karjalainen J. Streptococcal tonsillitis and acute nonrheumatic myopericarditis // Chest. 1989; 95: 359-63.
39. Nand N., Sharma M., Bhutani M. et al. Cardiac status in typhoid fever // Angiology. 1996; 47: 1095-100.
40. Choudhary S. Myocarditis in enteric fever // J. Assoc. Phys. India. 1974; 22: 251-4.
41. Pelupessy J.M., Sangka P. Electrocardiographic pattern of typhoid fever in children // Paediatr. Indones. 1989; 29: 215-20.
42. Akdeniz H., Tuncer I., Irmak H., Demiroz A.P. Salmonella myocarditis in a patient with Wolf — Parkinson — White syndrome that was confused with an inferior myocardial infarction // Clin. Infect. Dis. 1997; 25: 736-7.
43. Rajeshwari K., Yadav S., Puri R.K., Khanijo C.M. Sick sinus syndrome-a rare complication of typhoid fever // Indian Pediatr. 1994; 31: 995-8.
44. Mathur S.L. Sino-atrial block in typhoid fever [letter] // J. Assoc. Physicians India 1990; 38: 243-4.
45. Коваленко В.М., Рябенко Д.В., Солобюкова Н.О., Онищенко О.В. Міокардит: визначення, класифікація, стандарти діагностики та лікування / Методичні рекомендації, затверджені Українським центром науково-медичної інформації та патентно-ліцензійної роботи. — Київ, 2007. — 40 с.
46. Levine H.D. Virus myocarditis: a critique of the literature from clinical, electrocardiographic, and pathologic standpoints // Am. J. Med. Sci. 1979; 277: 132-43.
47. Hayakawa M., Inoh T., Yokota Y. et al. A long-term follow-up study of acute myocarditis an electrocardiographic and echocardiographic study // Jpn Circ. J. 1984; 48: 1362-7.
48. Baljepally R., Spodick D.H. PR-segment deviation as the initial electrocardiographic response in acute pericarditis // Am. J. Cardiol. 1998; 81: 1505-6.
49. Gunukula S.R., Spodick D.H. Pericardial disease in renal patients // Semin. Nephrol. 2001; 21: 52-6.
50. Marinella M.A. Electrocardiographic manifestations and differential diagnosis of acute pericarditis // Am. Fam. Physician. 1998; 57: 703.
51. Chan T.C., Brady W.J., Pollack M. Electrocardiographic manifestations: acute myopericarditis // J. Emerg. Med. 1999; 17: 865-72.
52. Meine T.J., Nettles R.E., Anderson D.J. et al. Cardiac conduction abnormalities in endocarditis defined by the Duke criteria // Am. Heart J. 2001; 142: 280-5.
53. Miyamoto M.I., Hutter A.M. Jr, Blum J.H., Torchiana D.F. Cardiac conduction abnormalities preceding transoesophageal echocardiographic evidence of perivalvar extension of infection in a case of Salmonella prosthetic valve endocarditis // Heart. 1997; 78: 416-8.
54. Berk W.A. Electrocardiographic findings in infective endocarditis // J. Emerg. Med. 1988; 6: 129-32.
55. Mogabgab W.J. Mycoplasma pneumoniae and adenovirus respiratory illnesses in military and university personnel, 1959–1966 // Am. Rev. Respir. Dis. 1968; 97: 345-58.
56. Feizi O., Grubb C., Skinner J.I. et al. Unusual complications of primary atypical pneumonia due to M.pneumoniae // Br. Med. J. 1971; 4: 751.
57. Chergui K., Fourme T., Veillard-Baron A. et al. Mycoplasma pneumoniae and second-degree heart block // Clin. Infect. Dis. 1998; 27: 1534-5.
58. Богомолов Б.П., Молоткова Т.Н., Девяткин А.В. Состояние сердечно-сосудистой системы при респираторном микоплазмозе // Клин. медицина. 2002; 80: 34-8.
59. Lim C.H., Toh C.C., Chia B.L., Low L.P. Stokes — Adams attacks due to acute nonspecific myocarditis // Am. Heart J. 1975; 90: 172-8.
60. Kawahara E., Ikeda S., Miyahara Y., Kohno S. Role of au- autonomic nervous dysfunction in electrocardiographic abnormalities and cardiac injury in patients with acute subarachnoid hemorrhage // Circ. J. 2003; 67: 753-6.
61. Syverud G. Electrocardiographic changes and intracranial pathology. AANA J. 1991; 59: 229-32.
62. Koepp M., Kern A., Schmidt D. Electrocardiographic changes in patients with brain tumors // Arch. Neurol. 1995; 52: 152-5.
63. Hersch C. Electrocardiographic changes in subarachnoid haemorrhage, meningitis, and intracranial space occupying lesions // Br. Heart J. 1964; 26: 785-93.
64. Morissette P., Hreiche R., Turgeon J. Drug-induced long QT syndrome and torsade de pointes // Can. J. Cardiol. 2005; 21: 857-64.
65. Eisenhauer M.D., Eliasson A.H., Taylor A.J. et al. Incidence of cardiac arrhythmias during intravenous pentamidine amidine therapy in HIV-infected patients // Chest. 1994; 105: 389-95.
66. Prabhakar M., Krahn A.D. Ciprofloxacin-induced acquired long QT syndrome // Heart Rhythm. 2004; 1: 624-6.
67. Tholakanahalli V.N., Potti A., Hanley J.F., Merliss A.D. Fluconazole-induced torsade de pointes // Ann. Pharmacother. 2001; 35: 432-4.
68. Gras J., Llenas J., Palacios J.M, Roberts D.J. The role of ketoconazole in the QTc interval prolonging effects of H1-antihistamines in a guinea-pig model of arrhythmogenicity // Br. J. Pharmacol. 1996; 119: 187-8.
69. Ohtani H., Taninaka C., Hanada E. et al. Comparative pharmacodynamic analysis of Q-T interval prolongation induced by the macrolides clarithromycin, roxithromycin, and azithromycin in rats // Antimicrob. Agents Chemother. 2000; 44: 2630-7.
Получено 14.06.10