Газета «Новости медицины и фармации» Кардиология (338) 2010 (тематический номер)
Вернуться к номеру
Хроническая сердечная недостаточность и хроническое обструктивное заболевание легких
Авторы: Л.Г. Воронков, д.м.н., профессор, Национальный научный центр «Институт кардиологии им. акад. Н.Д. Стражеско» АМН Украины
Версия для печати
Правильная клиническая оценка и адекватное ведение пациента с хронической сердечной недостаточностью (ХСН) в каждом отдельном случае представляют собой маленькую клиническую проблему, успешность решения которой в немалой степени определяется глубиной знаний врача о тех патологических состояниях, которые нередко сопутствуют ХСН, осложняют ее течение и ограничивают действенность лечебных мероприятий, предусмотренных стандартами терапии данного синдрома.
В ряду упомянутых коморбидных состояний существенное место принадлежит хроническому обструктивному заболеванию легких (ХОЗЛ). Медико-социальное значение ХСН и ХОЗЛ является сопоставимым. Хотя распространенность последнего среди взрослого населения (4–10 %) примерно вдвое превышает таковую ХСН, однако госпитальная летальность при обострениях обоих состояний достигает 10 % при практически одинаковой доле (до 70 %) экономических затрат на стационарное лечение [1, 2].
Данные о распространенности ХОЗЛ среди пациентов с ХСН разноречивы (варьирует от 7 до 52 %), что определяется различиями характера клинических выборок, используемых для такого рода анализа. Так, в многоцентровых исследованиях (SOLVD, ValHeF, ELITE-II, WATCH и др.) частота ХОЗЛ при ХСН составляет 7–13 %, что ненамного превышает популяционную, в то время как, по данным регистров крупных клиник, колеблется от 24 до 52 % в Северной Америке и от 19 до 41 % в странах Евросоюза [3]. Данное обстоятельство можно объяснить особенностями практики мультицентровых испытаний кардиологических препаратов, где клинически манифестированное ХОЗЛ обычно фигурирует в критериях исключения из исследования. Среди пациентов, находившихся на стационарном лечении по поводу ХСН в отделении сердечной недостаточности ННЦ «Институт кардиологии им. акад. Н.Д. Стражеско» АМН Украины в течение 5 лет, доля больных с сопутствующим ХОЗЛ составила 31 %, что близко к цифрам распространенности ХОЗЛ, по данным крупнейших регистров США — National HF Project (33 %) и US Medicare (26 %), охватившим соответственно 122 630 и 34 587 пациентов [4, 5].
Сочетание ХСН и ХОЗЛ порождает ряд клинических проблем, пока далеких от успешного разрешения.
Сложности клинической диагностики
Такие жалобы, как одышка, нехватка воздуха при физической нагрузке или ночью, предъявляют пациенты как с ХСН, так и с ХОЗЛ. Такой аускультативный признак, как ослабленное дыхание с обеих сторон, также может быть общим у многих пациентов с каждым из вышеназванных патологических состояний. С другой стороны, наличие выраженной эмфиземы легких у пациента с ХОЗЛ может затруднить идентификацию и оценку таких патогномоничных для ХСН объективных клинических признаков, как двусторонние влажные хрипы над нижними отделами легких, расширение перкуторных границ сердца и даже III протодиастолический тон [3, 6, 7]. Интересной и недостаточно освещенной проблемой является возможность гипердиагностики ХОЗЛ у пациентов, госпитализированных в связи с декомпенсированной ХСН на основании аускультативной картины бронхообструкции, обусловленной наружной компрессией бронхов, набуханием их слизистой и гиперреактивностью на фоне интерстициального отека легких [8, 9]. Подобного рода бронхообструкция является преходящим феноменом, исчезающим после стабилизации гемодинамики [8].
Отдельно следует рассмотреть природу и механизмы возникновения отеков при ХСН и ХОЗЛ. Если в подавляющем большинстве случаев ХСН отеки являются следствием бивентрикулярной дисфункции сердца и опосредуются цепью нейрогуморальных адаптивных реакций, возникающих в ответ на снижение сердечного выброса (рис. 1), то в качестве ведущих причин отеков при тяжелом ХОЗЛ в настоящее время рассматриваются такие механизмы, как гиперкапния и повышение внутригрудного давления [10]. Здесь необходимо отметить, что вопреки устоявшемуся мнению собственно правожелудочковая, объективизированная инструментальными методами исследования правых отделов сердца сердечная недостаточность (СН) является причиной отеков при ХОЗЛ не более чем в 0,2–0,5 % случаев, о чем свидетельствуют данные соответствующих обсервационных исследований [11, 12].
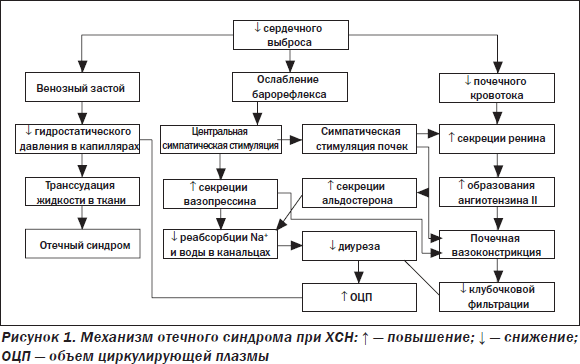
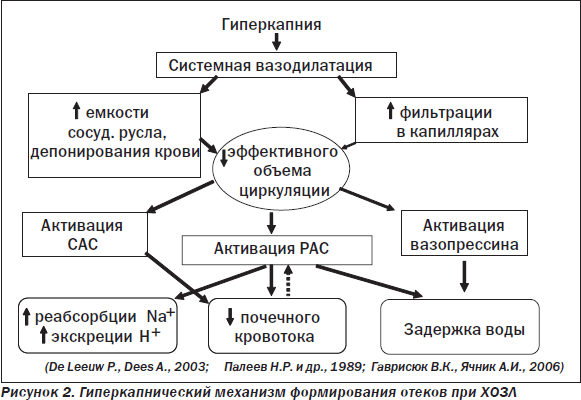
Гиперкапнический механизм формирования задержки жидкости при тяжелом ХОЗЛ, в основе которого лежит «мобилизационная» реакция нейрогормональных систем в ответ на снижение объема циркулирующей крови [13,14], схематически представлен на рис. 2. Не менее важным (а у многих пациентов с ХОЗЛ, возможно, играющим главную роль) механизмом циркуляторной недостаточности большого круга является ухудшение венозного возврата крови вследствие повышения внутригрудного давления. Как известно, в норме на вдохе создается отрицательное внутригрудное давление (минус 3–4 мм рт.ст.), что обеспечивает присасывающий эффект на венозные коллекторы и, соответственно, активный возврат крови к правым отделам сердца в фазу вдоха. При этом в фазе выдоха внутригрудное давление близко к нулю и возврат крови к сердцу обеспечивается за счет градиента давления между крупными венами и правым предсердием. Если у здоровых лиц длительность выдоха незначительно превышает длительность вдоха, то при выраженном ХОЗЛ — почти в 2,5 раза, в результате чего внутригрудное давление становится положительным (до 4–6 мм рт.ст.), что сопровождается резким ухудшением венозного возврата (снижение скорости кровотока по нижней и верхней полым венам более чем в три раза) и, соответственно, формированием венозной гипертензии в большом круге [10]. При клиническом обследовании больного с сочетанием ХСН и ХОЗЛ важно, базируясь на знании вышеизложенных особенностей, правильно оценить «вклад» каждого из названных патологических состояний в имеющуюся симптоматику, что способствует правильному формированию лечебной тактики уже на первых этапах курации пациента.
Особенности интерпретации данных инструментальных методов исследования
Хотя рентгенография грудной клетки остается стандартным диагностическим методом у пациентов и с ХСН, и с ХОЗЛ, сочетание вышеназванных состояний несколько ограничивает ее возможности. Так, выраженная эмфизема легких может затруднить оценку как кардиоторакального индекса, так и выраженности рентгенологических признаков легочного застоя [15].
Общеизвестно, что наличие ХОЗЛ уменьшает шансы на удовлетворительную визуализацию сердца эхокардиографическим методом, что находится в прямой зависимости с тяжестью данной патологии. Так, по данным различных обсервационных исследований, приемлемое «ультразвуковое окно» имеют 90 % пациентов с диагнозом ХОЗЛ, 65 % пациентов с ХОЗЛ III–IV ст. и лишь половина больных с клинически манифестированным тяжелым бронхообструктивным синдромом [16–18].
Судя по всему, роль определения циркулирующих натрийуретических пептидов (НУП) в дифференциальной диагностике и клинической оценке пациента с ХСН и ХОЗЛ является достаточно ограниченной. Известен алгоритм экспресс-диагностики СН на основании уровней в плазме мозгового НУП (BNP) либо аминотерминального фрагмента его предшественника (NT-pro-BNP) [19]. При этом, если низкие уровни BNP либо NT-pro-BNP исключают декомпенсированную или стабильно тяжелую стадию (III–IV ФК по NYHA), они не позволяют исключить ни ХОЗЛ, ни клинически компенсированную, правильно леченную ХСН. С другой стороны, высокий уровень НУП хотя и подтверждает наличие СН, не позволяет ни исключить, ни подтвердить сопутствующее ХОЗЛ. Кроме того, присутствует так называемая «серая» (неинформативная) зона значений НУП в достаточно широком диапазоне (100–400 пг/мл для BNP и 400–2000 пг/мл для NT-pro-BNP), не обладающая достаточной диагностической ценностью, однако могущая включать в себя достаточно большое число пациентов с сочетанием ХОЗЛ и ХСН [20].
В настоящее время золотым стандартом в объективизации состояния сердца у кардиологических пациентов с сопутствующим ХОЗЛ является магнитно-резонансная томография, позволяющая с высокой точностью и безопасностью для пациента оценивать объемы и фракции выброса левого и правого желудочков (ФВ ЛЖ и ПЖ), трансклапанные потоки, выраженность миокардиофиброза [21, 22].
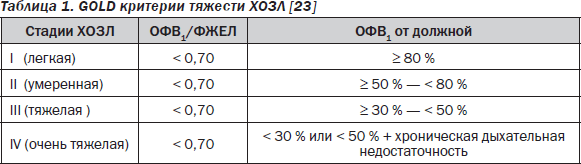
Исследование функции внешнего дыхания, выполняющее роль стандарта в объективизации и оценке степени тяжести ХОЗЛ [23] (табл. 1), имеет, тем не менее, диагностические ограничения при сочетании последней с СН. Как известно, практическая диагностика ХОЗЛ базируется на выявлении дыхательных нарушений обструктивного характера (величина объема форсированного выдоха за 1 с (ОФВ1), выраженная в процентах от должной), рестриктивного характера (так называемая форсированная жизненная емкость легких — ФЖЕЛ) и на соотношении типов вышеуказанных нарушений (отношение ОФВ1/ФЖЕЛ) (рис. 3), а также ОФВ1 может обратимо снижаться при декомпенсированной ХСН, отражая наличие феномена преходящей бронхообструкции у части пациентов с застойными явлениями в легких (см. выше). Наряду с этим отношение ОФВ1/ФЖЕЛ может обнаруживать нормальные значения при сочетании выраженного ХОЗЛ (обструктивный тип нарушений) с декомпенсированной ХСН, характеризующейся повышенной ригидностью легких в условиях их интерстициального отека (рестриктивный тип нарушения дыхательной функции) [3]. Из этого следует, что исследование функции внешнего дыхания у пациентов с ХСН до ликвидации застойных явлений в легких при подозрении на ХОЗЛ вряд ли целесообразно. Кроме того, важно понимать, что отношение ОФВ1/ФЖЕЛ может снижаться у лиц старше 75 лет без ХОЗЛ [24].
Качество жизни и особенности клинического прогноза
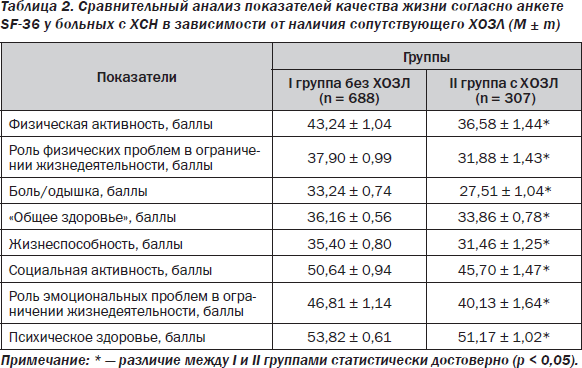
Наличие сопутствующего ХОЗЛ обусловливает худшие показатели качества жизни в сравнении с пациентами с ХСН без ХОЗЛ. Так, в выборке из 995 наблюдавшихся нами пациентов с клинически манифестированной ХСН (NYHA II–IV) наличие ХОЗЛ было сопряжено с высокодостоверно (p < 0,001) худшей величиной суммарного индекса качества жизни по специализированному Миннесотскому опроснику [25]. Анализ данных другой анкеты (SF-36) среди пациентов той же выборки показал, что наличие ХОЗЛ у них ассоциируется с достоверно более низкими, в сравнении с пациентами без ХОЗЛ, показателями всех 8 стандартных составляющих качества жизни, рассчитанных по соответствующим шкалам (табл. 2).
Наличие сопутствующего ХОЗЛ существенно отягощает клинический прогноз ХСН. Так, в группе из 1020 больных с ХСН, наблюдавшихся в одной из специализированных клиник сердечной недостаточности в Италии, смертность пациентов с наличием ХОЗЛ за 12 мес. наблюдения оказалась на 42 % выше (р = 0,01), а число госпитализаций в связи с клинической декомпенсацией за тот же период — на 35 % выше (р = 0,05), чем у пациентов без такового [26]. Анализ частоты и причин смертельных исходов в мегаисследовании (более 14 700 пациентов) VALIANT (валсартан против каптоприла после острого инфаркта миокарда — ИМ) показал, что при практически одинаковых средних величинах ФВ ЛЖ (34 и 35 %) пациенты с сопутствующим ХОЗЛ в сравнении с пациентами без такового характеризовались более высокими показателями смертности от любых причин (30 и 18 % соответственно), сердечно-сосудистой смертности (24 % против 16 %), внезапной смерти (10 % против 6 %). При этом частота приема бета-блокаторов (ББ) в группе пациентов с ХОЗЛ была существенно ниже — 51 % в сравнении с 72 % у пациентов без такового [27].
В качестве другой, кроме частого неназначения ББ, причины отягощения клинического прогноза пациентов с коронарогенной ХСН и сопутствующим ХОЗЛ можно рассматривать их более высокий исходный риск кардиоваскулярных осложнений. Так, согласно той же базе данных исследования VALIANT, они достоверно отличались в сравнении с пациентами без ХОЗЛ более высокой частотой инфаркта миокарда и инсульта в анамнезе, чаще имели стенокардию, дислипидемию, фибрилляцию предсердий, сахарный диабет, болезнь периферических артерий. Наиболее демонстративной оказалась разница в доле ранее куривших либо куривших на момент включения в испытание лиц: 83,2 % в группе пациентов с сопутствующим ХОЗЛ против 61,8 % среди пациентов без ХОЗЛ. При этом сам ИМ при наличии ХОЗЛ характеризовался более тяжелым течением, выразившимся в достоверно более частой встречаемости тяжелой левожелудочковой недостаточности (III–IV класс по Килип), рентгенологических признаков легочного застоя и более высокой частоте сердечных сокращений [27]. Концептуальное объяснение более серьезного кардиоваскулярного прогноза пациентов с сочетанием сердечно-сосудистой патологии (ИБС, артериальная гипертензия) с ХОЗЛ базируется на представлении о потенцировании у таких пациентов хронических системных воспалительных сдвигов, свойственных каждому из вышеуказанных заболеваний, следствиями которых являются оксидантный стресс, эндотелиальная дисфункция, повышение тромбогенного потенциала крови, интенсификация атерогенеза [27–29]. Для категории пациентов с ХСН и сопутствующим ХОЗЛ как актуальное следствие вышеуказанного потенцирования, кроме того, рассматривается апоптоз клеток миокарда и скелетных мышц наряду с выраженными нарушениями их энергетического обмена, усугубляющимися гипоксемией [30, 31].
Фармакотерапия
Клинические затруднения, могущие возникать при лечении пациентов с сочетанием ХСН и ХОЗЛ, можно условно разделить на 3 категории: 1) касающиеся назначения препаратов, используемых в лечении СН; 2) касающиеся назначения средств, направленных на лечение ХОЗЛ; 3) сопряженные с риском лекарственных взаимодействий.
Как известно, к современным стандартным средствам фармакотерапии ХСН относятся диуретики, ингибиторы ангиотензинпревращающего фермента (ИАПФ), блокаторы рецепторов ангиотензина II (БРА), бета-блокаторы, антагонисты альдостерона и дигоксин [19].
Применение диуретиков у больных с сочетанием ХСН и ХОЗЛ в целом не сопряжено с существенными дополнительными проблемами. Тем не менее, поскольку высокие дозы петлевых диуретиков могут вызывать метаболический алкалоз с последующим угнетением дыхательной функции, данный механизм может приобретать определенное клиническое значение у части пациентов с тяжелым ХОЗЛ [33]. Кроме того, форсированная диуретическая терапия может (по крайней мере, теоретически) способствовать увеличению вязкости мокроты [34].
Польза от назначения ингибиторов ренин-ангиотензиновой системы (РАС) у пациентов с сочетанием ХСН и ХОЗЛ расценивается как столь же несомненная, как и у больных с изолированной СН [6]. В связи с этим важно учитывать, что, во-первых, ИАПФ и БРА блокируют все РАС-обусловленные все механизмы задержки жидкости независимо от механизмов активации самой РАС, различающихся при ХСН и ХОЗЛ (см. выше); во-вторых, они снижают давление в легочных сосудах; в-третьих, улучшают газообмен через альволярную мембрану, и, наконец, замедляют процессы ремоделирования не только левого, но и правого желудочка [32–34]. Определенную проблему могут представлять сложности в клинической оценке кашля у больных с сочетанием ХСН и ХОЗЛ в случае приема ими ингибиторов АПФ. Как известно, сухой кашель, как обратимый побочный эффект ИАПФ, наблюдается, по различным данным, в 1–35 % случаев приема последних, связан с увеличением содержания в тканях бронхов прежде всего брадикинина и субстанции Р и не сопряжен с ухудшением проходимости бронхов [35]. Поэтому кашель, обусловленный ингибированием АПФ, является субъективным симптомом, не отражающим какую-либо серьезную патологию. Необходимо приложить все усилия для правильного дифференцирования природы кашля у таких пациентов, исходя из жизненной важности постоянного приема ИАПФ при ХСН, что и подчеркивается в действующих Национальных рекомендациях по лечению последней [36]. В затруднительных случаях оптимальным подходом является замена ИАПФ на БРА, лишенные вышеуказанного побочного эффекта.
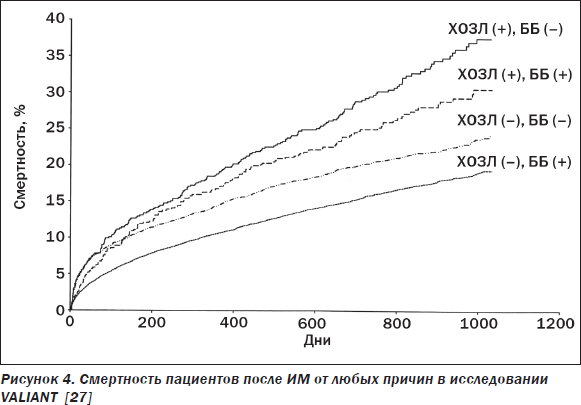
Как известно, доказанный в мультицентровых испытаниях выраженный «жизнепродлевающий» эффект длительного приема ББ у пациентов с ХСН сделал их, наряду с ИАПФ, базисным средством лечения таких пациентов. При этом если бронхиальная астма остается противопоказанием к назначению любого ББ, то назначение последних пациентам с ХСН и сопутствующим ХОЗЛ в настоящее время рекомендовано европейской группой экспертов по СН [19]. Наглядной иллюстрацией целесообразности длительного приема ББ постинфарктными больными с сопутствующим ХОЗЛ является субанализ ранее упоминавшегося мегаисследования VALIANT, согласно данным которого в течение в среднем 2-летнего наблюдения пациентов с ХОЗЛ (несмотря на их в целом худшую выживаемость в сравнении с пациентами без ХОЗЛ) наличие ББ в схеме лечения было сопряжено с более низкой смертностью (рис. 4).
Обобщение международного опыта приема ББ пациентами с ХСН, учитывающее данные как рандомизированных, так и обсервационных исследований, позволило вышеупомянутой экспертной группе ESC прийти к заключению о том, что большинство пациентов с сопутствующим ХОЗЛ могут адекватно переносить терапию ББ, рекомендованными для лечения ХСН (бисопролол, карведилол, метопролол CR/XL, небиволол), при условиях ее инициации с малой дозы и ступенчатого повышения; при этом специально оговаривается, что небольшое ухудшение дыхательной функции и симптоматики еще не должно обусловливать немедленную их отмену [19]. В разделе действующих рекомендаций ESC по лечению ХСН, посвященном пациентам с сопутствующей ХОЗЛ, говорится также о предпочтительности использования у них селективных ББ, что базируется как на общеизвестных данных об их клинической фармакодинамике, так и на благоприятных результатах специально выполненного в 2005 г. метаанализа безопасности селективных ББ при ХОЗЛ [37].
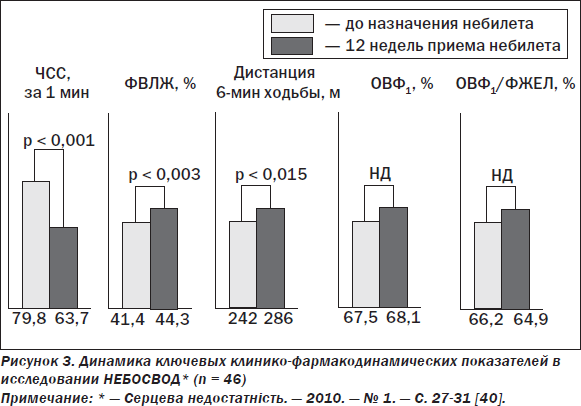
Известно, что среди всех ББ наибольшая β1-селективность свойственна небивололу, входящему в перечень ББ, ныне официально рекомендованных к применению при ХСН [19, 36]. В выполненном в 2002 г. пилотном исследовании было продемонстрировано отсутствие влияния небиволола в разовой дозе 5 мг на показатели бронхиальной проходимости у пациентов с артериальной гипертензией и сопутствующей бронхиальной астмой легкой и умеренной степени выраженности [38]. Имеются данные, что 6-месячный прием небиволола (при целевой дозе 5 мг) пациентами с ХСН и сопутствующим ХОЗЛ не сопровождается негативным влиянием на показатели функции внешнего дыхания [39]. В недавно завершившемся украинском кооперативном исследовании НЕБОСВОД, где небиволол (небилет) в рекомендованной целевой суточной дозе 10 мг (в среднем 7,3 мг) применялся в течение 12 недель у пациентов с ХСН и систолической дисфункцией ЛЖ с сопутствующим ХОЗЛ легкой — умеренной степени, в конце срока наблюдения также не наблюдали значимой динамики параметров функции внешнего дыхания наряду с достоверным возрастанием ФВ ЛЖ и дистанции 6-минутной ходьбы [40] (рис. 3). Приведенные данные свидетельствуют о безопасности применения небиволола при ХСН и сопутствующем (по крайней мере, легкой — умеренной степени) ХОЗЛ, что может быть особенно актуальным в популяции пациентов с ХСН пожилого и старческого возраста, характеризующейся возрастанием частоты ХОЗЛ.
К терапевтическим средствам, применяющимся для лечения ХОЗЛ, как известно, принадлежат β2-агонисты, глюкокортикоиды, пероральные ксантины и ингаляционные холинолитики [2].
Хорошо известными негативными факторами, сопутствующими клиническому использованию β2-агонистов, являются учащение сердечного ритма и проаритмогенный эффект, возрастание риска гипокалиемии и гипомагниемии и увеличение риска внезапной сердечной смерти [28, 44]. Кроме того, известно удлинение интервала QT на фоне приема сальметерола, в частности в сочетании с кетоназолом [44]. У пациентов с ХСН, нередко страдающих жизнеопасными нарушениями ритма сердца и характеризующихся высоким риском внезапной сердечной смерти, все вышеупомянутые эффекты являются весьма неблагоприятными. Клиническим подтверждением этому являются данные о повышении смертности и частоты госпитализаций у пациентов с дисфункцией ЛЖ, ассоциированные с приемом β2-агонистов короткого действия [41, 42].
По данным субанализа программы испытания кандесартана при ХСН — CHARM, охватившей 7599 пациентов, регулярное использование бронходилататоров ассоциировалось со статистически достоверным увеличением смертности от любых причин на 26 %, от сердечно-сосудистых — на 21 %, госпитализаций в связи с усугублением СН — на 49 % [43]. При этом остается неясным, в какой мере вышеуказанное отягощение клинического прогноза может быть обусловлено самим по себе негативным влиянием бронходилататоров, насколько — влиянием сопутствующего ХОЗЛ и в какой ме- ре — существенно меньшей частотой приема бета-блокаторов в означенной группе пациентов (32 % против 57 % среди пациентов, не использовавших бронхолитические средства, р < 0,0001). Так или иначе у пациентов с ХСН использование β2-агонистов допускается лишь при наличии безусловных к ним показаний и должно ограничиваться более безопасными [44] пролонгированными их формами (сальметерол, формотерол), при регулярном контроле ЧСС, ЭКГ и уровня К+ в плазме, а перед назначением сальметерола — и оценкой исходной продолжительности интервала QT.
Типичными негативными для больных с ХСН следствиями применения глюкокортикоидов являются задержка жидкости и увеличение риска гипокалиемии, в связи с чем показанная при сопутствующем ХОЗЛ терапия ими должна ограничиваться ингаляционными их формами, позволяющими избежать вышеозначенных системных эффектов.
Применение метилксантинов (теофиллин и его дериваты) сопряжено с активацией симпатоадреналовой системы и может так же, как и терапия β2-агонистами, сопровождаться учащением ритма, возрастанием эктопической активности миокарда и риска гипокалиемии [26, 45]. Другими недостатками этой группы препаратов при ХСН являются их печеночный метаболизм и усиление действия при совместном приеме с фуросемидом. В связи с этим не следует назначать их в качестве препаратов первой линии, сочетать с β2-агонистами, а лечение ими целесообразно осуществлять лишь в соответствии со строгими показаниями, в уменьшенных дозировках и с сопутствующим контролем клинической симптоматики, ЭКГ, электролитов плазмы и печеночных проб.
Применение современных комбинированных ингаляционных форм в настоящее время рассматривается как оптимальный подход у пациентов с ХОЗЛ и сопутствующей ХСН [45].
Говоря о проблеме лекарственных взаимодействий у обсуждаемой категории пациентов, целесообразно коснуться терапии непрямыми антикоагулянтами (антагонистами витамина К), показанной (прежде всего в связи с наличием фибрилляций предсердий) не менее чем трети таких больных. Как известно, особенности печеночного метаболизма варфарина обусловливают широкий спектр его лекарственных взаимодействий, в том числе усиление его действия при одновременном приеме ряда антибиотиков (цефалоспорины, макролиды). Поэтому у пациентов, принимающих варфарин, создается потенциальная опасность избыточной гипокоагуляции во время повторных курсов антибиотикотерапии, могущих проводиться в связи с обострением ХОЗЛ. Возможно, в подобных случаях с целью снижения риска кровотечений следует рекомендовать внеочередные определения международного нормализованного отношения с соответствующей, в случае необходимости, корректировкой дозы данного препарата.
В заключение отметим, что столь сложная и во многом пока не решенная проблема сочетания ХСН с ХОЗЛ, несомненно, требует не только обсервационных, но и соответствующих, специально спланированных рандомизированных исследований, в достаточной мере отражающих клинические особенности данного контингента пациентов.
1. Воронков Л.Г. Хронічна серцева недостатність // Настанова з кардіології / За ред. В.М. Коваленко. — Київ: Моріон, 2009. — С. 1232-1296.
2. Діагностика, клінічна класифікація та лікування хронічного обструктивного захворювання легень: Методичні рекомендації / Укл. Фещенко Ю.І., Яшина Л.О., Туманов А.М., Ігнатьє- ва В.І. — Київ, 2007. — 22 с.
3. Hawkins N.M., Petrie M.C., Jhund P.S. et al. Heart failure and chronic obstructive pulmonary disease: diagnostic pitfalls and epidemiology // Europ. J. Heart Failure. — 2009. — V. 11. — P. 130-139.
4. Havranek E.P., Masoudi F.A., Westfall K.A. et al. Spectrum of heart failure in older patients: Results from the National Heart Failure Project // Am. Heart J. — 2002. — V. 143. — P. 412-417.
5. Braunstein J.B., Anderson G.F., Gerstenblith G. et al. Noncardiac comorbidity increases preventable hospitalizations and mortality among medicare beneficiaries with chronic heart failure // J. Am. Coll. Cardial. — 2003. — V. 42. — P. 1226-1233.
6. Rutten F.H., Cramer M.-J.M. Lammers J.-W. et al. Heart failure and chronic obstructive pulmonary disease: An ignored combination ? // European J. Heart Failure. — 2006. — V. 8. — P. 706-711.
7. Remes J., Miettinen H., Reuna- nen A. et al. Validity of clinical diagnosis of heart failure in primary health care // Eur. Heart J. — 1991 — V. 12. — P. 315-321.
8. Light R.W., George R.B. Serial pulmonary function in patients with acute heart failure // Arch. Interm. Med. — 1983. — V. 143. — P. 429-433.
9. Anonymous. Cardiac asthma // Lancet. — 1990. — V. 335. — P. 693-694.
10. Гаврисюк В.К., Ячник А.И. Вопросы практического применения классификации недостаточности кровообращения при заболевании легких // Укр. кардіол. журнал. — 2006. — № 1. — C. 9-13.
11. Rutten H.F., Cramer M.J., Grobbee D.E. et al. Unrecognized heart failure in elderly patients with stable chronic obstructive pulmonary disease // Eur. Heart J. — 2005. — V. 26. — P. 1887-1894.
12. Naeije R. Pulmonary hypertension and right heart failure in chronic obstructive pulmonary disease // Proc. Am. Thorac. Soc. — 2005. — V. 2. — P. 20-22.
13. Palange P. Renal and hormonal abnormalities in chronic obstructive pulmonary disease (COPD) // Thorax. — 1998. — V. 53. — P. 989-991.
14. De Leeuw P.W., Dees A. Fluid homeostasis in chronic obstructive lung disease // Eur. Respir. J. — 2003. — V. 22(Suppl. 46). — P. 33-40.
15. Gechlbach B.K., Geppert E. The pulmonary manifestations of heart failure // Chest. — 2004. — V. 125. — P. 669-682.
16. Rutten F.H., Moons K.G., Cramer M.J. et al. Recognising heart failure in eiderly patients with stable chronic obstructive pulmonary disease in primary care: cross sectional diagnostic study // Br. Med. J. — 2005. — V. 331. — P. 1379.
17. Boussuges A., Pinet C., Molenat F. et al. Left atrial and ventricular filling in chronic obstructive pulmonary disease. An echocardiographic and Doppler study // Am. J. Respir. Crit.Care. Med. — 2000. — V. 162. — P. 670-675.
18. Vizza C.D., Lynch J.P., Ochoa L.L. et al. Rigt and left ventricular dysfunction in patients with severe pulmonary disease // Chest. — 1998. — V. 113. — P. 576-583.
19. Dickstein K., Cohen-Solal A., Filipatos G. et al. Authors/Task Force Members: ECS Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008 // Europ. J. Heart Failure. — 2008. — V. 10. — P. 933-989.
20. Silver M.A., Maisel A., Yancy C.W. et al. BNP Consensus Panel 2004: A clinical approach for the diagnostic, prognostic, screening, treatment monitoring and therapeutic roles of natriuretic peptides in cardiovascular diseases // Congest. Heart Failure. — 2004. — V. 10(suppl. 53). — P. 1-30.
21. Marcu C.B., Beek A.M. van Rossum A.C. Cardiovascular magnetic resonance imaging for the assessment of right heart involvement in cardiac and pulmonary disease // Heart Lung Circ. — 2006. — V. 15. — P. 362-370.
22. Hendel R.C., Patel M.R., Kramer C.M. et al. ACCF/ACR/SCCT/SCMR/ /ASNC/NASCI/SCAI/SIR 2006 appropriateness criteria for cardiac computed tomography and cardiac magnetic resonance imaging: a report // J. Am. Coll. Cardiol. — 2006. — V. 48. — P. 1475-1497.
23. Gold Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management and prevention of chronic obstructive pulmonary disease // NHLBI/WHO workshop report. 2006; Updated 2006 http: //www. goldcopt.com/.
24. Hardie J.A., Buist A.S., Voll- mer W.M. et al. Risk of overdiagnosis of COPD in asymptomatic elderly never-smokers // Eur. Respir. J. — 2002. — V. 20. — P. 1117-1122.
25. Ворнков Л.Г., Паращенюк Л.П., Яновський Г.В. та ін. Стан якості життя хворих з хронічною серцевою недостатністю залежно від основних показників демографічних та клініко-інструментальних досліджень // Кровообіг та гемостаз. — 2008. — № 4. — C. 52-56.
26. Macchia A., Monte S., Romero M. et al. The prognostic influence of chronic obstructive pulmonary disease in patients hospitalised for chronic heart failure // Eur. J. Heart Failure. — 2007. — V. 9. — P. 942-948.
27. Hawkins N.M., Huang Z., Pie- per K.S. et al. Chronic obstructive pulmonary disease is an independent predictor of death but not atherosclerotic events in patients with myocardial infarction: analysis of the Valsartan in Acute Myocardial Infarction Trial (VALIANT) // Eur. J. Heart Failure. — 2009. — V. 11. — P. 292-298.
28. Задионченко В.С., Адаше- ва Т.В., Мациевич М.В. Артериальная гипертония и хроническая обструктивная болезнь легких. — М., 2009. — 40 с.
29. Maclay J.D., McAllister D.A., MacNee W. Cardiovascular risk in chronic obstructive pulmonary disease // Respirology. — 2007. — V. 12. — P. 634-641.
30. Березин А.Е. Хроническая обструктивная болезнь легких и кардиоваскулярный риск // Укр. мед. часопис. — 2009. — № 2(70). — C. 62-68.
31. Le Jemtel T.H., Padelettti M., Jelic S. Diagnostic and therapeutic challenges in patients with coexistent chronic obstructive pulmonary disease and chronic heart failure // J. Am. Сoll. Сardiol. — 2007. — V. 49(2). — P. 171-180.
32. Forth R., Montgomery H. ACE in COPD: a therapeutic target? // Thorax. — 2003. — V. 58. — P. 556-558.
33. Guazzi M. Alveloar-capillary membrane dysfunction in heart failure: evidence of a parthophysiologic role // Chest. — 2003. — V. 124. — P. 1090-1102.
34. Цветкова О.А. Лечение легочного сердца у больных ХОЗЛ в сочетании с ИБС // Рус. мед. журн. — 2005. — Т. 13, № 7. — С. 425-427.
35. Dicpinigaitis P.V. Angiotensin-converting enzyme inhibitor-induced cough: ACCP evidence-based clinical practice guidelines // Chest. — 2006. — V. 129(I Suppl.). — 169S-173S.
36. Воронков Л.Г., Амосова К.М., Багрій А.Е. та ін. Рекомендації Асоціації кардіологів України з діагностики, лікування та профілактики хронічної серцевої недостатності у дорослих (2009). — Київ, 2009. — 23 с.
37. Salpeter S.R., Salpeter E.E. Cardiovascular effects of β-agonists in patients with astma and COPD: a meta-analysis // Chest. — 2004. — V. 125. — P. 2309-2321.
38. Dal Negro R.W., Tognella S., Micheletto C. Pharmacokinetics of the effect of nebivolol 5 mg on airmay patency in patients with mild to moderate bronchial astma and arterial hypertension / A randomized, placebo-controlled study // Clin. Drug. Invest. — 2002. — V. 22(3). — P. 197-204.
39. Евдокимова А.Г., Радзевич А.Э., Терещенко О.И. и др. Опыт применения небиволола в комплексной терапии хронической сердечной недостаточности у больных ишемической болезнью сердца в сочетании с хронической обструктивной болезнью легких // Росс. кардиол. журнал. — 2007. — № 1(63). — C. 41-44.
40. Воронков Л.Г., Перцева Т.А., Василенко А.М., Волков В.И., Серкова В.К., Стасюк Л.Б. Дизайн и предварительные результаты украинского кооперативного исследования НЕБОСВОД // Серцева недостатність. — 2010. — № 1. — В печати.
41. Au D.H., Udris E.M., Fan V.S. et al. Risk of mortality and heart failure exacerbations associated with inhaled beta-adrenoceptor agonists among patients with known left ventricular systolic dysfunction // Chest. — 2003. — V. 123. — P. 1964-169.
42. Hirono O., Minamihaba O. et al. Left ventricular diastolic dysfunction in patients with bronchial astma with long-term oral beta 2-adrenoceptor agonists // Am. Heart J. — 2001. — V. 142. — E 11.
43. Hawkins N.M., Wang D., Petrie M.C. et al. Baseline characteristics and outcomes of patients with heart failure receiving bronchodilators in the CHARM programme // Europ. J. Heart Failure. — 2010. — V. 12. — P. 557-565.
44. Cazzola M., Imperatore F., Salzillo A. et al. Cardiac effects of formoterol and salmeterol in patients suffering from COPD with preexisting cardiac arrhytmias and hypoxemia // Chest. — 1998. — V. 114. — P. 411-415.
45. Чучалин А.Г. Хроническая обструктивная болезнь легких и сопутствующие заболевания // Здоров я України. — 2010. — № 2. — C. 26-27.
