Газета «Новости медицины и фармации» Кардиология (338) 2010 (тематический номер)
Вернуться к номеру
Інгібітори ангіотензинперетворювального ферменту. сучасні погляди
Авторы: В.К. Тащук, Зав. кафедри внутрішньої медицини, фізичної реабілітації, та спортивної медицини Буковинського державного медичного університету, м. Чернівці
Версия для печати
Сучасні підходи до лікування гіпертонічної хвороби, порушень мозкового кровообігу, запобігання розвитку інфаркту міокарда, раптової серцевої смерті, серцевої й ниркової недостатності, оптимізації віддаленого прогнозу, у тому числі в умовах супутнього цукрового діабету, зумовлюють використання інгібіторів ангіотензинперетворювального ферменту (іАПФ) — сучасного та високоефективного антигіпертензивного, антиремоделюючого засобу.
Концепція факторів ризику і кінцевих точок у вигляді кардіоваскулярного континууму (від лат. continuum — безперервне, суцільне), ставлення до лікування згідно з «комплайєнсом» і «адгиренсом» (від англ. сompliance/adherence — згода або прихильність) щільно увійшли до практики кардіологів і асоціюються з лікуванням гіпертонічної хвороби, профілактикою ремоделювання лівого шлуночка після інфаркту міокарда, впливом на якість життя і клас стабільної стенокардії, профілактикою розвитку інсульту, а в кінцевому результаті — запобіганням серцево-судинній смерті [3].
Переконливо доведений зв’язок кардіоваскулярної патології з гіперхолестеринемією або збільшенням холестерину ліпопротеїнів низької щільності, низьким рівнем холестерину ліпопротеїнів високої щільності, надлишкового вмісту тригліцеридів, курінням, цукровим діабетом і маркерами ризику серцево-судинних захворювань (С-реактивного протеїну, гомоцистеїну, неоптерину, матриксних металопротеїназ) [13], медіаторами пошкодження ендотелію (гіперхолестеринемія, гіпергомоцистеїнемія, продукція цитокінів — інтерлейкін-1-бета, туморнекротичний фактор альфа, інтерлейкін-8) [9], факторами тромбогенності (фактор Віллебранда, інгібітор активації плазміногену 1-го і 2-го типів) [8] і атромбогенності (оксид азоту, тканинний активатор плазміногену, тромбомодулін) [14] судинної стінки та регуляції її тонусу (ендотелін, оксид азоту, простациклін) [7] і росту (фактор росту фібробластів/васкулярного ендотелію), адгезії лейкоцитів (Р-селектин, Е-селектин, молекули міжклітинної адгезії 1-го типу, васкулярно-клітинних адгезивних молекул) [5], маркерами серцевої недостатності (передсердний і мозковий натрійуретичний пептид) [14], маркерами пресорної ланки (катехоламіни, ангіотензин II, альдостерон, вазопресин, система ендотелінів, фактор росту, аргінін-вазопресин, система цитокінів, інгібітор активатора плазміногену) і депресорної ланки (система натрійуретичних пептидів, простацикліну, брадикініну, тканинного активатора плазміногену, монооксиду азоту, адреномедуліну) та інших гормонів, нейромесенджерів та трансмітерів.
Початковим у лікуванні всіх цих хворих визнано антитромбоцитарні, атиагрегантні, антикоагулянтні препарати, статини і в першу чергу інгібітори 3-гідрокси-3-метилглутарил-коензим-А-редуктази, бета-адреноблокатори, антагоністи кальцію, нітрати пролонгованої дії, діуретики, антагоністи альдостерону й багато інших сучасних медикаментозних засобів.
Домінантним є перегляд лікування, спрямованого на купірування симптомів, зокрема для гіпертонічної хвороби відповідно до міжнародних досліджень замість винятково зниження артеріального тиску перевага надається запобіганню ускладнень і впливу на так звані кінцеві точки, (для гіпертонічної хвороби це розвиток інфаркту/інсульту) [2, 4].
Таким чином, кінцева мета лікування кардіоваскулярної патології полягає в запобіганні розвитку інфаркту міокарда, раптової серцевої смерті, серцевої й ниркової недостатності, порушень мозкового кровообігу, оптимізації віддаленого прогнозу, впливу на фактори первинної та вторинної профілактики, модифікації ризику і способу життя, у тому числі в умовах супутнього цукрового діабету, що реалізується на тлі мінімальної кількості препаратів в ідеальних терапевтичних дозах відповідно до рекомендацій і результатів довгострокових досліджень, з позицій доказової медицини. Сучасним напрямом такого лікування стало вивчення можливих плейотропних (грець. pleion «численніший» + tropos «напрям», тобто множинних) ефектів цих препаратів.
Чи досяжно це?
У 1935 році група Eduardo Mendez (Mecical School of Buenos Aires University) і група Irving Page (Індіанаполіс, Eli-Lilly Laboratories) в умовах передавлювання ниркової артерії виділили з екстракту нирки, надалі і з ниркової артерії, пресорний агент (Аргентина — «ангіотонін», США — «гіпертензин», у подальшому «ангіотензин»), що має ренін-подібний ефект з іншою хімічною структурою. Отже, ренін впливає на циркулюючий у крові протеїн та справляє ензиматичну дію, активує його й перетворює на гіпертензивний модулятор [1, 11]. Формування «ери РААС», або ренін-ангіотензин-альдостеронової системи, вимагало відкриття M. Gross (1958) про збільшення вироблення альдостерону під впливом ангіотензину II і, як наслідок, появи препарату, що міг би вплинути на виявлену послідовність подій. Видозмінена парентеральна форма ангіотензину II саралазин (D. Pals і співавт., 1971) мала короткий період дії, недостатньо ефективна для лікування гіпертензії. Вдалим слід визнати дослідження отрути змії Bothrops Jararaca, проведене бразильським дослідником S. Ferreiro на початку 60-х рр. ХХ ст., що пояснює гіпотензивний вплив укусу змії «брадикінін-потенціюючою» дією. Дослідник виділив фактор перетворення ангіотензину I в активну форму, що демонструє гіпертензивний ефект ангіотензину II. Власне на підставі цих досліджень у 1975 р. був синтезований перший інгібітор ангіотензинперетворювального ферменту — каптоприл, застосований у клінічній практиці в 1979 р.
У 1980 р. в лабораторії Merck Sharp & Dohme синтезовано ще два трипептиди, аналогічні каптоприлу за дією, що не містять SH-групу, — еналаприл і лізиноприл, а в лабораторії Squibb з’являється фозиноприл, далі настає ера випуску на ринок нових поєднань іАПФ й оцінки ефективності препаратів за використання доказової медицини. Початкові дослідження на кшталт THOMS не довели суттєвих переваг ацебуталолу, амлодипіну, доксазозину, еналаприлу, окрім зниження маси міокарда лівого шлуночка при використанні діуретика хлорталідону [4]. Наступне дослідження STOP-2 з зіставлення атенололу, метопрололу, піндололу у поєднанні з гіпотіазидом або амілоридом проти еналаприлу/лізиноприлу у комбінації з фелодипіном/ісрадипіном було без істотних змін кінцевої точки. Дослідження CAPPP продемонструвало вірогідну ефективність каптоприлу, як і бета-адреноблокатора і тіазидового діуретика, більше виражену щодо випадків цукрового діабету. У дослідженнях EUCLID (лізиноприл), REIN і MICROHOPE (раміприл) виявлений ренопротективний ефект іАПФ.
Оцінка ефективності іАПФ у тому числі залежала від дизайну дослідження. Так, у дослідженні ALLHAT виявилось, що застосування лізиноприлу менш ефективне у зниженні систолічного артеріального тиску, ніж хлорталідону, в осіб африканської раси, тоді як у білих пацієнтів відмінностей між хлорталідоном і лізиноприлом виявлено не було.
Ціла серія досліджень (AIRE, SMILE, TRACE, GISSI-3, ISIS-4, SAVE, CONSENSUS II) показала високу ефективність застосування іАПФ при інфаркті міокарда й лівошлуночковій дисфункції, для профілактики серцевої недостатності у хворих із перенесеним інфарктом міокарда. В них доведено, що додавання до лікування іАПФ залежно/незалежно від артеріальної гіпертензії вірогідно знижує ризик смерті, ризик розвитку серцевої недостатності або необхідності госпіталізації з приводу хронічної серцевої недостатності (краще в комбінації з індапамідом — статистична значущість відмінностей досягалася, в тому числі, таким шляхом). Зниження ризику інсульту зареєстроване в дослідженні PROGRESS (периндоприл), також підтверджена доцільність індапаміду. Висока ефективність іАПФ зареєстрована в дослідженнях HOPE (раміприл) і EUROPA (периндоприл).
Відповідно до результатів HOPE при використанні раміприлу вдалося показати суттєвий вплив на первинну (інфаркт міокарда, інсульт, кардіоваскулярна і некардіоваскулярна смерть, загальна смертність) і вторинну (реваскуляризація, ускладнення цукрового діабету, сердечна недостатність і нею обумовлена госпіталізація, нові випадки цукрового діабету) кінцеві точки, а отже, істотно поповнити доказову базу використання іАПФ (рис. 1) [2].
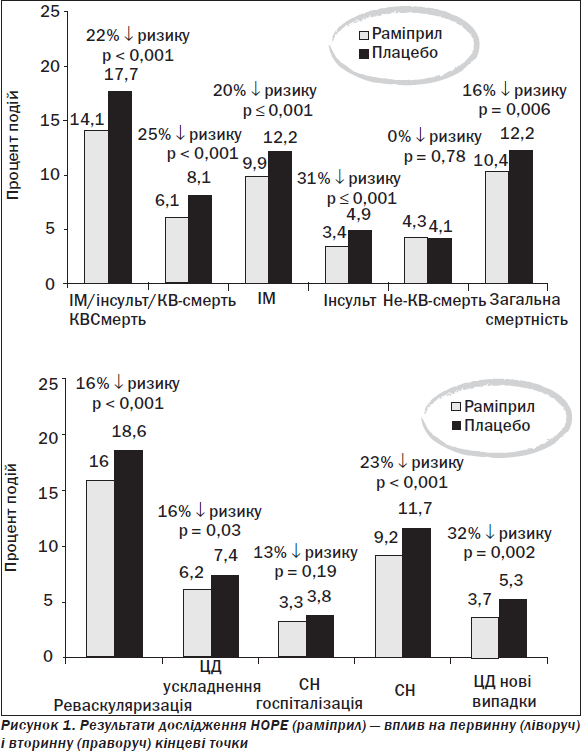
Як же співвідносяться дослідження HOPE і EUROPA?
У EUROPA було більше пацієнтів (12 236 проти 9297), вік різний у ранжуванні (60 (24–90) проти 66 (> 55) рр.), більше повторних інфарктів (65 проти 55 %), більше реваскуляризацій (55 проти 44 %), зате менше випадків периферичної судинної патології (7 проти 43 %), в усіх хворих у дослідженні EUROPA спостерігалася коронарна хвороба серця (100 проти 81 %), менше випадків артеріальної гіпертензії (27 проти 47 %) і відповідно інсультів (3 проти 11 %), менше випадків цукрового діабету (12 проти 39 %), частіше реєструвалося сучасне лікування з переважанням аспірину (91 проти 76 %), статинів (69 проти 29 %), бета-адреноблокаторів (63 проти 39 %).
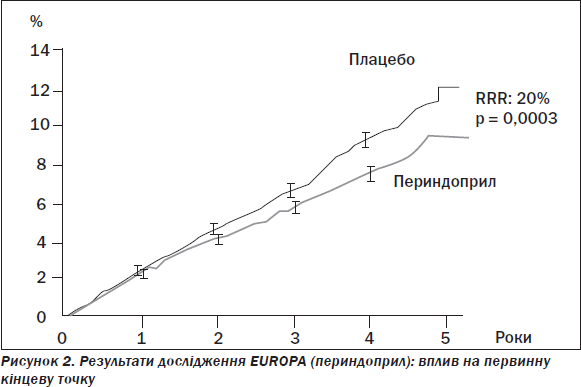
Як наведено на рис. 2, результати дослідження EUROPA показали в умовах сучасної терапії з більшою кількістю призначень аспірину, статинів, бета-адреноблокаторів, що застосування периндоприлу надає можливість зниження відносного ризику на 20 % (р = 0,0003), а отже, підкреслює високу ефективність іАПФ [2].
У сьогоденному арсеналі лікарської допомоги кардіологічному хворому в Україні широко використовуються такі препарати групи іАПФ:
1. Каптоприл* 25–50 мг 3 р/д.
2. Еналаприл* 5 мг 2 р/д (Берліприл® (Berlin-Chemie), Едніт (Gedeon Richter), Енам (Dr. Reddy’s) Енап® (KRKA), Енафрил (Концерн «Стирол»), Еналозид/Моно, (Фармак»), Ренітек® (Merck Sharp & Dohme) 5–10–20 мг 1–2 р/д; 1 мл Енапу (1,25 мг еналаприлату) може бути введений внутрішньовенно в 30–50 мл ізотонічного розчину натрію хлориду або 5% глюкози кожні 6 год. Час досягнення зниження артеріального тиску — 5–15 хв.
3. Лізиноприл* (Диротон (Gedeon Riсhter), Лізиноприл-ratiofarm, ЛізиГексал (Sandoz), Вітоприл (Stada), Лоприл (Bosnalijek) — 5–10–20 мг 1 р/д).
4. Раміприл* (Тритаце (Sanofi-Aventis), РаміГексал (Sandoz), Хартил (Egis), Амприл (KRKA), Полаприл (PolPharma)) 2,5–5–10 мг 1–2 р/д.
5. Спіраприл (Квадроприл (АWD.pharmа) 6 мг 1 р/д.
6. Квінаприл (Аккупро Pfizer, Квінард Actavis) 5–10–20 мг 1 р/д.
7. Моексиприл (Моекс®, Schwarz Pharma) 7,5–15 мг 1 р/д.
8. Периндоприл (Престаріум (Servier), Пренесса (Prenessa, KRKA) 4–8 мг 1 р/д.
9. Трандолаприл* (Гоптен (Ebbot), трандолаприл-ratiofarm) — 2 мг 1 р/д).
10. Зофеноприл — Зокардис® (Berlin-Chemie) 7,5–30 мг 1 р/д.
Також широко використовують комбінацію іАПФ із діуретиком — переважно гідрохлортіазидом або індапамідом.
1. Аккузид (Pfizer, Квінаприл 10 мг + Гідрохлоротіазид 12,5 мг).
2. Амприл HL/HD (KRKA, Раміприл 2,5/5 мг + Гідрохлоротіазид 12,5/25 мг).
3. ЕнаГЕКСАЛ композитум (Sandoz, Еналаприл 10 мг + Гідрохлоротіазид 25 мг).
4. Еналозид (Фармак, Еналаприл 10 мг + Гідрохлоротіазид 25 мг).
5. Енап Н/HL/20HL (KRKA, Еналаприл 10/10/20 мг + Гідрохлоротіазид 25/12,5/12,5 мг).
6. Ензикс дуо (Stada, Еналаприл + Індапамід 10/2,5 мг, дуо форте 20/2,5 мг).
7. Ко-Диротон (Gedeon Richter, Лізиноприл 10/20 мг + Гідрохлоротіазид 12,5 мг).
8. Ко-Пренесса (KRKA, Периндоприл 4 мг + Індапамід 1,25 мг).
9. Лізоретик (IPCA, складові — Лізиноприл 10/20 мг + Гідрохлоротіазид 12,5 мг).
10. Ноліпрел/форте (Servier, Периндоприл 2,5/5 мг + Індапамід 0,625/ 1,25 мг).
І ще більш оригінальні комбінації, що використовують іАПФ як складову та дозволені в Україні:
1. Екватор (Gedeon Richter, Амлодипін 5 мг + Лізиноприл 10 мг).
2. Гіприл-А плюс (Micro Labs, Амлодипін 5 мг + Лізиноприл 10 мг).
3. Рамі-Азомекс (Actavis, S-Амлодипін 2,5/5 мг + Раміприл 2,5/10 мг).
4. Тарка (Abbot, Трандолаприл 2 мг + Верапаміл CR 180 мг).
Вочевидь, дослідження, що проводяться з множинною таблеткою (Polycap/Polypill), згідно з дослідженням The Indian Polycap Study (TIPS), хоча і викликають певні сумніви своєю багатоваріантністю в одному з двох складових «поліпіл» (ацетилсаліцилова кислота (100 мг), раміприл (5 мг), симвастатин (20 мг), атенолол (50 мг), гідрохлортіазид (12,5 мг) або ацетилсаліцилова кислота (100 мг), еналаприл (5 мг), симвастатин (20 мг), атенолол (50 мг), гідрохлортіазид (12,5 мг), фолієва кислота), але мають певні перспективи з точки зору фармакологічних підходів [6, 12]. Відмінності, запропоновані в цих двох медикаментах, пов’язані з різними іАПФ (раміприл/еналаприл) і додаванням фолієвої кислоти з її антигіпергомоцистеїновим механізмом, що є суперечливим [10]. Проте майбутнє доведе, наскільки такі складні препарати будуть ефективні.
Останнім обговорюваним питанням слід визнати можливість негативних ефектів іАПФ (кашель — мінімальні побічні прояви у фозиноприлу) і комбінацію іАПФ з блокаторами рецепторів ангіотензину, які є доцільними при непереносимості іАПФ (у тому числі при кашлі), неефективності іАПФ (хімазний шунт) і визнані можливими до комбінованого використання.
1. Верткин А.Л., Талибов О.Б. Ингибиторы АПФ — от тепротида к фозиноприлу // Трудный пациент. — 2007. — 3. — Електронний ресурс. Режим доступу: http://t-pacient.ru/archive/tp3-2007/tp3-2007_283.html
2. Mancia G., De Backer G., Dominiczak A. et al. 2007 Guidelines for the management of arterial hypertension: The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // Eur. Heart J. — 2007. — Vol. 28, № 12. — P. 1462-1536.
3. Mazzaglia G., Ambrosioni E., Alacqua M. et al. Adherence to Antihypertensive Medications and Cardiovascular Morbidity Among Newly Diagnosed Hypertensive Patients // Circulation. — 2009. — Vol. 120, № 16. — P. 1598-1605.
4. Sever P.S., Poulter N.R., El- liott W.J. et al. Blood pressure reduction is not the only determinant of outcome // Circulation. — 2006. — Vol. 113, № 23. — P. 2754-2772.
5. O’Malley T., Ludlam C.A., Riemermsa R.A., Fox K.A. Early increase in levels of soluble inter-cellular adhesion molecule-1 (sICAM-1); potential risk factor for the acute coronary syndromes // Eur. Heart J. — 2001. — Vol. 22, № 14. — P. 1226-1234.
6. Yusuf S., Pais P., Afzal R. et al. Effects of a polypill (Polycap) on risk factors in middle-aged individuals without cardiovascular disease (TIPS): a phase II, double-blind, randomised trial // Lancet. — 2009. — Vol. 373, № 9672. — P. 1341-1351.
7. Eitel I., Nowak M., Stehl C. et al. Endothelin-1 release in acute myocardial infarction as a predictor of long-term prognosis and no-reflow assessed by contrast-enhanced magnetic resonance imaging // Am. Heart J. — 2010. — Vol. 159, № 5. — P. 882-890.
8. Wieberdink R.G., van Schie M.C., Koudstaal P.J. et al. High von Willebrand factor levels increase the risk of stroke: the Rotterdam study // Stroke. — 2010. — Vol. 41, № 10. — 2151-2156.
9. Rodondi N., Marques-Vidal P., Butler J. et al. Markers of atherosclerosis and inflammation for prediction of coronary heart disease in older adults // Am. J. Epidemiol. — 2010. — Vol. 171, № 5. — P. 540-549.
10. Bleie О., Semb A.G., Grundt H. et al. Homocysteine-lowering therapy does not affect inflammatory markers of atherosclerosis in patients with stable coronary artery disease // J. Intern. Med. — 2007. — Vol. 262, № 2. — P. 244-253.
11. Page I.H. Hypertension research. A memoir 1920–1960 // Hypertension. — 1990. — Vol. 15. — P. 117-118.
12. Patel A., Shah T., Shah G. et al. Preservation of bioavailability of ingredients and lack of drug-drug interactions in a novel five-ingredient polypill (polycap): a five-arm phase I crossover trial in healthy volunteers // Am. J. Cardiovasc. Drugs. — 2010. — Vol. 10, № 2. — P. 95-103.
13. van Haelst P.L., van Door- maal J.J., May J.F. et al. Secondary prevention with fluvastatin decreases levels of adhesion molecules, neopterin and C-reactive protein // Eur. J. Intern. Med. — 2001. — Vol. 12, № 6. — P. 503-509.
14. Kimura K., Shibazaki K., Iguchi Y. et al. The combination of elevated BNP and AF as a predictor of no early recanalization after IV-t-PA in acute ischemic stroke // J. Neurol. Sci. — 2010. — Vol. 290, № 1–2. — P. 37-40.
