Газета «Новости медицины и фармации» Пульмонология (344) 2010 (тематический номер)
Вернуться к номеру
О выборе антибиотика для лечения постгриппозной бактериальной пневмонии
Авторы: Н.А. Вознесенский, НИИ пульмонологии ФМБА России, г. Москва
Версия для печати
В обзоре рассматриваются особенности действия различных антибиотиков при постгриппозной бактериальной пневмонии. Данные экспериментальных работ показывают, что быстрое бактерицидное действие β-лактамных антибиотиков при пневмококковой постгриппозной пневмонии вызывает бурный воспалительный ответ, который может ухудшать прогноз. Антибиотики с нелитическим действием, тормозящие синтез белка (клиндамицин и азитромицин), могут обладать преимуществом перед β-лактамами. В клинических исследованиях показано снижение летальности у больных пневмококковой и другой внебольничной пневмонией при добавлении макролидов к β-лактамам по сравнению с монотерапией последними.
О значимости бактериальных осложнений гриппа говорит тот факт, что грипп и пневмония занимают седьмое место среди всех причин смертности населения в США, а у детей — пятое место [1]. Возбудителями вторичных бактериальных инфекций при гриппе чаще всего становятся Streptococcus pneumoniae и Staphylococcus aureus. Пневмококк особенно часто поражает маленьких детей, вызывая средний отит, синусит и пневмонию, а также пожилых людей, у которых этот возбудитель вызывает пневмонию [2]. Во время сезонных эпидемий гриппа пневмококковые инфекции становятся одной из важнейших причин смерти пожилых людей с хронической сердечно-сосудистой или легочной патологией. По данным ретроспективного анализа данных аутопсий, проведенных во время пандемии гриппа 1918 г. (печально знаменитой «испанки»), 93 % всех фатальных пневмоний имели бактериальную этиологию [3]. Высокая частота бактериальных осложнений характерна и для сезонных вспышек гриппа, и тем более — для высокопатогенных штаммов вируса гриппа, вызывающих пандемии.
Известно, что вторичная бактериальная пневмония, осложнившая течение гриппа, труднее поддается терапии, чем первичная пневмония (у исходно здорового человека). Среди объяснений этого факта — суммация эффектов двух заболеваний, более тяжелое течение пневмонии с большей частотой бактериемии и поражений плевры, а также состояние макроорганизма: безусловно, пожилой человек, ослабленный тяжелой болезнью, обладает меньшими резервами для борьбы с бактериальной пневмонией [4].
Более тяжелое течение бактериальной пневмонии на фоне гриппа обусловлено не только вирусным повреждением эпителия дыхательных путей, которое облегчает проникновение бактерий в слизистую оболочку. Вирус гриппа усиливает экспрессию молекул адгезии для бактерий на эпителиальных клетках и вызывает апоптоз ключевых защитных клеток — альвеолярных макрофагов и нейтрофилов, причем подвергшиеся апоптозу макрофаги оказывают иммуносупрессивное действие [5]. В повышении восприимчивости к бактериальной инфекции определенную роль играет и интерферон γ, подавляющий активность макрофагов против бактерий [6]. Повреждение эпителия и макрофагов сопровождается уменьшением синтеза ими антимикробных пептидов, ведет к нарушениям цитокинового профиля и способствует бактериальной диссеминации.
В серии экспериментов на животных моделях J.A. McCullers et al. показали, что вирус гриппа способствует развитию пневмококковой пневмонии, ускоряет ее прогрессирование, предрасполагает к бактериемии и многодолевому поражению легких [5, 7–10]. Кроме того, при взаимодействии этих двух возбудителей нарастают титры вируса гриппа в легких, а также утяжеляются патологические характеристики пневмонии: увеличивается число некрозов в дыхательных путях, нарастают воспалительные изменения и отложение фибрина. Выявлено два специфических механизма такого влияния: сиалидазная активность нейраминидазы и провоспалительный эффект вирусного протеина PB1-F2 [9, 10]. Белок PB1-F2 может объяснять исключительную патогенность экспрессирующего его пандемического штамма «испанки» 1918 г. В результате генно-инженерного внедрения PB1-F2 лабораторный штамм гриппа стал более вирулентным, вызывал более выраженный воспалительный ответ в легких и в большей мере способствовал развитию бактериальной пневмонии.
С открытия пенициллина и до настоящего времени β-лактамные антибиотики служат препаратами выбора при пневмококковой пневмонии. Поскольку целью антибактериальной терапии считается максимально быстрая эрадикация возбудителя, то предпочтение отдается бактерицидным антибиотикам. Американское общество по инфекционным заболеваниям (Infectious Diseases Society of America — IDSA) и Американское торакальное общество (American Thoracic Society — ATS) дают следующие совместные рекомендации по лечению внебольничной пневмонии у взрослых [11]. При лечении в амбулаторных условиях у исходно здоровых людей без факторов риска наличия резистентных пневмококков препаратами выбора служат макролиды (азитромицин, кларитромицин и др.). У пациентов с серьезными хроническими заболеваниями и при наличии других факторов риска, а также у больных, госпитализированных в терапевтическое отделение, применяется монотерапия респираторными фторхинолонами или сочетание β-лактамных антибиотиков с макролидами. Пациентам, госпитализированным в отделение интенсивной терапии, показана комбинация β-лактамного антибиотика (цефотаксим, цефтриаксон или ампициллин/сульбактам) с азитромицином или фторхинолоном.
С другой стороны, в рекомендациях IDSA/ATS указывается, что возбудителями бактериальной пневмонии на фоне гриппа чаще всего становятся S.pneumoniae, Staphylococcus aureus и Haemophilus influenzae, а при наличии этих возбудителей препаратами первой линии должны быть β-лактамные антибиотики. Между тем ряд экспериментальных данных подвергает сомнению преимущества β-лактамных антибиотиков, обладающих бактерицидным эффектом, перед некоторыми бактериостатическими препаратами, в частности макролидами (азитромицином). Как было показано на модели пневмококковой пневмонии на фоне гриппа, β-лактамный антибиотик ампициллин обеспечивает эффективную эрадикацию возбудителя из легких, но это не приводит к уменьшению летальности [5]. J.A. McCullers et al. предположили, что выраженный воспалительный ответ на тяжелый грипп, затем усиленный бактериальной суперинфекцией, может приводить к летальному исходу вследствие вызванного β-лактамами лизиса бактерий [8]. В проведенном этими авторами исследовании [12] было продемонстрировано, что антибиотики, ингибирующие синтез белка в бактериальной клетке (азитромицин и клиндамицин), приводят к лучшему исходу за счет уменьшения воспалительного ответа.
В работе A. Karlstrom et al. [12] мышей инфицировали адаптированным штаммом вируса гриппа (0,03 от летальной дозы для 50 % особей), а через 7 дней — штаммом S.pneumoniae (0,02 от летальной дозы для 50 % особей), который был трансформирован люксопероном (благодаря этому развитие и течение пневмонии можно было наблюдать в динамике с помощью метода биолюминесценции). Антибиотики вводили интраперитонеально 2 раза в день (ампициллин 200 мг/кг/сут, клиндамицин 30 или 120 мг/кг/сут) или 1 раз в день (азитромицин 10 мг/кг/сут в первые сутки, затем 5 мг/кг/сут). Лечение начинали сразу после подтверждения развившейся пневмонии с помощью биолюминесценции, которую проводили два раза в сутки.
Для оценки воспалительной реакции in vitro пневмококки инкубировали с ампициллином или клиндамицином, а затем супернатант жидкости добавляли к культуре макрофагов. Если бактерии подвергались киллингу ампициллином, то продукция фактора некроза опухоли α (ФНО-α) макрофагами оказывалась достоверно выше, чем при использовании клиндамицина или в контроле (экспозиция живых пневмококков). Синтез данного провоспалительного цитокина в ответ на воздействие ампициллином был в 6 раз сильнее, чем в случае клиндамицина.
В первой фазе исследования у всех животных, получавших ампициллин (8 из 8), произошла эрадикация возбудителя из легких (по данным биолюминесценции), однако, несмотря на это, 3 (38 %) из них погибли. При лечении клиндамицином эрадикация была достигнута лишь у 10 из 16 мышей (62 %), но при этом выжили все 10 особей. Без лечения погибло 100 % мышей. Таким образом, при менее эффективной эрадикации пневмококков клиндамицин обеспечил лучшую выживаемость в подгруппе успешной эрадикации.
Во второй фазе исследования сравнивали режимы увеличенной дозы клиндамицина (120 мг/кг/сут), ампициллина, их сочетания, а также азитромицина. Все режимы терапии сопровождались 100% эрадикацией бактерий из легких. В группе клиндамицина выжило 82 % мышей (14 из 17), при этом у погибших мышей наблюдалась тяжелая диарея. Сочетание клиндамицина и ампициллина (в 1-е сутки только клиндамицин, затем комбинация антибиотиков) привело к аналогичной выживаемости (рис. 1), а наилучшие результаты наблюдались в группе азитромицина (выжило 92 % животных). В группе ампициллина летальность была наибольшей (44 %) среди групп активной терапии.
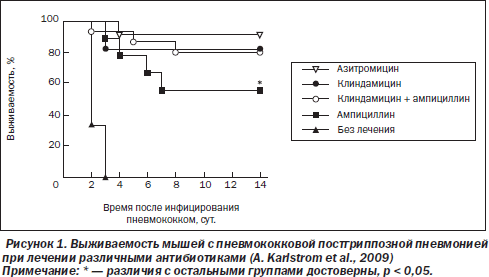
Авторы исследования связывают худший результат при лечении β-лактамным антибиотиком с быстрым лизисом бактерий и бурной воспалительной реакцией. Действительно, содержание в гомогенатах легких ФНО-α и ряда других провоспалительных цитокинов (интерлейкины 1, 6, 12 и др.) повышалось по сравнению с контролем через 4 ч после введения ампициллина, тогда как при лечении клиндамицином их уровни снижались. Это сопровождалось большей экссудацией нейтрофилов, лимфоцитов и макрофагов в бронхоальвеолярную жидкость в случае использования ампициллина (на 46–76 % по сравнению с группой клиндамицина). Данные изменения происходили на фоне быстрого киллинга бактерий в легких под действием ампициллина: в первые сутки лечения число пневмококков в легких уменьшилось более чем в 20 раз, тогда как в группе клиндамицина оно оставалось стабильным.
Патогистологические изменения в легких были выражены сильнее в группе ампициллина, где наблюдались распространенный некроз эпителия бронхов, лобарный фибриноидный некроз альвеолярной ткани и явления плеврита. При лечении клиндамицином подобные изменения были менее распространенными и не затрагивали долю целиком.
Таким образом, в эксперименте при пневмококковой постгриппозной пневмонии β-лактамный антибиотик, оказывающий бактерицидное действие, продемонстрировал худшую эффективность, чем бактериостатические антибиотики, тормозящие синтез белка, — клиндамицин и азитромицин. Более высокая летальность при лечении ампициллином (несмотря на эрадикацию возбудителя), вероятно, обусловлена бурной воспалительной реакцией на быстрый лизис бактерий: происходит активный выброс провоспалительных цитокинов, клеточная экссудация и массивное повреждение легочной ткани [12].
Несмотря на имеющийся арсенал антибактериальных препаратов, легочные инфекции сопровождаются значительной летальностью. При пневмококковой пневмонии даже в случае адекватной терапии смертность составляет 4–5 % в неосложненных случаях и 13 % у пациентов с бактериемией, причем эти данные существенно не изменились со времени внедрения пенициллина [13–15]. Бактериальная пневмония, возникшая на фоне гриппа, представляет собой серьезную клиническую проблему и связана с повышенной летальностью [16]. Ряд экспериментальных работ, в том числе обсуждавшееся исследование A. Karlstrom et al. [12], доказывают, что быстрое бактерицидное действие β-лактамных антибиотиков вызывает бурный воспалительный ответ, который ухудшает прогноз в целом. Напротив, антибиотики, оказывающие нелитическое действие (например, макролиды), могут обладать преимуществом.
Эти данные подтверждаются и в клинических исследованиях. В ретроспективном исследовании, включавшем 409 пациентов, продемонстрировано снижение летальности при добавлении макролидов к лечению β-лактамами у больных пневмококковой пневмонией с бактериемией [17]. При мультивариантном анализе было обнаружено, что факторами, независимо и достоверно ассоциированными с риском летального исхода, служат наличие шока, возраст ≥ 65 лет, резистентность возбудителя одновременно к β-лактамам и макролидам, а также неиспользование макролидов в стартовой антибактериальной терапии. Те же подходы к лечению пневмококковой пневмонии с бактериемией сравнивались у 844 взрослых пациентов в проспективном многоцентровом исследовании [18]. Среди всей выборки достоверных различий обнаружено не было, однако у наиболее тяжелых больных, госпитализированных в отделение интенсивной терапии, добавление макролидов приводило к снижению 14-дневной летальности более чем в два раза (с 55,3 до 23,4 %, p = 0,0015).
В когортном исследовании у 1391 пациента с внебольничной пневмонией различной этиологии показано, что положительное влияние макролидов, по-видимому, имеет место не только в случае пневмококковой пневмонии [19]. При назначении в качестве эмпирической терапии β-лактамов летальность составила 13,3 %, а при использовании их в комбинации с макролидами — 6,9 % (p = 0,001). После уравновешивания групп по тяжести пневмонии (по шкале PORT — Pneumonia Patient Outcomes Research Team) относительный риск летального исхода в группе монотерапии составил 2,0.
Вероятно, положительное влияние макролидов на течение и прогноз внебольничной пневмонии связано и с их неантибиотическими, в том числе иммуномодулирующими эффектами. Как показано в открытом проспективном исследовании у 896 пожилых пациентов с внебольничной пневмонией, отдельные представители класса макролидов могут различаться по эффективности [20]. Авторы сравнивали эффективность сочетания цефтриаксона с 3-дневным курсом азитромицина или с 10-дневным курсом кларитромицина. У пациентов, получавших азитромицин, не только сокращалась длительность госпитализации (7,4 против 9,4 сут.; p < 0,01), но и наблюдалась вдвое меньшая летальность (3,6 против 7,2 %; p < 0,05) по сравнению с группой кларитромицина.
Итак, бактериальные осложнения гриппа, прежде всего пневмония, являются серьезнейшей проблемой для современного здравоохранения. Бактерицидные антибиотики (в частности, β-лактамы) обеспечивают быструю эрадикацию чувствительных к ним возбудителей, однако это может сопровождаться выраженным воспалительным ответом, ведущим к массивному повреждению легких и тяжелой системной реакции организма. В особенности это опасно при значительной бактериальной нагрузке (что характерно для большинства пациентов, госпитализированных с постгриппозной пневмонией). Антибиотики с нелитическим действием (в частности, азитромицин), назначаемые в виде монотерапии или в комбинации с β-лактамами, могут обладать преимуществом при пневмококковой постгриппозной пневмонии, а также, по-видимому, при внебольничной пневмонии в целом [21].
1. Minino A.M., Heron M.P., Murphy S.L. et al. Deaths: final data for 2004 // Natl. Vital Stat. Rep. — 2007. — V. 55. — P. 1-119.
2. Kyaw M.H., Lynfield R., Schaffner W. et al. Effect of introduction of the pneumococcal conjugate vaccine on drug-resistant Streptococcus pneumoniae // N. Engl. J. Med. — 2006. — V. 354. — P. 1455-1463.
3. Morens D.M., Taubenberger J.K., Fauci A.S. Predominant role of bacterial pneumonia as a cause of death in pandemic influenza: implications for pandemic influenza preparedness // J. Infect. Dis. — 2008. — V. 198, № 7. — P. 962-970.
4. Louria D., Blumenfeld H., Ellis J. et al. Studies on influenza in the pandemic of 1957–58. II. Pulmonary complications of influenza // J. Clin. Invest. — 1959. — V. 38. — P. 213-265.
5. McCullers J.A. Effect of antiviral treatment on the outcome of secondary bacterial pneumonia after influenza // J. Infect. Dis. — 2004. — V. 190. — P. 519-526.
6. Sun K., Metzger D.W. Inhibition of pulmonary antibacterial defense by interferon-gamma during recovery from influenza infection // Nat. Med. — 2008. — V. 14, № 5. — P. 558-564.
7. McCullers J.A., Rehg J.E. Lethal synergism between influenza virus and Streptococcus pneumoniae: characterization of a mouse model and the role of platelet-activating factor receptor // J. Infect. Dis. — 2002. — V. 186. — P. 341-350.
8. Smith M.W., Schmidt J.E., Rehg J.E. et al. Induction of pro- and anti-inflammatory molecules in a mouse model of pneumococcal pneumonia following influenza // Comp. Med. — 2007. — V. 57. — P. 82-89.
9. McCullers J.A., Bartmess K.C. Role of neu-raminidase in lethal synergism between influenza virus and Streptococcus pneumoniae // J. Infect. Dis. — 2003. — V. 187. — P. 1000-1009.
10. McAuley J.L., Hornung F., Boyd K.L. et al. Expression of the 1918 influenza A virus PB1-F2 enhances the pathogenesis of viral and secondary bacterial pneumonia // Cell Host Microbe. — 2007. — V. 2. — P. 240-249.
11. Mandell L.A., Wunderink R.G., Anzueto A. et al. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults // Clin. Infect. Dis. — 2007. — V. 44, Suppl. 2. — P. 27-72.
12. Karlstrom A., Boyd K.L., English B.K. et al. Treatment with protein synthesis inhibitors improves outcomes of secondary bacterial pneumonia after influenza // J. Infect. Dis. — 2009. — V. 199. — P. 1-9.
13. Austrian R., Gold J. Pneumococcal bacteremia with especial reference to bacteremic pneumococcal pneumonia // Ann. Intern. Med. — 1964. — V. 60. — P. 759-776.
14. Rahav G., Toledano Y., Engelhard D. et al. Invasive pneumococcal infections: a comparison between adults and children // Medicine (Baltimore). — 1997. — V. 76. — P. 295-303.
15. Feikin D.R., Schuchat A., Kolczak M. et al. Mortality from invasive pneumococcal pneumonia in the era of antibiotic resistance, 1995–1997 // Am. J. Public Health. — 2000. — V. 90. — P. 223-229.
16. Nicholson K.G. Human influenza // Textbook of Influenza / Ed. by K.G. Nicholson, R.G. Webster, A.J. Hay. — London: Blackwell Science, 1998. — P. 222-223.
17. Martinez J.A., Horcajada J.P., Almela M. et al. Addition of a macrolide to a β-lactam-based empirical antibiotic regimen is associated with lower in-hospital mortality for patients with bacteremic pneumococcal pneumonia // Clin. Infect. Dis. — 2003. — V. 36. — P. 389-395.
18. Baddour L.M., Yu V.L., Klugman K.P. et al. Combination antibiotic therapy lowers mortality among severely ill patients with pneumococcal bacteremia // Am. J. Respir. Crit. Care Med. — 2004. — V. 170. — P. 440-444.
19. Garcia Vasquez E., Mensa J., Martinez J.A. et al. Lower mortality among patients with community-acquired pneumonia treated with a macrolide plus a β-lactam agent versus a β-lactam agent alone // Eur. J. Clin. Microbiol. Infect. Dis. — 2005. — V. 24. — P. 190-195.
20. Sanchez F., Mensa J., Martinez J.A. Is azithromycin the first-choice macrolide for treatment of community-acquired pneumonia? // Clin. Infect. Dis. — 2003. — V. 36. — P. 1239-1245.
21. Hussell T., Wissinger E., Goulding J. Bacterial complications during pandemic influenza infection // Future Microbiol. — 2009. — V. 4, № 3. — P. 269-272.
