Газета «Новости медицины и фармации» Пульмонология (344) 2010 (тематический номер)
Вернуться к номеру
Морфологические особенности форм идиопатических интерстициальных пневмоний и роль эпителиально-мезенхимальной трасформации в их патогенезе
Авторы: Н.Е. Моногарова, И.В. Василенко, Донецкий национальный медицинский университет им. М. Горького, кафедра внутренней медицины им. проф. А.Я. Губергриц, кафедра патологической анатомии
Версия для печати
Идиопатические интерстициальные пневмонии (ИИП) — группа болезней легких неустановленной этиологии, отличающихся друг от друга патоморфологическим типом неинфекционного воспаления и фиброзом преимущественно в интерстиции легкого и вариантом клинического течения и прогноза (Ю.И. Фещенко и соавт., 2007). Среди 7 форм этих пневмоний обычная интерстициальная пневмония (ОИП), или идиопатический фиброзирующий альвеолит (ИФА), — более часто применяющееся в нашей стране название — является самой частой, почти всегда фатальной, быстро прогрессирующей формой, не отвечающей на используемые методы терапии, которую следует отличать от других ИИП с лучшим прогнозом и более благоприятным ответом на терапию (Е.А. Коган и соавт., 2009; A.L. Katzenstein еt al., 2008; D. Shitrit еt al., 2009).
Е.А. Коган и соавт. (2009) выдвинули очень красивую, обоснованную иммуногистохимическими исследованиями концепцию патогенеза наиболее частых интерстициальных болезней легких, объясняющую их отличия. Важным патогенетическим отличительным признаком ОИП является инициальное повреждение (иммунная, воспалительная реакция) в зоне трансформации, где располагаются клетки — предшественники бронхиального и альвеолярного эпителия и происходит их одновременное повреждение, тогда как при десквамативной интерстициальной пневмонии повреждается альвеолярный эпителий, при облитерирующем бронхиолите с организующейся пневмонией (ОБОП) — эпителий бронхиол, при неспецифической интерстициальной пневмонии (НИП) повреждается легочный интерстиций. Такое представление о патогенезе обычной интерстициальной пневмонии объясняет особенно тяжелое ее течение одновременным поражением двух типов клеток эпителия, тогда как при других формах идиопатических интерстициальных пневмоний повреждается только один тип клеток. Действительно, при обычной интерстициальной пневмонии часто можно видеть одновременную гиперплазию и альвеолярного, и бронхиального эпителия.
Однако в последнее время в патогенезе фиброза многих органов придают значение эпителиально-мезенхимальной трансформации (ЭМТ), когда эпителиальные клетки теряют межклеточную адгезию и маркеры эпителия, приобретают мезенхимальный фенотип, переходят в интерстиций и участвуют в продукции экстрацеллюлярного матрикса (D.C. Radisky, 2005; F. Strutz, 2008; F. Kisseleva, D.A. Brenner, 2008; M. Guarino et al., 2009).
Мы изучили морфологию наиболее часто встречающихся ИИП с целью выявления особенностей, отличающих ОИП от их других форм, сосредоточив внимание на поиске в них признаков эпителиально-мезенхимальной трансформации.
Материалы и методы исследования
Всего изучено, преимущественно на материале биопсий, 40 наблюдений ИИП, из них в 21 случае была ОИП, в 9 наблюдениях — НИП, в 5 случаях — лимфоидная интерстициальная пневмония (ЛИП), в 3 — облитерирующий бронхиолит с организующейся пневмонией (ОБОП), по 1 наблюдению гистиоцитоза Х и хронического гиперсенситивного пневмонита.
Тканевые срезы окрашивались гематоксилином и эозином (г-э) по ван Гизону, ставилась PAS-реакция, а также проводились иммуногистохимические исследования с моноклональными антителами к цитокератину 18, панцитокератину АЕ1/3 (маркеры эпителия), десмину и α-гладкомышечному актину (маркеры мышечной ткани), виментину (маркер соединительной ткани), CD68 (маркер гистиоцитов-макрофагов и альвеолярных макрофагов), CD3 (маркер Т-лимфоцитов), CD20 (маркер В-лимфоцитов), белку S100, экспрессирующемуся в гистиоцитах Лангерганса.
Результаты исследования
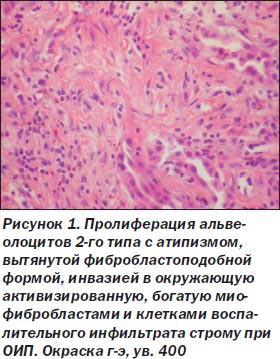
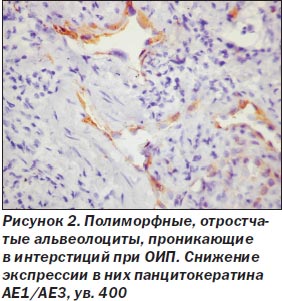
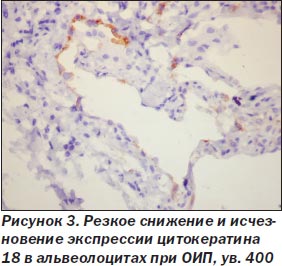
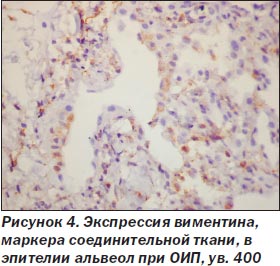
При ОИП процесс был выражен неравномерно, встречались небольшие участки почти нормального строения легких, но на большем протяжении обнаружены тяжелые изменения как в эпителии альвеол и бронхов, так и в интерстиции. Среди альвеолоцитов преобладал 2-й тип клеток (тогда как в норме они покрывают около 7 % поверхности альвеол), кубической формы клетки, участвующие в регенерации эпителия альвеол с последующей дифференцировкой в альвеолоциты 1-го типа и продуцирующие сурфактант (А.К. Загорулько, Т.А. Аскар, 2002). На отдельных участках, чаще среди значительного разрастания интерстициальной ткани, сужения просветов альвеол, иногда до щелевидной формы, альвеолоциты 2-го типа изменяют свою форму, приобретая отростки, вытягиваясь не только по поверхности альвеол, но и в направлении интерстиция, обосабливаясь и проникая в строму, становятся полиморфными, с крупными гиперхромными ядрами, приобретают признаки клеточного атипизма (рис. 1). Иммуногистохимическое исследование обнаруживает в эпителии альвеол снижение экспрессии панцитокератина АЕ1/3 в отдельных клетках, мелких группах клеток, вплоть до исчезновения его, особенно в альвеолоцитах, проникающих в интерстиций (рис. 2). Особенно резкое снижение и исчезновение в большинстве альвеолоцитов экспрессии обнаруживается с цитокератином 18 (рис. 3), что, согласно данным литературы (S. Guaitas еt al., 2002; A. Nieto, 2008), является показателем ЭМТ. Гораздо реже в эпителии, выстилающем альвеолы, обнаруживается экспрессия виментина (рис. 4), возможно, он чаще обнаруживается в альвеолоцитах, проникших в строму, но там эти клетки не отличаются от фибробластов, миофибробластов.
Чаще всего признаки ЭМТ в эпителии обнаруживаются в участках активированной стромы с рыхлым расположением волокон, накоплением гликозаминогликанов в экстрацеллюлярном матриксе (его базофилия), большим числом миофибробластов, фибробластов, местами с выраженной воспалительной, иммуноклеточной инфильтрацией. При этом гистиоциты Лангерганса (S100 положительные), SD68 положительные макрофаги и Т-лимфоциты (SD3 положительные) обнаруживались вокруг и в контакте с клетками альвеолярного эпителия. Согласно литературным данным, в развитии ЭМТ особенно велика роль макрофагов и миофибробластов, продуцирующих трансформирующий фактор роста бета (TGF-β), который является экстрацеллюлярным сигналом, инициирующим и поддерживающим программу ЭМТ (T. Kisseleva, D.A. Brenner, 2008). В эксперименте на культуре ткани альвеолоцитов 2-го типа выявлена также секреция TGF-β, т.е. возможен и аутокринный путь стимуляции ЭМТ (J. Sevilla Perez, 2007).
Морфологические признаки ЭМТ выявлены в обычной интерстициальной пневмонии в 15 из 21 наблюдения (71,4 %), т.е. в большинстве случаев. Очевидно, этим обусловлена тяжесть и необратимость изменений при этом заболевании.
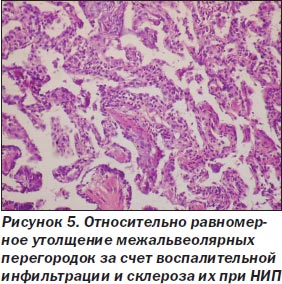
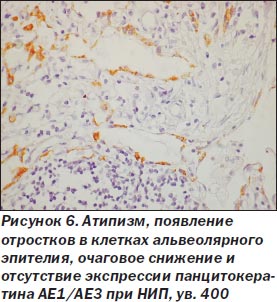
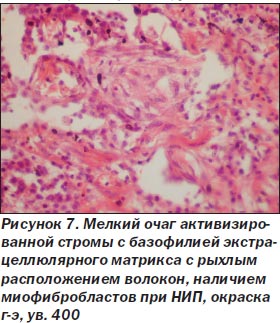
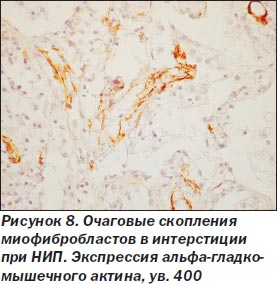
При неспецифической интерстициальной пневмонии процесс в легких более равномерный, нет сохраненной нормальной структуры легкого. Межальвеолярные перегородки утолщены, чаще умеренно, за счет склероза и воспалительной инфильтрации (рис. 5), нет крупных очагов фиброза, выраженной гиперплазии гладкомышечной ткани, как при ОИП. Морфологические признаки ЭМТ обнаружены только в 2 наблюдениях, при этом очажки эти были значительно меньше как по числу, так и по размерам в сравнении с ОИП (рис. 6). Обнаруживалась слабо или умеренно выраженная гиперплазия альвеолоцитов 2-го типа, при иммуногистохимическом исследовании в межальвеолярных перегородках было мало Т-лимфоцитов, В-лимфоциты сосредоточены в основном в лимфоидных фолликулах, CD68 положительные макрофаги чаще крупные, располагались в просвете альвеол, редко встречались S100 положительные клетки Лангерганса. В инфильтрате межальвеолярных перегородок чаще были плазматические клетки, нейтрофилы. В двух наблюдениях с ЭМТ встречались небольшие очаги рыхлой волокнистой соединительной ткани с наличием скоплений, пучков миофибробластов с экспрессией только альфа-гладкомышечного актина (рис. 7, 8), не было экспрессии десмина, среди такой активизированной стромы обнаруживались крупные полиморфные, отростчатые альвеолоциты, отдельные из них — со снижением (вплоть до потери) экспрессии панцитокератина АЕ1/3 (рис. 6).
Следовательно, в группе НИП небольшие очажки ЭМТ встречались редко — только в двух случаях из девяти (22,2 %), т.е. значительно реже, чем при ОИП. В остальных случаях ИИП ни разу не встретилась ЭМТ, следовательно, среди 19 случаев всех ИИП, кроме ОИП, частота ЭМТ окажется совсем низкой — 10,5 %.
Обсуждение
Процесс ЭМТ в патологии встречается при заживлении ран, склерозе различных органов (почки, легкого, печени и др.), а также в злокачественных опухолях (M. Guarino еt al., 2009), где так же возникает при возрастании активности стромы, как при заживлении ран или хроническом воспалении, и сопровождается усилением инвазивности, метастазирования опухоли (R.A. Weinberg, 2008). При ИИП так же возникают атипические, диспластические разрастания эпителия, как это описано Е.А. Коган и соавт. (2003) и как выявили мы в альвеолоцитах.
В опухолях не все варианты одной локализации прогрессируют путем включения ЭМТ. Так, при раке молочной железы из пяти вариантов, отличающихся своим происхождением и молекулярно-генетическими особенностями, только в одном часто наблюдается ЭМТ — в базальноподобном типе, который копирует миоэпителий. Очевидно, опухоли, копирующие бипотентные клетки с двойным направлением дифференцировки, более склонны к ЭМТ.
В случаях ИИП только ОИП, согласно концепции Е.А. Коган и соавт. (2009), происходит при повреждении и регенерации клеток, способных дифференцироваться в двух направлениях — альвеолярного и бронхиального эпителия. Возможно, это и определяет более высокую частоту ЭМТ при ОИП и более тяжелое, неблагоприятное в прогностическом отношении течение.
Следует отметить, что ЭМТ является обратимым процессом, существует и мезенхимально-эпителиальная трансформация, механизм развития которой пока менее понятен, чем ЭМТ (D.C. Radisky, 2005). Однако в последнее время на модели легочного фиброза у мышей были показаны возрастание пролиферации и изменения экспрессии WNT-сигнального пути в альвеолоцитах 2-го типа с усилением экспрессии в них WNT-индуцируемого сигнального протеина-1 (WISP-1), повышение уровня которого отмечено и у пациентов с идиопатическим пульмональным фиброзом. В модели легочного фиброза у мышей нейтрализация WISP-1 моноклональными антителами снижает его экспрессию и ведет к обратимости экспрессии генов, связанных с ЭМТ, заметному уменьшению легочного фиброза. Следовательно, найдена потенциальная терапевтическая мишень для регуляции гиперплазии альвеолоцитов 2-го типа и снижения легочного фиброза (M. Königshoff еt al., 2009).
1. Загорулько А.К., Аскари Т.А. Атлас ультраструктурной морфологии респираторного отдела легких. — Симферополь, 2002. — 144 с.
2. Коган Е.А., Мануйлова Т.Ю., Краева В.В., Попова Е.Н. Атипическая аденоматозная гиперплазия и дисплазия в плоском эпителии в сотовом легком в исходе идиопатического фиброзирующего альвеолита // Архив патологии. — 2003. — № 5. — С. 35-40.
3. Коган Е.А., Тыонг Ф.В., Демура С.А. Молекулярные основы формирования вариантов идиопатического фиброзирующего альвеолита // Архив патологии. — 2009. — Т. 71, № 1. — С. 12-18.
4. Фещенко Ю.И., Гаврисюк В.К., Моногарова Н.Е. Идиопатические интерстициальные пневмонии: классификация, дифференциальная диагностика // Український пульмонологічний журнал. — 2007. — № 2. — С. 5-11.
5. Guaita S., Puig I., Franci S. еt al. Smail Induction of Epithelial to Mesenchimal Transition in Tumor Cells. Is Accompanied by MUC1 Repression and LED1 Expression // J. Biol. Chem. — 2002. — V. 277, № 42. — Р. 39209-39216.
6. Guarino M., Tosoni A., Nebuloni M. Direct contribution epithelium to organ fibrosis: epithelial-mesenchymal transition // Hum. Pathol. — 2009. — V. 40, № 10. — Р. 1365-1376.
7. Katzenstein A.L., Mukhopadhyay S., Myers J.L. Diagnosis interstitial pneumonia and distinction from other fibrosing interstitial lung deseases // Hum. Pathol. — 2008. — V. 39. — Р. 1275-1294.
8. Kisseleva T., Brenner D.A. Mechanisms of Fibrogenesis // Exp. Biology a Medicine. — 2008. — V. 233. — Р. 109-122.
9. Königshoff M., Kramer M., Balsars N. et al. WNT-1 inclusible signaling protein-mediates pulmonary fibrosis in mice and is upregulated in humans with idiopathic pulmonary fibrosis // J. Clin. Invest. — 2009. — V. 119, № 4. — Р. 772-787.
10. Nieto M.A. Epithelial-Mesenchimal transition in development and desease: old views and new perspectives // Int. J. Dev. Biol. — 2008. — V. 52. — Р. 1-7.
11. Radisky D.C. Epithelial-mesenchimal transition // Journal of Cell Science. — 2005. — V. 118. — P. 4325-4326.
12. Shitrit D., Rusanov V., Peled N., Amital A., Fuks L., Kramer M.R. The 15 step oximetri test: a reliabe tool to identify candidates for lung transplantation among patients with idiopathic pulmonary fibrosis // J. Heart Lung Transplant. — 2009. — V. 28, № 4. — Р. 328-333.
13. Strutz F. How Many Different Roads May a Cell Walk down in Order to become a Fibroblast // J. Am. Soc. Nephrol. — 2008. — V. 19. — Р. 2246-2248.
14. Weinberg R.A. Mechanisms of malignant progression // Carcinogenesis. — 2008. — V. 29, № 6. — P. 1092-1095.
