Газета «Новости медицины и фармации» Акушерство и гинекология (347) 2010 (тематический номер)
Вернуться к номеру
Вагінальні інфекції
Авторы: Джейн Р. Швебке, Алабстський університет в Бірмінгемі (штат Алабама)
Версия для печати
Вступ
Вагінальні інфекції — джерело значної захворюваності серед жінок. Головними причинами інфекційного вагініту є вульвовагінальний кандидоз, трихомоноз і бактеріальний вагіноз. Кожен із цих розладів може викликати неприємні вагінальні симптоми, а два останніх спричиняють ускладнення з боку верхніх репродуктивних шляхів. Ці інфекційні хвороби також здатні сприяти передачі й набуванню вірусу імунодефіциту людини (ВІЛ).
Встановлено, що понад 10 мільйонів відвідувань лікарів щорічно відбувається через вагінальні інфекції [1]. Оскільки жодна з цих інфекцій не є хворобою, про яку необхідно обов’язково повідомляти до органів контролю, їхня точна кількість невідома. Незважаючи на наявність ефективних діагностичних тестів, багато випадків у жінок діагностують помилково через те, що лікарі не проводять їх. Далі, через загальне хибне уявлення (яке підтримують засоби масової інформації), що найпоширенішою причиною вагініту є кандидоз (дріжджовий грибок), багато жінок із вагінальними виділеннями вдаються до самолікування протигрибковими препаратами, які продають без рецептів, зволікаючи з належною терапією [2, 3]. Важливо усвідомити, що вищезгадані коментарі стосуються лише інфекцій з клінічними проявами і що трихомоноз і бактеріальний вагіноз можуть перебігати без симптомів. Лікарі рідко обстежують жінок без клінічних проявів цієї патології на вагінальні інфекції, отже, у таких жінок цю патологію часто не виявляють.
Нормальна екосистема піхви
Екосистема людської піхви складна й тільки-но стає зрозумілою. Більша частина нашого сучасного знання стосується типу мікробної флори, і ми маємо лише обмежену інформацію стосовно чинників, які впливають на цю флору. Також починає накопичуватися інформація щодо імунологічних і клітинних захисних механізмів піхви.
Молочні бактерії (лактобактерії) стають домінуючими «мешканцями» піхви під час статевої зрілості, можливо через дію естрогенів на вміст глікогену у вагінальних епітеліальних клітинах [4]. Коли рівні естрогену знижуються, наприклад у жінок після пологів або в період менопаузи, кількість лактобактерій зменшується [5]. In vitro лактобактерії демонструють здатність виробляти різні потенційно токсичні для мікробів речовини, включаючи перекис водню і менш точно визначені бактеріоцини [6, 7]. Лактобактерії, які виробляють Н2О2 in vitro, показали здатність пригнічувати мікроорганізми, включаючи Gardnerella vaginalis, анаероби, Neisseria gonorrhoeae і ВІЛ [8–12]. Малоймовірно — і це засвідчили результати епідеміологічних досліджень, — що жінки з лактобактеріями, які виробляють Н2О2 in vitro, матимуть збудники бактеріального вагініту та хвороб, що передаються статевим шляхом, типу N.gonorrhoeae, Chlamydia trachomatis і Trichomonas vaginalis [13–15]. Отже, чітко встановлено, що вироблення мікробами перекису водню може відігравати важливу роль у стабілізації екології піхви. Чинники, що змінюють вироблення лактобактеріями Н2О2, невідомі. Інші механізми, за допомогою яких лактобактерії можуть виконувати захисну функцію в екосистемі піхви, включають змагання за місця приєднання до епітеліальних клітин і стимуляцію локальної імунної системи [5, 16].
На додаток до механізмів, специфічних до лактобактерій, піхва має й інші засоби захисту: вагінальну епітеліальну слизову оболонку, рН вагінального секрету, локальні антимікробні секреторні чинники, а також гуморальні й клітинні імунні чинники. Слизова оболонка піхви є фізичним бар’єром для патогенів. Потік слизу, який виробляє в основному шийка матки, несе антимікробні елементи, а також фізично вимиває мікроорганізми з піхви [17]. З’являються нові дані щодо активного вироблення плоскими епітеліальними клітинами дефензинів і цитокінів як реакції на патогени та інші стимули, що викликають запалення. Ці мікроорганізми допомагають ініціювати імунну реакцію [18]. Нормальний вагінальний рН < 4,5 несприятливий для багатьох бактерій. Ця кислотність підтримується за рахунок вироблення молочної кислоти як метаболічного побічного продукту використання глікогену лактобактеріями. На рН впливають зміни у вагінальній флорі, а також менструація та зовнішні чинники, наприклад спринцювання та сперма [19]. Неспецифічними антимікробними елементами, присутніми у вагінальному секреті, є лізосоми та лактоферин, які змагаються з мікробами за залізо, цинк і пероксидази [17]. До специфічних імунних механізмів зараховують гуморальний і клітинний імунітет. Репродуктивний шлях є досить імунокомпетентним об’єктом циклічного типу, на який впливає гормональна регуляція [20].
Хоча лактобактерії є домінуючими мікроорганізмами у піхві здорової дорослої жінки, існує безліч інших бактерій [15]. Наприклад, G.vaginalis, яку раніше вважали збудником бактеріального вагінозу, фактично наявна в менших концентраціях майже у 55% жінок без цієї хвороби [21]. В екосистемі міститься багато інших анаеробних і факультативно анаеробних мікроорганізмів, так само як і деяких інших різновидів лактобактерій [21, 22]. Складні взаємодії різних елементів вагінальної флори недостатньо зрозумілі, однак з’ясовано, що склад флори може змінюватися щодня, навіть у жінок без очевидної інфекції. Дослідження, в яких вивчалися послідовні вагінальні культури або мазки з піхви, показали, що в деяких жінок відбуваються значні транзиторні зміни флори. Найбільш нестабільний період припадає на час напередодні менструації, але конкретні чинники, що відповідають за ці зміни, невідомі [23–28].
Діагностика вагініту
Адекватна медична допомога при вагінальних інфекціях потребує визначення специфічного, правильного діагнозу. Найпоширенішими типами медичних помилок є емпіричні діагнози на основі анамнезу пацієнтки або простої візуалізації виділень і неналежної перевірки на наявність інфекції, зокрема на трихомоноз, сексуально активних жінок без клінічної симптоматики. Незважаючи на той факт, що бактеріальний вагіноз є найпоширенішою інфекцією, найчастіший емпіричний діагноз, який встановлять практикуючі лікарі, — дріжджова грибкова інфекція [29, 30]. Хоча можливо вивести закономірності щодо появи вагінальних виділень, пов’язаних із тією чи іншою інфекцією, треба проводити специфічний аналіз, щоб підтвердити діагноз. Трапляються змішані інфекції [31]. У багатьох жінок із бактеріальним вагінозом або трихомонозом інфекції є безсимптомними і їх можна діагностувати лише шляхом загальноприйнятого скринінгу. Питання лікування безсимптомного бактеріального вагінозу є спірним, на відміну від питання лікування безсимптомного трихомонозу, а тому жінки з діагнозом трихомонозу потребують консультування й лікування.
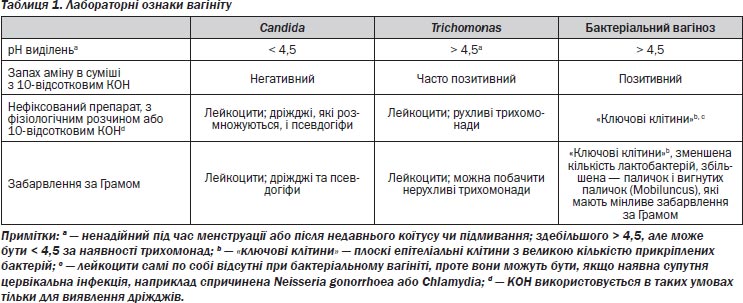
Клінічне дослідження вагініту відносно швидке й недороге. Воно передбачає опис виділень, вимірювання вагінального рН, проведення амінового тесту і — найважливіше — дослідження вагінального секрету під мікроскопом [32, 33]. Важливо, щоб пробу для вимірювання рН було отримано з піхви і щоб вона не містила цервікального секрету, який звичайно більш лужний за своїм складом. Кров, сперма і недавнє спринцювання також можуть впливати на результат цього аналізу. Пробу наносять на рН-папір, а отриманий колір порівнюють із таблицею кольорів. Другий вагінальний мазок використовується для мікроскопії та амінового тесту. Цю пробу розводять фізіологічним розчином і 10-відсотковим розчином гідроокису калію (КОН), потім нюхають, аби перевірити на наявність «рибного» запаху амінів, який, якщо він є, вказує на наявність бактеріального вагінозу або трихомонозу. Препарат із цього розчину досліджують при 400-кратному збільшенні на наявність дріжджів і/або псевдогіфів у стадії розмноження, рухливих трихомонад, лейкоцитів і «ключових клітин» (плоских епітеліальних клітин, укритих бактеріями настільки, що обриси клітин стають нечіткими). Уважний дослідник також зверне увагу на кількість і морфотипи вагінальних бактерій. Лейкоцити можуть спостерігатися при вульвовагінальному кандидозі або трихомонозі. Вони також можуть бути в цервікальному секреті, що свідчить про наявність цервіциту. У підготовці й дослідженні зразка для мікроскопії важливо взяти достатню кількість матеріалу, а саме таку, щоб він не був занадто рідкий при змішуванні із сольовим розчином. Також іноді потрібно досліджувати більш ніж один препарат, особливо для виявлення псевдогіфів дріжджів. За результатами цих простих аналізів здебільшого можна встановити конкретний діагноз (табл. 1).
Вульвовагінальний кандидоз
Вульвовагінальний кандидоз є найвідомішою з вагінальних інфекцій, особливо серед населення. Його поширеність, імовірно, спричинена самолікуванням протигрибковими препаратами, що продаються без рецептів, і рекламою в популярній пресі. Багато жінок припускаються помилки, вважаючи, що їхні вагінальні симптоми виникають через дріжджову інфекцію, або думаючи про діагностичну помилку лікаря.
З’ясовано, що дріжджові інфекції становлять 20–30 % випадків вагініту [34]. Найвища поширеність вульвовагінального кандидозу припадає на третє й четверте десятиріччя життя [35].
Дріжджі можуть колонізувати піхву приблизно у 15 % жінок, а можуть також існувати на шкірі та у шлунково-кишковому тракті [34]. Вважають, що клінічні симптоми вульвовагінального кандидозу розвиваються внаслідок надмірного розмноження збудників у відповідь на різні пускові механізми. Умови, що сприяють розвитку вульвовагінального кандидозу, включають цукровий діабет, вагітність, екзогенні естрогени, використання антимікробних препаратів широкого спектра, імуносупресію і, можливо, статевий акт. Здебільшого пусковий механізм неможливо ідентифікувати [31, 35]. До рецидивів вульвовагінального кандидозу схильна невелика кількість жінок [35].
Candida albicans — це різновид бактерії, що найчастіше спричиняє вульвовагінальний кандидоз, хоча це можуть бути С.glabrata або С.tropicalis і рідко інші різновиди Candida [34]. Кілька різних штамів С.albicans здатні викликати інфекцію. У жінок з повторним вульвовагінальним кандидозом це звичайно той самий штам, який залишається в організмі носія [36]. Жінки з вульвовагінальним кандидозом не мають очевидних змін вагінальної флори, у них домінують лактобактерії [37].
Ознаками вульвовагінального кандидозу є вагінальні виділення та свербіж. Виділення густі, білі, «сироподібні» на вигляд і можуть прилипати до слизової оболонки, але можуть переважати такі ознаки, як еритема, набряк і екскоріації [34]. Треба спробувати підтвердити діагноз прямою мікроскопією вагінальних виділень. Присутність псевдогіфів Candida підтверджує діагноз. Їх можна краще розгледіти при додаванні 10%-відсоткового КОН до речовини, що руйнує інші клітинні елементи й бактерії. Можливо, доведеться дослідити кілька проб, щоб виявити псевдогіфи, оскільки чутливість цих аналізів є субоптимальною [35]. Іноді помічають лише дріжджі, що розмножуються, особливо в пацієнток з С.glabrata [31]. У пацієнток з вульвовагінальним кандидозом вагінальний рН < 4,5 і аміновий тест негативний, якщо немає супутнього бактеріального вагінозу або Т.vaginalis. Оскільки це запалення, часто присутні лейкоцити. Виявлення кількох клітин дріжджів на нефіксованому препараті за відсутності клінічних симптомів вважають нормальним. Використання культури треба залишити для спеціальних обставин, наприклад для підтвердження клінічного діагнозу в пацієнтки з негативною мікроскопією або з резистентністю до лікування інфекції, коли ідентифікація й аналіз на чутливість можуть стати в нагоді [38]. Використання культури кожного разу призведе до гіпердіагностики, оскільки дріжджі можуть колонізувати піхву, не викликаючи інфекції.
Лікувальні заходи в разі вульвовагінального кандидозу передбачають застосування препаратів, які вживають перорально, і ліків місцевого використання; ефективність усіх цих препаратів досягає понад 80 % [31]. Вагінальні азолеві мазі та свічки, наприклад з клотримазолом, терконазолом і бутоконазолом, залишаються найчастіше рекомендованими, курс лікування — 3–7 днів. Деякі препарати продаються без рецепта. Серед засобів, які вживають перорально, кетоконазол значною мірою замінено флуконазолом через сприятливіший профіль побічних ефектів останнього. Одноразова доза флуконазолу виявилася настільки ж ефективною, як і вагінальні засоби, і має таку саму вартість, однак його не можна використовувати в період вагітності [39]. Основний курс лікування жінок з рецидивами вульвовагінального кандидозу триває 14 днів, після цього їм призначають щотижневий медикаментозний підтримувальний курс упродовж принаймні шести місяців [35]. Показано, що така схема допомагає запобігти рецидивам у 90 % жінок протягом курсу підтримувальної терапії [35]. Хоча інші за albicans різновиди Candida мають тенденцію досягти вищих мінімальних концентрацій, чутливих до азолів, кількість активного засобу у звичайно використовуваних препаратах здебільшого достатня для лікування [35].
Трихомоноз
З трьох основних причин інфекційного вагініту трихомоноз є єдиним захворюванням, щодо якого доведено, що воно передається статевим шляхом. Трихомоноз не є хворобою, про яку обов’язково слід повідомляти, отже, справжня кількість випадків невідома, але щороку трихомоноз діагностують у Сполучених Штатах у трьох мільйонів осіб [34]. Хоча дані, отримані від лікарів, свідчать про те, що кількість випадків зменшується, деякі групи населення залишаються серйозно ураженими. Наприклад, серед відвідувачів спеціалізованих клінік з лікування хвороб, які передаються статевим шляхом, поширеність цього захворювання сягає понад 25 % [40]. Національне дослідження показників захворюваності і лікування засвідчило, що випадки вагінального трихомонозу трапляються часто, але більш високі показники спостерігаються на півдні. Велику кількість випадків виявлено серед афроамериканок, однак майже дві третини усіх відвідувань лікаря через цю проблему припадає на білих жінок. Інфекції найпоширеніші серед молодих, сексуально активних жінок [41].
Інфекцію викликає паразит Trichomonas vaginalis. Хоча зареєстровано його виживання на предметах спільного користування, вважають, що мікроорганізм передається виключно статевим шляхом [42]. Інкубаційний період цієї інфекції невідомий, але дослідження in vitro показують інкубаційний період від 4 до 28 днів [43]. Trichomonas часто виявляють при гонореї та бактеріальному вагінозі [42–44].
Жінки з клінічними проявами трихомонозу скаржаться на вагінальні виділення, свербіж і подразнення. Ознаки інфекції включають виділення (42%), запах (50%) і набряк або еритему (22–37 %). Виділення класично описують пінистими на вигляд, але фактично пінистими вони є приблизно у 10% пацієнток. Колір виділень може змінюватися. Плямистий кольпіт («сунична шийка матки») — специфічна клінічна ознака цієї інфекції, але його виявляють лише кольпоскопією, а не під час звичайного огляду [44]. Інші скарги можуть включати дизурію і біль унизу живота, етіологія останнього неясна [45]. Майже половина всіх жінок з Т.vaginalis не мають симптомів [46]. Отже, якщо цих жінок не обстежити, діагноз буде пропущений. Ступінь запальної реакції на паразита визначає серйозність ознак. Чинники, що впливають на запальну реакцію хазяїна-носія, недостатньо зрозумілі, але це можуть бути супутня вагінальна флора, штам і відповідна концентрація мікроорганізмів, наявних у піхві. Безсимптомні інфекції можуть урешті-решт перетворитися на хворобу з клінічною симптоматикою [47]. Більшість інфікованих чоловіків не мають симптомів, але трихомоноз може викликати негонококовий уретрит.
Трихомоноз пов’язаний із серйозними наслідками, наприклад передчасні пологи і передача/набуття ВІЛ. У мультицентровому дослідженні вагінальних інфекцій під час вагітності виявлено, що трихомоноз значною мірою пов’язаний із передчасним розродженням [48]. Цікаво, що коров’ячий венеричний трихомоноз — подібна інфекція рогатої худоби, що викликає безплідність [49]. У різних дослідженнях виявлено, що ВІЛ-інфекція пов’язана з трихомонозом [50, 51]. Локальне запалення й мікроскопічні подряпини поверхні, викликані паразитом, сприяють набуванню ВІЛ-інфекції через бар’єр слизової оболонки. Передача ВІЛ посилюється через збільшення генітального обсіменіння у місці запалення.
Найпоширенішими засобами діагностики є виявлення рухливих трихомонад у препараті з фізіологічним розчином вагінальних виділень. Мікроорганізми мають приблизний розмір клітин білої крові й можуть активно рухатися, або можна помітити в пульсуючому русі їхні джгутики. Хоча цей аналіз швидкий і недорогий, він має обмежену чутливість від 60 до 70 % [40, 52, 53]. У вагінальній рідині часто наявні лейкоцити. Вагінальний рН здебільшого підвищений (понад 4,5), але може бути й нормальним. Аміновий тест дає різні результати.
Нині золотим стандартом у діагностиці трихомонозу є культура мікроорганізмів. Традиційно для цього беруть живильне середовище Diamond, хоча таке культивування не є широко доступним, а отже, його використовують переважно з дослідницькою метою. Однак новий комерційно доступний метод вирощування культури мікроорганізмів, а саме використання рідкого живильного середовища в стерильному пакеті, так само ефективний, як і традиційний метод дослідження. Живильне середовище забезпечує розмноження трихомонад до достатньої кількості, такої, що їх можна виявити мікроскопією. Цей метод успішно застосовують як до проб, узятих лікарем, так і до проб, узятих самою пацієнткою, останній стає дуже корисним у ситуації, коли огляд органів малого таза неможливий або небажаний (наприклад, під час обстеження підлітків або в країнах, що розвиваються). Результати вирощування культури мікроорганізмів з’являються через 2–5 днів [40, 54, 55]. Полімеразна ланцюгова реакція (PCR) на Т.vaginalis перебуває у стадії розробки. Лабораторний аналіз проби олігонуклеотиду також доступний, він має чутливість 80–90 % і специфічність 95 % [56, 57]. Трихомонади можна помітити на пап-мазках; цей метод має чутливість приблизно 60 % і специфічність 95 % [52].
Метронідазол є єдиним ефективним антибіотиком, доступним у Сполучених Штатах для лікування трихомонозу. Рекомендована доза — 2 г перорально при одноразовому прийомі. Також треба лікувати статевих партнерів. Вагінальний гель метронідазолу має обмежену ефективність щодо трихомонозу [58]. Хоча залишається спірним питання щодо безпеки застосування метронідазолу під час вагітності, не зареєстровано жодного випадку каліцтва плода через його використання, навіть у перший триместр вагітності [59, 60]. Іноді пацієнтки мають алергію на метронідазол. Оскільки немає жодної ефективної альтернативи, десенсибілізація залишається єдиним вибором [58]. Інша терапевтична проблема полягає в резистентності Т.vaginalis до метронідазолу. Ця резистентність відносна, зазвичай її долають збільшеними дозами метронідазолу для перорального використання [58, 61]. Внутрішньовенні склади не мають жодних переваг порівняно з пероральним лікарським засобом. Жінок із безсимптомною інфекцією також треба лікувати. Якщо хворобу залишити без лікування, пізніше може розвитися клінічна симптоматика і без лікування жінка продовжуватиме передавати інфекцію.
Бактеріальний вагіноз
Бактеріальний вагіноз — найчастіша причина вагінальних виділень у жінок у Сполучених Штатах [45]. Хоча це захворювання, яке не підлягає обов’язковому повідомленню, щороку виявляють понад 3 мільйони випадків з клінічною симптоматикою [62]. Оскільки приблизно половина випадків бактеріального вагінозу є безсимптомними [32], фактична щорічна кількість нових випадків перевищує 6 мільйонів. Поширеність бактеріального вагінозу коливається в межах від 25 % у жінок із загальної популяції до 50–60 % у жінок, які відвідують спеціалізовані клініки з лікування хвороб, які передаються статевим шляхом. Захворювання спостерігається виключно в сексуально активних жінок. Раніше бактеріальному вагінозу приділяли незначну увагу і називали його неспецифічним вагінітом (або Gardnerella-вагінітом); нині його вважають значною мірою пов’язаним із ускладненнями вагітності, наприклад передчасний розрив оболонок плода, передчасні пологи і мала маса тіла новонародженого [63–65]. Крім того, він пов’язаний з гінекологічними ускладненнями, такими як післяабортний ендометрит, післяекстирпаційний целюліт склепіння піхви і запалення органів малого таза [65, 66].
Хоча патогенез бактеріального вагінозу все ще неясний, мікробіологічні кореляти його описано добре. Коротко кажучи, невідомий, провокуючий випадок призводить до різких змін вагінальної флори. Нормальна здорова вагінальна флора вміщує насамперед лактобактерії в кислому середовищі. У жінок із бактеріальним вагінозом кількість лактобактерій, зокрема штамів, що виробляють Н2О2 зменшується і у вагінальній флорі з’являється велика кількість анаеробних і факультативно анаеробних бактерій [22, 67]. Ці мікроорганізми містять надмірну кількість G.vaginalis, Mycoplasma hominis, Bacteroides spp., Prevotella можуть існувати у невеликій кількості в нормі, Mobiluncus spp. рідко спостерігають у нормальній здоровій вагінальній флорі [70]. Це неймовірне зростання кількості анаеробних мікроорганізмів у вагінальній флорі жінок із бактеріальним вагінозом порівнюють з анаеробним абсцесом [71]. Деякі середовищні наслідки виникають разом із цим зростанням кількості анаеробних мікроорганізмів, наприклад знижений окислювально-відновлювальний потенціал і накопичення поліамінів [71]. Поліаміни викликають запах при бактеріальному вагінозі й сприяють вагінальній ексфоліації епітеліальних клітин, характерній саме для нього [71, 72]. Цікаво, що запальна реакція при цій патології відсутня, отже, термін «вагіноз» точніший, аніж термін «вагініт».
Точна етіологія бактеріального вагінозу невідома. Крім того, послідовність мікробіологічних процесів, що відбуваються, недостатньо визначена. Епідеміологічні кореляти бактеріального вагінозу включають використання внутрішньоматкових пристроїв, хвороби, які передаються статевим шляхом (особливо трихомоноз) в анамнезі, збільшення кількості сексуальних партнерів, новий сексуальний партнер протягом місяця, що передує початку ознак, і спринцювання [32, 73–76]. Причина й механізм взаємозв’язку між бактеріальним вагінозом і спринцюванням неясні. Невідомо, чи викликає спринцювання зміни у вагінальній флорі, або жінки вдаються до спринцювання через запах, спричинений бактеріальним вагінозом.
Часто говорять про передачу бактеріального вагінозу статевим шляхом, але це не доведено.
Бактеріальний вагіноз рідко виявляють у жінок, які не мали статевих стосунків [77]. У своїй першій доповіді стосовно Haemophilus vaginalis (тепер G.vaginalis) Gardner і Dukes недвозначно заявили, що хвороба передається статевим шляхом, виходячи з показників високої частоти рецидивів і виявлення мікроорганізмів (Н.vaginalis) у понад 90 % партнерів-чоловіків [78]. G.vaginalis і анаеробні бактерії, подібні до виявлених у пацієнток з бактеріальним вагінозом, пов’язані із баланопоститом у чоловіків, інфекцією, яка певним чином у клінічному та мікробіологічному плані нагадує синдром бактеріального вагінозу в жінок [79, 80]. Крім того, G.vaginalis і анаероби часто ізолюють у спермі чоловіків, які не мають клінічних симптомів [81]. Нарешті, серед лесбіянок у разі моногамних стосунків виявили високий показник збігу випадків бактеріального вагінозу [82]. Це, так само, як і наявність пов’язаних із бактеріальним вагінозом мікроорганізмів у чоловічих статевих шляхах, свідчить про статеву передачу інфекції.
На доказ протилежної точки зору бактерії, пов’язані з бактеріальним вагінозом, виявлено у прямій кишці, і це може бути потенційним резервуаром інфекції. Ректальне бацилоносійство Mobiluncus spp., M.hominis або G.vaginalis виявили у 45–62 % жінок з бактеріальним вагінозом проти 10–14 % жінок без нього, підтверджуючи тим самим, що бактерії, пов’язані з бактеріальним вагінозом, скоріше надходять з ректального резервуара, аніж через статеву передачу [83]. Крім того, виявлено, що лікування партнера-чоловіка не корелює з меншою частотою рецидивів бактеріального вагінозу [84–86].
Бактеріальний вагіноз із клінічними проявами викликає вагінальні виділення і/або запах. Запах, звичайно описуваний як «рибний», може бути більш відчутний після незахищеного статевого акту або під час менструації. Іноді пацієнтка може скаржитися на подразнення вульви. Оскільки не було ідентифіковано єдиного збудника, клініцисти покладаються на так звані критерії Amsel [32]. Ці критерії полягають у тому, що бактеріальний вагіноз діагностують, якщо наявні три з чотирьох умов: 1) підвищений вагінальний рН (більше 4,5); 2) позитивний запах аміну при пробі з 10%-відсотковим КОН (аміновий тест); 3) наявність «ключових клітин» (плоских епітеліальних клітин, обліплених бактеріями) у препараті вагінальних виділень у фізіологічному розчині; 4) однорідність вагінальних виділень [32, 33]. Хоча оригінальні критерії Amsel не визначали кількість «ключових клітин», які повинні бути наявні, зараз вважають, що принаймні 20 % епітеліальних клітин мають бути «ключовими клітинами» [33]. Ця модифікація дещо посилює специфічність діагнозу, але суттєво зменшує чутливість [87]. При дослідженні вагінальних виділень під мікроскопом також треба визначити морфотипи бактерій. Наприклад, якщо присутні лише морфотипи лактобактерій (помірно довгі палички), малоймовірно, що в пацієнтки бактеріальний вагіноз. З іншого боку, рухливі вигнуті палички, що є Mobiluncus, змушують замислитися щодо діагнозу [69, 88]. Лейкоцити будуть наявні не лише у пацієнток із бактеріальним вагінозом, їхня присутність у вагінальній рідині має насторожити клініциста щодо можливості супутньої інфекції як у піхві, так і в шийці матки. Хоча критерії Amsel є найчастіше використовуваними методами діагностики бактеріального вагінозу, існують труднощі з чутливістю і специфічністю окремих параметрів. Наприклад, підвищення вагінального рН недостатньо специфічне, а аміновий тест є суб’єктивним і має недостатню чутливість [33]. Хоча наявність «ключових клітин» — найчутливіший і найспецифічніший з конкретних параметрів, їх виявлення залежить від професіоналізму і майстерності спеціаліста з мікроскопії. Забарвлення за Грамом як надійний засіб діагностики бактеріального вагінозу має перевагу в тому, що воно зберігається і його можна перевірити. При використанні цього методу можна підрахувати кількість бактерій морфотипів, які відповідають lactobacilli, Gardnerella і Mobiluncus. Розроблено стандартизовані критерії, що сприяють інтерпретації і мають задовільну відтворюваність як для одного дослідника, так і для різних дослідників [89]. У мультицентровому дослідженні, в якому порівнювали забарвлення за Грамом вагінальних виділень та критерії Amsel, виявлено, що чутливість і специфічність забарвлення за Грамом становить відповідно 89 і 83 %. Якщо забарвлення за Грамом вважається золотим стандартом, чутливість і специфічність критеріїв Amsel — відповідно 70 і 94 %, це свідчить про те, що використання критеріїв Amsel може призводити до гіподіагностики [87]. Інші діагностичні тести в разі бактеріального вагінозу передбачають виявлення пролін-амінопептидази у вагінальній рідині, аналіз проби олігонуклеотиду для виявлення високої концентрації G.vaginalis [57] і швидкий аналіз з використанням тест-смужок на визначення рН і амінів, який може бути корисний для скринінгу. Отримання мікробної культури Gardnerella з вагінальних виділень не має жодного значення в діагностиці бактеріального вагінозу, оскільки Gardnerella можуть бути присутні у близько 60 % здорових жінок [21].
Половина всіх жінок з бактеріальним вагінозом не мають клінічних симптомів [32]. У попередніх дослідженнях не вивчали систематично, чи насправді жінки з безсимптомним бактеріальним вагінозом не мають симптоматики, чи їхні симптоми недостатньо розпізнано або не зафіксовано. Чверть жінок з бактеріальним вагінозом визнають у себе ознаки вагінальної патології лише після прямого опитування [32]. Жінки можуть не визнавати наявності неприємного вагінального запаху або деякі з них, можливо, сприймають цей запах за нормальний. Лікарі можуть підкріплювати останнє неналежним діагностуванням і лікуванням бактеріального вагінозу. Лікування безсимптомного бактеріального вагінозу в невагітних пацієнток є спірним і нині не є стандартом практики [58]. Можливі винятки стосуються жінок, яким роблять аборти або екстирпацію матки, оскільки бактеріальний вагіноз у цих пацієнток корелює з інфекційними ускладненнями. Упроваджуються методичні рекомендації стосовно дослідження і лікування бактеріального вагінозу у вагітних пацієнток через його зв’язок з передчасними пологами і розродженням. Сьогодні деякі спеціалісти радять проводити скринінгове обстеження й лікування безсимптомного бактеріального вагінозу в другий триместр вагітності в жінок, які мають високий ризик передчасного розродження (у них вже було передчасне розродження) [58]. Лікування цих жінок дає змогу суттєво зменшити кількість нових випадків передчасних пологів [90]. Триває дослідження таких самих проблем у жінок, які не мають високого ризику передчасного розродження.
Мета лікування бактеріального вагінозу — знищити анаеробні та факультативно анаеробні бактерії, присутні при цій полімікробній інфекції. Ефективність лікування метронідазолом (metronidazole) чи кліндаміцином (clindamycin) наближається до 90 % [91,92]. Вилікування, однак, часто нетривале; повідомляють про частоту повторного захворювання у 30–40 % протягом трьох місяців [93]. Повторна хвороба може являти собою рецидив або повторну інфекцію. На підтримку можливості рецидиву свідчить той факт, що навіть після успішного знищення більшості патогенних бактерій можуть залишатися постійні порушення, наприклад підвищений вагінальний рН і певна кількість бактерій, пов’язаних з бактеріальним вагінозом [94]. Проблему повторної інфекції вивчено недостатньо, але в лонгітюдному дослідженні біотипів G.vaginalis у 90 % жінок, в яких розвивався бактеріальний вагіноз, визначали новий біотип мікроорганізмів, що свідчить радше про нову інфекцію, аніж про рецидив [95]. Лікувальні препарати — метронідазол і кліндаміцин як перорально, так й інтравагінально. Хоча деякі клініцисти віддають перевагу використанню одноразово 2 г метронідазолу в таблетках, щоб полегшити дотримання режиму лікування, 500 мг перорально двічі на день протягом семи днів має вищу ефективність [84]. Місцеве використання препаратів метронідазолу або кліндаміцину настільки ж ефективне в лікуванні бактеріального вагінозу, як і пероральні засоби, і воно позбавлене системних побічних ефектів, хоча трапляються локальні побічні ефекти, наприклад вагінальні дріжджові інфекції [58, 96–98]. Викликає занепокоєння те, що місцеві засоби не є адекватною терапією для вагітних пацієнток, у яких, можливо, відбулася колонізація верхніх репродуктивних шляхів бактеріями, пов’язаними з бактеріальним вагінозом, але в жодному з досліджень не вивчали конкретно цю проблему [99]. Вагітним не рекомендують користуватися маззю кліндаміцину, оскільки це пов’язано із зростанням ризику передчасного розродження [58]. Багато клініцистів відмовляються призначати метронідазол у період вагітності, але немає жодних доказів на підтримку цієї думки [59, 60]. Відновлення вагінальної флори екзогенними лактобактеріями запропоновано як доповнення до терапії антибіотиками, однак ефективна колонізація неможлива без використання штаму, отриманого від людини [31, 100].
Бактеріальний вагіноз часто є супутньою інфекцією за наявності інших інфекцій піхви і шийки матки. Зв’язок між бактеріальним вагінозом і цервіцитом добре підтверджений [74, 101, 102]. До 50 % жінок з цервіцитом можуть мати супутній бактеріальний вагіноз — це відкриття започаткувало гіпотезу про те, що фізіологічні зміни, пов’язані з цервіцитом, створюють сприятливі умови для розвитку бактеріального вагінозу [101, 103]. Зауважимо, що високий показник цієї супутньої інфекції створює проблеми для лікування, оскільки до розробки місцевих засобів лікування бактеріального вагінозу одночасне лікування обох інфекцій потребуватиме застосування двох пероральних засобів, кожен із яких має побічні ефекти з боку шлунково-кишкового тракту. Ця проблема, разом із переконанням, що бактеріальний вагіноз може спонтанно зникнути під час лікування цервіциту, є підставою для рекомендацій лікувати лише інфекцію шийки матки [101]. Однак нові дані свідчать про те, що такий підхід не сприяє вилікуванню бактеріального вагінозу, натомість він призводить до непотрібного й потенційно небажаного зволікання з відновленням нормальної вагінальної флори [104].
Досліджувалися й інші зв’язки між бактеріальним вагінозом і хворобами, що передаються статевим шляхом. У ретроспективному дослідженні статевих контактів жінок з чоловіками, хворими на гонорею, виявлено, що більш імовірним було інфікування N.gonorrhoeae жінок без лактобактерій, аніж жінок з лактобактеріями [9]. Виявлено потужні кореляції між бактеріальним вагінозом з єдиною доведеною причиною вагініту, який передається статевим шляхом, — Т.vaginalis. Відомо, що жінки з трихомонозом часто мають супутню інфекцію збудниками бактеріального вагінозу або бактеріями, пов’язаними з ним, при цьому показники подвійної інфекції сягають 86 % [44, 105]. Накопичується інформація також щодо можливої ролі бактеріального вагінозу як чинника ризику ВІЛ-інфекції. Серед представниць секс-індустрії в Таїланді серопозитивний статус щодо ВІЛ значною мірою корелював з наявністю бактеріального вагінозу [106]. Подібні результати підтверджено дослідженнями, проведеними в Уганді [107]. Отже, альтернативне пояснення співіснування бактеріального вагінозу і хвороб, які передаються статевим шляхом, полягає в тому, що відсутність захисних лактобактерій у пацієнток із бактеріальним вагінозом передує зараженню хворобою, що передається статевим шляхом, і полегшує цей процес.
Інфекції верхніх репродуктивних шляхів також пов’язані з аномальною вагінальною флорою. Епідеміологічні дослідження довели, що бактеріальний вагіноз може спричинити запальні процеси в органах малого таза і пов’язані з ним мікроорганізми часто ізолюють у культурах з маткових труб жінок з такими захворюваннями, як з С.trachomatis або N.gonorrhoeae, і без них [33, 66, 108, 109]. В одному з досліджень виявлено, що домінують ізоляти анаеробних бактерій, які трапляються у 92 % пацієнток з негонококовим і нехламідійним запальними процесами органів малого таза [110]. Ендометрит — це початковий етап патогенезу сальпінгіту (запалення маткової труби). Дослідження, у якому порівнювали різні режими лікування запальних процесів органів малого таза, показало, що бактерії, пов’язані з бактеріальним вагінозом, набагато частіше ізолювали з ендометрію тих жінок, у яких виявилося невдалим початкове лікування запальних процесів органів малого таза [111]. Вважається, що мікроорганізми, пов’язані з бактеріальним вагінозом, здатні колонізувати ендометрій. Серед жінок без клінічних ознак інфекції верхніх репродуктивних шляхів виявлено, що жінки з бактеріальним вагінозом імовірніше, аніж жінки без вагінозу, мають внутрішньоматкову колонізацію мікроорганізмами, пов’язаними з бактеріальним вагінозом, так само як гістологічно підтверджений ендометрит [112]. Інші інфекції верхніх репродуктивних шляхів, пов’язані з бактеріальним вагінозом, включають післяекстирпаційний ендометрит, целюліт склепіння піхви і запалення органів малого таза після аборту в першому триместрі вагітності [65, 66, 113, 114].
Також спостерігалася колонізація верхніх репродуктивних шляхів бактеріями, пов’язаними з бактеріальним вагінозом, під час вагітності. У дослідженні з вивчення ролі хоріоамніоніту в передчасних пологах мікробна колонізація хоріоамніону виявилася пов’язаною з передчасним розродженням [64]. Численні епідеміологічні дослідження довели, що бактеріальний вагіноз пов’язаний із малою масою тіла дитини при народженні, передчасним руйнуванням оболонок плода і передчасними пологами [64, 65, 115–117]. У рандомізованому контрольованому дослідженні, присвяченому проблемі використання антибіотиків (метронідазолу і еритроміцину) порівняно з плацебо в другому триместрі вагітності з метою запобігти передчасному розродженню в жінок з високим ризиком цієї патології, прийом антибіотиків сприяв зменшенню частоти передчасного розродження, особливо серед жінок з бактеріальним вагінозом [90]. Інше дослідження щодо використання лише одного метронідазолу порівняно з плацебо в групі жінок із високим ризиком передчасних пологів за наявності бактеріального вагінозу також засвідчило зменшення кількості випадків передчасного розродження в групі жінок, які отримували лікування з цього приводу [118]. Післяпологовий ендометрит також більш поширений серед жінок з бактеріальним вагінозом [65].
Висновки
Дедалі більше усвідомлення ролі нормальної вагінальної флори та несприятливих наслідків, пов’язаних із вагінітом, сприяло новій оцінці важливості своєчасного, точного діагнозу й лікування. Розроблено швидкі й недорогі діагностичні тести, і варто розпочати проведення скринінгу серед жінок із групи високого ризику. Необхідні додаткові дослідження для того, щоб визначити перевагу скринінгу й лікування для жінок без клінічної симптоматики з групи низького ризику.
1. Kent H.Z. Epidemiology of vaginitis // Am. J. Obstet. Gynecol. 1991. 165, 1168-1176.
2. Ferris D.G., Dekle C., Litaker M.S. Women’s use of over-the counter antifungal medications for gynecologic symptoms // J. Fain. Pract. 1996. 42, 595-600.
3. Nyirjesy P., Weitz M.V., Lorber B. Over-the-counter and alternative medicines in the treatment of chronic vaginal symptoms // Obstet. Gynecol. 1997. 90, 50-53.
4. Paavonen J. Physiology and ecology of the vagina // Scand. J. Infect. Dis. 1983. S40, 31-35.
5. Redondo-Lopez V., Cook R.L., Sobel J.D. Emerging role of lactobacilli in the control and maintenance of the vaginal bacterial microflora // Rev. Infect. Dis. 1990. 12, 856-872.
6. Whittenbury R. Hydrogen peroxide formation and catalase activity in the lactic acid bacteria // J. Gen. Microbiol. 1964. 35, 13-26.
7. Barefoot S.F., Klaenhammer T.R. Detection and activity of lactacin B. A bacteriocin produced by Lactobacillus acidophilus // Appl. Environ. Microbiol. 1983. 45, 1808-1815.
8. Skarin A., Sylwan J. Vaginal lactobacilli inhibiting growth of Gardnerella vaginalis, Mobiluncus and other bacterial species cultured from vaginal content of women with bacterial vaginosis // Acta Pathol. Microbiol. Immunol. Scand., Sect. В. 1986. 94В, 399-403.
9. Saigh J.H., Sanders C.C., Sanders W.E. Inhibition of Neisseria gonorrhoeae by aerobic and facultatively anaerobic components of the endocervical flora: Evidence for a protective effect against infection // Infect. Immun. 1978. 19, 704-710.
10. Klebanoff S.J., Coombs R.W. Viricidal effect of Lactobacillus acidophilus on human immunodeficiency virus type I: Possible role in heterosexual transmission // J. Exp. Med. 1991. 174, 289-292.
11. Klebanoff S.J., Hillier S.L. Control of the microbial flora of the vagina by H202-generating lactobacilli // J. Infect. Dis. 1991. 164, 94-100.
12. Zheng H., Alcorn T.M., Cohen M.S. Effects of H2O2-producing lactobacilli on Neisseria gonorrhoeae and catalase activity // J. Infect. Dis. 1994. 170, 1209-1215.
13. Hillier S.L., Krohn M.A., Klebanoff S.F., Eschenbach D.A. The relationship of hydrogen peroxide-producing lactobacilli to bacterial vaginosis and genital microflora in pregnant women // Obstet. Gynecol. 1992. 79, 369-373.
14. Hillier S.L., Krohn M.A., Nugent R.P., Gibbs R.S. Characteristics of three vaginal flora patterns assessed by Gramstain among pregnant women // Am. J. Obstet. Gynecol. 1992. 166, 938-944.
15. Hillier S.L., Krohn M.A., Nugent R.P., Gibbs R.S. The normal vaginal flora, H2О2-producing lactobacilli and bacterial vaginosis in pregnant women // Clin. Infect. Dis. 1993. 16(S4), S273-S281.
16. Boris S., Suarez J.E., Vazquez F., Barber C. Adherence of human vaginal lactobacilli to vaginal epithelial cells and interaction with uropathogens // Infect. Immun. 1998. 66, 1985-1989.
17. Cohen M.S., Weber R.D., Mardh P.A. Genitouri-nary mucosal defenses // Sexually Transmitted Diseases / K.K. Holmes, P.A. Mardh, P.G. Sparling, eds. — New York: McGraw-Hill, 1990. — Р. 117-127.
18. Rasmussen S.J., Echmann L., Quayle A.J., Shen L., Zhang Y., Anderson D.J., Fierer J.S., Stephens J., Kagnoff R.S., Stephens R.S., Kagnoff M.F. Secretion of pro-inflammatory cytokines by epithelial cells in response to chlamydia infections suggests a central role for epithelial cells in chlamydial pathogenesis // J. Clin. Invest. 1997. 99, 77-87.
19. Stevens-Simon C., Jamison J., McGregor J.A., Douglas J.M. Racial variation in vaginal pH among healthy sexually active adolescents // Sex. Transin. Dis. 1994. 21, 168-172.
20. White H.D., Yeaman G.R., Givan A.L., Wira C.R. Mucosal immunity in the human female reproductive tract: Cytotoxic T lymphocyte function in the cervix and vagina of premen-opausal and postmenopausal women // Am. J. Reprod. Immunol. 1997. 37, 30-38.
21. Hillier S.L. Diagnostic microbiology of bacterial vaginosis // Am. J. Obstet. Gynecol. 1993. 169, 455-459.
22. Eschenbach D.A., Davick P.R., Williams B.L., Klebanoff S.J., Young-Smith K., Critchlow C.M., Holmes K.K. Prevalence of hydrogen peroxide-producing Lactobacillus species in normal women and women with bacterial vaginosis // J. Clin. Microbiol. 1989. 27, 251-256.
23. Bartlett J.G., Onderdonk A.B., Drude E., Goldstein C., Ander- ka M., Alpert S., McCormick W.M. Quantitative bacteriology of the vaginal flora // J. Infect. Dis. 1977. 136, 271-277.
24. Sautter R.L., Brown W.J. Sequential vaginal cultures from normal young women // J. Clin. Microbiol. 1980. 11, 479-484.
25. Brown W.J. Variations in the vaginal bacterial flora // Ann. Intern. Meet. 1982. 96, 931-934.
26. Johnson S.R., Petzold C.R., Galask R.P. Qualitative and quantitative changes of the vaginal microbial flora during the menstrual cycle // Am. J. Reprod. Immunol. Microbiol. 1985. 9, 1-5.
27. Priestley C.J.F., Jones В.М., Dhar J., Goodwin L. What is normal vaginal flora? // Genilourin Med. 1997. 73, 23-28.
28. Schwebke J.R., Morgan S.C., Weiss H.L. The use of sequential self-obtained vaginal smears for detecting changes in the vaginal flora // Sex. Transm. Dis. 1997. 24, 236-239.
29. Berg A.O., Heidrich F.E., Fihn S.D., Bergmann J.J., Wood R.W., Stamm W.E., Holmes K.K. Establishing the cause of genitourinary symptoms in women in a family practice: Comparison of clinical examination and comprehensive microbiology // J. Am. Med. Assoc. 1984. 251, 620-625.
30. Thomason J.L., Gelbart S.M., Scaglione J.J. Bacterial vaginosis: Current review with indications for asymptomatic therapy // Am. J. Obstet. Gynecol. 1991. 165, 1210-1217.
31. Sobel J.D. Vaginitis // N. Engl. J. Med. 1997. 337, 1896-1903.
32. Amsel R., Totten P.A., Spiegel C.A., Chen K.C.S., Eschenbach D., Holmes K.K. Non-specific vaginitis: Diagnostic and microbial and epidemiological associations // Am. J. Med. 1983. 74, 14-22.
33. Eschenbach D.A., Hillier S., Critchlow C., Stevens C., De-Rouen T., Holmes K.K. Diagnosis and clinical manifestations of bacterial vaginosis // Am. J. Obstet. Gynecol. 1988. 158, 819-828.
34. Sparks J.M. Vaginitis // J. Reprod. Med. 1991. 36, 745-752.
35. Sobel J.D., Faro S., Force R.W., Forman B., Ledger W.J., Nyirjesy P.R., Reed B.D. Vulvovaginal candidiasis: Epidemiologic, diagnostic and therapeutic considerations // Am. J. Obstet. Gynecol. 1998. 178, 203-211.
36. Vazquez J.A., Sobel J.D., Demitriou R., Vaishampayan J., Lynch M., Zervos M.J. Karyotyping of Candida albicans isolates obtained longitudinally in women with recurrent vulvovaginal candidiasis // J. Infect. Dis. 1994. 170, 1566-1569.
37. Sobel J.D., Chaim W. Vaginal microbiology of women with acute recurrent vulvovaginal candidiasis // J. Clin. Microbiol. 1996. 34, 2497-2499.
38. Nyirjesy P., Seeney S.M., Grody M.H.T., Jordan C.A., and Brickley H.R. Chronic fungal vaginitis: The value of cultures // Am. J. Obstet. Gynecol. 1995. 173, 820-823.
39. Sobel J.D., Brooker D., Stein G.E., Thomason J.L., Wermeling D.P., Bradley B., Weinstein L. Study Group FV Single oral dose fluconazole compared with conventional clotri-mazole topical therapy of Candida vaginitis // Am. J. Obstet. Gynecol. 1995. 172, 1263-1264.
40. Schwebke J.R., Morgan S.C., Pinson G.B. Validity of self obtained vaginal specimens for diagnosis of trichomoniasis // J. Clin. Microbiol. 1997. 35, 1618-1619.
41. Lossick J.G. The descriptive epidemiology of vaginal trichomoniasis and bacterial vaginosis // Vaginitis and Vaginosis / B.J. Horowitz, P.A. Mrdh, eds., Wiley-Liss. — New York, 1991. — Р. 77-84.
42. Lossick J.S. Epidemiology ofurogenital trichomoniasis // Trichomonads Parasitic in Humans / В.М. Honigberg, ed. — New York: Springer, 1989. — Р. 313.
43. Jirovec O., Petri M. Trichomonas vaginalis and trichomoniasis // Adv. Parasitol. 1968. 6, 117.
44. Wölner-Hanssen P., Krieger J.N., Stevens C.E., Kiviat N.B., Koutsky L., Critchlow C., DeRouen T., Hillier S., Holmes K.K. Clinical manifestations of vaginal trichomoniasis // J. Am. Meet. Assoc. 1989. 261, 571-576.
45. Rein M.R, Holmes K.K. «Non-specific vaginitis», vulvovaginal candidiasis, and trichomoniasis clinical features, diagnosis and management // Curr. Clin. Top. Infect. Dis. 1983. 4, 281-315.
46. Fouts A.C, Kraus S.J. Trichomonas vaginalis: Re-evaluation of its clinical presentation and laboratory diagnosis // J. Infect. Dis. 1980. 141, 137-143.
47. Rein M.F., Müller M. Trichomonas vaginalis and trichomoniasis // Sexually Transmitted Diseases / K.K. Holmes, P.A. Mardh, P.F. Sparling, eds. — New York: McGraw-Hill, 1990. — Р. 481-490.
48. Cotch M.F., Pastorek J.G., Nugent R.P., Hillier S.L, Gibbs R.S., Martin D.H, Eschenbach D.A., Edelman R., Carey J.C., Reegan J.A., Krohn M.A., Klebanoff M.A., Rao A.V, Rhoads G.G. (1997).
49. Trichomonas vaginalis associated with low birth weight and preterm delivery // Sex. Transm. Dis. — 24. — 361-362.
49. Skirrow S.Z., BonDurant R.H. Bovine trichomoniasis // Vet. Bull 1988. 58, 591-603.
50. Klouman E., Massenga E.J. HIV and reproductive tract infections in a total village population in rural Kilimanjaro, Tanzania: Women at increased risk // AIDS Hum. Retrovirol. 1997. 14, 163-168.
51. Laga M., Manoka A., Kivuvu M., Malele B., Tuliza M., Nzila N., Goeman J., Behets F., Batter V., Alary M. Non-ulcerative sexually transmitted diseases as risk factors for H1V-1 transmission in women: Results from a cohort study // AIDS 1993. 7, 95-102.
52. Krieger J.N., Tarn M.R., Stevens C.E., Nielsen I.O., Hale J., Kiviat N.B., Holmes K.K. Diagnosis of trichomoniasis // J. Am. Med. Assoc. 1988. 259, 1223-1227.
53. Pastorek J.G., Cotch M.F., Martin D.H., Eschenbach D.A. Clinical and microbiological correlates of vaginal trichomoniasis during pregnancy. The Vaginal Infections and Prematurity Study Group // Clin. Infect. Dis. 1996. 23, 1075-1080.
54. Draper D., Parker R., Patterson E., Jones W., Beutz M., French J., Borchardt K., McGregor J. Detection of Trichomonas vaginalis in pregnant women with the InPouch TV system // J. Clin. Microbiol. 1993. 31,1016-1018.
55. Wawer M.J., McNairn D., Wabwire-Mangen R., Paxton L., Gray R.H., Kiwanuka N. Self administered vaginal swabs for population-based assessment of Trichomonas vaginalis prevalence // Lancet 1995. 345, 131-132.
56. DeMeo M.R., Draper D.L., McGregor J.A., Moore D.F., Petey C.R., Kapernick P.S., McCormack W.M. Evaluation of a deoxyribonucleic acid probe for the detection of Trichomonas vaginalis in vaginal secretions // Am. J. Obstet. Gynecol. 1996. 174, 1339-1342.
57. Briselden A.M., Hillier S.L. Evaluation of Affirm VP microbial identification test for Gardnerella vaginalis and Trichomonas vaginalis // J. Clin. Microbiol. 1994. 32, 148-152.
58. Centers for Disease Control 1998 Guidelines for treatment of sexually transmitted diseases // Morbid. Mortal. Wkly. Rep. 1998. 47(RR-1), 70-79.
59. Burtin P., Taddio A., Aribumu O., Einarson T.R., Koren G. Safety of metronidazole in pregnancy: A meta-analysis // Am. J. Obstet. Gynecol. 1995. Ill, 525-529.
60. Schwebke J.R. Metronidazole: Utilization in the obstetric and gynecologic patient // Sex. Transm. Dis. 1995. 22, 370-376.
61. Lossick J.G., Muller M., Gorrell T.E. In vitro drug susceptibility and doses of metronidazole required for cure in cases of refractory vaginal trichomoniasis // J. Infect. Dis. 1986. 153, 948-955.
62. Fleury P.J. Adult vaginitis // Clin. Obstet. Gynecol. 1981. 24, 407-438.
63. Martius J., Eschenbach D.A. The role of bacterial vaginosis as a cause of amniotic fluid infection, chorioamnionitis and prematurity — a review // Arch. Gynecol. Obstet. 1990. 247, 1-13.
64. Hillier S.L., Martius J., Krohn M., Kiviat N., Holmes K.K., and Eschenbach D.A. A case-control study ofchorioam-nionic infection and histologic chorioamnionitis in prematurity // N. Engl. J. Med. 1988. 319, 972-978.
65. Eschenbach D.A. Bacterial vaginosis and anaerobes in obstetric-gynecologic infection // Clin. Infect. Dis. 1993. 16, S282-S287.
66. Paavonen J., Teisala K., Heinonen P.K., Aine R., Laine S., Lehtinen M., Miettinen A., Punnonen R., Gronroos P. Microbiological and histopathologi-cal findings in acute pelvic inflammatory disease // Br. J. Obstet. Gynaecol. 1987. 94, 454-460.
67. Spiegel C.A., Amsel R., Eschenbach D., Schoenknecht R., Holmes K.K. Anaerobic bacteria in non-specific vaginitis // N. Engl. J. Med. 1980. 303, 601-607.
68. Spiegel C.A. Bacterial vagino- sis // Clin. Microbiol. Rev. 1991. 4, 485-502.
69. Thomason J.L., Schreckenberger P.C., Spellacy W.N., Riff L.J., Le Beau L.J. Clinical and microbiological characterization of patients with non-specific vaginosis associated with motile, curved anaerobic rods // J. Infect. Dis. 1984. 149, 801-809.
70. Hillier S.L., Critchlow C.W., Stevens C.E., Roberts M.C., Wölner-Hanssen P., Eschenbach D.A., Holmes K.K. Microbiological, epidemiological and clinical correlates of vaginal colonization by Mohiluncus species. Genitourin. Med. 1991. 67, 26-31.
71. Sobel J.D. Bacterial vaginosis — an ecologic mystery // Ann. Intern. Med. 1989. 111, 551-553.
72. Chen K.C.S., Forsyth P.S., Buchanan T.M., Holmes K.K. Amine content of vaginal fluid from untreated and treated patients with nonspecific vaginitis // J. Clin. Invest. 1979. 63, 828-835.
73. Barbone R., Austin H., Louv W.C., Alexander W.J. A follow-up study of methods of contraception, sexual activity and rates of trichomoniasis, candidiasis and bacterial vaginosis // Am. J. Obstet. Gynecol. 1990. 163, 510-514.
74. Moi H. Prevalence of bacterial vaginosis and its association with genital infections, inflammation and contraceptive methods in women attending sexually transmitted disease and primary health clinics // Int. J. STD AIDS 1990. 1, 86-94.
75. Paavonen J., Miettinen A., Stevens C.E., Chen K.C.S., Holmes K.K. Mycoplasma hominis in non-specific vaginitis // Sex. Transm. Dis. 1983. 45, 271-275.
76. Wölner-Hanssen P., Eschenbach D.A., Paavonen J., Stevens C.E., Kiviat N.B., Critchlow C., DeRouen T., Koutsky L., Holmes K.K. Association between vaginal douching and acute pelvic inflammatory disease // J. Am. Med. Assoc. 1990. 263, 1936-1941.
77. Bump R.C., Buesching W.J. Bacterial vaginosis in virginal and sexually active adolescent females: Evidence against exclusive sexual transmission // Am. J. Obstet. Gynecol. 1988. 158, 935-939.
78. Gardner H.L., Dukes C.D. Haemophilus vaginalis vaginitis // Am. J. Obstet. Gynecol. 1955. 69, 962-976.
79. Kinghorn G.R., Jones B.M., Chowdhury F.H., Geary I. Balanoposthitis associated with Gardnerella vaginalis infection in men // Br. J. Verier. Dis. 1982. 58, 127-129.
80. Masfari A.N., Kinghorn G.R., Duerden B.I. Anaerobes in genitourinary infections in men // Br. J. Verier. Dis. 1983. 59, 255-259.
81. Hillier S.L., Rabe L.K, Muller C.H., Zarutskie P., Kuzan F.B., Stenchever M.A. Relationship of bacteriologic characteristics to semen indices in men attending an infertility clinic // Obstet. Gynecol. 1990. 75, 800-804.
82. Berger В.J., Kolton S., Zenilman J.M., Cummings M.C., Feldman J., McCormick W.M. Bacterial vaginosis in lesbians: A sexually transmitted disease // Clin. Infect. Dis. 1995. 21, 1402-1405.
83. Hoist E. Reservoir of four organisms associated with bacterial vaginosis suggests lack of sexual transmission // J. Clin. Microbiol. 1990. 28, 2035-2039.
84. Swedberg J., Steiner J.F., Deiss F., Steiner S., Driggers D.A. Comparison of single-dose vs. one-week course of metronidazole for symptomatic bacterial vaginosis // J. Am. Med. Assoc. 1985. 254, 1046-1049.
85. Vejtorp M., Bollerup A.C., Vejtorp L., Fanoe E., Nathan E., Reiter A., Anderson M.E., Stromsholt B., Schroder S.S. Bacterial vaginosis: A double-blind randomized trial of the effect of treatment of the sexual partner // Br. J. Obstet. Gynaecol. 1988. 95, 920-926.
86. Mengel M.B., Berg A.O., Weaver C, Herman D.J., Herman S.J., Hughes V.L., Koepsell T.K. The effectiveness of single-dose metronidazole therapy for patients and their partners with bacterial vaginosis // J. Fam. Pract. 1989. 28, 163-171.
87. Schwebke J.R., Hillier S.L., Sobel J.D., McGregor J.A., Sweet R.L. Validity of the vaginal Gram stain for the diagnosis of bacterial vaginosis // Obstet. Gynecol. 1996. 88, 573-576.
88. Livengood C.H., Thomason J.L., Hill G.B. Bacterial vaginosis: Diagnostic and pathogenetic findings during topical clindamycin therapy // Am. J. Obstet. Gynecol. 1990. 163, 515-520.
89. Nugent R.P., Krohn M.A., Hillier S.L. Reliability of diagnosing bacterial vaginosis is improved by a standardized method of Gram stain interpretation // J. Clin. Microbiol. 1991. 29, 297-301.
90. Hauth J.C, Goldenberg R.L., Andrews W.W., DuBard M.B., Copper R.L. Reduced incidence ofpreterm delivery with metronidazole and erythromycin in women with bacterial vaginosis // N. Engl. J. Med. 1995. 333, 1732-1736.
91. Lossick J.G. Treatment of sexually transmitted vaginosis/vaginitis // Rev. Infect. Dis. 1990. 12(S6), S665-S681.
92. Pheiffer T.A., Forsyth P.S., Durfee M.A., Pollock H.M., Holmes K.K. Non-specific vaginitis // N. Engl. J. Med. 1978. 298, 1429-1434.
93. Blackwell A.L., Fox A.R., Phillips I., Barlow D. Anaerobic vaginosis (non-specific vaginitis): Clinical, microbiological and therapeutic findings // Lancet 1982. 2, 1379-1382.
94. Cook R.L., Redondo-Lopez V., Schmitt C., Meriweather C., Sobel J.D. Clinical, microbiological, and biochemical factors in recurrent bacterial vaginosis // J. Clin. Microbiol. 1992. 30, 870-877.
95. Briselden A.M., Hillier S.H. Longitudinal study of the biotypes of Gardnerella vaginalis // J. Clin. Microbiol. 1990. 28, 2761-2764.
96. Hillier S.L., Krohn M.A., Watts H., Wölner-Hanssen P., Eschenbach D. Microbiologic efficacy of intravaginal clindamycin cream for the treatment of bacterial vaginosis // Obstet. Gynecol. 1990. 76, 407-412.
97. Hillier S.L., Lipinski C., Brieselden A.M., Eschanbach D.A. Efficacy of intravaginal 0,75% metronidazole gel for the treatment of bacterial vaginosis // Obstet. Gynecol. 1993. 81, 963-967.
98. Ferris D.G., Litaker M.S., Woodward L., Mathis D., Hendrich J. Treatment of bacterial vaginosis: A comparison of oral metronidazole vaginal gel and clindamycin vaginal cream // J. Fam. Pract. 1995. 41, 443-449.
99. McGregor J.A., French J.I., Jones W., Milligan K., McKinney P.G., Patterson E., Parker R. Bacterial vaginosis is associated with prematurity and vaginal fluid mucinase and siali-dase: Results of a controlled trial of topical clindamycin cream // Am. J. Obstet. Gynecol. 1994. 170, 1048-1060.
100. Hughes V.L., Hillier S.L. Microbiologic characteristics of Lactobacillus products used for colonization of the vagina // Obstet. Gynecol. 1990. 178, 203-211.
101. Paavonen J., Critchlow C.W., CeRouen T., Stevens C.E., Kiviat N., Brunham R.C., Stamm W.E., Kuo C., Hyde K.E., Corey L., Eschenbach D.A., Holmes K.K. Etiology of cervical inflammation // Am. J. Obstet. Gynecol. 1986. 154, 556-564.
102. Paavonen J., Roberts P.L., Stevens C.E., Wölner-Hanssen P., Brunham R.C., Hillier S., Stamm W.E., Kuo C., DeRouen T., Holmes K.K. Randomized treatment ofmucopuru-lent cervicitis with dox-ycycline or amoxicillin // Am. J. Obstet. Gynecol. 1989. 161, 128-135.
103. Holmes K.K., Chen K.C.S., Lipinski C.M., Eschenbach D.A. Vaginal redox potential in bacterial vaginosis (non-specific vaginitis) // J. Infect. Dis. 1985. 152, 379-382.
104. Schwebke J.R., Schulien M.B., Zajackowski M. Pilot study to evaluate the appropriate management of patients with coexistent bacterial vaginosis and cervicitis // Infect. Dis. Obstet. Gynecol. 1995. 3, 199-122.
105. Thomason J.L., Gelbart S.M., Sobun J.F., Schulien M.B., Hamilton P.R. Comparison of four methods to detect Trichomonas vaginalis // J. Clin. Microbiol. 1988. 26, 1869-1870.
106. Cohen C.R., Duerr A., Pruithithada N., Rugpao S., Hillier S., Garcia P., Nelson K. Bacterial vaginosis and HIV seroprevalence among female commercial sex workers in Chiang Mai, Thailand // AIDS 1995. 9, 1093-1097.
107. Sewankambo N., Gray R., Waiver M.J., Paxton L., McNairn D., Wabruire-Mangen R., Sewankambo D., Li C., Kievanuker N., Hillier S.L., Rabe L., Gydos C.A., Quinn T.C, Kondi-Lute J. HIV-1 infection associated with abnormal vaginal flora morphology and bacterial vaginosis // Lancet 1997. 350, 546-550.
108. Wasserheit J.N., Bell T.A., Kiviat N.B., Wölner-Hanssen P., Zabriskie V., Kirby B.D., Prince E.C., Holmes K.K., Stainm W.E., Eschenbach D.A. Microbial causes of proven pelvic inflammatory disease and efficacy of clindamycin and tobramycin // Ann. Intern. Med. 1986. 104, 187-193.
109. Eschenbach D.A., Buchanan T.M., Pollock H.M., Forsyth P.S., Alexander E.R., Lin J., Wang S., Wentwoith B.B., McCormack W.M., Holmes K.K. Polymicrobial etiology of acute pelvic inflammatory disease // N. Engl. J. Med. 1975. 293, 166-171.
110. Sweet R.L., Schachter J., Robie M.O. Failure of beta-lactam antibiotics to eradicate Chlamydia trachomatis in the endometrium despite apparent clinical cure of acute salpingitis // J. Am. Med. Assoc. 1983. 293, 166-171.
111. Hemsell D.L., Little B.B., Faro S., Sweet R.L., Ledger W., Berkeley A.S., Eschenbach D.A., Wölner-Hanssen P., Pastorek J.G. Comparison of three regimens recommended by the Centers for Disease Control and Prevention for the treatment of women hospitalized with acute pelvic inflammatory disease // Clin. Infect. Dis. 1994. 19, 720-727.
112. Korn A.P., Bolan G., Padian N., Ohm-Smith M., Schachter J., Landers D.V. Plasma cell endometritis in women with symptomatic bacterial vaginosis // Obstet. Gynecol. 1995. 85, 387-390.
113. Soper D.E., Bump R.C., Hurt W.G. Bacterial vaginosis and trichomoniasis vaginitis are risk factors for cuff cellulitis after abdominal hysterectomy // Am. J. Obstet. Gynecol. 1990. 163, 1016-1023.
114. Larsson P.G., Platz-Christensen J.J., Thejls H., Forsum U., Pahlson C. Incidence of pelvic inflammatory disease after first trimester legal abortion in women with bacterial vaginosis after treatment with metronidazole: A double-blind, randomized study. Am. J. Obstet. Gynecol. 1992. 166, 100-103.
115. Hillier S.L., Nugent R.P., Eschenbach D.A., Krohn M.A., Gibbs R.S., Martin D.H., Cotch M.F., Edelman R., Pastorek J.G., Rao A.V., McNellis D., Regan J.A., Carey J.C., Klebanoff M.A. Association between bacterial vaginosis and preterm delivery of a low-birth-weight infant // N. Engl. J. Med. 1995. 333, 1737-1742.
116. Hoist E., Goffeng A.R., Andersch B. Bacterial vaginosis and vaginal microorganisms in idiopathic premature labor and association with pregnancy outcome // J. Clin. Microbiol. 1994. 32, 176-186.
117. Martius J.M., Krohn A., Hillier S.L., Stamm W.E., Holmes K.K., Eschenbach D.A. Relationships of vaginal Lactobacillus species, cervical Chlamydia trachomatis and bacterial vaginosis to preterm birth // Obstet. Gynecol. 1988. 71, 89-95.118. Morales W.J., Schorr S., Albritton J. Effect of metronidazole in patients with preterm birth in preceding pregnancy and bacterial vaginosis: A placebo-controlled double-blind study // Am. J. Obstet. Gynecol. 1994. 171, 345-349.