Журнал «Боль. Суставы. Позвоночник» 1 (01) 2011
Вернуться к номеру
Роль біопсії в діагностиці захворювань кісток: аналітичні методи (клінічне дослідження 152 послідовних випадків протягом 12 років)
Авторы: Resch H., Trubrich A., Bittighofer Ch., Kocijan R., Pirker Th., Patsch J., Muschitz Ch.
Medical University, Vienna, Department II Rheumatology/Osteology & Gastroenterology
KH Barmherzige Schwestern (St. Vincent Hospital), Academic Teaching Hospital of the Medical University Vienna, Austria
Рубрики: Семейная медицина/Терапия, Ревматология, Травматология и ортопедия, Неврология
Версия для печати
 Вступ
Вступ
Остеопороз характеризувався та визначався як системне захворювання кісткової тканини, що викликає пошкодження скелета та порушення його механічних властивостей [1–3]. Проте за останні роки визначення остеопорозу суттєво змінилося. На противагу класичній гістопатофізіології прийшли структурний, механічний, генетичний і тканинний аналіз. Із клінічної точки зору, неагресивні діагностичні процедури широко використовувані та з першого погляду дозволяють дуже легко поставити правильний клінічний діагноз [4–7].
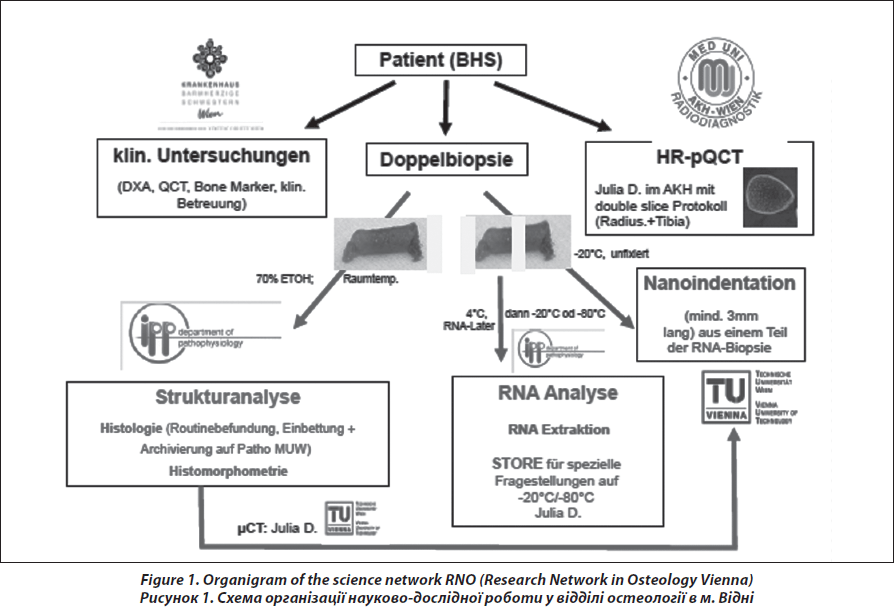
Раніше призначення біопсії кістки було обмеженим, вона виконувалася лише в нетипових, нечітких та складних клінічних випадках, згідно з рекомендаціями щодо діагнозу та лікування остеопорозу [8, 9]. Проте у зв’язку із прогресом у вивченні кісткової тканини на структурному та генетичному рівнях, а з іншого боку, із прогресом медикаментозного лікування і розвитком нового напрямку лікування, показання до призначення кісткової біопсії розширилися, і сьогодні вона дозволена для молодих людей, і навіть для дітей, чоловіків і пацієнтів, які мають значні відхилення при клінічних дослідженнях. На сьогодні залишаються дискусійними питання щодо методики виконання кісткової біопсії, шляху підготовки та збереження зразків і їх правильної інтерпретації, стосовно діагнозу остеопорозу з високою та низькою швидкістю ремоделювання, а також щодо впливу терапії на архітектоніку кортикальної та трабекулярної кісткової тканини [10–14]. У цьому контексті в даній статті подано методику проведення процедури біопсії, її наукове обґрунтування та роль й доцільності біопсії кістки в медичному центрі, який займається вивченням захворювань скелета, як на рутинному рівні, так і на рівні клінічних досліджень (рис. 1). Метою цієї роботи став описовий аналіз частоти та причин кісткової біопсії, якості зразків, гістопатологічних діагнозів та можливостей використання аналізу кісткової біопсії для обґрунтування терапевтичної стратегії.
Пацієнти
Було проведено 152 черезклубові біопсії кістки протягом періоду з квітня 1995 по грудень 2010 р. Біопсія кістки виконувалася в другому медичному відділі ревматології/остеології Лікарні Святого Вінсента (Відень) у співпраці з університетською клінікою Медичного університету Відня. Показаннями для біопсії кістки були такі:
I. З метою диференційного діагнозу захворювань кістки:
— зокрема, ранній (пременопаузальний) остеопороз (з метою диференційного діагнозу недосконалого остеогенезу);
— остеопороз у чоловіків і наявність низькоенергетичних переломів;
— клінічні розбіжності — поява переломів при нормальній мінеральній щільності кісткової тканини або при остеопенії;
— гіперостоз;
— низькоенергетичні переломи в молодих пацієнтів;
— пацієнти, які не мали відповіді на антирезорбтивну терапію;
— науково-дослідницька робота.
II. Метою процедури загалом є:
— аналіз мікроархітектоніки та матеріальних властивостей (мінералізація кісткової тканини);
— аналіз мРНК на тканинному рівні;
— гендерні специфічні відмінності у структурі та динаміці метаболізму кісткової тканини;
— призначення специфічної терапії.
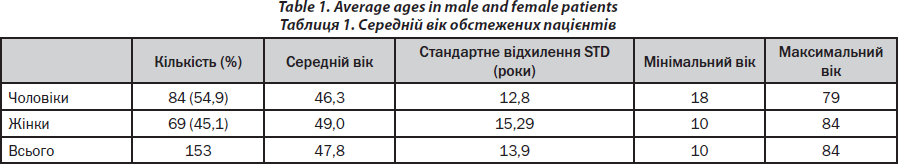
Коротка характеристика обстежених пацієнтів подана в табл. 1. За період спостереження щотижнево (із понеділка по п’ятницю) здійснювалося близько 80–100 поліклінічних та стаціонарних консультацій для пацієнтів із захворюваннями кісток. Більшість біопсій (90 %) кістки виконував один єдиний дослідник (PHK). Черезклубова біопсія кістки виконувалася згідно з раніше опублікованою методикою, що була описана в одній із попередніх публікацій авторів статті [15] та є модифікацією методики Бордієра та співавт. [16].
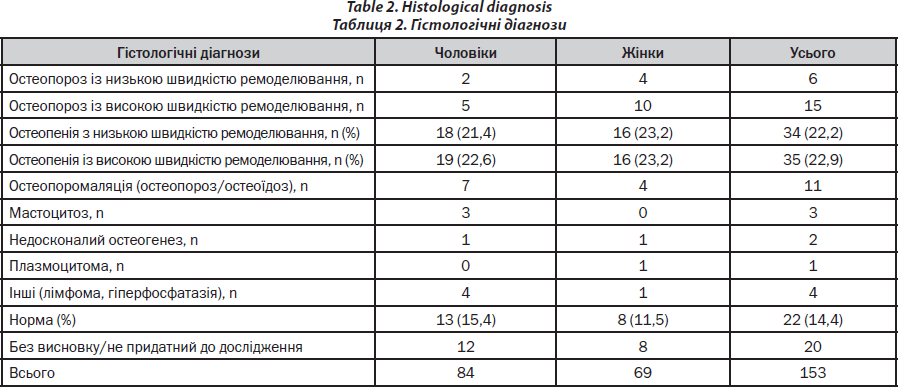
Спектр діагнозів наведено в табл. 2.
Показання та клінічна оцінка
Згідно з затвердженими вимогами місцевого комітету етики, пацієнти з хворобами кісток спостерігаються у поліклінічному відділенні другого медичного відділу Лікарні Святого Вінсента м. Відня (Австрія).
Усім пацієнтам необхідно підписати інформовану згоду перед проведенням будь-яких загальноприйнятих чи спеціальних процедур.
Історія хвороби має детальну інформацію щодо попереднього використання остеопоротичних медикаментів, терапії супутніх захворювань, шкідливих звичок (наприклад, паління), стилю життя, анамнезу переломів із детальним описом травми, переломів у батьків, оцінку FRAX. Критерії включення адаптовані до критеріїв включення головних клінічних досліджень з остеопорозу в жінок та чоловіків, які супроводжувалися інвазивними методиками [17, 18]. Критеріями виключення для проведення кісткової біопсії є попереднє використання будь-яких специфічних антирезорбтивних медикаментів (наприклад, бісфосфонатів) протягом тривалого періоду (понад 12 місяців), окрім вітаміну D та препаратів кальцію. Також до критеріїв виключення відносяться гіпогонадизм, захворювання щитоподібної залози, використання кортикостероїдів, гормонів щитоподібної залози, антиепілептичних медикаментів, злоякісні новоутворення протягом останніх п’яти років.
Клінічне обстеження, денситометрія та рентгенографія
Перед проведенням кожної біопсії кістки виконували загальноприйняте клінічне обстеження. Вимірювали масу тіла та зріст пацієнта за допомогою ростоміру зі шкалою маси тіла (BWB 700, Tanita). Здійснювали забір крові в усіх пацієнтів натще, між 8.00 та 10.00 годиною. Загальноприйняті дослідження крові та сечі проводили у Віденській центральній лабораторії Святого Вінсента. Дослідження крові включало загальний аналіз крові, визначення рівня калію, натрію, кальцію і фосфору, а також паратгормона, 25-(ОН)-вітаміну D, ТТГ, аналіз ниркових та печінкових проб, а також визначення рівня загального тестостерону в чоловіків. Окрім цього, досліджували рівень кальцію та фосфору в добовій сечі. Також усім пацієнтам проводили двофотонну рентгенівську денситометрію (DXA) на рівні кульшових суглобів та хребта (Lunar iDXA, GEHealthcare). У разі непоказових даних DXA через дегенеративні зміни призначали кількісну комп’ютерну томографію (QCT) поперекового відділу хребта та кульшових суглобів. Наявність переломів визначали за допомогою прямої та бокової рентгенографії грудного та поперекового відділу хребта. Оцінку рентгенограми проводив досвідчений радіолог, який проходив курси із методики діагностики переломів за Дженантом [19].
Біохімічні маркери кісткової тканини
Маркери кісткового метаболізму проводили у відділі лабораторної медицини Медичного університету Відня. Усім пацієнтами забирали по 2 мл сироватки крові та розділяли їх на дві проби, одну із яких заморожували при температурі –70 °С та використовували для контролю результатів. Маркери визначали за допомогою хемілюмінесцентного методу імуноферментним аналізатором Modular Analytics E170 (Roche Diagnostics). Досліджували рівень b-CTх (зшивки спіралей колагену, CrossLaps), остеокальцину, P1NP (N-термінальний пропептид проколагену І типу).
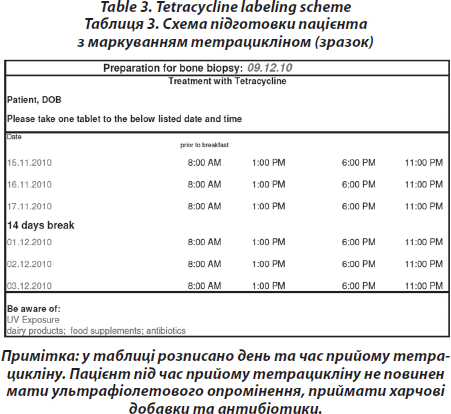
Маркування тетрацикліном — процедура, що проводиться перед кістковою біопсією
Для візуалізації швидкості мінералізації призначають 200 мг тетрацикліну за 21–20–19 та 8–7–6 днівперед біопсією. Подвійне маркування тетрацикліном виконується зазвичай для кількісного апостеріорного аналізу та для проведення динамічної гістоморфометрії [16]. Проте ця процедура не проводиться перед гістологічним дослідженням кісткової тканини з метою диференційного діагнозу, при якому призначається звичайна (статична) гістоморфометрія без маркування. Маркування із тетрацикліном дозволяє дослідити наявність чи відсутність дефектів мінералізації або діагностувати остеомаляцію з остеопенією чи без неї (табл. 3).
Техніка черезклубової біопсії кістки
Перед кістковою біопсією проводиться моніторинг основних параметрів (артеріальний тиск, сатурація кисню) та безперервна оксигенація. Анестезія здійснюється за допомогою введення мідазоламу та 1% пропофолу внутрішньовенно та 1% лідокаїну підшкірно.
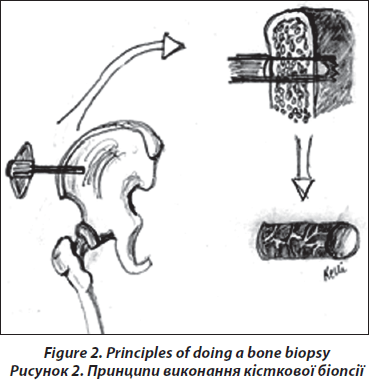
Черезклубова біопсія здійснюється 6-міліметровим троакаром після проведеного надрізу шкіри в ділянці, яка знаходиться на 5–8 см нижче spina iliaca anteriorsuperior, до точки, що локалізується на 8 см нижче за найвищу точку гребеня клубової кістки.
Для того щоб провести структурний, гістоморфометричний аналіз та тест на експресію генів, кожному пацієнту проводиться дві орієнтовані паралельно черезклубові біопсії лівої клубової кістки (рис. 2). Біопсія кістки здійснюється в операційному залі в стерильних умовах. Отримані біоптати (діаметром 7 мм) спочатку оцінюються візуально. Біоптати повинні мати кортикальний шар із зовнішньої та внутрішньої сторони завтовшки 6–8 мм, тобто біоптат є повним зразком клубової кістки, цілісного органу, що має трабекулярний та два кортикальних шари, які можна поміряти (рис. 3). Тривалість процедури — близько 12–15 хвилин.
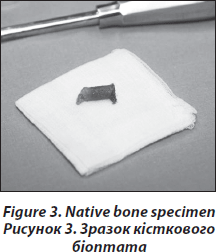 Найбільший та непошкоджений зразок відбирають для подальшого гістоморфометричного та структурного аналізу та поміщають у контейнер із 70% етиловим спиртом. Другий біоптат очищують від кусочків шкіри, жирової та м’язової тканини та негайно поміщають у спеціальний розчин, який використовують для підготовки зразків до дослідження мРНК, та відправляють на сухому льоді до Медичного університету Відня.
Найбільший та непошкоджений зразок відбирають для подальшого гістоморфометричного та структурного аналізу та поміщають у контейнер із 70% етиловим спиртом. Другий біоптат очищують від кусочків шкіри, жирової та м’язової тканини та негайно поміщають у спеціальний розчин, який використовують для підготовки зразків до дослідження мРНК, та відправляють на сухому льоді до Медичного університету Відня.
Після проведеної біопсії, пацієнтам радять знаходитися в ліжку протягом 6 годин. На зазначений час на місце, де було взято біоптат, кладуть мішечок із піском. Пацієнта звільняють від важкої роботи щонайменше на 3–4 дні. Шви знімають через 14 днів після проведеної процедури. Із місцевих побічних ускладнень іноді виникає локальна гематома, яка зазвичай пов’язана із порушенням рухового режиму. У жодного пацієнта не було інфекції післяопераційної рани.
Гістологічне та гістоморфометричне дослідження
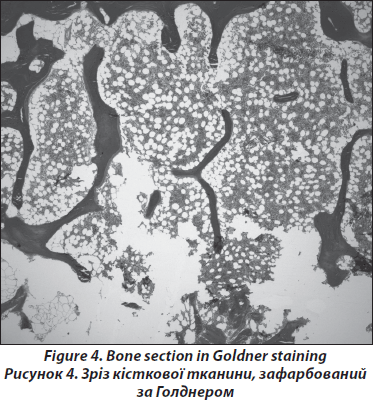
Підготовка зразків до дослідження проводиться без декальцифікації, як здійснювалося раніше [19, 20]. Зрізи завтовшки 5–8 мм фарбуються за Голднером та Гімзе; підготовка зразків до гістологічного дослідження здійснюється за методикою Roschger та співавторів [22, 23]. Усі біоптати для вивчення структурних властивостей фіксуються спочатку в етанолі, потім зневоднюються, після чого фіксуються поліметилметакрилом. Безпосередньо перед фарбуванням за Голднером зразки фіксуються 2-метоксиетілацетатом. Гістологічний аналіз здійснюють за методикою Парфіта та ін. [24], при якому вивчається вся площа отриманого біоптата. З метою виключення злоякісного ґенезу остеопорозу, наприклад лімфоми або мастоцитозу, зразки направляються до сертифікованого патологоанатома для висновку (рис. 4). Наступним етапом є світлооптична мікроскопія (Axiophot, Zeiss, Oberkochen, Німеччина), обладнана відеокамерою (Zeiss AxioCam) для отримання цифрових зображень зразка, а також використовуються загальноприйняті методики. У чоловіків отримані результати структурного та статичного аналізу формування та резорбції кістки порівнюються з опублікованими нормативними даними чоловіків 41–50-річного віку [25].
Аналітична гістоморфометрія здійснюється за допомогою аналізатора зображення BIOQUANT (Nashville, TN) із використанням системи дослідження біологічних параметрів кісткової тканини BIOQUANT OSTEO, версія 8.40.10. Дана система дозволяє вивчати одночасно 25 різних ділянок кісткової тканини зі збільшенням об’єктива х 20, при якому можна оцінити структуру трабекули. Результати гістоморфометрії (рис. 5) відповідають стандартизованій номенклатурі [24]. Додатково оцінюється об’єм кісткового мозку, як об’єм тканини мінус об’єм кістки, та об’єм жиру, який обчислюється як повний об’єм адипоцитів у межах об’єму кісткового мозку кістки.

Також проводиться альтернативний напівкількісний аналіз на остеопоромаляцію (остеопороз та остеомаляція) у пацієнтів із високим ступенем кісткового ремоделювання, метод ґрунтується на визначенні характерологічних та кількісних властивостей остеобластів. Остеопороз із високим ступенем кісткового ремоделювання характеризується гістологічною картиною, при якій близько 30 % остеоїду покрито кубічними остеобластами та кількість остеокластів сягає верхньої межі норми або є вищою за норму. Мінералізація поверхні кістки або частота її активації збільшена, тоді як швидкість мінералізації та час затримки мінералізації в межах норми. Остеопороз із низькою швидкістю ремоделювання характеризується лише кількома фокусами ремоделювання та зниженням кількості остеоцитів та остеобластів. Остеоїдоз та фіброостеоклазія можуть розцінюватися як індикатор ниркової остеодистрофії, якщо у пацієнта є порушення ниркової функції (ця інформація повинна бути в остеопатофізіолога), якщо ж такого симптому немає, то це може бути ознакою первинного гіперпаратиреозу.
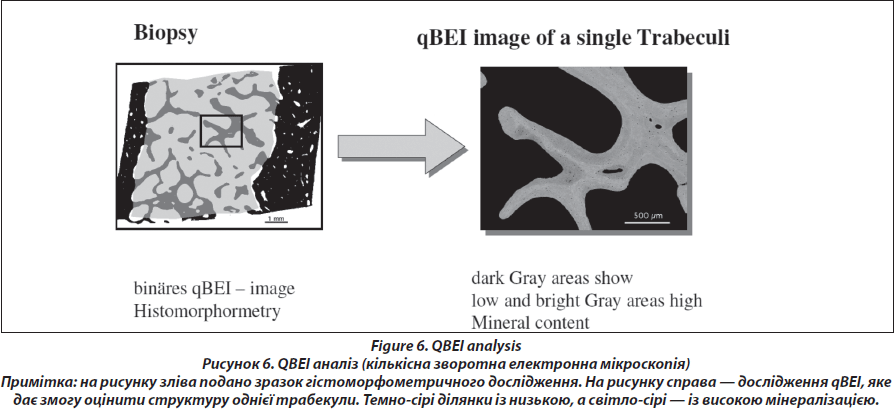
Кількісна зворотна електронна мікроскопія qBEI (рис. 6)
Підготовленні блоки для електронної мікроскопії мають губчату та кортикальну кістку. Зразки фіксуються поліметилметакрилом (PMMA) для полірування та шліфування, щоб отримати чітку поверхню кісткової тканини. Під час проведення qBEI в електронному мікроскопі зовнішня поверхня блока, яка містить тканину кістки, занурюється у вуглець (проходить вакуумне випаровування).
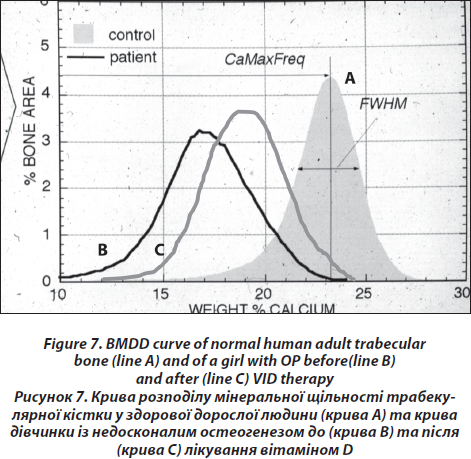
Дана методика дозволяє визначити розподіл мінеральної щільності (BMDD) в трабекулярній (Cn.) та кортикальній (Ct.) кістці, використовуючи потужний цифровий електронний мікроскоп (DSM 962, Zeiss, Oberkochen, Німеччина). Структура губчатої та кортикальної тканини можна вивчати при збільшенні х 50, що відповідає роздільній здатності 4 мм/пікселів, використовуючи швидкість сканування до 100 с/кадр, що дозволить отримати цифрове зображеннями з роздільною здатністю 512 х 512 пікселів. Даний метод дозволяє із цифрового зображення вивести показник кістки, зайнятої пікселями певного рівня яскравості, у відсотках. Таким чином, можна оцінити насичення певної ділянки кісткової тканини кальцієм. Технічна точність сягає 0,3 %. Можна оцінити такі показники з діаграм розподілу мінеральної щільності кістки (BMDD): середня концентрація кальцію в кістці (CaMean); найчастіша концентрація кальцію в зразку (CaPeak); ширина розміщення кальцію (CaWidth), яка визначає гетерогенність мінералізації зразка; показник низької фракції кальцію (CaLow), тобто у відсотках показник площі із рівнем кальцію нижчим 17,68 wt% (показник нижче 5 ‰); фракція повної мінералізації кістки (CaHigh), яка відображає ділянки із концентрацією кальцію вищою за 25,30 wt% (показник вище 95-го процентиля BMDD) [27, 28]. Усі отримані результати пацієнта порівнюються з нормативними даними BMDD здорових дорослих людей (рис. 7) [28, 29].
Мікрокомп’ютерна томографія (μ-CT)
Система мікротомографічної візуалізації (μCT40, Scanco Medical AG, Brьttisellen, Швейцарія) обладнана рентгенівською трубкою. Двовимірний зарядний пристрій приєднаний до тонкого сцинтилятора як детектора, який дозволяє робити паралельно 206 томографічних зображень. Фіксований поліметилметакрилом біоптат кладуть так, щоб по довжині він збігався з віссю обертання сканера. Сканування здійснюється при ізотропічній номінальній роздільності 10 μм (висока роздільність). Дані зображення фільтрують, використовуючи фільтр Гауса. Мінералізована тканина фрагментується залежно від кольору тканини (22 % — максимально сірий колір шкали). Використання 3D [30] дозволяє досліджувати об’єм трабекул в середині біоптата із виділенням досліджуваної зони. Морфометричні показники визначаються у дев’яти різних місцях трабекулярної кістки і включають об’єм кістки, товщину трабекул, розгалуженість трабекул, кількість трабекул, щільність трабекул, структурний індекс зразка.
Витяг РНК, кДНК та полімеразноланцюгова реакція в реальному часі
З найбільш неушкодженої трабекулярної частини біоптата (ближче до середини) надрізається зразок розміром 5 х 5 х 5 мм. Для звільнення зразка від кісткового мозку його промивають спеціальним розчином RNA-later. Після цього зразок поміщають в спеціальні пробірки (RNAse-free) разом із двома сталевими кульками та заморожують у рідкому азоті. Після цього заморожені пробірки поміщають у спеціальний пристрій для подрібнення зразка до гомогенної маси (3 хв). Витяг РНК здійснюється з використанням тризолу та інвітрогену [31]. Наступним кроком є стадія із використанням ізопропанолу (згідно з протоколом), на якій двічі проводяться преципітації та центрифугування (12 000 г; 10 хвилин; при 4 °C). Якість і кількість РНК перевіряють шляхом електрофорезу та фотометрії при 260 нм та 280 нм (260/280-нм співвідношення спектральної поглинальної здатності від 1,5 до 2).
Для дослідження кДНК потрібно 4 мг речовини, отриманої для дослідження РНК, та тест-система для визначення кДНК (High Capacity cDNA reverse transcription kit, Applied Biosystems). Здійснюється полімеразноланцюгова реакція в реальному часі згідно з інструкцією виробника. Проби ставляться тричі для кожного гена. Визначаються RANKL, OPG, OSX і runx2 (граничне значення показника складає 0,15), GAPDH (граничне значення показника становить 0,03 одиниці), wnt, остеокальцин і SOST (граничне значення показника становить 0,07) [32]. Отримані результати дослідження експресії генів використовують для аналізу µ-CT та отримують збільшене в кілька разів зображення, змодельоване GAPDH експресією генів (рис. 8).

Висновок
У більшості випадків хворим з остеопорозом призначають сироваткові біохімічні маркери та неінвазивні інструментальні методи дослідження. Незважаючи на значний прогрес неінвазивних методів, які використовуються для діагностики метаболічних захворювань кістки, зокрема остеопорозу, існує маленька група пацієнтів, для яких важливе включення кісткової біопсії в діагностичний алгоритм. Клінічні випадки у таких хворих називають атиповими, для прикладу, чоловіки, пре- та постменопаузальні жінки із низькоенергетичними переломами, тобто це ті пацієнти, у яких дані, отримані за допомогою сучасних неінвазивних методів, неінформативні щодо етіології хвороби кістки, або ті пацієнти, які не відповідають на призначену терапію.
Недоліки біопсії можна усунути шляхом накопичення досвіду її проведення та кращого усвідомлення важливості й інформативності даних, отриманих із використанням цього методу. З’явилися нові терапевтичні середники, які пригнічують активність остеобластів, та розроблено остеоакластіндукуючу терапію, метою якої є стимулювання формування кістки. В основному кісткова біопсія повинна призначатися у випадку незрозумілих патогенетичних механізмів розвитку хвороби.
Порушення якості кістки та її тканинних властивостей, таких як мікроархітектоніка, якість матриксу, незадовільний стан мінералізації як чинники, що сприяють крихкості кістки, — усе це вимагає призначення інвазивного методу дослідження і не може бути описано за допомогою жодної неінвазивної техніки.
Переклад Роксолани Поворознюк та Наталії Балацької
1. Kruse H.-P., Kuhlencordt F. Grundzьge der Osteologie. — Berlin: Heidelberg; New York: Springer-Verlag; Tokyo,1984.
2. Malluche H.H., Faugere M.-C. Bone biopsies: histology and histomorphometry of bone // Metabolic bone disease and clinically related disorders / Avioli L.V., Krane S.M. (eds). — Philadelphia: WB Saunders Company, 1990. — Р. 283-328.
3. Meunier P.J. Assessment of bone turnover by histomorphometry in osteoporosis // Osteoporosis — etiology, diagnosis and management / Riggs B.L., Melton L.J. (eds). — New York: Raven Press, 1988. — Р. 317-332.
4. Kann P.H. Bone densitometry and ultrasound studies of the bone: methods, indications and efficacy // Orthopдde. — 2001. — 30. — 437-443.
5. Pfeilschifter J., Kann P.H. Evaluation of osteoporosis // Z. Gastroenterol. — 2002. — 40 (Suppl. 1). — S46-S56.
6. Ettinger MP Aging bone and osteoporosis: strategies for preventing fractures in the elderly // Arch. Intern. Med. — 2003. — 163. — 2237-2246.
7. Kenny A.M., Joseph C., Taxel P., Prestwood K.M. Osteoporosis in older men and women // Conn. Med. — 2003. — 67. — 481-486.
8. Scheidt-Nave C., Baum E., Dцren M., Hadji P., Keck E., Minne E., Seibel M. DVO-Leitlinie Osteoporose bei postmenopausalen Frauen // Osteologie. — 2003. — 12. — 13-41.
9. Fassbender W.J., Scheidt-Nave Ch., Pfeilschifter J. Dachverband der Deutschsprachigen Osteologischen Fachgesellschaften Evidence-based clinical practice guidelines for diagnosis and treatment of osteoporosis // Dtsch Med. Wochenschr. — 2003. — 128. — 1615-1616.
10. Hauge E., Mosekilde L.E., Melsen F. Missing observations in bone histomorphometry on osteoporosis: implications and suggestions for an approach // Bone. — 1999. — 25. — 389-395.
11. Ziegler R Osteoporose: aktuelle Diagnostik und Therapie // Orthopдdische Praxis. — 2002. — 38. — 570-577.
12. Mehl B., Delling G., Schlindwein I., Heilmann P., Voia C., Ziegler R., Nawroth P., Kasperk C. Do markers of bone metabolism reflect the presence of a high- or low-turnover state of bone metabolism? // Med. Klin. — 2002. — 97. — 588-594.
13. Allolio B. Role of bone histology in the determination of bone metabolism // Med. Klin. — 2003. — 98. — 110.
14. Barthel H.R., Seibel M.J. Role of bone histology in the determination of bone metabolism // Med. Klin. — 2003. — 98. — 111-112.
15. Patsch J., Kohler T., Berzlanovic A., Muschitz C., Bieglmayr, Roschger P., Resch H., Pietschmann P. Trabecular bone microstructure and local gene expression in iliac crest biopsies of men with idiopathic osteoporosis // JBMR, accepted 2011.
16. Bordier P., Matrajt H., Miravet L., Hioco D. Mesure histologique de la masse et de la rйsorption des travйes osseuses // Pathol. Biol. — 1964. — 12. — 1238-1243.
17. Orwoll E., Ettinger M., Weiss S., Miller P., Kendler, Graham J., Adami S., Weber K., Lorenc R., Pietschmann P., Vandormael K., Lombardi A. Alendronate for the treatment of osteoporosis in men // N. Engl. J. Med. — 2000. — 343. — 604-10.
18. Orwoll E.S., Scheele W.H., Paul S., Adami S., Syversen U., Diez-Perez A., Kaufman J.M., Lancy A.D., Gaich G.A. The effect of teriparatide (human parathyroid hormone (1–34)) therapy on bone density in men with osteoporosis // J. Bone Miner. Res. — 2003. — 18. — 9-17.
19. Genant H.K., Wu C.Y., van Kuijk C., Nevitt M.C. Vertebral fracture assessment using a semiquantitative technique // J. Bone Min. Res. — 1993. — 8. — 1137-48.
20. Hahn M., Vogel M., Delling G. Undecalcified preparation of bone tissue: report of technical experience and development of new methods // Virchows Arch. а Pathol. Anat. — 1991. — 418. — 1-7.
21. Delling G., Werner M. Ist die histologische Untersuchung des Knochengewebes noch zeitgema Я? // Osteologie. — 2001. — 10. — 3-14.
22. Roschger P., Rinnerthaler S., Yates J., Rodan G.A., Fratzl P., Klaushofer K. Alendronate increases degree and uniformity of mineralization in cancellous bone and decreases the porosity in cortical bone of osteoporotic women // Bone. — 2001. — 29. — 185-91.
23. Roschger P., Gupta H.S., Berzlanovich A., Ittner G., Dempster D.W., Fratzl P., Cosman F., Parisien M., Lindsay R., Nieves J.W., Klaushofer K. Constant mineralization density distribution in cancellous human bone // Bone. — 2003. — 32. — 316-23.
24. Parfitt A.M., Drezner M.K., Glorieux F.H., Kanis J.A., Malluche H., Meunier P.J., Ott S.M., Recker R.R. Bone histomorphometry: standardization of nomenclature, symbols, and units. Report of the ASBMR Histomorphometry Nomenclature Committee // J. Bone Miner. Res. — 1987. — 2. — 595-610.
25. Rehman M.T., Hoyland J.A., Denton J., Freemont A.J. Age related histomorphometric changes in bone in normal British men and women // J. Clin. Pathol. — 1994. — 47. — 529-534.
26. Roschger P., Fratzl P., Eschberger J., Klaushofer K. Validation of quantitative backscattered electron imaging for the measurement of mineral density distribution in human bone biopsies // Bone. — 1998. — 23. — 319-326.
27. Roschger P., Paschalis E.P., Fratzl P., Klaushofer K. Bone mineralization density distribution in health and disease // Bone. — 2008. — 42. — 456-466.
28. Roschger P., Gupta H.S., Berzlanovich A., Ittner G., Dempster D.W., Fratzl P., Cosman F., Parisien M., Lindsay R., Nieves J.W., Klaushofer K. Constant mineralization density distribution in cancellous human bone // Bone. — 2003. — 32. — 316-32.
29. Fratzl-Zelman N., Roschger P., Misof B., Nawrot-Wawrzyniak K., Pцtter-Lang S., Muschitz C., Resch H., Klaushofer K., Zwettler E. Fragility fractures in men with idiopathic osteoporosis are associated with undermineralisation of the bone matrix. Accepted CTI 2011.
30. Hildebrand T., Laib A., Mьller R., Dequeker J. and Rьegsegger P. Direct three-dimensional morphometric analysis of human cancellous bone: microstructural data from spine, femur, iliac crest, and calcaneus // J. Bone Miner. Res. — 1999. — 14. — 1167-74.
31. Chomczynski P., Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction // Anal. Biochem. — 1987. — 162. — 156-919.
32. Kuliwaba J.S., Findlay D.M., Atkins G.J., Forwood M.R., Fazzalari N.L. Enhanced expression of osteocalcin mRNA in human osteoarthritic trabecular bone of the proximal femur is associated with decreased expression of interleukin-6 and interleukin-11 mRNA // J. Bone Miner. Res. — 2000. — 15. — 332-41.