Журнал «Боль. Суставы. Позвоночник» 1 (01) 2011
Вернуться к номеру
Болевой синдром при остеопорозе и методы его коррекции
Авторы: Поворознюк В.В., Григорьева Н.В., ГУ «Институт геронтологии НАМН Украины», Украинский научно-медицинский центр проблем остеопороза, г. Киев
Рубрики: Семейная медицина/Терапия, Ревматология, Травматология и ортопедия, Неврология
Версия для печати

В связи со значительным постарением населения планеты и увеличением в популяции женщин в постменопаузальном периоде проблема остеопороза становится особенно актуальной. Остеопороз поражает от трети до половины всех женщин, находящихся в постменопаузе [Riggs B.L., Melton L., 1986; Kanis J.A., 2000; Поворознюк В.В., Григорьева Н.В., 2004]. В большинстве случаев первыми клиническими проявлениями остеопороза являются его грозные осложнения — малотравматические переломы, поэтому в литературе и появилось определение заболевания как «тихой», «безмолвной» эпидемии. Однако приблизительно у каждой женщины после 65 лет случается минимум один перелом костей [Kanis J.A., 2004], а риск последующих переломов при наличии их в анамнезе у пациента резко возрастает. Приблизительно 750 000 новых вертебральных переломов регистрируются в США ежегодно среди людей старше 50 лет [Melton L.J., Thamer M., Ray N.F. et al., 1997], и у четверти из них в течение жизни возникнет по крайней мере еще один перелом тела позвонка [Jones G., White C., Nguyen T. et al., 1996].
Острый болевой синдром при остеопорозе чаще всего связан с возникновением перелома (вертебрального или невертебрального). Длительное течение заболевания приводит к формированию хронического болевого синдрома, уменьшению функциональных возможностей, ухудшению качества жизни и снижению ожидаемой продолжительности жизни.
Клинические проявления остеопороза
В дебюте заболевания пациенты предъявляют жалобы на снижение работоспособности и повышенную утомляемость. Одним из ведущих начальных симптомов остеопороза является боль в спине. Боль может быть эпизодической и связанной либо с неловким движением, либо с поднятием тяжести. Часто пациенты предъявляют жалобы на «повышенную утомляемость и ноющие боли в спине» после вынужденного пребывания в одном и том же положении или при ходьбе. Их беспокоит «ощущение тяжести» между лопатками, необходимость многократного отдыха в течение дня, желательно в положении лежа.
Реже встречаются жалобы на боли по ходу длинных трубчатых костей, в суставах и мягких тканях. Боли в костях летучие, по локализации и силе непостоянные, усиливаются при изменении погоды, в холодное время года, при физических нагрузках, массаже, после переутомления и даже после отрицательных эмоций. Боли по ходу ребер могут быть опоясывающими и воспринимаются как межреберная невралгия. Степень выраженности боли может быть разной у одного и того же пациента в разные периоды времени. Прием нестероидных противовоспалительных препаратов не купирует болевой синдром.
В течении заболевания отмечаются периоды обострения и ремиссии. Через 2–10 лет заболевания достигается окончательное формирование и стабилизация болевого синдрома. При этом появляется дополнительная боль, поскольку из-за увеличения кифоза меняется осанка больного и ребра начинают давить на гребни подвздошных костей. Постоянная боль в области позвоночника сохраняется. У многих больных длительный интенсивный болевой синдром обусловливает разнообразные психосоматические проявления, невротизацию и формирование депрессии.
Механизмы формирования болевого синдрома при остеопорозе
В основе формирования болевого синдрома при остеопорозе лежат разнообразные патологические процессы в костной ткани, мышцах, связочно-сухожильном аппарате и других компонентах опорно-двигательного аппарата.
Основными причинами возникновения вертебрального болевого синдрома при остеопорозе могут быть:
— компрессионный перелом тела позвонка или частичный его надлом с периостальным кровоизлиянием;
— механическое сдавление связок и мышц; кифоз грудного отдела позвоночника;
— снижение роста и укорочение параспинальной мускулатуры.
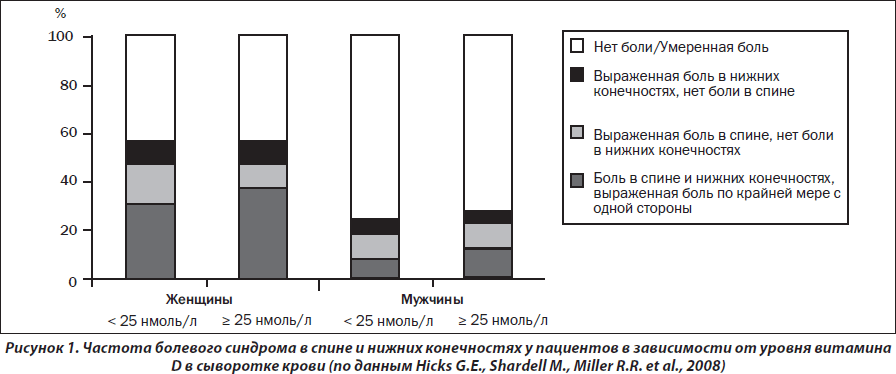
В недавно проведенном в Италии одномоментном исследовании (Chianti Study) с участием 958 пациентов старше 65 лет [Hicks G.E., Shardell M., Miller R.R. et al., 2008] по изучению частоты и выраженности болевого синдрома в спине и нижних конечностях в зависимости от уровня витамина D в сыворотке крови показано, что низкая концентрация 25(OH)D в крови ассоциирована с достоверным увеличением частоты віраженного вертебрального болевого синдрома у женщин старших возрастных групп (рис. 1). Подобной зависимости между частотой и выраженностью болевого синдрома и уровнем витамина D в сыворотке крови у мужчин не обнаружено.
В настоящее время известно, что в распространении боли принимают участие различные эндогенные субстанции:
— периферические альгогенные вещества: гистамин, серотонин, кинины, простагландины, ацетилхолин, калий, аденозинмоно-, ди- и трифосфаты;
— вещества, принимающие участие в передаче боли: субстанция Р, серотонин, энкефалин, нейротензин, соматостатин;
— эндогенные опиатоподобные пептиды ЦНС: производные эндорфинов, энкефалины.
При возникновении перелома тела позвонка возникает острая боль, иррадиирующая в грудную клетку, брюшную полость или бедро по типу корешковой боли и резко ограничивающая движения больного. Боль усиливается при минимальных движениях и длится в течение 1–2 нед. Затем интенсивность ее постепенно уменьшается в течение 2–3 мес. и чаще всего болевой синдром приобретает хронический характер. Снижение высоты тел позвонков и увеличение переднезадней кривизны в месте переломов приводит к увеличению поясничного лордоза, в связи с чем в течение последующих 3–6 мес. боль в спине постепенно уменьшается [Поворознюк В.В. и соавт., 2004; Suzuki N., Ogikubo O., Hansson T., 2008].
Компрессионные переломы тел позвонков и «ползучая» деформация неизбежно приводят к снижению роста и формированию выраженного грудного кифоза, что является причиной боли от давления на ребра, гребни подвздошных костей и межпозвоночные суставные поверхности. Пациенты годами жалуются на тупую хроническую боль в спине, ребрах, тазовых костях. Они имеют характерную походку — идут медленно и осторожно, с видимым трудом поднимаются по ступенькам, входят в городской транспорт. Боль увеличивается при ходьбе и любой физической нагрузке. У многих пациентов прослеживается определенная чувствительность к сотрясению, и они жалуются на боль «во всех костях».
Прогрессирующие изменения осанки приводят и к укорочению параспинальной мускулатуры, которая активно сокращается, вызывая боли от мышечного перенапряжения. Это одна из главных причин хронической боли в спине. Такая боль часто локализуется не в самом позвоночнике, а паравертебрально и усиливается при длительном стоянии и ослабевает при ходьбе.
Хронический вертебральный болевой синдром способствует повышенной раздражительности, возбужденности и даже развитию депрессии, пищевым расстройствам и изменению массы тела.
Коррекция болевого синдрома у пациентов с остеопорозом
Комплексная терапия вертебрального болевого синдрома направлена на пораженный сегмент, устранение мышечно-тонических проявлений и миогенных триггерных зон, очагов нейромиоостеофиброза, аутоаллергических процессов.
Лечение пациента с остеопорозом должно быть направлено как на купирование болевого синдрома (симптоматическая терапия), так и на предупреждение прогрессирования остеопороза, и, следовательно, на профилактику последующих вертебральных и невертебральных переломов (патогенетическая терапия).
Симптоматическая терапия направлена на уменьшение болевого синдрома или реакций пациента на боль и устранение вегетативных реакций. Она включает режим, использование корсетов или опорных средств, назначение анальгетиков, рефлекторно-отвлекающих средств на болевые зоны (мази, гели), иглорефлексотерапию и др. [Wang Z., Zhang T.F., Zhang H.X., Zhang Q.J., 2008; Zhao R., Liu Z.L., Wang J.M., Xie G.D., 2008; Hall H., McIntosh G., 2008; Bhandary A.K., Chimes G.P., Malanga G.A., 2010].
Патогенетическая терапия предусматривает назначение антиостеопоротических препаратов, с помощью которых достигается повышение минеральной плотности костной ткани и снижение риска вертебральных и периферических переломов. Однако в настоящее время показано, что некоторые антирезорбенты и стимуляторы костеобразования обладают не только положительным действием на показатели костной ткани, но и самостоятельно могут снижать выраженность болевого синдрома у пациентов с остеопорозом.
Особое место в реабилитации больного, снижении выраженности болевого синдрома и восстановлении функциональных возможностей пациента занимает лечебная физкультура, которая не только обладает симптоматическим эффектом, но и способствует приросту костной и мышечной массы, улучшению координации, а следовательно, уменьшению риска переломов.
В настоящее время для уменьшения выраженности болевого синдрома при переломе тел позвонков, который не может быть купирован с помощью консервативных методов лечения, используются новые малоинвазивные технологии (вертебропластика и кифопластика).
При остром болевом синдроме, обусловленном остеопоротическим переломом тела позвонка, показаны ношение корсета, постельный режим либо периоды отдыха в горизонтальном положении, регулярное использование анальгетиков и миорелаксантов центрального действия.
При хроническом болевом синдроме достичь адекватного обезболивания сложнее. Пациентам с хронической болью показаны неопиоидные анальгетики, нестероидные противовоспалительные препараты (НПВП) и специально разработанные комплексы физических упражнений. Кроме того, используют акупунктуру и чрескожную электростимуляцию (уровень доказательности D) [Malmros B., Mortensen L., Jensen M.B., Charles P., 1998]. У пациентов с болью в спине часто наблюдаются депрессия и нарушение сна, что требует назначения антидепрессантов и помощи психолога [Scottish Intercollegiate Guidelines Network, www.sign.ac.uk, 2003].
Немедикаментозные методы коррекции болевого синдрома у пациентов с остеопорозом
При новом компрессионном переломе тел позвонков основные немедикаментозные мероприятия включают ношение корсета, периоды отдыха в горизонтальном положении. Если пациенту рекомендован более длительный постельный режим, то он должен чередоваться с ходьбой или отдыхом в положении сидя (по 30–60 мин несколько раз день) с целью предотвращения снижения минеральной плотности костной ткани и сохранения подвижности позвоночника. В первые несколько месяцев после перелома следует избегать силовых упражнений. Другие средства (паравертебральные блокады, акупунктура, электростимуляция) также могут уменьшать боль, но доказательства их эффективности при переломах тел позвонков нет, а паравертебральные блокады с гидрокортизоном противопоказаны [Bonner F.J. Jr, Sinaki M. et al., 2003]. Мануальная терапия при остеопорозе позвоночника противопоказана в связи с высоким риском последующих переломов тел позвонков.
Корсеты могут уменьшить боль у пациента с остеопорозом благодаря ограничению подвижности пораженного отдела позвоночника и тем самым способствовать более раннему восстановлению физической активности [Sinaki M., 1998], однако их длительное использование способствует развитию слабости и атрофии мышц спины [Bonner F.J. Jr, Sinaki M., Grabois M. et al., 2003].
При недавно произошедшем переломе тела позвонка ходьба часто болезненна, поэтому пациентам могут быть рекомендованы опорные устройства на колесах с ручным тормозом, что позволит уменьшить боль при передвижении и предотвратить новые вертебральные переломы благодаря выпрямлению спины и уменьшению нагрузки на позвоночник [Scharla S., 2002; Bonner F.J. Jr, Sinaki M., Grabois M. et al., 2003; O’Neill Sh., MacLennan A., Bass Sh. et al., 2004].
Снижение роста вследствие переломов тел позвонков может привести к тому, что нижние ребра начинают соприкасаться с гребнями подвздошных костей, что вызывает боль в боковых отделах туловища. Для ее уменьшения предлагается использовать специальные мягкие ремни, уменьшающие соприкосновение костных структур [Bonner F.J. Jr, Sinaki M., Grabois M. et al., 2003].
После перелома позвонков чрезвычайно важно выработать стереотип движений с сохранением прямой осанки, чтобы снизить риск последующих переломов, уменьшить нагрузку на позвоночник и боль [O’Neill Sh., MacLennan A., Bass Sh. et al. Australian Guidelines for the management of postmenopausal osteoporosis for GPs, 2004].
Для уменьшения психологических проблем, связанных с хроническим болевым синдромом, используют различные образовательные программы для пациентов с обучением пациентов самоконтролю [Bonner F.J. Jr, Sinaki M., Grabois M. et al. Health professional’s guide to rehabilitation of the patient with osteoporosis, 2003].
Физические упражнения
Физические упражнения являются важнейшим методом терапевтического вмешательства. Гиподинамия вследствие болевого синдрома при переломе тела позвонка ведет к уменьшению объема и слабости мышц спины, также уменьшается аэробная способность организма. Физические упражнения необходимы для увеличения мышечной силы и выносливости, они улучшают гибкость позвоночника и повышают аэробную активность [Hall H., McIntosh G., 2008].
В настоящее время по данным различных авторов установлено, что регулярно выполняемые физические упражнения (силовые, упражнения на растяжение и тренировку координации), а также ходьба уменьшают выраженность боли в спине, потребность в анальгетиках, увеличивают мышечную силу, улучшают координацию движений и улучшают качество жизни женщин с остеопоротическими переломами [Malmros B., Mortensen L. еt al., 1998; Papaioannou A., Adachi J.D. et al., 2004; Поворознюк В.В., Орлик Т.В., Слюсаренко О.Н. и др., 2004]. Важно отметить, что улучшение координации предупреждает падения, а следовательно, новые переломы. Пациентам с остеопорозом следует избегать резких, особенно ротационных движений в позвоночнике, которые будут способствовать усилению болевого синдрома и возникновению новых деформаций.
Согласно данным доказательной медицины, через 3 мес. после перелома тела позвонка необходимо начать регулярные упражнения, включающие упражнения для укрепления мышц передней брюшной стенки, силовые упражнения для мышц верхних и нижних конечностей, тренировку равновесия и ходьбу (уровень доказательности В).
Медикаментозные методы лечения болевого синдрома у пациентов с остеопорозом
Комплексная медикаментозная терапия болевого синдрома у пациента с остеопорозом и его осложнениями предусматривает назначение анальгетиков, миорелаксантов, антиостеопоротических препаратов и в некоторых случаях антидепрессантов.
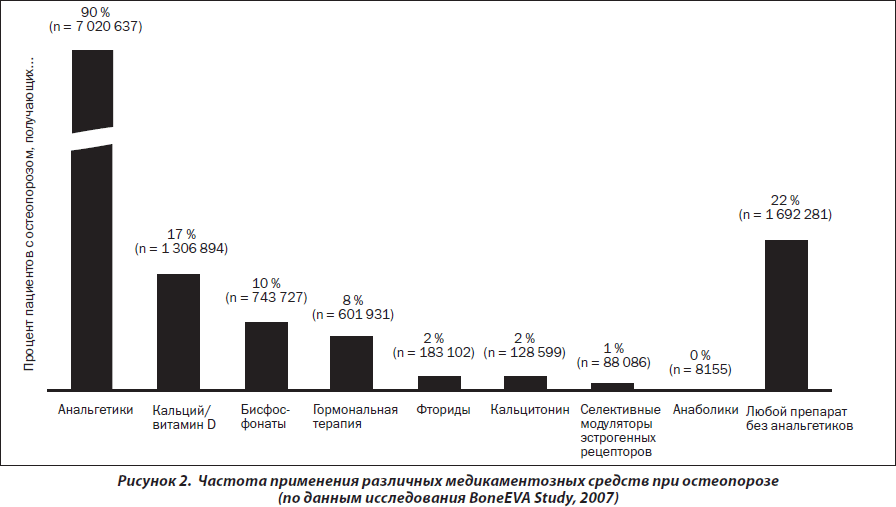
По данным исследования BoneEVA Study, проведенного в Германии (рис. 2), показано, что доля различных препаратов, применяемых в лечении остеопороза, различна, однако наиболее используемым классом препаратов являются анальгетики.
Нестероидные противовоспалительные препараты и миорелаксанты
Во всем мире около 30 млн человек регулярно принимают НПВП. Их число, вероятно, будет расти, поскольку в связи со старением населения планеты будет увеличиваться распространенность патологии опорно-двигательного аппарата и, в частности остеопороза. Считают, что все НПВП имеют сопоставимый обезболивающий эффект со снижением выраженности болевого синдрома приблизительно на 30 % и улучшением функции приблизительно на 15 %. При их использовании доза подбирается в зависимости от профиля побочных эффектов и ответа на лечение. Основной проблемой, ограничивающей использование НПВП, являются их побочные эффекты со стороны желудочно-кишечного тракта, что связано с подавлением синтеза простагландинов, обеспечивающих целостность слизистой оболочки желудка. Открытие двух изоформ циклооксигеназы (ЦОГ-1 и ЦОГ-2), обладающих селективным действием, создало предпосылки для синтеза новой группы НПВП — селективных ингибиторов ЦОГ-2. Однако в настоящее время у людей старших возрастных групп существуют ограничения и для применения ингибиторов ЦОГ-2, связанные с их кардиальными и церебральными осложнениями [Поворознюк В.В., Григорьева Н.В., 2004; Поворознюк В.В., Литвин В.О., 2005; Нall H., McIntosh G., 2008].
К препаратам, вызывающим центральную релаксацию спазмированной скелетной мускулатуры, относится мидокалм (толперизон). По данным литературы [Adams B.A. et al., 1997; Авакян Г.Н. и соавт., 2002; Поворознюк В.В. и др., 2006], он значительно улучшает кровоснабжение в спазмированных мышцах, прерывает образованный порочный круг «спазм — боль — спазм», оказывает мембраностабилизирующее действие и, соответственно, выраженный анальгезирующий и миорелаксирующий эффекты. Применение мидокалма в комплексной терапии с НПВП позволяет снизить дозы последних, уменьшая риск побочных явлений.
Кальцитонины
В настоящее время накоплен достаточно большой опыт применения кальцитонина при остром и хроническом болевом синдроме, связанном с остеопорозом [Silverman S.L., Azria M., 2002; Lyritis G.P., Trovas G., 2002; Поворознюк В.В., Орлик Т.В., 2002; Верткин А.Л., Алексанян Л.А., Ткачева О.Н., 2002; Мазуров В.И., Столов С.В. и др., 2006].
По данным некоторых авторов, кальцитонин может необратимо связываться со специфическими рецепторами, которые локализуются в различных структурах мозга, особенно в тех зонах гипоталамуса, которые принимают участие в передаче и восприятии болевого ощущения.
По данным некоторых авторов [Pasile А., 1983], центральные анальгетические эффекты кальцитонина напоминают действие опиоидных анальгетиков, а также связаны со стимуляцией высвобождения эндогенного агониста опиоидных рецепторов β-эндорфина [Laurian L. et al., 1986; Rochner J., Planche D., 1985].
В настоящее время, по мнению многих авторов, механизм анальгетического эффекта кальцитонина осуществляется посредством следующих механизмов:
— действие на специфические центральные рецепторы подобное таковому у нейротрансмиттеров;
— влияние на избыточное выделение кальция в нейрональной мембране;
— повышение уровня β-эндорфинов в крови;
— воздействие на метаболизм серотонина и моноаминов в ЦНС;
— снижение чувствительности ноцицептивных рецепторов к локальным альгогенным факторам (гистамин, серотонин, простагландины, кинины, ацетилхолин, тромбоксан и др.);
— подавление синтеза медиаторов, участвующих в передаче боли (нейротензин, соматостатин и др.).
Кроме выраженного анальгетического действия кальцитонин обладает и некоторым противовоспалительным эффектом, который подтвержден и при лечении бронхиальной астмы, острого панкреатита и других заболеваний.
Также в настоящее время исследован и антистрессорный эффект кальцитонина. Секреция гормона повышается под влиянием на организм различных стрессорных факторов [Држевецкая И.А. и др., 1983], а его уровень увеличивается при интенсивной мышечной нагрузке, иммобилизации, алкогольной интоксикации, инсулиновой гипогликемии и др. Назначение препарата в острый период заболевания может иметь защитный характер. Гипокальциемия, обусловленная усиленной секрецией кальцитонина, тормозит активность гипоталамо-гипофизарно-надпочечниковой системы и таким образом ослабляет избыточную стресс-реакцию [Држевецкая И.А. и др., 1981; Поворознюк В.В., Евтушенко О.А., 2004].
Доказано обезболивающее действие кальцитонина лосося у пациентов с переломами тел позвонков в остром периоде [Lyritis G.P., Tsakalakos N. et al., 1991; Lyritis G.P., Paspati I. et al., 1997; Lyritis G.P., Ioannidis G.V. et al., 1999]. Данные ряда исследований подтверждают то, что успешная анальгезия кальцитонином лосося при переломах тел позвонков позволяет избежать длительной иммобилизации пациента [Lyritis G.P., Paspati I. et al., 1997; Lyritis G.P., Ioannidis G.V. et al., 1999].
В исследовании, проведенном M.P. Abellan и соавт., при оценке параметров болевого синдрома и количества новых переломов показано, что в группе больных, которые интраназально принимали миакальцик (по 100 МЕ/день в течение 14 дней с 14-дневным перерывом + 500 мг кальция в день) в сочетании с небольшим количеством анальгетиков, значительно снизилась выраженность болевого синдрома, а частота переломов тел позвонков была достоверно ниже по сравнению с группой, в которой в течение 12 мес. принимали только препараты кальция [Abellan M.P. et al., 1995].
Выраженным анальгетическим эффектом обладают как парентеральные, так и интраназальные формы кальцитонина, однако результаты некоторых исследований показывают, что для снижения выраженности болевого синдрома при переломах тел позвонков интраназальный кальцитонин более эффективен по сравнению с инъекционными его формами [Abate G. et al., 1994].
Таким образом, на основании накопленного в настоящее время опыта применения кальцитонина при остеопорозе согласно критериям доказательной медицины можно сделать следующие заключения:
— терапия кальцитонином уменьшает интенсивность острого болевого синдрома, связанного с компрессионными переломами тел позвонков при остеопорозе. Интраназальная или парентеральная форма кальцитонина является препаратом выбора у больных, имеющих:
а) острый болевой синдром на фоне компрессионных переломов тел позвонков при остеопорозе (уровень доказательности А);
б) хронический болевой синдром на фоне компрессионных переломов тел позвонков при остеопорозе (уровень доказательности С);
— при недавно произошедшем переломе тела позвонка с целью уменьшения болевого синдрома и укорочения срока иммобилизации рекомендовано использование кальцитонина лосося (уровень доказательности В).
Таким образом, комбинированный анальгетический, противовоспалительный, антистрессорный и антирезорбтивный эффект кальцитонина чрезвычайно важен при лечении пациентов с выраженным (острым или хроническим) болевым синдромом вследствие переломов, особенно тел позвонков.
Кроме того, в настоящее время положительные результаты при использовании кальцитонина в качестве обезболивающего средства достигнуты в лечении ревматоидного артрита [Баженов А.Н., Трусов В.В., 1998], послеоперационных больных [Miralles F.S. et al., 1997], мигрени, фантомной боли [Kessel G., Worz R., 1987], боли в костях при болезни Педжета [Martin T.J., 1979], метастатических поражений кости [Agnusdei D. et al., 1992; Martin T.J., 1979], остеопороза, осложненного переломами костей [Gennari С. et al., 1991; Lyritiz G.P. et al., 1991; Поворознюк В.В., Орлик Т.В., 2004; Мазуров В.И., Столов С.В., 2007], обструктивного поражения периферических артерий.
Бисфосфонаты
В настоящее время наличие антиноцицептивного эффекта бисфосфонатов подтверждено в экспериментальных и клинических исследованиях [Hortobagyi G.N., Theriault R.L. et al., 1996; Fulfaro F., Casuccio A. et al., 1998; Nevitt M.C., Thompson D.E. et al., 2000; Рappagallo M., Breuer B. et al., 2003; Kawate H., Ohnaka K. et al., 2010]. Механизм положительного влияния бисфосфонатов в снижении уровня болевого синдрома до конца не ясен и продолжает изучаться.
В некоторых исследованиях установленно что снижение частоты вертебральных переломов на фоне терапии алендронатом сопровождается уменьшением выраженности вертебрального болевого синдрома [Nevitt M.C., Thompson D.E. et al., 2000], однако в других работах продемонстрирован анальгетический эффект алендроната даже при отсутствии новых компрессионных переломов уже через 2 мес. лечения [Kawate H., Ohnaka K. et al., 2010]. По данным некоторых авторов, такой быстрый анальгезирующий эффект алендроната может быть не связан с его антиостеопоротическим действием, а опосредован другими механизмами купирования боли [Рappagallo M., Breuer B. et al., 2003; Kawate H., Ohnaka K., et al., 2010].
По данным некоторых [Iwamoto J., Takeda T. et al., 2004], но не всех исследований, положительная динамика болевого синдрома коррелирует со снижением уровня маркеров резорбции костной ткани, в частности N-телопептида.
В исследовании японских ученых [Kawate H., Ohnaka K. et al., 2010] при сравнительном изучении эффективности 5 мг/день алендроната и 0,5 мкг/день альфакальцидола у 44 женщин в постменопаузальном периоде показано, что уже через 4 мес. лечения только в группе женщин, получавших алендронат, выявлено достоверное снижение выраженности болевого синдрома, улучшение качества жизни на фоне увеличения минеральной плотности костной ткани.
При сравнительном исследовании [Dursun N., Dursun E., Yalcin S., 2001] влияния препарата кальция (1000 мг/день) и комбинированного на его фоне приема кальцитонина (100 МЕ/день) или алендроната (10 мг/день) у 151 женщины в постменопаузальном периоде с остеопорозом через 1 год выявлено достоверное снижение выраженности болевого синдрома и улучшение качества жизни в группах, получавших кальцитонин либо алендронат, однако не в группе принимавших монотерапию препаратами кальция.
По данным многочисленных исследований, у пациентов с метастатическим поражением костной ткани либо множественной миеломой внутривенное применение бисфосфонатов, в частности памидроновой и золендроновой кислоты, эффективно снижает выраженность болевого синдрома [Berenson J.R., Lichtenstein A. et al., 1996; Hortobagyi G.N., Theriault R.L. et al., 1996; Fulfaro F., Casuccio A. et al., 1998].
Анальгетический эффект внутривенного введения памидроновой кислоты подтвержден не только при костных метастазах и миеломной болезни, но и при многих других заболеваниях, таких как анкилозирующий спондилоартрит, ревматоидный артрит, комплексный региональный болевой синдром. При обследовании 25 пациентов с болью в спине без остеопороза и вертебральных переломов на фоне лечения памидронатом установлено снижение выраженности болевого синдрома у 91 % больных на 41 % (р < 0,0001) [Pappagallo M., Breuer B. et al., 2003].
Стронция ранелат
В настоящее время в литературных источниках увеличивается количество данных, свидетельствующих об анальгетическом эффекте еще одного антиостеопоротического средства — стронция ранелата, представленного в Украине препаратом бивалос. Это единственный препарат для лечения остеопороза, обладающий двойным действием, не только антирезорбтивным, но и влияющим на процессы формирования костной ткани.
Уже в исследовании SOTI (Spinal Osteoporosis Therapeutic Intervention) с участием 1649 женщин, находящихся в постменопаузе, было показано, что применение стронция ранелата связано со значительным уменьшением выраженности вертебрального болевого синдрома через 12 мес. лечения. Так, при анализе результатов 1088 женщин в постменопаузальном периоде из группы активного лечения и группы плацебо было установлено, что выраженность вертебрального болевого синдрома была на 29 % выше в группе плацебо (р = 0,03) [Marquis P. et al., 2005]. Через 3 года лечения боль в спине отмечали 17,7 % женщин в группе получавших стронция ранелат и 21,3 % пациентов в группе плацебо (р = 0,07) [Meunier P.J., Roux C., Seeman E. et al., 2004].
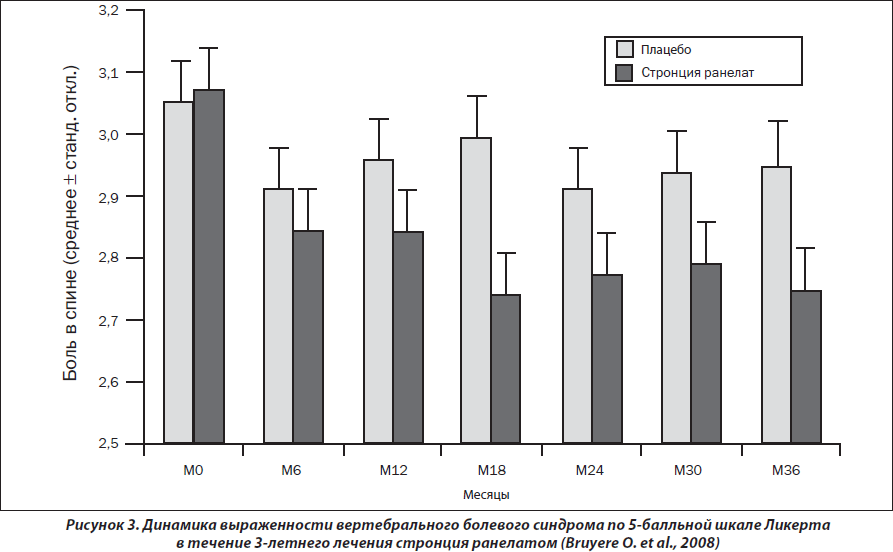
В дальнейшем при анализе показателей 1105 женщин с остеопорозом и сопутствующими рентгенологическими проявлениями дегенеративно-дистрофических изменений позвоночника, участвующих в исследованиях SOTI и TROPOS (рис. 3), был продемонстрирован выраженный анальгетический эффект стронция ранелата, который был достоверным уже с 12-го мес. наблюдения и поддерживался в течение 36 мес. исследования (р = 0,03) [Bruyere O. et al., 2008].
Впоследствии при проведении украинскими учеными [Поворознюк В.В., Дзерович Н.И. и др., 2007] исследования БАЛАНС с участием 74 женщин, находящихся в постменопаузальном периоде, также был подтвержден выраженный анальгетический эффект бивалоса. Достоверное уменьшение боли по результатам визуально-аналоговой шкалы (ВАШ) зарегистрировано уже на 3-й мес. лечения, а уменьшение болевых ощущений в средней и верхней части спины через 6 мес. отмечено у 45 % больных (р < 0,005).
Вертебропластика, кифопластика
Чрескожная вертебропластика используется более 15 лет в лечении пациентов с остеопоротическими переломами тел позвонков, однако до настоящего времени существует недостаточно лонгитудинальных контролированных исследований, оценивающих ее безопасность и эффективность в лечении больных с остеопорозом.
В большинстве из существующих исследований подтверждена положительная роль кифопластики в снижении выраженности болевого синдрома у пациентов с переломами тел позвонков [Lieberman I.H., Dudeney S. et al., 2001; Coumans J.V., Reinhardt M.K., Lieberman I.H., 2003; Grafe I., Da Fonseca K., Hillmeier J. et al., 2005; Kasperk C., Hillmeier J., Noldge G. et al., 2005; Majd M.E., Farley S., Holt R.T., 2005].
При анализе баз данных Medline, Embase и The Cochrane Controlled Trials Register [Ploeg W.T., Veldhuizen A.G. et al., 2006] проведен анализ 15 исследований: 11 проспективных, 3 ретроспективных и 1 контролированного. При анализе 1136 процедур у 793 пациентов выявлено достоверное уменьшение показателей визуально-аналоговой шкалы боли с 7,8 до 3,1 (–60,3 %) в раннем послеоперационном периоде.
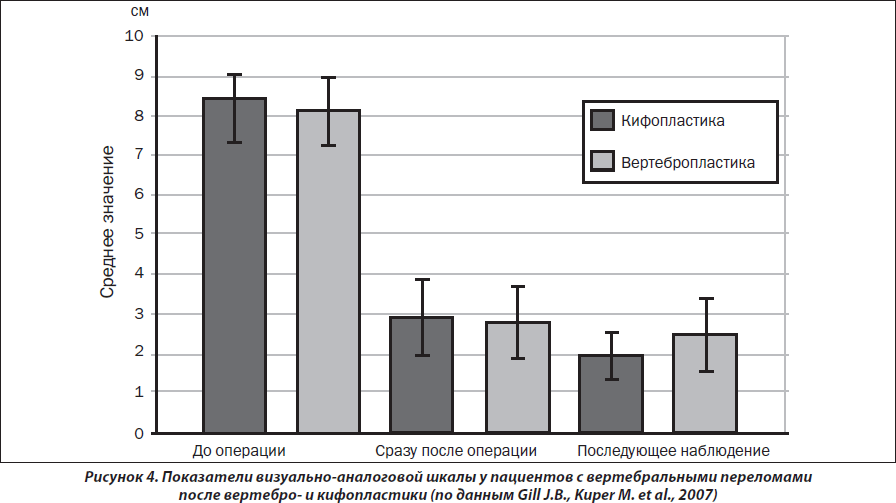
В недавно опубликованном мета-анализе [Gill J.B., Kuper M. et al., 2007] оценена эффективность вертебро- и кифопластики в снижении выраженности болевого синдрома, связанного с переломами тел позвонков (рис. 4). В анализ включены результаты 1046 вертебропластик (14 исследований), 263 кифопластик (7 исследований). Установлено, что кифо- и вертебропластика обладает выраженным анальгетическим действием в раннем послеоперационном периоде (p < 0,00001), однако достоверных различий между эффективностью вышеуказанных методик не выявлено. При дальнейшем наблюдении (минимальный период наблюдения — 6 мес.) отмечен длительный эффект обеих процедур, однако показатели визуально-аналоговой шкалы достоверно не отличались от таковых в раннем послеоперационном периоде (p = 0,25 и p = 0,38 для вертебро- и кифопластики соответственно). Проведенный анализ продемонстрировал выраженное (приблизительно на 50 %) снижение интенсивности болевого синдрома в раннем послеоперационном периоде на фоне отсутствия положительных результатов при предшествующем консервативном лечении остеопоротических переломов.
В 2006 году Национальным институтом здоровья (National Institute for Health) опубликованы рекомендации по ведению пациентов с вертебральными переломами, подлежащих вертебро- и кифопластике, в которых проанализированы накопленные результаты относительно эффективности и безопасности данных методов и подтверждена их положительная роль в снижении вертеброгенного болевого синдрома (www.nice.org.uk).
В недавно опубликованном исследовании [Kumar K., Nguyen R., Bishop Sh., 2010] проведен сравнительный анализ результатов вертебро- и кифопластики у пациентов с компрессионными переломами тел позвонков (средний период наблюдения составил приблизительно 42 нед.).
В группе пациентов после проведенной вертебропластики выраженность болевого синдрома согласно данным визуально-аналоговой шкалы уменьшилась с 8,0 до 5,5 см (р = 0,001), в группе кифопластики — с 7 до 2,5 см (р = 0,000001). Также уменьшились показатели индекса нетрудоспособности и улучшилось качество жизни больных.
Достоверное снижение выраженности болевого синдрома выявлялось уже через 1 нед. после проведения процедуры (показатели ВАШ для группы пациентов после вертебро- и кифопластики составили соответственно 4,7 ± 0,5 (р = 0,0001) и 3,3 ± 0,6 (р = 0,0005)) и было достоверно на 15 % выше во второй группе (р = 0,05). В последующем более выраженный анальгетический эффект продолжал сохраняться в группе пациентов после кифопластики: показатели ВАШ через 10,5 мес. после операции составляли в первой группе 5,5 ± 0,4 см и во второй группе 2,5 ± 0,7 см (р = 0,0005).
В 2009 году в журнале New England Journal of Medicine опубликованы результаты сразу двух рандомизированных мультицентровых плацебо-контролируемых исследований, в которых поставлена под сомнение эффективность анальгетического эффекта вертебропластики у пациентов с остеопорозом. В одном исследовании [Buchbinder R., Osborne R.Н., Ebeling P.R. et al., 2009] при участии 78 пациентов с одним либо двумя вертебральными переломами через 1 нед., а также 1, 3 и 6 мес. после выполненной чрескожной вертебропластики не выявлено достоверных различий в динамике болевого синдрома между исследуемыми группами.
В другом мультицентровом исследовании [Kallmes D.F., Comstock B.A., Heagerty P.J. et al., 2009] с участием 131 пациента с 1–3 вертебральными переломами показано сопоставимое по эффекту уменьшение выраженности болевого синдрома в раннем послеоперационном периоде, однако через 1 мес. после процедуры показатели болевого синдрома в группах не различались.
Полученные данные требуют более детального анализа отдаленных результатов в рандомизированных исследованиях, но не следует забывать, что сама процедура вертебро- или кифопластики способствует устранению болевого синдрома в позвоночнике, однако не уменьшает риск последующих переломов. В связи с этим патогенетическое лечение остеопороза, включающее применение антирезорбентов и стимуляторов формирования костной ткани, должно быть обязательным компонентом комплексного лечения больных.
Таким образом, проведенный анализ литературных источников позволяет сделать вывод о том, что комплексная терапия болевого синдрома у пациента с остеопорозом должна предусматривать назначение немедикаментозных и медикамендозных методов. Многие антиостеопоротические препараты не только помогают достичь повышения минеральной плотности костной ткани и снижения риска последующих переломов, но и оказывают выраженный анальгетический эффект, повышая качество жизни пациента.