Журнал «Боль. Суставы. Позвоночник» 1 (01) 2011
Вернуться к номеру
Біль при ревматоїдному артриті: патогенетичні механізми виникнення і клінічна характеристика
Авторы: Головач І.Ю., Клінічна лікарня «Феофанія» Державного управління справами, м. Київ
Рубрики: Семейная медицина/Терапия, Ревматология, Травматология и ортопедия, Неврология
Версия для печати
 Термін «біль» походить від латинського слова poena, що означає «покарання». І дійсно, вираженість больового синдрому може варіювати від мінімальних до нетерпимих значень. Біль рано чи пізно виникає в житті будь-якої людини, спричиняючи дискомфорт, знижуючи якість життя або взагалі роблячи її нестерпною [2, 5].
Термін «біль» походить від латинського слова poena, що означає «покарання». І дійсно, вираженість больового синдрому може варіювати від мінімальних до нетерпимих значень. Біль рано чи пізно виникає в житті будь-якої людини, спричиняючи дискомфорт, знижуючи якість життя або взагалі роблячи її нестерпною [2, 5].
Біль, безсумнівно, належить до найчастіших скарг, з якими мають справу лікарі різних спеціальностей у своїй повсякденній практиці. У ревматологічній практиці біль супроводжує будь-яке ураження суглобів і має запальний, дегенеративно-дистрофічний або кристалічний характер. У клініці ревматоїдного артриту (РА) саме біль займає провідне місце.
Біль являє собою типовий патологічний процес, що не має цільної нозологічної характеристики і є найпоширенішим симптомом, який завдає страждання мільйонам людей планети [1]. Парадоксально звучить, але з позицій філогенетики біль розглядається як захисна реакція, що сигналізує про наявність пошкоджуючого триггера, про необхідність усунення і зниження впливу патогенного чинника. Недарма Ч. Шерингтон влучно назвав біль «вартовим псом здоров’я» [5]. Біль є стимулятором антистресової захисної реакції організму, що активізує системи підтримання гомеостатичної рівноваги в мінливих умовах зовнішнього чи внутрішнього середовища. До таких захисних структур зараховують гіпоталамо-гіпофізарну, адренергічну і симпатоадреналову системи, тобто вищі надсегментарні вегетативні центри, мобілізатором яких в умовах патологічного впливу і є біль. Водночас сильний, нестерпний, тривало існуючий біль самостійно формує вогнища патологічного збудження, поглиблює функціонально-морфологічні зміни в органах і кістково-м’язових утвореннях, що первісно є джерелом больового синдрому внаслідок прогресуючого набряку і вторинної ішемії.
Феномен болю реалізується через спеціалізовану систему і являє собою мультифакторіальний процес, у якому задіяні численні нейротрансмітери і рецептори як периферичної, так і центральної нервової системи. Біль — це завжди суб’єктивний феномен, і його кінцева оцінка визначається місцем і характером пошкодження, природою пошкоджуючого чинника, психологічним станом людини і його індивідуальним життєвим досвідом. За тривалістю больові синдроми можуть бути гострими чи хронічними, за місцем виникнення — вісцеральними, віддзеркаленими, центральними та/або периферичними, за локалізацією — глибокими чи поверхневими. При цьому больові синдроми різної локалізації і характеру можуть опосередковано впливати один на одного.
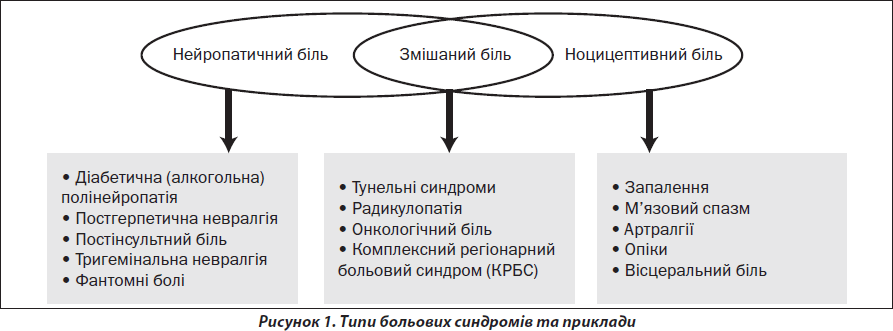
З позицій патофізіології запропоновано розрізняти ноцицептивний і нейропатичний біль [5, 6]. Ноцицептивний біль виникає, коли пошкоджуючий подразник діє на периферичні больові рецептори (ноцицептори), що розташовані в різних тканинах: у шкірі, м’язах, зв’язках, капсулах, суглобах тощо. Подразником ноцицепторів можуть бути як екзогенні термічні й механічні фактори, так і ендогенні процеси (запалення, м’язовий спазм). Ноцицептивний біль зазвичай буває гострим і виконує захисну роль. Характерною рисою даного больового синдрому є швидкий регрес після припинення дії пошкожуючого фактора і застосування болезаспокійливих засобів. Нейропатичний біль — це біль, що виникає при органічному ураженні різних відділів нервової системи, які відповідальні за контроль і проведення болю. Причинами нейропатичного болю можуть бути пошкодження аферентної соматосенсорної системи на будь-якому рівні, починаючи від периферичних чутливих нервів і завершуючи корою великих півкуль, а також порушення у низхідних антиноцицептивних системах (опіатній, серотонінергічній, норадренергічній). Поряд із «чистими» ноцицептивними і нейропатичними типами болю існує змішана група синдромів, при яких присутні ноцицептивний і нейропатичний компоненти. До таких синдромів належать онкологічні болі, радикулопатії, тунельні синдроми, комплексний регіонарний больовий синдром тощо (рис. 1).
Хронічний прогресуючий аутоімунний запальний процес і ураження суглобів у хворих на РА супроводжуються різними проявами, до яких зараховують такі властиві і прогностично значущі ознаки, як припухлість і деструктивні зміни суглобів, функціональні порушення, підвищення рівня гострофазових показників, ревматоїдного фактора і антитіл до циклічного цитрульованого пептиду. Однак центральне місце в клінічній картині захворювання, безсумнівно, займає біль. Саме біль є головною причиною звертання пацієнта по медичну допомогу. За останні роки якість лікування хворих на РА істотним чином покращилася, що сприяло зменшенню тяжкості перебігу захворювання, можливості досягнення ремісії, припинення прогресування недуги та навіть можливості загоєння ерозій кісток. Водночас біль продовжує залишатися серйозною проблемою [4, 9, 19].
Як клініка ревматоїдного процесу характеризується прогресуючим розвитком та появою нових симптомів і втягненням у патологічний процес усе нових і нових суглобів і структур, так і больовий синдром при РА набуває певних особливостей і відмінностей відповідно до перебігу недуги. Розрізняють гострий і хронічний біль. Гострий біль — це новий, нещодавній біль, нерозривно пов’язаний з пошкодженням, що викликало його, постає симптомом певного захворювання. Такий біль зникає при усуненні тригерного фактора. Гострий біль при ревматоїдному артриті виникає на ранніх стадіях захворювання, під впливом цитокінів, що запускають каскад патологічних реакцій. Хронічний біль часто набуває статусу самостійної хвороби, триває довгий період, і фактор, що спричинив цей біль, взагалі може не верифікуватися. Хронічний біль при РА виникає на більш пізніх стадіях хвороби, що пов’язано з необоротним ураженням суглобових тканин, розвитком панусу, ураженням періартикулярних тканин, м’язів, судин, нервових закінчень. Тому якщо на ранніх стадіях РА біль має суто ноцицептивний характер, то хронічний біль при РА — це типовий прояв змішаного болю — поєднання ноцицептивного і нейропатичного болю.
У загальній структурі болю будь-якого походження можна виділити п’ять основних компонентів:
1. Перцептуальний компонент, що дозволяє визначити місце пошкодження болю.
2. Емоційно-афективний компонент, що відображає психоемоційну реакцію на пошкодження.
3. Вегетативний компонент, пов’язаний з рефлекторними змінами тонусу симпатоадреналової системи.
4. Руховий компонент, спрямований на усунення дії пошкоджуючих чинників.
5. Когнітивний компонент, що бере участь у формуванні суб’єктивного ставлення до болю, що відчувається в даний момент, на основі накопиченого попереднього досвіду [2, 3].
При РА найкраще вивчений периферичний механізм суглобового болю, пов’язаний з активацією неінкапсульованих нервових закінчень (ноцицепторів) прозапальними медіаторами (інтерлейкін-1, інтерлейкін-6, туморнекротизуючий фактор a), синтез яких визначає властиву для РА кореляцію між інтенсивністю болю і запаленням. У зв’язку з цим значне поширення в лікуванні суглобового болю отримали нестероїдні протизапальні препарати, протизапальний і анальгетичний ефекти яких реалізуються через гальмування циклооксигенази-2 (ЦОГ-2) і пригнічення синтезу простагландинів — важливих медіаторів болю і запалення [8]. Центральний механізм болю полягає у розладах функцій центральної нервової системи, у виникненні психічних і емоційних порушень, які формують больовий поріг, больові відчуття і больову поведінку. На жаль, ці ефекти больового синдрому часто ігноруються і не враховуються в комплексі терапевтичних заходів.
Біль — це своєрідний психофізіологічний стан, що супроводжується не тільки органічними або функціональними порушеннями в організмі, а й призводить до психоемоційних змін [7]. Психологічні й емоційні ефекти болю часто впливають на суб’єктивну реакцію пацієнта, перебільшення або зменшення значущості болю. Лікарю часто доводиться мати справу з психоемоційними проявами больового синдрому, що формують так звану больову поведінку. Психологічний статус також може суттєво вплинути на сприйняття болю. Депресія і тривога асоціюються з посиленням болю при РА і здатні зумовити більш інтенсивний біль при порівняльній активності патологічного процесу [15]. Тривога, пов’язана з очікуванням болю, негативно відбивається на функціональному стані пацієнтів та врешті-решт посилює больові відчуття.
Біль як суб’єктивний симптом виникає при всіх захворюваннях суглобів, однак при кожній нозологічній формі він має відмінні риси [16]. Сприйняття болю у кожного пацієнта є строго індивідуальним, унікальним і залежить від різних чинників. Провідну роль у розвитку болю при хронічному артриті відіграють патофізіологічні особливості захворювання, психологічний статус та генетичні параметри пацієнта. Біль, зумовлений ураженням суглоба і позасуглобових структур, по-різному сприймається при різних ревматичних захворюваннях. Хворі на РА можуть стійко переносити дискомфорт, пов’язаний із болем, але поріг больових відчуттів у них нижчий, ніж у здорових осіб. Численні ранні дослідження стосовно больового порогу у хворих із артритами засвідчують, що інтенсивність больового синдрому варіює від пацієнта до пацієнта. Так, дослідники спостерігали пацієнтів з РА з істотними рентгенологічними змінами і вираженою атрофією м’язів кистей рук; при цьому пацієнти продовжувати виконувати тяжку роботу і подавали дуже мало скарг на больовий синдром [17]. При остеоартрозі й анкілозуючому спондилоартриті, навпаки, больовий поріг є надто високим [16]. Водночас болючість суглобів при РА виражена значно більше, ніж при псоріатичному артриті та остеоартрозі.
Відмінною особливістю больового синдрому при РА є погане перенесення болю, навіть при його незначній вираженості [19, 26]. У дебюті РА здебільшого біль має неінтенсивний характер, але внаслідок клінічних особливостей погано переноситься пацієнтами. Біль на ранніх стадіях РА має постійний характер, посилюється в ранні ранкові години, у стані покою; болі мають дифузний характер, відчуваються навіть там, де при пальпації суглоба не відзначається болючість; біль поширюється на весь суглоб; пацієнту складно виділити одну больову зону. Болі в суглобах супроводжуються скутістю, слабкістю в кінцівках, значним обмеженням функціональної активності, водночас болі виникають у регіонарних м’язах, сухожиллях, зв’язках, що додатково ускладнює рухи в суглобах.
Вираженість больових відчуттів не завжди відповідає ступеню розвитку запального процесу і рентгенологічним змінам у суглобах. Інтенсивність больових відчуттів залежить і від гормональних змін в організмі. Так, добре відомий факт, що больовий синдром у суглобах у жінок посилюється під час менструації.
Добові ритми симптоматики артриту і больового синдрому при РА є віддзеркаленням циркадних змін концентрацій медіаторів імунозапальних процесів при ревматоїдному артриті [13]. Період максимальної інтенсивності симптомів суглобової декомпенсації точно збігається з піками концентрації прозапальних цитокінів (інтерферону-g — ІФН-g, туморнекротизуючого фактора a, інтерлейкіну-1, інтерлейкіну-2, інтерлейкіну-6). Їх активність відповідає активності гіпоталамо-гіпофізарно-наднирникової системи (зниження продукції кортикостероїдів у ранні ранкові години) і епіфізу (підвищення нічної продукції мелатоніну).
Недавно було встановлено, що мелатонін — гормон шишкоподібної залози — бере участь у циркадних ритмах запальних реакцій, проявляючи при цьому антагоністичну спрямованість щодо кортизолу. Мелатонін і кортизол проявляють різноспрямовану реакцію на світло. Так, освітлення в ранкові години спричинює пік секреції кортизолу, а мелатонін, навпаки, синтезується лише в нічний час, коли освітлення відсутнє [10]. Нещодавно також досліджено, що у здорових осіб добова ритмічність клітинного (Th1) і гуморального (Th2) імунітету пов’язана з імуномодулюючими властивостями мелатоніну і кортизолу. Так, співвідношення ІФН-g/ІЛ-10 сягають максимуму в ранні ранкові години, корелюючи при цьому негативно з плазмовим рівнем кортизолу і позитивно — з рівнем мелатоніну [14]. Відповідно, інтенсивність болю при артриті змінюється послідовно впродовж доби: біль сильніший після пробудження, зранку, ніж у другій половині дня.
ІЛ-6 є одним із найпотужніших факторів, здатних стимулювати гіпоталамо-гіпофізарно-наднирникову систему людини. В експериментах на тваринах було продемонстровано, що різка активація гіпоталамо-гіпофізарно-наднирникової системи під впливом ІЛ-6 насамперед зумовлена його впливом на нейрони, що секретують кортикотропін-рилізинг-гормон. Блокада секреції цього гормону пригнічує вплив екзогенного ІЛ-6 на гіпоталамо-гіпофізарно-наднирникову систему [20].
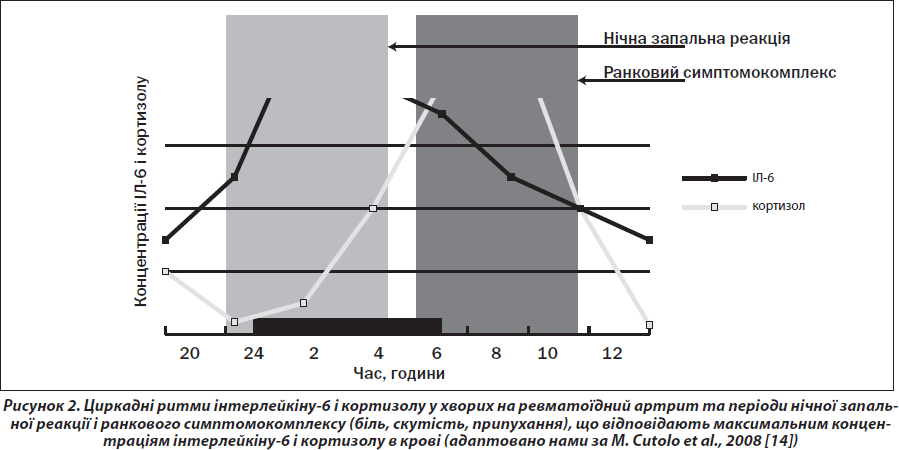
У нормі рівень кортизолу починає збільшуватися о 2.00 ночі, досягаючи піку до 8.00 години ранку (безпосередньо після ранкового пробудження), потім відбувається поступове зниження його концентрації до базальних значень приблизно до 12.00 години дня [23]. Пік концентрації ІЛ-6 настає на 2–3 години раніше, ніж АКТГ і кортизолу (між 1–4-ю годинами ночі). Ці гормональні зміни пояснюють, чому симптоми ревматоїдного артриту (біль, скутість, припухання суглобів) зазвичай зменшуються невдовзі після прокидання — на піку секреції кортизолу.
При ревматоїдному артриті пік ІЛ-6 досягається пізніше — між 2-ю та 7-ю годинами ранку, а його концентрація суттєво перевищує норму. Кортизол здійснює гальмівний вплив на ІЛ-6, але із затримкою на 5–6 годин (рис. 2). Це доводить, що гіпоталамо-гіпофізарно-наднирникова система не здатна упоратися з запаленням [11].
Той факт, що у хворих на ревматоїдний артрит пікова концентрація мелатоніну досягається щонайменше на 2 години раніше, ніж у здорових осіб, і триває довше, ніж у здорових осіб, дав можливість M. Cutolo et al. (2008) [14] припустити таку схему формування типової ранкової симптоматики при артриті. Відповідно до цієї гіпотезі, вранішнє та більш тривале підвищення рівня мелатоніну в першу половину ночі патогенетично пов’язано зі зниженням пікової концентрації кортизолу в ранні ранкові години — «відносна наднирникова недостатність». Оскільки відомо, що пікові концентрації основних прозапальних цитокінів — ІЛ-1, ІЛ-2, ІЛ-6, ІЛ-12, ІФН-g, ФНП-a — реєструються впродовж ночі та збігаються з високими концентраціями мелатоніну та низькими концентраціями кортизолу, було висловлене припущення про активну роль мелатоніну в індукуванні більш активного запального процесу в ці години. Водночас низькі концентрації кортизолу в ранкові години при ревматоїдному артриті порівняно зі здоровими особами здійснюють менш ефективне протистояння щодо запальних стимулів.
Отже, хронобіологічні ритми секреції основних гормонів істотним чином порушуються при ревматичних захворюваннях. При цьому особливе значення мають цитокін-опосередковані зміни циркадного ритму кортизолу і мелатоніну та їх участь у розвитку ревматоїдного запалення і формування своєрідної симптоматики ревматоїдного артриту, зокрема больового синдрому. Біль при РА характеризується добовим ритмом і залежить від внутрішніх чинників нервового й ендокринного порядку.
Тривалий хронічний перебіг артриту призводить до ослаблення суглобової капсули і зв’язкового апарату, що поєднано з гіпотрофією м’язів сприяє формуванню контрактур кисті різних типів. При ревматоїдному артриті найчастіше зустрічається:
— ульнарне відхилення пальців, що отримало специфічну назву «ласти моржа»;
— деформації за типом ґудзикової петлі (або бутон’єрки), що характеризується гіперекстензією п’ястковофалангових суглобів, згинальною контрактурою проксимальних і дистальних мідфалангових суглобів;
— деформація за типом лебединої шиї, що виникає внаслідок згинальної контрактури п’ястковофалангового суглоба і наступною гіперекстензією проксимального міжфалангового суглоба, а також згинання дистальної фаланги;
— деформація кисті за типом руки з лорнетом, що виникає внаслідок остеолітичного процесу, мутиляції та вкорочення фаланг, що супроводжується морщенням шкіри над ними.
Поява стійких деформацій призводить до порушення нормальних співвідношень у суглобі і перенавантаження тих ділянок суглоба, що фізіологічно непридатні для цього. Особливо критичним це постає для суглобів нижніх кінцівок, що мають більше навантаження, ніж суглоби верхніх кінцівок. У таких випадках типовий запальний характер болю, властивий РА, може модифікуватися на механічний біль, що виникає впродовж дня після навантаження, а його інтенсивність залежить від інтенсивності навантаження на суглоб.
Джерелом больової імпульсації також може бути ревматоїдне ураження м’язів [21]. Гіпотрофія і атрофія регіонарних м’язів виявляється вже на ранніх стадіях РА. Механізм такого швидкого розвитку аміотрофії з ураженням периферичних мононейронів залишається нез’ясованим, хоча ревматологи припускають нейрон-трофічний механізм ураження м’язів. Біохімічно в м’язових біоптатах виявляється зменшення вмісту глікогену і активності гліколітичних ферментів. Морфологічно виявляються запальні вогнища в сполучній тканині, ендомізії і перемізії, клітинні інфільтрати навколо кровоносних судин, іноді з їх облітерацією.
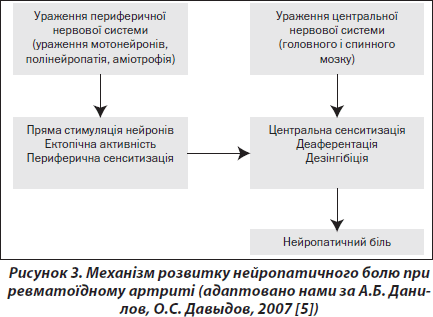
Перебіг РА супроводжується ураженням периферичної нервової системи. Так, РА може супроводжуватися розвитком 4 типів полінейропатії: дистальної симетричної сенсорної полінейропатії, множинної мононейропатії, змішаної сенсомоторної полінейропатії тяжкого ступеня, тунельної нейропатії. Зазвичай полінейропатії є частиною клінічної картини генералізованого васкуліту. У таких випадках у пацієнтів спостерігається типовий нейропатичний біль. Численні наукові роботи, присвячені іннервації суглобів, засвідчують, що суглобові нерви вміщують Аb-, Аd- і С-волокна. Нервові закінчення Аb-волокон ідентифіковані у зв’язках і суглобовій капсулі. Вільні нервові закінчення також знайдені в усіх структурах суглоба. Отже, всі суглобові компоненти, включаючи зв’язки, капсулу, синовіальну оболонку, жирову тканину, меніски й інші внутрішньосуглобові структури, але не суглобовий хрящ, можуть бути джерелом патологічної сенситації.
Больовий синдром РА не завжди свідчить про загострення процесу і не завжди постає віддзеркаленням інтенсивності запального процесу. Нерідко причиною болю є переломи, що досить часто виникають у хворих на РА, особливо у разі системної глюкокортикоїдної терапії, але погано діагностуються. Найчастішими локалізаціями виникнення переломів кісток є кістки, багаті на губчасту кісткову тканину, — хребці, ребра, гомілкові кістки, променева кістка, кістки таза та інші. Водночас і мікропереломи та зміни мікроархітектоніки кістки здатні стати джерелом больової імпульсації при РА.
Важливу роль у формуванні больових відчуттів при РА може відігравати патологія позасуглобових м’яких тканин. Запальний процес при РА уражає не тільки синовіальну оболонку суглобів, але й інші синовіальні структури. У частини пацієнтів теносиновіт сухожилків згиначів пальців кистей може бути одним із перших проявів захворювання і бути предиктором розвитку РА у хворих із раннім недиференційованим артритом [9]. Запалення синовіальної оболонки сухожилкових піхв супроводжується аналогічними змінами щодо синовії суглобів. При морфологічному дослідженні виявляють гіперплазію покривного шару і формування клітинних інфільтратів, що складаються з CD4+ Т-клітин і CD68+ макрофагів.
Проведені дослідження стосовно характеристики болю у хворих на РА дозволили встановити, що приблизно у третини пацієнтів існує дисоціація між болем і об’єктивними симптомами запалення [24, 25]. Вважається, що біль у таких випадках може індукуватися пошкодженням суглобів, а не активністю захворювання, яку зазвичай пов’язують із вираженістю запалення. Дослідники зауважують, що припухлість суглобів та тривалість ранкової скутості більшою мірою корелюють із рівнем С-реактивного білка, серопозитивністю за ревматоїдним фактором, ніж больовий синдром [18]. Водночас близько 10 % пацієнтів із РА не скаржаться на біль, незважаючи на високі показники активності [12, 25].
Таким чином, при РА можна виділити декілька варіантів болю [22]:
— Гострий біль, пов’язаний із вираженістю запалення в суглобах, корелює з концентрацією цитокінів у синовіальній рідині, ШОЕ та С-реактивним протеїном. За механізмом розвитку це ноцицептивний біль.
— Хронічний біль, пов’язаний із наслідками РА — деформаціями, деструкцією суглобових структур, ураженням періартикулярних тканин, м’язів, нервів. За механізмом розвитку це змішаний біль, що характеризується поєднанням ноцицептивних і нейропатичних компонентів.
Запалення в суглобі є причиною периферичної сенситизації (підвищення чутливості ноцицептивних первинних аферентних нейронів) і центральної сенситизації (підвищена збудливість ноцицептивних нейронів у центральній нервовій системі). Процеси сенситизації при артриті лежать в основі такого типу болю, що з’являється як спонтанний біль (суглоби у спокої), та гіпералгезії (додаткова відповідь на дію небольових стимуляторів). Сенситизації сприяють також еферентні нервові волокна, через які нервова система впливає на запалення.
При РА біль є сумісним результатом патологічного подразнення периферичних ноцицепторів і ноцицепторів нейронів спинного мозку. Патофізіологічним підґрунтям первинної гіпералгезії є сенситизація (підвищення чутливості) ноцицепторів до дії пошкоджуючих стимулів. Електрофізіологічно сенситизація ноцицепторів проявляється зниженням порогу їх активації, збільшенням частоти і тривалості розрядів у нервових волокнах, що призводить до посилення аферентного ноцицептивного потоку. Сенситизація ноцицепторів відбувається внаслідок виділення в зоні пошкодження медіаторів запалення, насамперед брадикініну, метаболітів арахідонової кислоти (простагландини і лейкотрієни), біогенних амінів, пуринів і низки інших речовин, взаємодіючи з відповідними рецепторами на терміналях ноцицептивних аферентів, підвищують чутливість останніх до механічних і термічних стимулів. У даний час велике значення в ініціації механізмів, що забезпечують сенситизацію ноцицепторів, надається брадикініну, який може здійснювати як прямий, так і непрямий вплив на чутливі нервові закінчення. Прямий збуджуючий ефект брадикініну на чутливі нервові закінчення опосередковується В2-рецепторами і пов’язаний з активацією мембранної фосфоліпази С.
На сенситизацію ноцицепторів і розвиток первинної гіпералгезії також впливають еференти симпатичної нервової системи. Встановлено, що підвищення чутливості терміналей високопорогових тонких аферентів при активації постгангліонарних симпатичних волокон опосередковується двома шляхами. По-першe, за рахунок підвищення судинної проникності у зоні пошкодження і збільшення концентрації медіаторів запалення і, по-друге, через прямий вплив нейротрансмітерів симпатичної нервової системи — норадреналіну і адреналіну, на a2-адренорецептори, розташовані на мембрані ноцицепторів [2, 5, 6].
Таким чином, периферичне пошкодження — пошкодження суглобових структур — запускає каскад патофізіологічних і регуляторних процесів, що охоплюють усю ноцицептивну систему — від тканинних рецепторів до коркових нейронів. Водночас, характеризуючи патогенез суглобового больового синдрому при РА, можна виділити такі ланки:
— подразнення ноцицепторів при пошкодженні суглобових тканин (внаслідок синовіту);
— виділення алгогенів (простагландини, лейкотрієни, брадикінін, цитокіни) і сенситизація ноцицепторів у ділянці пошкодження;
— посилення ноцицептивного аферентного потоку з периферії;
— сенситизація ноцицептивних нейронів на різних рівнях ЦНС.
Тому патогенетично обґрунтованими при больовому синдромі при РА вважається застосування засобів, спрямованих:
— на пригнічення синтезу медіаторів запалення;
— обмеження надходження ноцицептивної імпульсації із зони пошкодження в ЦНС;
— активацію структур антиноцицептивної системи.
Нейрогенні больові синдроми, щоправда, виникають при пошкодженні структур, пов’язаних із проведенням ноцицептивних сигналів. Важливим доказом цього положення є клінічні спостереження. Так, у пацієнтів після пошкодження периферичних нервів у ділянці постійної болючості, окрім парестезії і дизестії, відзначається підвищення порогів на укол і ноцицептивний електричний стимул [6]. Нейрогенному больовому синдрому властива наявність таких симптомів: постійний, спонтанний або пароксизмальний біль, сенсорний дефіцит у зоні болючості, алодинія (поява болючості при легкому непошкоджуючому впливі), гіпералгезія, гіперпатія. Поліморфізм больових відчуттів у різних пацієнтів зумовлений характером, місцем і ступенем ураження [21]. Однією з типових рис нейрогенних больових синдромів є алодинія — больові відчуття, що виникають при слабкому механічному подразненні, наприклад пензликом, певних ділянок шкіри.
При РА нейропатичний компонент болю з’являється на етапі формування хронічного больового синдрому, при пошкодженні нервових закінчень.
Отже, біль при РА, що формується внаслідок складного аутоімунного ураження периферичних суглобів та білясуглобових структур, має складний патогенез і є сумісним результатом патологічного подразнення периферичних ноцицепторів і ноцицепторів нейронів спинного мозку (рис. 3).
1. Ананьева Л.П. Симптоматическая терапия боли при ревматических заболеваниях // Consilium medicum. — 2002. — Т. 4, № 8. — P. 416-426.
2. Вейн А.М., Авруцкий М.Я. Боль и обезболивание. — Москва, 1997. — 279 с.
3. Головач І.Ю. Комбіновані анальгетичні препарати в симптоматичній терапії больового синдрому у ревматологічних хворих // Мистецтво лікування. — 2008. — № 2(48). — С. 72-75.
4. Головач І.Ю. Нова парадигма ревматоїдного артриту: імплементація рекомендацій ACR/EULAR’2010 // Внутрішня медицина. — 2011. — № 1. — С. 103-106.
5. Данилов А.Б., Давыдов О.С. Нейропатическая боль. — М.: Боргес, 2007. — 192с.
6. Кукушкин М.Л. Патофизиологические механизмы болевых синдромов // Боль. — 2003. — Т. 1, № 1. — С. 5-12.
7. Лисенко Г.И., Ткаченко В.И. Психоэмоциональные аспекты хронической боли у больных ревматоидным артритом // Здоровье Украины. — 2008. — № 5. — С. 66-67.
8. Насонов Е.Л., Чичасова Н.В., Шмидт Е.И. Перспективы применения неселективных нестероидных противовоспалительных препаратов (на примере кетопрофена) и селективных ингибиторов ЦОГ-2 в клинической практике // РМЖ. — 2002. — Т. 10, № 22. — С. 1014-1017.
9. Олюнин Ю.А. Боль при ревматоидном артрите. Особенности развития и методы коррекции // Современная ревматология. — 2010. — № 2. — С. 74-80.
10. Погожева Е.Ю., Каратеев А.Е., Каратеев Д.Е. Мелатонин и его роль в регуляции циркадного ритма воспалительной реакции при ревматоидном артрите // Научно-практическая ревматология. — 2008. — № 3. — С. 54-61.
11. Arvidson N.G., Gudbjrnsson B., Elfman L. et al. Circadian rhythm of serum interleukin-6 in rheumatoid arthritis // Ann. Rheum. Dis. — 1994. — Vol. 53(8). — P. 521-524.
12. Carr A.J., Thompson P.W. (1994) Towards a measure of patient-perceived handicap in rheumatoid arthritis // Br. J. Rheumatol. — 1994. — Vol. 33. — P. 378-382.
13. Cutolo M., Seriolo B., Craviotto C. et al. Circadian rhythms in RA // Ann. Rheum. Dis. — 2003. — Vol. 62. — P. 593-596.
14. Cutolo M., Straub R.H., Buttgereit F. Circadian rhythms of nocturnal hormones in RA: from bench to bedsite // Ann. Rheum. Dis. — 2008. — Vol. 67. — P. 905-908.
15. Dickens C., McGowan L., Clark-Carter D. et al. Depression in rheumatoid arthritis: a systematic review of the literature with meta-analyis // Psychosom. Med. — 2002. — Vol. 64(1). — P. 52-60.
16. Gerecz-Simon E.M., Tunks E.R., Heale J.-A., Kean W.F., Buchanan W.W. Measurement of pain threshold in patients with rheumatoid arthritis, osteoarthritis, ankylosing spondylitis, and healthy controls // Clin. Rheumatol. — 1989. — Vol. 8(4). — P. 467-474.
17. Huskisson E.C., Hart F.D. Pain threshold and arthritis // Br. Med. J. — 1972. — Vol. 4(5834). — P. 193-195.
18. Jones J.G. Pain in the rheumatic diseases // Ann. Rheum. Dis. — 1998. — Vol. 57(1). — P. 62-63.
19. Mengshoel A.M., Fоrre O. Pain and fatigue in patients with rheumatic disorders // Clin. Rheumatol. — 1993. — Vol. 12. — P. 515-522.
20. Naitoh Y., Fukata J., Tominaga T. et al. Interleukin-6 stimulates the secretion of adrenocorticotropic hormone in conscious, freely-moving rats // Biochem. Biophys. Res. Commun. — 1988. — Vol. 155. — P. 1459-1463.
21. Schaible H.G., Ebersberger A., Von Banchet G.S. Mechanisms of pain in arthritis // Ann. N.Y. Acad. Sci. — 2002. — Vol. 966. — P. 343-354.
22. Schaible H.G., Richter F., Ebersberger A. et al. Joint pain // Exp. Brain Res. — 2009. — Vol. 196(1). — P. 153-162.
23. Schmidt-Reinvald A., Pruessner J.C., Hellhammer D.H. et al. The cortisol response to awakening in relation to different challenge tests and a 12-hour corlisol rhythm // Life Sci. — 1999. — Vol. 64. — P. 1653-1660.
24. Sharpe L., Dear B.F., Schrieber L. Attentional biases in chronic pain associated with rheumatoid arthritis: hypervigilance or difficulties disengaging? // J. Pain. — 2009. — Vol. 10(3). — P. 329-335.
25. Thompson P.W. Pain in the rheumatic diseases // Ann. Rheum. Dis. — 1997. — Vol. 56 (12). — P. 395.
26. Wong H.Y. Neural mechanisms of joint pain // Ann. Acad. Med. Singapore. — 1993. — Vol. 22(4). — P. 646-650