Международный неврологический журнал 2 (40) 2011
Вернуться к номеру
Новые мишени терапевтического воздействия у пациентов с хронической ишемией головного мозга
Авторы: Мищенко Т.С., Здесенко И.В., Линская А.В., Мищенко В.Н., ГУ «Институт неврологии, психиатрии и наркологии АМН Украины», г. Харьков
Рубрики: Неврология
Версия для печати
В статье рассмотрены основные патогенетические механизмы хронического нарушения мозгового кровообращения. Особое внимание уделено изучению венозного компонента мозгового кровообращения и коррекции его нарушений. На основе проведенного исследования доказана эффективность препарата L-лизина эсцинат® в комплексной терапии пациентов с ликворно-венозными нарушениями при хронической ишемии мозга.
Ишемия головного мозга, L-лизина эсцинат®, ликворно-венозные нарушения.
Сосудистая патология головного мозга остается одной из основных причин смертности и инвалидизации населения земного шара. Эксперты ВОЗ предполагают дальнейший рост этой патологии в ближайшие десятилетия, что обусловлено «постарением» планеты и возрастающим распространением в популяции таких факторов риска развития сосудистых заболеваний головного мозга, как артериальная гипертензия, болезни сердца, сахарный диабет, гиперхолестеринемия, гиподинамия, курение и др. [1–6].
Важное место в структуре сосудистых заболеваний головного мозга занимают хронические нарушения мозгового кровообращения, обозначаемые нами в отечественной литературе и клинической практике термином «дисциркуляторная энцефалопатия» (ДЭ).
В Украине, по данным официальной статистики МЗ Украины, ДЭ занимает в структуре всех форм цереброваскулярных заболеваний около 90 % [4–6]. Почти 6 % населения страны обратились за медицинской помощью по поводу данного заболевания. За последние 10 лет темпы роста ДЭ практически удвоились, что связано как с истинным ростом данной патологии, так и гипердиагностикой данного заболевания [5–9].
Важность проблемы ДЭ определяется и тем, что течение этого заболевания у части больных осложняется развитием острых нарушением мозгового кровообращения (транзиторных ишемических атак, мозговых инсультов), а также сосудистой деменции.
Основными причинами ДЭ являются артериальная гипертензия (АГ) и атеросклероз. Установлено, что в процессе развития и прогрессирования этих заболеваний на всех структурно-функциональных уровнях сосудистой системы головного мозга формируется сложный и многообразный комплекс первичных деструктивных (острых, повторных), вторичных репаративных изменений и адаптивных процессов — ДЭ головного мозга. Из-за гипертонического стеноза, облитерации или атеросклеротического поражения мелких внутримозговых артерий нарушается кровоток в бассейне этих сосудов, а также развиваются наиболее типичные малые глубинные (лакунарные) инфаркты головного мозга. При неблагоприятном течении АГ повторные острые эпизоды нарушения мозгового кровообращения приводят к лакунарному состоянию мозга. Помимо острых повторных нарушений, часто возникающих в зонах терминального кровообращения, развиваются явления хронической ишемии, маркером которой является разрежение перивентрикулярного или субкортикального белого вещества — лейкоареоз, который патоморфологически представляет собой зону демиелинизации, глиоз и расширение периваскулярных пространств. В некоторых случаях неблагоприятного течения АГ возможно подострое развитие диффузного поражения белого вещества головного мозга с клиникой быстро прогрессирующей деменции и других проявлений разобщения, что обозначается в литературе термином «болезнь Бинсвангера».
Таким образом, в основе патоморфогенеза ДЭ лежит поражение перфорирующих церебральных артерий, приводящее к патологии белого вещества мозга (демиелинизация, поражение клеток олигодендроглии, апоптоз, лейкоареоз, атрофия коры). Характерные для ДЭ изменения (фибриноидный некроз, облитерирующий гиалиноз и склероз сосудистых стенок, милиарные аневризмы, очаги периваскулярного энцефалолизиса, малые глубинные инфаркты и др.) развиваются как в белом веществе полушарий, так и в определенных подкорковых структурах и стволе головного мозга. Наряду со множественными мелкоочаговыми изменениями в белом веществе полушарий мозга при ДЭ обнаруживаются его диффузные изменения (персистирующий отек, деструкция миелиновых волокон, спонгиоз и др.) [10–14].
Ведущим патофизиологическим моментом хронической ишемии головного мозга является гипоксия, которая влечет за собой по принципу порочного круга увеличение РаСО2, тканевый ацидоз, блокаду натриевого насоса, вазодилатацию, замедление артериального кровотока, затруднение ликвороциркуляции и венозного оттока из полости черепа [15–17].
В общей проблеме сосудистой патологии мозга особый интерес представляет изучение венозного звена. Постепенно в ангионеврологии утверждается концепция венозной дисфункции в формировании цереброваскулярной патологии.
Нарушения венозной циркуляции при хронической ишемии головного мозга закономерны ввиду анатомо-функционального единства артериальной и венозной систем мозга. Клиническая картина различных форм хронической церебральной ишемии — дисциркуляторной энцефалопатии — зачастую определяется не только нарушениями в артериальной системе головного мозга, но и в значительной мере расстройствами венозного кровообращения, причем в этих случаях течение и исход болезни зачастую зависят именно от венозных нарушений [18–22]. Указанные авторы настаивали на необходимости всестороннего расширения и углубления знаний о всех звеньях цереброваскулярных расстройств, признании терминов «венозная дисгемия», «венозная дисциркуляторная энцефалопатия».
До последних лет изучение венозного компонента мозгового кровообращения значительно отставало по своему объему от исследований артериальной гемодинамики. Вместе с тем у 71,5 % больных с артериальной гипертензией методом УЗИ обнаружена компрессия внутренних яремных, брахиоцефальных, позвоночных вен, а у ряда больных — веногипотония, недостаточность клапанов в устьях вен и аномалии их строения. По данным МР-венографии у больных с тяжелой и злокачественной АГ признаки нарушения венозного оттока головного мозга встречаются в 91 % случаев, а у больных с АГ 1–2-й стадии — в 55 % случаев.
В последние годы становится очевидным, что при нарушениях мозгового кровообращения наиболее важное патогенетическое значение имеют два фактора: 1) недостаточность притока крови к тканям мозга в бассейне стенозированной или закупоренной артерии и 2) недостаточность или задержка венозного оттока. Эти два процесса тесно взаимосвязаны, так как при нарушениях кровообращения в артериях мозга в той или иной степени страдает венозный отток; равным образом патология вен мозга приводит к нарушению артериальной гемодинамики и метаболизма мозга [18–23]. В настоящее время венозную систему мозга рассматривают как высокоорганизованную рефлексогенную зону, ответственную за развитие сложных, имеющих важнейшее физиологическое значение компенсаторных реакций, обеспечивающих постоянство мозгового кровотока.
Венозный застой в головном мозге является наиболее частой формой расстройств венозного мозгового кровообращения. При нарастании венозного застоя наступают значительные изменения мозгового метаболизма, нарушается кислородный, водный, углеводный, жировой баланс мозга, нарастают гипоксия и гиперкапния, повышается венозное и внутричерепное давление, развивается отек мозга. Показана высокая степень зависимости дисциркуляторной энцефалопатии от венозного застоя, который у этих больных носит тотальный (по типу общей флебопатии) характер. Это выдвигает проблему борьбы с ликворно-венозными нарушениями у больных с ДЭ в число приоритетных и определяет актуальность поиска терапевтических воздействий, направленных на снижение венозного давления в мозге.
В лечении больных с нарушениями венозной мозговой гемоциркуляции значительное место занимает медикаментозная терапия, направленная на обеспечение интракраниального венозного оттока [24–26]. К сожалению, вопросы фармакотерапии расстройств венозного мозгового кровообращения до сих пор остаются спорными и недостаточно отработанными. Спектр действия большинства препаратов достаточно узок (декстраны влияют на реологию крови, антиагреганты уменьшают агрегационную активность тромбоцитов, венотоники улучшают тонус венозной стенки), и для достижения оптимального эффекта необходимо применять несколько препаратов разных групп. Сегодня идет поиск идеального препарата для лечения расстройств венозного мозгового кровообращения, который должен воздействовать на как можно большее количество патогенетических звеньев, иметь минимальное количество побочных эффектов и высокую биодоступность.
Сегодня на фармакологическом рынке присутствует препарат L-лизина эсцинат® (Корпорация «Артериум», Украина) действующим веществом которого является водорастворимая соль сапонина конского каштана — эсцина и аминокислоты L-лизина. В препарате содержание b-эсцина составляет 76,35–79,29 %. Препарат обладает венотоническим, противоотечным действием, уменьшает явления венозного застоя и нарушения питания ткани благодаря нормализации микроциркуляции, сосудистой и тканевой проницаемости.
Проведено достаточное количество различных многоцентровых исследований, которые показали эффективность препарата L-лизина эсцинат® при лечении больных в нейрохирургии, неврологии, вертебрологии, ревматологии, травматологии [27–29].
Показано, что терапия препаратом L-лизина эсцинат® приводит к уменьшению воспалительных, болевых проявлений, тяжести, дискомфорта, отеков, оказывает умеренный иммунокорригирующий и гипогликемический эффекты. Эффективность препарата доказана при тяжелых отеках головного и спинного мозга, в том числе при травматических поражениях, субарахноидальных кровоизлияниях и внутричерепных гематомах со смещением срединных структур головного мозга и с явлениями отека-набухания; при отечно-болевых, отечно-воспалительных синдромах позвоночника, туловища, конечностей; тяжелых нарушениях венозного кровообращения нижних конечностей при остром тромбофлебите.
Препарат оказывает действие на основные звенья формирования венозной дисциркуляторной патологии (центральные, гемодинамические, циркуляторные).
Исходя из приведенных выше данных, нами предпринято исследование по изучению эффективности препарата L-лизина эсцинат® (Корпорация «Артериум», Украина) в комплексной терапии пациентов с ликворно-венозными нарушениями при хронической ишемии мозга.
Основные задачи исследования:
1. Оценить эффективность исследуемого препарата в лечении ликворно-венозных нарушений у больных с хронической ишемией мозга (дисциркуляторной энцефалопатией).
2. Изучить венотропный эффект исследуемого препарата, его влияние на венозный кровоток и гемодинамику в лечении больных с хронической ишемией мозга.
3. Оценить превышающую терапевтическую эффективность исследуемого препарата по сравнению с группой контроля на основании результатов лечения, полученных в основной и контрольной группах.
Всем больным проводили полное клинико-инструментальное обследование.
Основными методами обследования были:
1. Объективный осмотр (измерение артериального давления (АД), частоты сердечных сокращений (ЧСС), проведение ЭКГ, измерение температуры (t) тела, аускультация сердца, легких, оценка субъективных жалоб).
2. Клинико-неврологическое обследование. Оценивали выраженность следующих симптомов: головная боль, шум в голове, шаткость при ходьбе, колебания артериального давления, цианоз кожных покровов лица, отечность под глазами, утренняя отечность лица, расширение вен кожи лица, зрительные нарушения, нарушения сна, утомляемость, снижение работоспособности. Оценка клинико-неврологических показателей проводилась с использованием вербальной аналоговой шкалы в баллах: 0 — признак отсутствует; 1 — признак выражен слабо; 2 — признак выражен умеренно; 3 — признак выражен сильно.
3. Нейропсихологическое обследование (определение состояния пациента согласно данным шкалы астенического состояния (ШАС)). Шкала астенического состояния разработана Л.Д. Майковой и адаптирована Т.Г. Чертовой на базе данных клинико-психологических наблюдений и известного опросника MMPI (Миннесотский многомерный личностный перечень). Шкала состоит из 30 пунктов-утверждений, отражающих характеристики астенического состояния. Оценка астенического состояния по ШАС проводилась согласно градации: от 30 до 50 баллов — отсутствие астении; от 51 до 75 баллов — слабая астения; от 76 до 100 баллов — умеренная астения; от 101 до 120 баллов — выраженная астения.
4. Транскраниальное дуплексное сканирование (ТКДС) интракраниального венозного кровотока с оценкой скоростных параметров в венах Розенталя. ТКДС проводили на аппарате Sci med производства фирмы Medata (Швеция) по методике В.Г. Лелюк, С.Э. Лелюк, 2003 г. Повышение усредненной по времени максимальной скорости кровотока (ТАМАХ) в венах Розенталя более 15 см/с расценивали как проявление внутричерепной гипертензии и нарушения венозной циркуляции.
5. Регистрация спонтанной пульсации церебрального участка ретинальной вены. Осуществлялась визуально методом прямой офтальмоскопии электрическим офтальмоскопом ОР-2 в затемненном помещении после предварительного расширения зрачка. О наличии пульсации судили по спонтанному изменению диаметра вены в пределах диска зрительного нерва.
Нами было обследовано 150 пациентов обоих полов (53 мужчины и 97 женщин) в возрасте от 35 до 59 лет с диагнозом: хроническая ишемия мозга (дисциркуляторная энцефалопатия 1–2-й стадии) с ликворно-венозными нарушениями и выраженностью астении по ШАС 76–95 баллов, что соответствовало астении средней степени выраженности.
Все испытуемые методом простой рандомизации были распределены на две группы — основную (75 человек) и контрольную (75 человек).
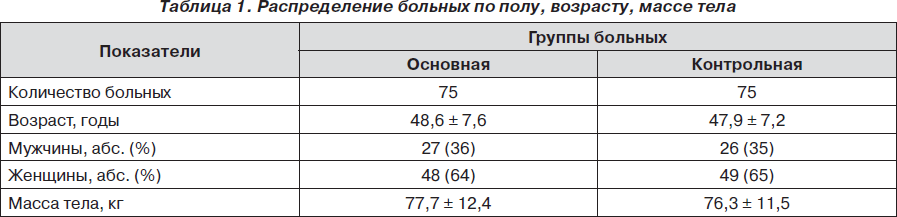
В табл. 1 приведено распределение пациентов по полу, возрасту, массе тела.
Как видно из табл. 1, группы были однородными по полу, возрасту, массе тела с равным преобладанием в каждой женщин.
Все пациенты получали базисную терапию согласно стандартам лечения больных с хронической ишемией мозга (дисциркуляторной энцефалопатией), включающую гипотензивные, гиполипидемические средства, антиагреганты (дозы которых были уменьшены в связи с возможностью усиления эффекта при совместном применении с препаратом L-лизина эсцинат®), при необходимости — седативные препараты, а также физиотерапевтические процедуры.
Пациенты основной группы наряду с базисной терапией ежедневно на протяжении 10 дней (1 раз в день в первой половине дня) получали исследуемый препарат L-лизина эсцинат®, 0,1% раствор, по 10 мл внутривенно капельно, в 50 мл физиологического раствора.
Положительными результатами терапии считали: устранение симптомов болезни или снижение выраженности симптомов до 1 балла; хорошую переносимость препарата; отсутствие побочных реакций.
Критериями эффективности препарата были: нормализация клинико-неврологического статуса, показателей ТКДС, офтальмоскопии; переход на более чем один уровень вниз по ШАС или уменьшение суммы баллов по ШАС более чем на 25 баллов в конце 10-дневного курса приема препарата.
Статистическую обработку полученных данных проводили с использованием методов описательной статистики (для количественных показателей — n, среднее арифметическое, медиана, стандартное отклонение, минимальное и максимальное значения; для качественных показателей — частота и доля в %), графических методов, методов интервального оценивания, критериев Манна — Уитни или Стьюдента для независимых выборок, критериев знаковых рангов Уилкоксона или критериев Стьюдента для связанных выборок для сравнения значений показателей до и после лечения (уровень значимости был взят равным 0,05), критериев Шапиро — Уилка.
Результаты и их обсуждение
Для обследованных больных как основной, так и контрольной группы характерным было возникновение в ночные или утренние часы головной боли с ощущением тяжести в затылке, с иррадиацией в лобно-глазничную область, давлением изнутри на глазные яблоки. С нарастанием интенсивности головная боль становилась распирающей, приобретала характер диффузной, постоянной. Помимо этого, пациенты жаловались на головокружение, шум в голове, закладывание в ушах, ощущение «сетки», «пелены», «мушек» перед глазами, расстройство сна, раннее пробуждение от интенсивной головной боли. Отмечалось снижение памяти, быстрая утомляемость, снижение внимания, работоспособности. У больных была заметна пастозность лица, век, больше выраженная в утренние часы, отечность под глазами, синюшность губ, изредка кончика носа, мочек ушей, расширение вен кожи лица, приступообразное покраснение или побледнение лица. Выраженность признаков у больных соответствовала 2–3 баллам. Очаговых расстройств в неврологическом статусе не было или они носили единичный, рассеянный характер.
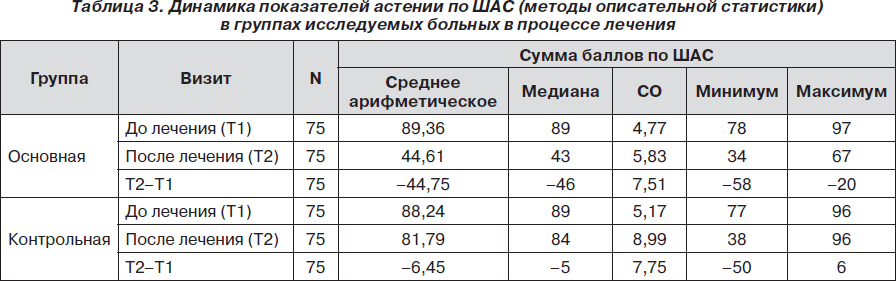
Пациенты обеих групп имели умеренную астению по категориальной ШАС. Пациенты основной группы в исходном состоянии имели уровень астении по ШАС от 78 до 97 баллов (среднее 89,40 ± 4,75 балла), пациенты контрольной — от 77 до 96 баллов (среднее 88,20 ± 5,18 балла).
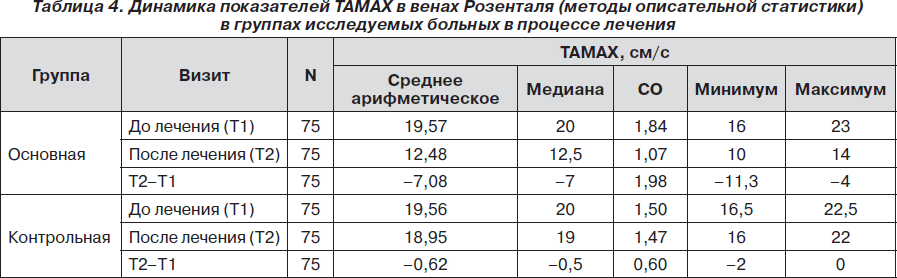
У всех пациентов по данным ТКДС ТАМАХ в венах Розенталя была больше чем 15 см/с, что расценивалось как нарушение венозной циркуляции и проявление внутричерепной гипертензии. Так, пациенты основной группы имели ТАМАХ в венах Розенталя в исходном состоянии от 16 до 23 см/с (среднее 19,57 ± 1,84 см/с), а пациенты контрольной — от 16,5 до 22,5 см/с (среднее 19,56 ± 1,50 см/с). При офтальмоскопии у всех пациентов не прослеживалась пульсация церебрального участка ретинальной вены, что также рассматривалось в пользу ликворно-венозных нарушений.
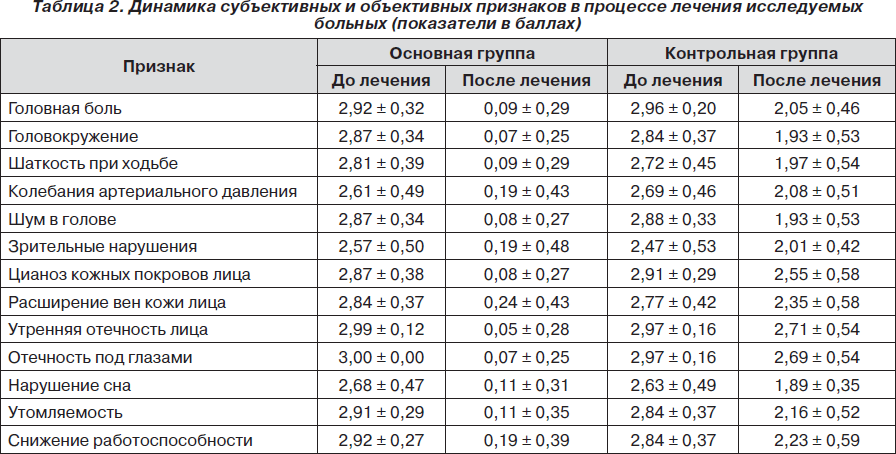
Динамика выраженности субъективной и объективной симптоматики, степени выраженности астении по ШАС, гемодинамических показателей по данным ТКДС, данных офтальмоскопии в процессе 10-дневного курса лечения представлена в табл. 2–5.
Как видно из табл. 2–5, у всех обследованных отмечалась положительная динамика в процессе 10-дневного курса лечения. Вместе с тем у больных основной группы с хронической ишемией мозга установлена превышающая эффективность терапии, включающей препарат L-лизина эсцинат® (Корпорация «Артериум», Украина) ликворно-венозных нарушений по сравнению со стандартной терапией по уменьшению выраженности субъективных жалоб, суммы баллов по ШАС, нормализации линейной скорости кровотока в базальной вене Розенталя и данным офтальмоскопии.
У всех больных основной группы применение на фоне базисной терапии препарата L-лизина эсцинат® способствовало клиническому улучшению в виде нивелирования головных болей, шума в голове, признаков венозных нарушений (отечность лица, век, цианоз кожных покровов лица, отечность под глазами), стабилизации АД, значительного уменьшения выраженности вестибулярных, зрительных нарушений, нормализации формулы сна, работоспособности и неврологической симптоматики (выраженность признаков не более 1 балла). В то же время в контрольной группе динамика клинико-неврологической симптоматики была незначительной. Выраженность признаков оставалась в пределах 2–3 баллов. Различия между основной и контрольной группами по одному из важнейших направлений исследования (уменьшение выраженности клинико-неврологических признаков к концу 10-дневного курса лечения до 1 балла) были статистически значимы (р < 0,001) и свидетельствовали в пользу превышающей эффективности терапии с применением препарата L-лизина эсцинат®.
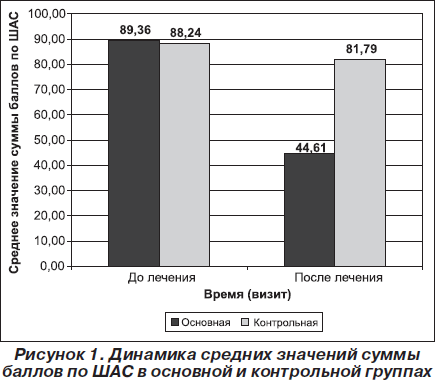
Отмечалась статистически значимая динамика показателей астенической симптоматики по ШАС. Сумма баллов по ШАС статистически значимо уменьшалась в конце курса лечения по сравнению с исходным состоянием как в основной (р < 0,001), так и в контрольной (р < 0,001) группе, что свидетельствовало о влиянии терапии на данный показатель в обеих группах. Однако уменьшение количества баллов по ШАС в основной группе было более выраженным, чем в контрольной. Так, среднее значение суммы баллов по ШАС в основной группе снизилось на 50,07 %: с 89,36 ± 4,77 балла до 44,61 ± 5,83 балла, в то время как в контрольной группе — на 7,31 %: с 88,24 ± ± 5,17 балла до 81,79 ± 8,99 балла (рис. 1). Различия между группами по одной из главных переменных исследования (переход на более чем один уровень вниз по ШАС или уменьшение суммы баллов более чем на 25 баллов в конце 10-дневного курса приема препарата) статистически значимы (р < 0,001), что также свидетельствовало в пользу превышающей эффективности терапии с применением препарата L-лизина эсцинат®.
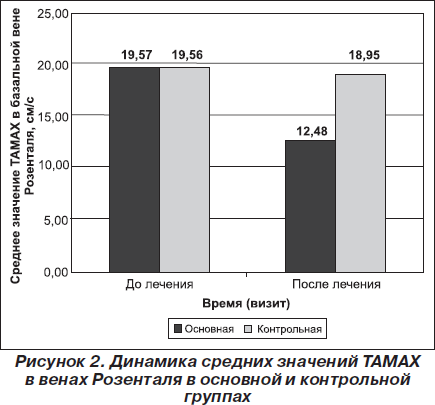
Позитивная динамика отмечалась и по показателям ТКДС. ТАМАХ в венах Розенталя статистически значимо уменьшалась в конце 10-дневного курса лечения по сравнению с исходным состоянием как в основной (р < 0,001), так и в контрольной (р < 0,001) группах. Однако уменьшение ТАМАХ в венах Розенталя в основной группе было более выраженным, чем в контрольной. Так, среднее значение ТАМАХ в венах Розенталя в основной группе снизилось на 36,21 %: с 19,57 ± 1,84 см/с до 12,48 ± 1,07 см/с, в то время как в контрольной группе — на 3,15 %: с 19,56 ± 1,5 см/с до 18,95 ± 1,47 см/с (рис. 2). Различия между группами по этой переменной исследования (нормализация ТАМАХ в базальной вене Розенталя) статистически значимы (р < 0,001), что также свидетельствовало в пользу превышающей эффективности терапии с применением препарата L-лизина эсцинат®.
По завершении курса лечения спонтанная пульсация церебрального участка ретинальной вены восстанавливалась у 94,7 % пациентов основной группы и только у 2,7 % пациентов контрольной группы, что дополнительно свидетельствовало о высокой эффективности исследуемого препарата.
Препарат L-лизина эсцинат® хорошо переносился больными, не оказывал влияния на показатели периферической крови, функциональное состояние поджелудочной железы, печени, почек. Содержание гемоглобина, количество лейкоцитов, эритроцитов, уровень глюкозы, билирубина, активность АСТ, АЛТ, СОЭ под влиянием лечения препаратом L-лизина эсцинат® существенно не изменялись.
Таким образом, оценивая суммарный лечебный эффект препарата L-лизина эсцинат®, можно считать его эффективным в лечении ликворно-венозных нарушений у больных с хронической ишемией мозга.
Выводы
1. В патогенезе цереброваскулярных заболеваний значительное место занимают ликворно-венозные нарушения, что определяет актуальность терапевтических воздействий, направленных на снижение венозных и ликворных составляющих при хронической ишемии мозга.
2. Лекарственный препарат L-лизина эсцинат® (Корпорация «Артериум», Украина) эффективен у пациентов с ликворно-венозными нарушениями при хронической ишемии мозга.
3. Результаты клинических исследований позволяют сделать вывод, что применение на протяжении 10 дней препарата L-лизина эсцинат®, 0,1% раствора, по 10 мл внутривенно, капельно, в 50 мл физиологического раствора ведет к статистически значимой положительной динамике как по данным клинико-неврологического статуса, так и по показателям категориальной ШАС, данным ТКДС и офтальмоскопии.
4. Терапия с применением препарата L-лизина эсцинат® (Корпорация «Артериум», Украина) превышает по эффективности стандартную терапию в лечении ликворно-венозных нарушений у пациентов с хронической ишемией мозга, в пользу чего свидетельствуют:
— переход на более чем один уровень вниз по ШАС или уменьшение суммы баллов более чем на 25 баллов в конце 10-дневного курса приема препарата;
— нормализация показателей ТАМАХ в венах Розенталя;
— выраженность субъективных жалоб не более 1 балла;
— восстановление спонтанной пульсации церебрального участка ретинальной вены.
5. Препарат L-лизина эсцинат® хорошо переносится больными, не оказывает отрицательного влияния на витальные функции, лабораторные показатели, улучшает качество жизни пациентов с ликворно-венозными нарушениями при хронической ишемии мозга.
1. Москаленко В.Ф., Волошин П.В., Петрошенко П.Р. Стратегія боротьби з судинними захворюваннями головного мозку // Український вісник психоневрології. — 2001. — Т. 9, вип. 1 (26). — С. 5-7.
2. Демографический ежегодник России. Статистический сборник. — М., 2007. — 30 с.
3. Стан неврологічної служби України в 2009 році. — Харків, 2010. — 10 с.
4. Варакин Ю.Я. Распространенность и структура цереброваскулярных заболеваний в различных регионах СССР по данным одномоментного эпидемиологического исследования // Журн. неврологии и психиатрии им. С.С. Корсакова. — 2005. — № 11. — С. 7-10.
5. Курачицкий В.И. Эпидемиология сосудистых заболеваний головного мозга // Журнал неврологии и психиатрии им. С.С. Корсакова. — 1995. — № 2. — С. 4-9.
6. Лущик У.Б., Алексєєва Т.С. Чому сьогодні не зменшуються показники захворюваності та смертності, пов’язані із серцево-судинною патологією // Практична ангіологія. — 2010. — № 3 (32). — С. 5-11.
7. Калашникова Л.А., Кулов Б.Б. Факторы риска субкортикальной атеросклеротической энцефалопатии // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2002. — Т. 7. — С. 3-8.
8. Инсульт / Ч.П. Ворлоу, М.С. Деннис, Ж. Ван Гейн, Г.Ж. Ханпий, П.А.Г. Салдерконн, Ж.М. Балефорд, Ж. Ворлоу. — 629 с.
9. Bautz-Holter E., Sveen U., Bruun Wyller T., Rygh J. Early Supported Discharge of Patients with Acute Stroke. A Randomised Controlled Trial // Cerebrovascular Disease. Official Journal of the European Stroke Council — 9th European Stroke Conference, Vienna, Austria, May 24–27, 2000. Abstracts. — P. 61.
10. Максудов Г.А. Дисциркуляторная энцефалопатия (сосудистые заболевания нервной системы). — М., 1975. — С. 501-512.
11. Шмидт Е.В., Лунев Д.К., Верещагин Н.В. Дисциркуляторная энцефалопатия. Сосудистые заболевания головного и спинного мозга. — М., 1976. — С. 227-244.
12. Верещагин Н.В., Моргунов В.А., Гулевская Т.С. Патология головного мозга при атеросклерозе и артериальной гипертензии. — М., 1997. — 288 с.
13. Дамулин И.В., Захаров В.В. Дисциркуляторная энцефалопатия: Методические рекомендации. — М., 2000. — 20 с.
14. Гусев Е.И. Ишемическая болезнь мозга. Актовая речь. — М., 1992.
15. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. — М., 2001. — 328 с.
16. Дамулин И.В. Сосудистая деменция // Неврологический журнал. — 1999. — Т. 4. — С. 4-11.
17. Мищенко Т.С., Шестопалова Л.Ф. Когнитивные и аффективные нарушения у постинсультных больных и возможности их коррекции // Международный неврологический журнал. — 2007. — № 2 (12). — С. 26 -30.
18. Карлов В.А., Куликов Ю.А., Ильина Н.Л., Грабовская Н.В. Дисциркуляторная энцефалопатия у больных артериальной гипертензией // Журнал невропатологии и психиатрии им. С.С. Корсакова. — 1997. — Т. 97 (5). — С. 15-17.
19. Шумилина М.В. Нарушения венозного церебрального кровообращения с сердечно-сосудистой патологией: Автореф. дис… д-ра мед. наук. — М., 2002. — 44 с.
20. Крыжановский Г.Н. Общая патофизиология нервной системы. — М.: Медицина, 1997. — 352 с.
21. Бердичевский М.Я. Венозная дисциркуляторная патология головного мозга. — М., 1989. — 224 с.
22. Бабенков Н.В. Нарушения венозного кровообращения мозга: патогенез, клиника, течение, диагностика // Журнал невропатологии и психиатрии им. С.С. Корсакова. — 1984. — Т. 84, вып. 2. — С. 281-288.
23. Мищенко Т.С. Вторичная профилактика ишемического мозгового инсульта // Український медичний часопис. — 2001. — № 5 (25). — С. 9-17.
24. Волошин П.В., Тайцлин В.И. Лечение сосудистых заболеваний головного и спинного мозга. — М.: Медпресс-информ, 2005. — 688 с.
25. Табеева Г.Р. Патогенетическая терапия хронической ишемии головного мозга // Справочник поликлинического врача. — 2007. — № 10.
26. Коркушко О.В., Лишневская В.Ю. Терапевтические возможности лечения хронической венозной недостаточности // Здоров’я України. — 2004. — № 9. — С. 3.
27. Бурлай В.З., Васильєва Л.В., Белименко В.А., Дейниченко Ю.К. Эффективность применения L-лизина эсцината в интенсивной терапии раннего послеоперационного периода у больных с внутримозговыми гематомами различного генеза // Новости медицины и фармации. — 2002. — № 19–20. — С. 3.
28. Горидова Л.Д. Применение L-лизина эсцината в острой фазе посттравматического периода при закрытой травме опорно-двигательного апарата // Вісник ортопедії, травматології та протезування. — 2002. — № 3. — С. 55-57.
29. Кардаш A.M., Черний В.И., Городник Г.А., Островой Е.Л. Лечение отека и набухания L-лизином эсцинатом у пациентов с опухолями головного мозга // Український нейрохірургічний журнал. — 2003. — № 3 (23). — С. 37-41.
30. Никонов В.В., Павленко А.Ю. Патогенетические аспекты комбинированного применения L-лизина эсцината и мексидола при травматическом отеке головного мозга // Медицина неотложных состояний. — 2006. — № 4 (5).
31. Новицкая-Усенко Л.В., Слива В.И. Отчет о клиническом исследовании препарата «Раствор L-лизина эсцинат 0,1% для инъекций» (3-я фаза клинических испытаний). — Днепропетровск, 2007.