Международный неврологический журнал 2 (40) 2011
Вернуться к номеру
Предикторы и фармакологическая коррекция недостаточности модулирующих систем мозга при мозговом инсульте и тяжелой черепно-мозговой травме
Авторы: Черний Т.В., Андронова И.А., Черний В.И., Донецкий национальный медицинский университет им. М. Горького, Донецкое областное клиническое территориальное медицинское объединение
Рубрики: Неврология
Версия для печати
Представлены данные клинического, неврологического и электроэнцефалографического исследования у 60 пациентов в возрасте от 22 до 68 лет с острой церебральной недостаточностью различного генеза. Исследования проводили до введения Глиатилина и на фоне максимальной концентрации препарата в плазме — через 30 минут после введения. С помощью метода интегрального количественного анализа целостного ЭЭГ-паттерна определялись коэффициенты, отражающие соотношения спектральных мощностей всех ЭЭГ-диапазонов. Реактивность мозга оценивалась по изменению абсолютной спектральной мощности и интегральных коэффициентов в ответ на введение нейротропного препарата. Были проанализированы особенности фармакологического ответа на введение Глиатилина с учетом реактивных перестроек исходной электроэнцефалограммы при фотостимуляции с частотой 2, 5 и 10 Гц. Установлены предикторы морфофункциональных нарушений модулирующей системы мозга, которые предопределяли высокую эффективность применения Глиатилина в минимальной дозе 1000 мг в сутки. Выявлены признаки функциональной состоятельности активирующих систем мозга, которые предопределяли эффективность применения Глиатилина в более высоких дозировках — от 1000 до 9000 мг в сутки. Используя классификацию типов реакций ЦНС на фармакологическое воздействие, оценивали адекватность употребляемой дозы препарата Глиатилин и способы ее коррекции.
Холинергическая система мозга, Глиатилин, интегральный количественный анализ ЭЭГ, типы реакций ЦНС.
Актуальность
В ангионеврологии применяется ряд препаратов, влияющих на нейропластические, нейромедиаторные, нейропротективные, нейротрофические и интегративные процессы в мозге [1, 2]. Реорганизация нейрональных процессов представляет собой совокупность ряда механизмов, включающих функционирование ранее неактивных путей, нейротрофическое восстановление волокон сохранившихся клеток с формированием новых синапсов, активацию нейрональных цепей. Поэтому продолжается поиск высокоэффективных нейропротекторов среди средств, восстанавливающих межнейрональную трансмиссию, обладающих трофическими и модуляторными свойствами, оказывающих регенераторно-репаративное действие, способствуя восстановлению нарушенных функций [2].
Одним из наиболее перспективных направлений метаболической защиты мозга от ишемии считается непосредственное воздействие на системы нейротрансмиттеров и нейромодуляторов мозга, на нейрональные рецепторы, создание условий для нормализации соотношения процессов возбуждающей и тормозной нейротрансмиссии [3, 4].
Установлено, что в основе когнитивных нарушений при церебральной недостаточности лежит холинергическая недостаточность, обусловленная снижением выработки ацетилхолина (АХ), нарушением баланса холинергических энзимов, потерей холинергических нейронов [5].
Изучение биохимических основ ЭЭГ-реакции активации показало, что кора получает широкие проекции от четырех основных медиаторных систем — дофаминергической, норадреналинергической, серотонинергической и холинергической. Однако только последняя причастна к ее активации. Кортикальная активация, вызванная электрической стимуляцией ретикулярной формации (РФ) ствола, сопровождается высвобождением ацетилхолина в коре, т.е. РФ действует на кору через холинергические афференты. Конечное звено корковой активации холинергично и представлено мускариновыми рецепторами нейронов коры, чувствительными к АХ [6–8].
Сенсорные раздражения разной модальности увеличивают количество высвобождающегося АХ в коре, а деафферентация животного сопровождается падением свободного АХ [7]. Реакция ЭЭГ-активации коррелирует с ростом количества АХ в жидкости, омывающей поверхность коры. Наркоз снижает выход АХ, одновременно блокируя ЭЭГ-активацию. Во время парадоксального сна активация также имеет холинергическую природу, которая развивается в коре на фоне редукции норадренергической и серотонинергической модуляций из-за снижения активности нейронов синего пятна и ядер шва. По данным позитронно-эмиссионной томографии, во время парадоксального сна активацию находят в покрышке варолиева моста, в лимбической системе: миндалине, парагиппокампальной коре, передней поясной коре и тесно связанной с лимбическими структурами медиальной префронтальной коре при одновременной деактивации дорсолатеральной префронтальной коры, в которой представлен аппарат рабочей памяти [8].
Холинергические нейроны переднего мозга принимают участие и в реакции активации, которая у животных представлена усилением гиппокампального тета-ритма. Их активирующие влияния из медиального септального ядра (MS) и ядра диагонального пучка, связанного с вертикальной ветвью (VDB), достигают гиппокампа, вызывая тета-ритм. Усиление гиппокампального тета-ритма в ответ на электрическую стимуляцию РФ реализуется через путь: РФ — базальная холинергическая система переднего мозга — гиппокамп [7, 8].
Все три системы активации коры мозга, реализуя свои специфические функции, вместе с тем имеют общие входы и выходы. Создавая свои локальные эффекты активации, все системы имеют выход на кору через таламус. Стволово-таламо-кортикальная система использует таламус для локальной активации как компонента ориентировочного рефлекса. Базальная холинергическая система переднего мозга через таламус реализует корковую активацию на значимые стимулы. Каудо-таламо-кортикальная система также использует таламус для создания в коре картины распределения локусов активации, необходимой для выполнения той или иной деятельности. Кортикофугальные влияния, главным образом из префронтальной коры, достигают холинергической активационной системы через стриопаллидарную (хвостатое и прилегающее ядра). Генерализованная реакция активации, вызываемая сенсорными стимулами вследствие возбуждения РФ среднего мозга, опосредована холинергической системой переднего мозга. Последняя имеет прямое отношение к регуляции цикла «бодрствование — сон», что сближает механизм генерализованного ориентировочного рефлекса с функциональным состоянием бодрствования [7–10].
Приведенные данные позволяют понять значимость сохранения медиаторной холинергической системы мозга для процессов кома — сопор — оглушение — бодрствование.
Предшественники холина — экзогенные вещества, которые в организме превращаются в холин и обеспечивают поддержку, восстановление и синтез фосфолипидов клеточных мембран, а также нейромедиаторов ацетилхолина и дофамина. К предшественникам холина относят лецитин, холина альфосцерат и цитидин-5-дифосфохолин натрия [11].
На сегодняшний день известны два класса медикаментозных препаратов, направленных на преодоление холинергической недостаточности: 1) препараты, непосредственно восполняющие дефицит ацетилхолина. К ним относятся: холиномиметик центрального действия — холина альфосцерат (Глиатилин), являющийся прекурсором ацетилхолина, проникающим через гематоэнцефалический барьер; цитидин-5-дифосфохолин натрия (цитиколин), который является донором холина в процессах синтеза ацетилхолина [12]; 2) ингибиторы ацетилхолинэстеразы: прозерин, галантамин, нейромидин и др.
Установлена способность фосфолипидов и деацитилированных фосфолипидов поддерживать целостность мембран нервных клеток путем восстановления синтеза фосфолипидов и нейротрансмиттера ацетилхолина в поврежденном мозге. Поэтому центральные холиномиметики (холина альфосцерат, цитидин-5-дифосфохолин), являясь источниками холина и фосфатидилхолина, поддерживая физиологический уровень ацетилхолина, обладают мембраностабилизирующими свойствами, служат средствами, восстанавливающими межнейрональную трансмиссию.
Глиатилин (L-альфа глицерилфосфорилхолин (a-GPC), или холина альфосцерат) — холиномиметик с преимущественным влиянием на ЦНС. В состав препарата входит 40,5 % метаболически защищенного холина [13, 14]. Метаболическая защита обеспечивает высвобождение холина в головном мозге. При попадании в организм холина альфосцерат расщепляется под действием ферментов на холин и глицерофосфат: холин участвует в биосинтезе ацетилхолина — одного из основных медиаторов нервного возбуждения; глицерофосфат является предшественником фосфолипидов (фосфатидилхолина) нейронной мембраны [14].
Экспериментальные исследования показали, что Глиатилин стимулирует дозозависимое выделение ацетилхолина в физиологических условиях нейротрансмиссии. Глиатилин, с одной стороны, являясь донором холина, увеличивает синтез ацетилхолина, что, в свою очередь, имеет положительное воздействие на нейротрансмиссию, с другой — глицерофосфат участвует в синтезе фосфатидилхолина (мембранного фосфолипида) [14]. В результате то и другое оказывает положительное воздействие на мембранную эластичность и на функции рецепторов, что улучшает синаптическую трансмиссию.
Установлено, что Глиатилин увеличивает церебральный кровоток, усиливает метаболические процессы, активирует структуры ретикулярной формации головного мозга и восстанавливает сознание при травматическом поражении головного мозга [15]. По мнению М.М. Одинака и соавт. [14], этот пробуждающий эффект Глиатилина обладает четкой дозозависимостью и объясняется нормализацией уровня ацетилхолина в очаге поражения, восстановлением межнейронных связей. Таким образом, фармакодинамические исследования показали, что Глиатилин улучшает передачу нервных импульсов в холинергических нейронах, положительно воздействует на пластичность нейрональных мембран и на функцию рецепторов.
Таким образом, установлены три основных механизма, с помощью которых реализуется нейропротективный эффект холина альфосцерата при острой церебральной недостаточности (ОЦН): 1) Глиатилин — донор ацетилхолина, способствующего восстановлению межнейронных связей и нейротрансмиссии; 2) Глиатилин осуществляет прямую репарацию нейрональных мембран; 3) метаболотропное действие Глиатилина, связанное с уменьшением дегенерации свободных жирных кислот [14, 15].
Принципиальным отличием холина альфосцерата, по данным R. Di Perri et al., является способность нормализовать уровень ацетилхолина в остром периоде заболевания — от холина Глиатилин отделяет одна неэнергозатратная реакция, в то время как цитиколин — пять энергозатратных [16]. Именно поэтому центральный холинергический препарат — Глиатилин обладает не только мембраностабилизирующими и противоотечными свойствами, но и пробуждающим эффектом у пациентов в коматозных состояниях. Дозозависимый эффект восстановления сознания связывают со способностью Глиатилина стимулировать выделение ацетилхолина из пресинаптических терминалей и восстанавливать синаптическую нейротрансмиссию в первые минуты после введения препарата [16].
Цель исследования: оценка эффективности применения Глиатилина с помощью метода интегрального количественного анализа и изучения реактивности мозга в ответ на применение препарата.
Материал и методы исследования
Обследовано 60 пациентов с ОЦН различного генеза в нейрохирургическом центре ДОКТМО. В 1-ю группу вошли 36 больных с тяжелой черепно-мозговой травмой (ТЧМТ) (23 мужчины и 13 женщин в возрасте от 22 до 56 лет), а во 2-ю — 24 пациента с острым нарушением мозгового кровообращения (ОНМК) (18 мужчин и 6 женщин в возрасте от 45 до 68 лет). Исследования проводили до введения препарата Глиатилин, на фоне максимальной концентрации препарата в плазме (через 0,5 часа после введения препарата) и после завершения курса лечения. Глиатилин вводился по 1000 мг/сутки.
Проводили компьютерную и магнитно-резонансную томографию головного мозга, транскраниальную ультразвуковую допплерографию. Регистрация биопотенциалов мозга осуществлялась с помощью нейрофизиологического комплекса, состоящего из 8-канального электроэнцефалографа фирмы Medicor, персонального компьютера IBM PC AT с аналогово-цифровым преобразователем и специальным программным обеспечением Brain mapping [17, 18].
Изучались показатели абсолютной мощности (АМ, мкВ/√Гц), относительной мощности (%) для - (1–4 Гц), - (5–7 Гц), - (8–12 Гц), 1- (9–11 Гц), 1- (13–20 Гц), 2- (20–30 Гц) частотных диапазонов ЭЭГ. Для объективизации оценки ЭЭГ использован метод интегрального количественного анализа ЭЭГ-паттерна [17] с применением интегральных коэффициентов, которые дают возможность провести оценку спектральной мощности всех частотных диапазонов ЭЭГ и определить значимость отдельных частотных спектров ЭЭГ в формировании целостного паттерна ЭЭГ [18, 19]. Реактивность мозга оценивалась по изменению абсолютной спектр-мощности и интегральных коэффициентов на основании классификации типов реакций ЦНС на фармакологическое воздействие [18, 20]. Все полученные данные обрабатывались с использованием методов математической статистики с применением корреляционного анализа [21, 22].
Анализ полученных результатов и их обсуждение
Степень неврологического дефицита у больных с ОНМК по Скандинавской шкале инсультов составила 2–12 баллов [23]. Глубина коматозного состояния по шкале комы Глазго [17] в 1-й группе была 7–12 баллов, а во 2-й группе — 4–9 баллов.
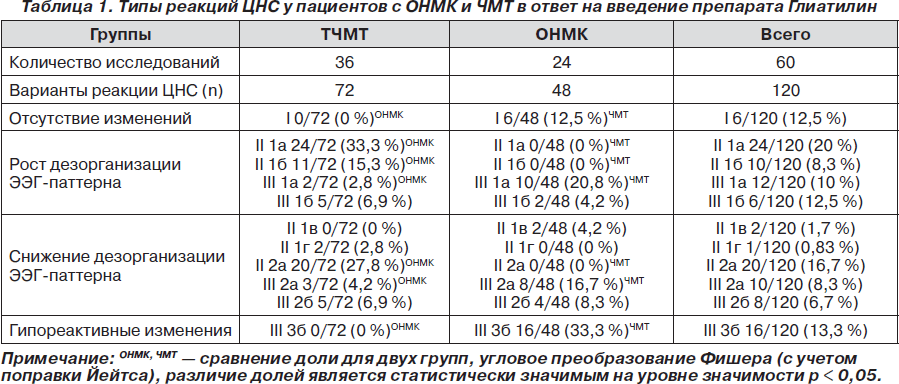
Используя классификацию типов реакций ЦНС [18, 20], у пациентов 1-й и 2-й групп были зафиксированы значимые изменения количественных и интегральных показателей ЭЭГ в ответ на фармакологическое воздействие Глиатилина (табл. 1).
У пациентов с тяжелой ЧМТ преобладали реакции ЦНС, характеризующиеся ростом дезорганизации ЭЭГ-паттерна за счет увеличения мощности медленноволновой активности дельта- и тета-диапазонов (II 1а, II 1б, III 1а, III 1б) (табл. 1). Они составляли 58,3 % от всех выявленных реакций. Реакции ЦНС, характеризующиеся активацией a- и b-ритмов ЭЭГ (II 1в, II 1г, III 2а, III 2б) или снижением уровня дезорганизации ЭЭГ-паттерна за счет угнетения медленноволновой активности (II 2а), составляли 41,7 % от всех выявленных ЭЭГ-изменений в ответ на введение препарата Глиатилин (табл. 1).
У больных с ОНМК в ответ на введение препарата Глиатилин доминировали так называемые гипореактивные реакции ЦНС (33,3 % от всех выявленных реакций), характеризующиеся перераспределением ЭЭГ- активности с увеличением бета2-мощности за счет редукции патологического дельта-ритма (III тип, 3б подгруппа) (табл. 1).
Таким образом, наборы типов реакций ЦНС в ответ на фармакологическое воздействие препарата Глиатилин значимо отличались у пациентов с ТЧМТ и ОНМК. При ТЧМТ не было зафиксировано реакций I типа и III 3б подгруппы, преобладали реакции II типа (79,2 %), причем чаще были зафиксированы реакции, отражающие снижение уровня активирующих подкорковых процессов (подгруппы II 1а — 33,3 %, II 1б — 15,3 %). При ОНМК преобладали реакции ЦНС III 3б подгруппы, из реакций ЦНС II типа были зафиксированы только изменения II 1в подгруппы, характеризующиеся значимым ростом суммарной мощности ЭЭГ-паттерна за счет активации высокочастотного бета2-ритма, то есть выраженной корковой ирритацией на фоне снижения неспецифических активирующих подкорковых влияний прежде всего со стороны РФ.
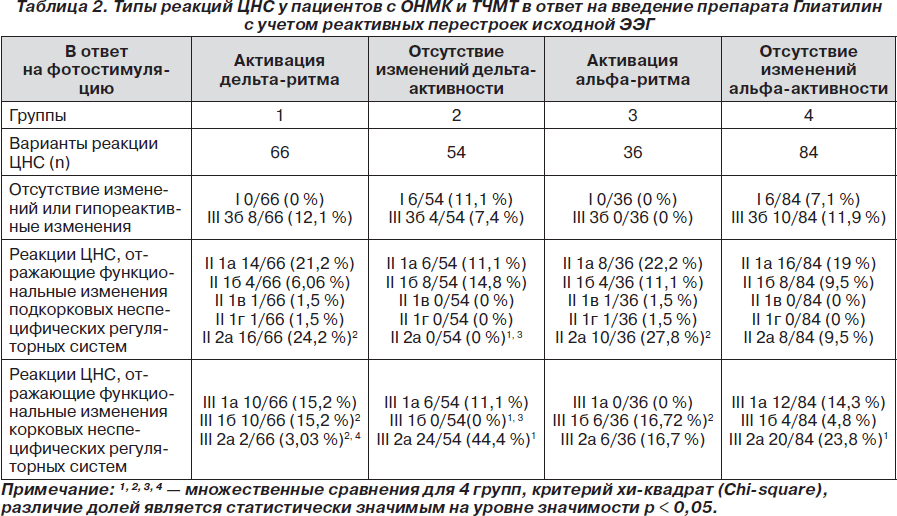
Были проанализированы особенности фармакологического ответа на введение Глиатилина с учетом реактивных перестроек исходной электроэнцефалограммы при фотостимуляции с частотой 2, 5 и 10 Гц (табл. 2).
Если до введения препарата Глиатилин в ответ на фотостимуляцию любой частоты на исходной ЭЭГ регистрировалась активация дельта-ритма (табл. 2), то после введения препарата преобладали реакции ЦНС II типа, отражающие функциональные изменения подкорковых неспецифических регуляторных систем и характеризующиеся значимым снижением (II 2а — 24,2 %) или ростом (II 1а — 21,2 %, II 1б — 6,06 %, II 1в — 1,5 %, II 1г — 1,5 %) суммарной мощности ЭЭГ-паттерна. Кроме того, реакции ЦНС I типа не были зарегистрированы, реакции III типа составляли только 45,5 %, среди них преобладали реакции III 1а (15,2 %) и III 1б (15,2 %) подгрупп, которые характеризовались перераспределением спектральной мощности в диапазоны медленных дельта- и тета-ритмов.
Если до введения препарата Глиатилин в ответ на фотостимуляцию любой частоты на исходной ЭЭГ увеличение спектральной мощности дельта-ритма не было зафиксировано (табл. 2), то после введения препарата преобладали реакции ЦНС III типа (62,9 %), из которых доминировали реакции III 2а подгруппы (44,4 %), характеризующиеся перераспределением спектральной мощности с активацией a- и b2-ритмов (нормальных ритмов ЭЭГ) за счет редукции дельта-активности.
Аналогичные закономерности были выявлены и в случае увеличения или стабильности уровня альфа-активности в ответ на фотостимуляцию на исходной ЭЭГ. Если до введения препарата Глиатилин при фотостимуляции любой частоты на исходной ЭЭГ регистрировался рост спектральной мощности альфа-ритма (табл. 2), то в ответ на введение препарата преобладали реакции ЦНС II типа (64,1 %), характеризующиеся значимым снижением (II 2а — 27,8 %) или ростом (II 1а — 22,2 %, II 1б — 11,1 %, II 1в — 1,5 %, II 1г — 1,5 %) суммарной мощности ЭЭГ-паттерна, и не регистрировались реакции ЦНС I типа и гипореактивные реакции III 3б подгруппы. И наоборот, если в ответ на фотостимуляцию на исходной ЭЭГ уровень альфа-активности оставался стабильным, то после введения препарата Глиатилин преобладали реакции ЦНС III типа (54,9 %), из которых доминировали реакции III 2а подгруппы (23,8 %).
Принято считать, что функция стволовой неспецифической системы (ретикулярной формации среднего мозга) состоит в поддержании в мозге определенного функционального состояния. Изменения спонтанной электрической активности коры в ответ на действие сенсорного раздражителя следует понимать как выражение диффузной активации коры со стороны неспецифических образований ствола мозга. Возбуждения со специфической проекционной системы по коллатералям поступают в РФ ствола, где происходит их интеграция с различными центрифугальными влияниями [8]. Поэтому световой раздражитель (фотостимуляция) вызывает, с одной стороны, проведение возбуждения по специфическим проекционным путям, выполняющим функцию информации организма, с другой — активацию коры, да и всего организма, осуществляемую через РФ ствола мозга [24]. Выход стволовой ретикулярной формации на кору осуществляется через базальную холинергическую систему переднего мозга, которая, в свою очередь, проецируется на кору как моносинаптически, так и через таламус [7].
Как известно, таламический, в отличие от коркового, ЭЭГ-ритм дельта-диапазона генерируется отдельной клеткой таламуса на самом глубоком уровне ее гиперполяризации [8, 24]. А для генерации таламусом альфа-ритмов адекватного функционирования отдельных клеток недостаточно, необходимы свойства нейронных сетей, такие как синхронизированное торможение ретикулярными нейронами (вентральный таламус — ретикулярное ядро) таламо-кортикальных нейронов при их относительной деполяризации [25]. То есть усвоение навязываемого ритма световых мельканий при фотостимуляции свидетельствует о функциональной состоятельности активирующей системы ретикулярной формации ствола, базальной холинергической системы переднего мозга и активирующей — инактивирующей системы неспецифического таламуса (таламо-кортикальной системы). В этом случае препарат Глиатилин целесообразно применять под нейрофизиологическим контролем и начинать введение с минимальных дозировок (1000 мг/сутки). Введение Глиатилина должно регламентироваться в соответствии с типами реакций ЦНС в ответ на его фармакологическое воздействие: постепенное («шаг» — от 1000 мг) [11, 14] увеличение дозировки при реакциях II 2а, III 2а, III 3б, снижение при реакциях II 1а, II 1б, стабильность дозы препарата при реакциях II 1в, II 1г, III 1а, III 1б.
И наоборот, отсутствие усвоения при моноритмической фотостимуляции является предиктором морфофункциональных нарушений на любом уровне модулирующей системы мозга. В таком случае исходная доза препарата Глиатилин может быть увеличена с 1000 мг/сутки до 9000 мг/сутки. Это позволит в условиях функциональной недостаточности активирующих систем мозга (неспецифическая система (РФ) среднего мозга, активирующая — инактивирующая система неспецифического таламуса и т.д.) обеспечить прямую холинергическую кортикальную активацию [6, 7]. А последующие нисходящие корковые влияния оптимизируют функционирование как активирующих, так и обладающих свойствами торможения (синхронизирующий центр Моруцци, преоптическая область латерального гипоталамуса, фронтальная кора, комплекс синего пятна и ядер шва и т.д.) модулирующих систем головного мозга [8, 26].
Причем, вероятно, реакции ЦНС III 3б подгруппы (перераспределение спектральной мощности ЭЭГ-паттерна в диапазон высокочастотного бета2-ритма за счет редукции медленноволновых, преимущественно дельта-частотных, ритмов) в данном случае отражают этап кортикальной активации, а реакции III 2а подгруппы (перераспределение спектральной мощности ЭЭГ-паттерна в диапазон альфа-ритма с умеренной активацией бета-диапазона за счет редукции медленноволновых ритмов) — начальный период оптимизации функционирования неспецифического таламуса.
Выводы
1. Использование классификации типа реактивности ЦНС в ответ на введение Глиатилина с помощью количественной ЭЭГ с применением метода интегральной количественной оценки ЭЭГ-паттерна позволяет оценивать адекватность употребляемой дозы препарата и необходимость ее коррекции.
2. У пациентов с мозговым инсультом и черепно-мозговой травмой отсутствие усвоения навязываемых ЭЭГ-ритмов при фотостимуляции является предиктором морфофункциональных нарушений на любом уровне активирующих модулирующих систем головного мозга и предопределяет высокую эффективность применения Глиатилина.
3. Адекватное усвоение навязываемого ритма световых мельканий при фотостимуляции свидетельствует о функциональной состоятельности активирующих систем мозга, применение препарата Глиатилин в таких условиях должно начинаться с минимальных дозировок (1000 мг/сутки), дозу препарата целесообразно корригировать под нейрофизиологическим контролем. Дозозависимый эффект Глиатилина — предмет отдельного исследования.
1. Черний В.И., Колесников А.Н., Городник Г.А., Остро-вая Т.В., Чернявский Р.И. Ишемия головного мозга в медицине критических состояний. Нейропротекция (патофизиология, терминология, характеристика препаратов): Метод. рекомендации. — Киев, 2007. — 72 с.
2. Беленичев И.Ф., Черний В.И., Колесников Ю.М. и др. Рациональная нейропротекция. — Донецк: Издатель Заславский А.Ю., 2009. — 262 с.
3. Верещагин Е.И. Современные возможности нейропротекции при острых нарушениях мозгового кровообращения и черепно-мозговой травме (обзор литературы) // Журнал интенсивной терапии. — 2006. — № 3. — С. 4-28.
4. Верещагин Н.В., Пирадов М.А. Принципы ведения и лечения больных в острейшем периоде инсульта. Интенсивная терапия острых нарушений мозгового кровообращения. — Орел, 1997. — С. 3-11.
5. Flentge F., Van Der Berg C.J. Choline administration and Ach in brain // J. Neurochem. — 1979. — 32. — 1331-1333.
6. Cummings, Jeffrey L.M.D. Cholinesterase Inhibitors: A New Class of Psychotropic Compounds // The American Journal of Psychiatry. — 2000. — Vol. 157(1). — Р. 4-15.
7. Основы психофизиологии: Учебник / Отв. ред. Ю.И. Александров. — М.: ИНФРА-М, 1997. — 349 с.
8. Данилова Н.Н. Психофизиология: Учебник для вузов. — М.: Аспект Пресс, 2001. — 373 с.
9. Borbйly A.A., Achermann P. Sleep homeostasis and models of sleep regulation // Principles and Practice of Sleep Medicine / Ed. by M.H. Kryger, T. Roth, W.C. Dement. — Philadelphia: Elsevier/Saunders, 2005. — Р. 405-417.
10. Путилов А.А., Донская О.Г., Веревкин Е.Г., Пути- лов Д.А. Изучение пространственно-временной структуры ЭЭГ активности для объективизации оценки индивидуальных особенностей цикла сон — бодрствование // Бюллетень сибирской медицины. — 2010. — 2. — С. 145-153.
11. Румянцева С.А., Афанасьев В.В., Кузьмина Ю.В., Силина Е.В. Рациональная фармакокоррекция поражений мозга при острой и хронической ишемии // Consilium Medicum. — 2010. — Vol. 12, № 9. — Р. 23-31.
12. Adibhatla R.M., Hatcher J.F., Dempsey R.J. Citicoline: Neuroprotective mechanisms in cerebral ischemia // J. Neurochem. — 2002. — Vol. 80. — Р. 12-23.
13. Афанасьев В.В, Румянцева С.А., Лукьянова И.Ю. и др. Нейроцитопротекция на догоспитальном этапе при ишемическом инсульте // Материалы конференции «Скорая медицинская помощь, 2009». — СПб. — 2009. — С. 144-147.
14. Одинак М.М., Вознюк И.А., Пирадов М.А., Румянцева С.А., Кузнецов А.Н., Янишевский С.Н., Голохвастов С.Ю., Цыган Н.В. Многоцентровое (пилотное) исследование эффективности глиатилина при остром ишемическом инсульте // Клиническая неврология. — 2010. — Т. 4, № 1. — С. 20-27.
15. Одинак М.М., Вознюк И.А., Голохвастов С.Ю. и др. Мониторинг перфузионных нарушений в острейшую стадию ишемического инсульта // Вестн. Рос. воен.-мед. акад. — 2005. — № 2. — С. 25-30.
16. Di Perri R. et al. A multicentre trial to evaluate the efficacy and tolerability of a-glyceryl-phosphorylcholine vs Cytidine diphosphocholine in patients with vascular dementia // The Journal of International Medical Research. — 1991. — № 19. — С. 43-56.
17. Острова Т.В., Черній В.І., Шевченко А.І. Алгоритм діагностики реактивності ЦНС методами штучного інтелекту. — Д.: ІПШІ МОНУ і НАНУ «Наука і освіта», 2004. — 180 с.
18. Островая Т.В., Черний В.И., Андронова И.А. Исследование реактивности ЦНС в ответ на фармакологическое воздействие (тиоцетам) // Международный неврологический журнал. — 2007. — № 2(12). — С. 2-11.
19. Черний В.И., Островая Т.В., Андронова И.А. Оценка реактивности ЦНС при сочетанном применении Актовегина и Цераксона у пациентов с острой церебральной недостаточностью различного генеза // Український вісник психоневрології. — 2007. — Т. 15, вип. 1(50), додаток. — С. 133.
20. Черний Т.В., Андронова И.А. Нейрофизиологические эффекты и типы реакций ЦНС в ответ на фармакологическое воздействие: нейропептиды // Медицина неотложных состояний. — 2010. — № 1(26). — С. 92-107.
21. Орлов А.И. Прикладная статистика. Учебник. — М.: Экзамен, 2004. — 656 с.
22. Лях Ю.Е., Гурьянов В.Г., Хоменко В.Н., Панченко О.А. Основы компьютерной биостатистики: анализ информации в биологии, медицине и фармации статистическим пакетом MedStst. — Д.: Папакица Е.К., 2006. — 214 с.
23. Віничук С.М. Мозговой інсульт: Навчальний посібник. — Київ, 1998. — 50 с.
24. Данилова Н.Н., Крылова А.Л. Физиология высшей нервной деятельности. — М.: Учебная литература, 1997. — 322 c.
25. Кропотов Ю.Д. Количественная ЭЭГ, когнитивные вызванные потенциалы мозга человека и нейротерапия: Пер. с англ. / Под ред. В.А. Пономарева. — Донецк: Издатель Заславский А.Ю., 2010. — 512 с.
26. Леутин В.П., Николаева Е.И. Функциональная асимметрия мозга: мифы и действительность. — СПб.: Речь, 2005. — 368 с.