Международный неврологический журнал 2 (40) 2011
Вернуться к номеру
Опыт применения мемантина в терапии когнитивных расстройств при различных органических заболеваниях нервной системы
Авторы: Гончарова Я.А., Евтушенко С.К., Симонян В.А., Евтушенко И.С., Филимонов Д.А., Морозова А.В., ГУ ИНВХ им. В.К. Гусака НАМН Украины, отделение ангионеврологии, г. Донецк
Рубрики: Неврология
Версия для печати
Успешная терапия когнитивных расстройств является одной из важнейших задач современной медицины. В ходе проведенного клинического исследования обследована группа пациентов с легкими и умеренными когнитивными расстройствами различной этиологии, применены клинические и инструментальные методы оценки высших корковых функций, показана эффективность применения мемантина в терапии различных органических заболеваний нервной системы, сопровождающихся когнитивными нарушениями.
Когнитивные расстройства, мемантин.
Введение
Определенные успехи отечественной медицины, здравоохранения, социальные достижения позволили увеличить продолжительность жизни людей. Однако эти достижения в комплексе со снижением рождаемости имеют важный сопутствующий эффект — увеличение числа лиц преклонного возраста в структуре населения и, как следствие, изменение структуры заболеваемости, увеличение доли сосудистых и нейродегенеративных дементирующих заболеваний. Таким образом, повышение доли когнитивных нарушений в структуре заболеваемости представляет собой одну из первоочередных проблем современной медицины.
В клинической неврологии под когнитивными функциями (лат. cognitio — познание, изучение, осознание) принято понимать наиболее сложные интегративные процессы, необходимые для осуществления восприятия, переработки и использования внешней информации. К таким функциям относятся восприятие информации (гнозис), ее анализ и обработка (так называемые исполнительные функции), хранение информации (мнестические функции — память) и передача информации (праксис и речь). О когнитивных нарушениях говорят в тех случаях, когда отмечается ухудшение в одной или более из вышеуказанных сфер по сравнению с преморбидным уровнем, то есть снижение мнестико-интеллектуальных способностей относительно индивидуальной нормы для конкретного человека. Когнитивные расстройства не являются самостоятельной нозологией, а представляют собой синдром, которым могут проявляться различные по этиологии органические заболевания центральной нервной системы. При этом в основе ряда болезней становятся облигатным симптомом.
Основные причины когнитивных нарушений:
I. Нейродегенеративные заболевания:
1. Болезнь Альцгеймера.
2. Деменция с тельцами Леви.
3. Кортико-базальная дегенерация.
4. Заболевания с преимущественным поражением подкорковых базальных ганглиев.
II. Сосудистые заболевания головного мозга:
1. Последствия единичного инсульта в «стратегической» зоне.
2. Мультиинфарктное состояние.
3. Когнитивные нарушения, связанные с хронической церебральной ишемией.
4. Болезнь Бинсвангера.
III. Смешанные (сосудисто-дегенеративные) когнитивные нарушения.
IV. Нейроинфекции, в том числе медленно прогрессирующие, и демиелинизирующие заболевания:
1. ВИЧ-ассоциированная энцефалопатия.
2. Губчатый энцефалит (болезнь Крейцфельда — Якоба).
3. Прогрессирующий панэнцефалит.
4. Последствия острых и подострых менингоэнцефалитов.
5. Прогрессивный паралич.
6. Рассеянный склероз.
7. Мультифокальная лейкоэнцефалопатия.
V. Последствия перенесенной черепно-мозговой травмы.
VI. Нормотензивная (арезорбтивная) гидроцефалия.
Основополагающую роль в развитии когнитивных нарушений играет так называемый феномен разобщения — нарушение связей между корой головного мозга (в особенности лобных долей) и подкорковыми структурами. И все же в подавляющем большинстве случаев триггерным фактором является неконтролируемая хроническая артериальная гипертензия. В результате нарушения трофики сосудов в сочетании с дислипопротеинемией в сосудах микроциркуляторного русла происходят вторичные изменения в виде липогиалиноза и, как следствие, артериолосклероза, что приводит к нарушению реактивности сосудистой стенки и недостаточности ее функции. В дальнейшем процесс усугубляется нарушением системной гемодинамики на фоне кардиальной недостаточности или чрезмерно агрессивной гипотензивной терапии. Наиболее четко изменения заметны в перивентрикулярных и субкортикальных зонах в виде лейкоареозиса. При тяжелом течении гипертонической болезни возможно и диффузное поражение белого вещества — болезнь Бинсвангера.
Вторым важным фактором являются острые эпизоды нарушения мозгового кровообращения. Наиболее выраженные когнитивные изменения вызываются множественными «немыми» инфарктами головного мозга и инфарктами «стратегических» зон. По данным литературы, наиболее часто в качестве «стратегических» зон называют префронтальную кору, медиальные отделы височных долей, таламус, базальные ганглии (прежде всего хвостатое ядро, в меньшей степени — бледный шар), прилегающее белое вещество, область стыка затылочной, височной и теменной коры (особенно угловая извилина) и мозжечок, который также участвует в обработке информации от зон, связанных с когнитивными функциями, выполнении автоматизированных действий и процедурной памяти. Клиническая картина при поражении каждой из «стратегических» зон может быть относительно специфична. В последнее время концепция инфарктов «стратегических» зон пересматривается, так как современные методы исследования наряду с инфарктами «стратегических» зон обнаруживают также изменения и в других отделах головного мозга [3].
В настоящее время существует несколько взглядов на патогенез постинсультных когнитивных расстройств. Согласно одной из точек зрения, инсульт вызывает срыв компенсации уже имеющейся болезни Альцгеймера или иного цереброваскулярного дементирующего процесса. Другая концепция утверждает, что острая ишемия способна инициировать или ускорить (вероятно, при определенной предрасположенности пациента) нейродегенеративный процесс. Таким образом, ишемическую болезнь мозга (ИБМ), инсульт и нейродегенерацию следует считать компонентами порочного круга. Патофизиологической основой когнитивных расстройств являются нарушения нейротрансмиттерных (ацетилхолинергических, дофаминергических, норадренергических, серотонинергических) систем. Дегенерация дофаминергических нейронов среднего мозга влечет уменьшение содержания дофамина и его метаболитов в префронтальной коре, стриатуме и ассоциативных зонах височной коры головного мозга. Снижение активности норадренергических нейронов негативно сказывается на обработке сенсорных стимулов в ассоциативных зонах височно-теменно-затылочной коры и консолидации следа памяти. Определенную роль в этих процессах играет эксайтотоксичность — патологический феномен, ведущий к повреждению и гибели нервных клеток под воздействием нейромедиаторов, способных гиперактивировать NMDA- и AMPA-рецепторы.
Одним из современных направлений лечения когнитивных расстройств является нивелирование эффектов эксайтотоксичности и патологической гиперактивности NMDA-рецепторов. Наиболее перспективным в этом отношении в настоящее время считается мемантин — потенциалзависимый, средней аффинности неконкурентный антагонист NMDA-рецепторов. Мемантин блокирует эффекты патологически повышенного уровня глутамата, который может привести к дисфункции нейронов.
Цель исследования: определить эффективность использования антагониста NMDA-рецепторов Мема фирмы «Актавис» в терапии легких и умеренных когнитивных расстройств при органических заболеваниях нервной системы.
Материалы и методы
Для исследования было отобрано 30 (17 женщин и 13 мужчин) пациентов, находящихся на лечении и обследовании в отделении ангионеврологии ГУ ИНВХ им. В.К. Гусака, страдающих когнитивным снижением легкой и умеренной степени выраженности, обусловленным различными органическими заболеваниями нервной системы. Возраст пациентов колебался от 27 до 75 лет. Из них цереброваскулярными заболеваниями (атеросклероз сосудов мозга, гипертоническая болезнь) страдало 22 человека, рассеянным склерозом с ремиттирующим течением — 2 человека, последствиями черепно-мозговых травм с церебрастеническим синдромом и ликворососудистой дисциркуляцией — 4 человека, постреанимационным гипоксическим поражением головного мозга — 2 человека, последствиями отравления угарным газом (токсическая энцефалопатия) — 2 человека.
Исследование проводилось в течение 3 месяцев.
Были определены критерии исключения пациента из кандидатов в исследование:
— отказ пациента или его ближайших родственников от участия в исследовании;
— наличие сопутствующей соматической патологии с выраженным нарушением функции или в стадии декомпенсации;
— наличие сопутствующих неврологических заболеваний (болезнь Альцгеймера, Паркинсона, мультисистемные атрофии, последствия перенесенных нейроинфекций), а также психических заболеваний;
— отягощенный аллергологический анамнез, наличие в анамнезе лекарственной бронхиальной астмы, крапивницы, отека Квинке, анафилактического шока;
— оценка по MMSE < 22 баллов;
— наличие грубых речевых, моторных или сенсорных расстройств.
Исследование прекращалось в случае возникновения нижеперечисленных ситуаций:
— отказ пациента или его ближайших родственников от участия в исследовании;
— появление выраженных побочных реакций в первые дни проведения испытания;
— несоблюдение пациентом протокола исследования;
— появление в процессе исследования любого из критериев исключения;
— ухудшение состояния пациента, нарастание неврологического дефицита;
— индивидуальная непереносимость препарата.
Перед проведением исследования тщательно изучался анамнез пациентов. Анализировались данные амбулаторной карты, наследственного и аллергологического анамнеза, проводился подробный неврологический осмотр. Также были привлечены смежные специалисты: все пациенты были проконсультированы терапевтом, окулистом, при необходимости пациенты осматривались эндокринологом, психоневрологом.
Спектр диагностических обследований включал обязательную МР-визуализацию головного мозга, ультразвуковое дуплексное и, при необходимости, триплексное исследование сосудов шеи и головного мозга, анализ параметров ЭЭГ и вызванных потенциалов, связанных с событием (ВПСС).
Пациентам проводилось нейропсихологическое тестирование, которое включало анализ по краткой шкале оценки психического статуса, шкале деменции Маттиса (Mattis Dementia Rating Scale), тест слежения (Trial making test, ТМТ), MMSE, тест с рисованием часов, тест FAB (Frontal Assessment Battery); нарушения памяти исследовались при помощи теста на заучивание 10 слов (количество пропусков) из шкалы ADAS-Cog.
Особое внимание уделялось исследованию высших корковых функций. Проводилась оценка высших осязательных функций и стереогноза, исследование сложных форм организации движений и действий, исследование слухомоторных координаций. Высшие зрительные когнитивные функции оценивались по методу Поппельрейтера, с помощью теста с замаскированными зрительными структурами Готтшальдта, опыта с выделением фигуры на шахматной доске. Для исследования процесса заучивания пациенту предлагалось запомнить ряд слов, не связанных между собой (10–12 слов), создавалась кривая заучивания.
В оценке состояния когнитивно-мнестической сферы и эффективности терапии применялась методика исследования мультимодальных ВПСС, которые отражают эндогенный электрофизиологический процесс, обусловленный активностью мозга, которая является непосредственным результатом мышления и специфических познавательных возможностей. Регистрация ВПСС производилась с помощью компьютерно-диагностического комплекса «Эксперт» (Tredex, Украина). Пациентам предъявляли зрительные и слуховые (бинауральная стимуляция с частотой тона 2000 Гц для значимого и 1000 Гц для незначимого) стимулы. Частота подачи стимула — 1 с, длительность стимуляции — 100 с. Значимый стимул (триггер) составлял 20 % и фиксировался нажатием на кнопку. Регистрация вызванной электрической активности мозга осуществлялась биполярно 16 электродами (Fz, F3-4, Cz, C3-4, Pz, P3-4, T5-6, Oz, O1-2), заземление — в точке Fpz (по системе 10/20). Эпоха анализа — 1000 мс.
Нейропсихологическое исследование, оценка вызванных потенциалов проводились дважды — до назначения терапии и после завершения ее курса.
Результаты исследования
При клинико-инструментальном обследовании наблюдаемых пациентов были диагностированы: последствия перенесенного ишемического инсульта — у 16 пациентов (53 %), из них у 3 пациентов (10 %) были выявлены последствия перенесенных повторных ишемических инсультов, атеросклероз церебральных и прецеребральных сосудов (некритический) — у 4 человек (13 %), гипертоническая болезнь с транзиторной ишемической атакой — у 2 пациентов (7 %), рассеянный склероз (цереброспинальная форма, EDSS 3,5–4 балла) — у 2 пациентов (7 %), последствия черепно-мозговых травм — также у 2 пациентов (7 %), пост-реанимационная энцефалопатия — у 2 (7 %) пациентов и отравление угарным газом — у 2 человек (7 %).
В группе больных с последствиями перенесенного ишемического инсульта у 2 пациентов ведущим неврологическим синдромом был легкий гемипарез, у 4 пациентов — вестибулоатактический синдром, у 2 пациентов — дизартрия и у 8 пациентов — пирамидная недостаточность.
У пациентов с рассеянным склерозом в неврологическом статусе доминировал вестибулоатактический синдром.
В группе пациентов с церебральным атеросклерозом и гипертонической болезнью у 2 пациентов отмечался легкий паркинсонический синдром, у 6 больных — пирамидная недостаточность и у 3 пациентов — вестибулоатактический синдром.
У пациентов, страдающих от последствий черепно-мозговой травмы, ведущими синдромами были ликвородистензионный и церебрастенический. Похожая симптоматика наблюдалась и у пациентов, перенесших отравление угарным газом.
У всех наблюдаемых пациентов были выявлены легкие или умеренные когнитивные нарушения. По данным нейропсихологического тестирования до назначения терапии, у 18 человек (60 %) показатели MMSE находились в пределах 26–27 баллов и у 12 пациентов (40 %) отмечалось снижение показателей MMSE до 24–25 баллов. Из обследованных больных наименьшую сумму баллов в тесте MMSE (24 балла, что соответствует когнитивным расстройствам умеренной степени выраженности) показали трое пациентов с последствиями повторных инсультов, а также 1 пациент, страдающий от последствий закрытой черепно-мозговой травмы, ушиба головного мозга средней степени тяжести. У пациентов с последствиями единичного инсульта в основном (у 7 из 13 пациентов) результат тестирования по шкале MMSE составил 25 баллов, что также соответствует умеренным когнитивным расстройствам (УКР). Умеренные когнитивные расстройства (25 баллов) были выявлены и у 1 пациента, страдающего рассеянным склерозом. У остальных 18 пациентов, согласно тестированию MMSE, были выявлены легкие когнитивные расстройства (ЛКР).
Результаты остальных нейропсихологических тестов коррелировали с данными теста MMSE (наиболее значимые изменения отмечались у пациентов, набравших менее 26 баллов). Нарушения высших корковых зрительных функций в основном наблюдались у пациентов, перенесших мультиинфаркты головного мозга. Наибольшее количество ошибок в тесте с рисованием часов (снижение результата до 5–6 баллов) допустили пациенты с мультиинфарктами головного мозга. В группе пациентов с последствиями острой гипоксической энцефалопатии (постреанимационная, отравление угарным газом) отмечались легкие когнитивные расстройства, в основном нарушения функции кратковременной памяти.
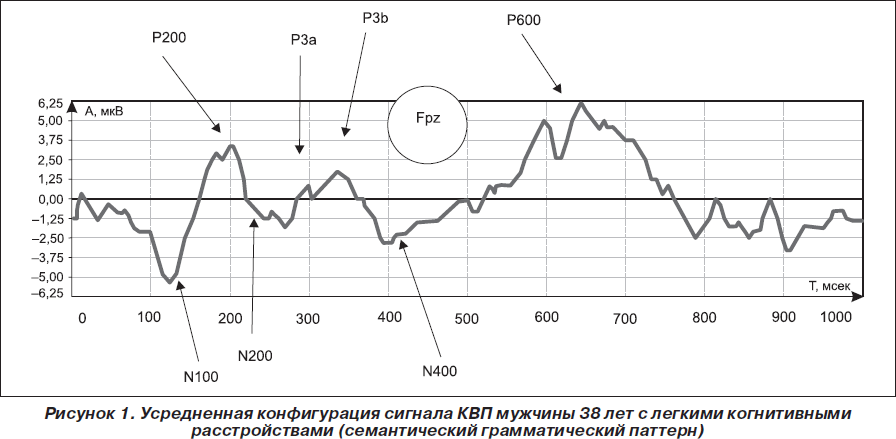
У больных с легкими и умеренными когнитивными расстройствами латентный период (ЛП) компонентов N100 — Р200 — N200 не выходил за рамки нормативных данных, что свидетельствует о сохранной работе модально-специфических корковых зон, процессов опознания и дифференцировки сигналов. Глобальные характеристики мультимодальных сигналов КВП при ЛКР показывали тотальное снижение амплитуды без нарушения формы сигнала, удлинение Р300 в пределах 1s, что отражает дисфункцию механизмов нейромедиаторной регуляции когнитивного процесса и направленного внимания. Нарушений функции процедурной и декларативной памяти не отмечалось — комплекс волн с ЛП 400–700 мс в норме. Однако при УКР наряду со снижением амплитуды наблюдалось изменение формы волны, что может быть связано не только с нарушением нейромедиаторной регуляции, но и с изменением переработки сенсорной информации в ассоциативных областях коры, нарушением процессов избирательного внимания. При УКР девиации сигнала были выявлены при исследовании абстрактно-вербального (53,3 %) и зрительно-пространственного (56,7 %) паттернов, регистрировалось селективное снижение семантической памяти, о чем свидетельствовало удлинение ЛП Р300 и N400. В 76,7 % случаев отмечено снижение скорости сенсомоторных реакций и увеличение числа ошибок.
Усредненная конфигурация сигнала КВП при ЛКР представлена на рис. 1.
Изменения длиннолатентных вызванных потенциалов коррелировали с выраженностью когнитивных расстройств. Глобальные характеристики мультимодальных сигналов при наиболее выраженных когнитивных расстройствах демонстрировали значительное снижение амплитуды, изменение формы сигнала и удлинение ЛП N200 — Р300 более 3σ. Это указывало на то, что опознание и дифференцировка осуществляются, но страдает оперативная память и процесс направленного внимания. Отсутствие позитивного сдвига поздних когнитивных волн (P500–700), выраженное снижение амплитуды и изменение габитуации наблюдалось у 12 пациентов, что свидетельствовало о трудности переработки информации и снижении возможностей обращения как к процедурной, так и к семантической и эпизодической подсистемам декларативной памяти. В 6 случаях были выраженные изменения конфигурации сигнала, снижение амплитуды, удлинение ЛП N200 более 3s, а N200 практически не выделялся, что отражало нарушение процессов опознания и дифференцировки сигналов. Такие показатели были получены у пациентов с цереброваскулярными заболеваниями.
Изменения комплекса N200 — P300 были выявлены у пациентов с последствиями ЧМТ, перенесенной гипоксической энцефалопатией, рассеянным склерозом.
Таким образом, анализ сигнала ВПСС у больных выявил как тотальные, так и различные селективные нарушения формы, амплитуды и тайминга на этапах мыслительной обработки предъявляемых паттернов, что явилось свидетельством когнитивной дезинтеграции различного уровня и степени тяжести независимо от этиологии поражения головного мозга.
Согласно протоколу всем пациентам был назначен трехмесячный курс приема препарата Мема производства фирмы «Aктавис» по следующей схеме:
1-я неделя — 1/2 таблетки (5 мг) утром;
2-я неделя — 1/2 таблетки утром и вечером;
3-я неделя — 1 таблетка (10 мг) утром и 1/2 таблетки вечером;
4-я неделя и далее (до 8-й недели) — 1 таблетка утром и вечером.
За время проведения исследования каких-либо серьезных осложнений, препятствующих продолжению приема препарата, или появления любых иных критериев исключения не наблюдалось. Препарат переносился хорошо. Только у одного пациента с последствиями ЧМТ зарегистрировано усиление головной боли, у 2 пациентов с гипертонической болезнью отмечались эпизоды нарушения сна (трудности при засыпании), не требовавшие дополнительной медикаментозной коррекции.
У 28 из 30 пациентов результаты повторного нейропсихологического тестирования показали положительные результаты. Особенно были заметны улучшения у пациентов, перенесших острую гипоксическую энцефалопатию (постреанимационную), отравление угарным газом. В наиболее полном объеме отмечалось восстановление функции памяти, как долговременной, так и оперативной, улучшились функции счета, значительно регрессировали проявления церебрастенического синдрома.
Также отмечалась положительная динамика и у пациентов с последствиями ОНМК. Увеличились показатели MMSE в среднем на 1–2 балла, улучшилось выполнение других психоневрологических тестов (показатели теста с рисованием часов увеличились в среднем на 2 балла).
Менее отчетливо наблюдалась положительная динамика у пациентов с последствиями повторных ОНМК. Субъективно больные отмечали улучшение состояния, повышение способности к концентрации внимания, однако значительной динамики при проведении повторного нейропсихологического исследования не наблюдалось: остались прежними показатели MMSE, несколько улучшилась память и показатели теста Поппельрейтера.
У пациентов, страдающих когнитивными расстройствами после перенесенной ЧМТ, отмечалось значительное восстановление функции памяти. Улучшилась как кратковременная, так и долговременная память.
Улучшения у пациентов, страдающих рассеянным склерозом, в основном коснулись эмоционально-волевой сферы: стабилизировался фон настроения, регрессировали волевые нарушения, отмечался некоторый антидепрессивный эффект препарата. Также повысилась способность к концентрации внимания, улучшились высшие зрительные функции (зарегистрированы более высокие показатели при выполнении теста Поппельрейтера, теста с выделением фигур на шахматной доске).
После проведенного курса лечения отмечено уменьшение выраженности лобно-подкорковой дисфункции (повысилось внимание), улучшился конструктивный праксис, зрительно-пространственные функции, кратковременная и долговременная память (р < 0,05), что статистически значимо коррелировало (r = 0,61; р < 0,05) с динамикой исследуемых электрофизиологических параметров сигнала ВПСС. Кроме полной в 10 % и частичной в 26,7 % нормализации формы волны и высоты амплитуды сигнала в 66,7 %, у всех больных с легкими и умеренными когнитивными расстройствами на фоне терапии увеличилась скорость сенсомоторных реакций и процент правильных ответов.
Выводы
В ходе проведенного клинического исследования с применением комплексной оценки когнитивного статуса была показана высокая эффективность применения препарата Мема в комплексной терапии легких и умеренных когнитивных расстройств при различных органических заболеваниях нервной системы. Побочных эффектов, требующих отмены приема препарата, зарегистрировано не было.
1. Лурия А.Р. Высшие корковые функции человека. — СПб.: Питер, 2008.
2. Кропотов Ю.Д. Количественная ЭЭГ, когнитивные вызванные потенциалы мозга человека и нейротерапия. — М.: ГЭОТАР-МЕД, 2009. — С. 352.
3. Яхно Н.Н. Сопоставление клинических и МРТ-данных при дисциркуляторной энцефалопатии // Неврологический журнал. — 2001. — Т. 6, № 2. — С. 1016.
4. Duncan C.C., Barry R.J., Connolly J.F., Fischer C., Michie P.T., Nддtдnen R., Polich J., Reinvang I., Petten C.V. Event-related potentials in clinical research: Guidelines for eliciting, recording, and quantifying mismatch negativity, P300, and N400 // Clinical Neurophysiology. — 2009. — № 120. — С. 1883-1908.
5. Englund E. Neuropathology of White Matter Changes in Alzheimer's Disease and Vascular Dementia // Dement. Geriatr. Cogn. Disord. — 1998. — № 9 (Suppl. 1). — С. 6-12.
6. Zarow C. et al. Neuropathologic substrates of ischemic vascular dementia // J. Neuropathol. Exp. Neurol. — 2000. — № 59. — С. 931-945.
7. Mungas D., Reed B.R., Kramer J.H. Psychometrically matched measures of global cognition, memory, and executive function for assessment of cognitive decline in older persons // Neuropsychology. — 2003. — № 17. — С. 380-392.
8. Fabiani M., Gratton G., Federmeier K.D. Event-Related Brain Potentials: Methods, Theory and Applications // Handbook of Psychophysiology / Еd. by J.T. Cacioppo, L.G. Tassinary, G.G. Berntson. — 3rd ed. — Cambridge: Cambridge University Press, 2007. — C. 85-119.