Международный неврологический журнал 2 (40) 2011
Вернуться к номеру
Влияние инсульта на когнитивную сферу
Авторы: Henry J. Riordan, Laura A. Flashman, Dartmouth Medical School, USA
Рубрики: Неврология
Версия для печати
Частота инсультов резко увеличивается с возрастом — после достижения людьми 55 лет наблюдается ее удвоение каждые 10 лет. Поэтому когнитивные и поведенческие последствия ишемических и геморрагических инсультов станут одними из наиболее распространенных заболеваний, с которыми человечеству придется бороться по мере роста данного сегмента популяции.
В целом цереброваскулярные повреждения, включая те, которые вызваны ишемическими или геморрагическими инсультами, могут оказывать три различных эффекта на когнитивную сферу и поведение — вызывать утрату функции, появление функции или дезорганизацию функции. Наиболее очевидным и прямым эффектом церебральных повреждений является утрата функции, вследствие чего пациент не может больше выполнять специфическую когнитивную или поведенческую задачу или набор задач. Появление функции подразумевает появление нового поведения или значительное возрастание частоты существующего поведения после повреждения мозга. Если фрагменты поведения все еще присутствуют, но появляются в неправильном порядке или если поведение проявляется в неправильное время и в ошибочном месте, то говорят о дезорганизации функции.
Многие поведенческие изменения могут носить временный характер вследствие повреждений мозга, вторичных к ишемическому и геморрагическому инсульту. В этом случае функция восстанавливается в сроки от нескольких дней и недель до нескольких лет. По состоянию на сегодняшний день процессы, вовлеченные в это восстановление, плохо изучены. Их понимание затруднено вариабельностью процессов восстановления у разных индивидуумов, а также неопределенностью времени появления когнитивных симптомов. Часто оказывалось, что когнитивное снижение, обнаруживаемое после развития инсульта, в действительности было результатом предсуществующих когнитивных нарушений. Pohjasvaara и соавт. [84] сообщили, что частота снижения когнитивных функций после развития инсультов, включая деменцию, составляет приблизительно 9 %. Факторами риска являются пожилой возраст, более низкий уровень образования и наличие инсульта в анамнезе. Результаты исследования Baltimore Longitudinal Study of Aging (Балтиморское многолетнее исследование старения) [39] свидетельствуют о том, что если когнитивных нарушений не было до начала инсульта, то риск развития деменции не увеличивается, и что сосудистая деменция и болезнь Альцгеймера могут приводить к развитию доинсультных когнитивных нарушений. Следовательно, при диагностике и лечении когнитивной дисфункции, предположительно связанной с ишемическим или геморрагическим инсультом, необходимо помнить, что в основе данной патологии могут лежать два или более болезненных процесса.
Нейроповеденческие следствия повреждений церебральных сосудов
Развитие специфических когнитивных нарушений является прямым результатом изолированных повреждений. Однако в клинической практике редко встречаются пациенты с когнитивным нарушением, которое вызвано изолированным повреждением, затрагивающим одну функциональную область мозга. Кроме того, повреждение любого количества областей мозга может приводить к очень похожим или связанным паттернам когнитивных нарушений или даже к целому комплексу поведенческих нарушений. Задача усложняется еще и тем, что лишь очень немногие из часто используемых стандартизированных нейропсихологических тестов специально разработаны для оценки унитарных когнитивных функций, поскольку решение почти всех когнитивных задач основано на сложных сетевых коммуникациях между различными функциональными областями мозга. Например, многие нейропсихологические тесты — даже тесты, которые требуют только вербального ответа, — вовлекают визуальную модальность и требуют наличия минимального уровня активности, внимания и организационных способностей, равно как и способности генерировать поведенческий ответ. Таким образом, лишь минимальное количество нейропсихологических тестов (или же лучше сказать, что их практически нет) было разработано для выявления специфического функционального дефицита в одном когнитивном домене, таком как память, внимание или исполнительная функция.
Информация, представленная ниже, является общим руководством по некоторым наиболее частым и интересным нарушениям в когнитивной и поведенческой сфере, возникающим вследствие ишемических или геморрагических инсультов. При оценке выраженности когнитивной дисфункции после инсульта важное значение имеет величина повреждения и знание базовых положений теории о преимущественной локализации функций в той или иной области мозга. Более полная информация о поведенческой географии человеческого мозга и нейроповеденческих последствиях ишемического и геморрагического инсульта представлена в работах Lezak [66] и Robinson [88].
Когнитивные эффекты корковых повреждений
Окклюзия каротидных артерий может приводить к инфаркту в пограничных зонах между передней и средней или средней и задней мозговыми артериями. Клиническая картина в этих случаях проявляется главным образом кортикальным дефицитом, что включает транскортикальную афазию с сохранившимся повторением слов, визуально-пространственные нарушения и сенсомоторные изменения в проксимальных отделах рук и ног [100]. Окклюзия передней, средней или задней мозговой артерии вызывает гемисферо-специфичный дефицит, проявления которого зависят от функции пораженной ткани в бассейне кровоснабжения артерии. К характерным признакам левополушарного дефицита относят афазию, апраксию, алексию, аграфию и акалькулию, а правополушарного — визуально-пространственные нарушения, амузию и нарушение просодии.
Лобная кора
На лобные доли приходится около одной трети массы полушарий мозга, они являются наибольшими из долей мозга и эволюционно развивались самыми последними. Лобные доли называют «исполнителем», поскольку они контролируют протекание всех других когнитивных процессов. Лобные доли прямо не связаны с формированием внешних видов поведения, однако играют исполнительную роль при их планировании и реализации. Важно отметить, что повреждение префронтальной коры может приводить к дефициту самосознания, что, в свою очередь, может нарушать почти все виды когнитивных функций. Повреждение отдельных областей лобной доли может приводить к двигательным или речевым нарушениям, а также нарушениям когнитивных процессов относительно более высокого порядка, таких как абстрактное мышление, планирование, избирательное внимание, решение сложных проблем, формирование концепций и когнитивная гибкость [108].
Лобные доли играют важную роль почти во всех когнитивных процессах. Речеопосредованные задачи обычно контролируются доминантным, чаще левым, полушарием, в то время как невербальные задачи обычно связаны с недоминантным полушарием. Поэтому повреждение левой лобной доли может привести к нарушениям вербального поведения, в том числе в назывании предметов и беглости речи, в то время как повреждение правой лобной доли — к нарушениям невербальной беглости [25, 55]. Стоит отметить, что нарушения вербальной беглости, хотя и менее тяжелые, были отмечены также при повреждениях правой лобной доли, что свидетельствует о варьировании степени латерализации среди разных индивидуумов. К некоторым наиболее часто видимым нейроповеденческим расстройствам, наблюдаемым при повреждении префронтальной коры, относят афазию Брока, нарушение памяти, нарушение внимания и нарушение воли.
Афазия Брока
Повреждение оперкулярной и триангулярной областей нижней лобной извилины (известных также как поле Бродмана 44) вызывает ряд нарушений в выразительной речи, обычно называемых афазией Брока. Это расстройство известно также как выразительная, небеглая или моторная афазия и характеризуется в большей степени нарушением выражения речи, а не ее восприятия. Фактически пациенты с афазией Брока склонны к относительно хорошему пониманию речи. Однако они воспроизводят очень мало слов в устной или письменной форме, поскольку это им трудно дается, у них нарушена способность к повторению слов и называнию предметов, они пропускают артикли и определители, говорят и пишут таким образом, который лучше всего описывается термином «телеграфически».
Нарушение памяти
Пациенты с повреждениями префронтальной коры имеют трудности с первоначальным восприятием новой информации вследствие плохого внимания и организационных навыков. Они также склонны делать большое количество ошибок персеверации и комиссии (например, ложноположительные ошибки в задачах на воспоминание с подсказками), поскольку у них возникают трудности с торможением неправильных ответов. Рабочая память, отвечающая за временное (в течение нескольких секунд) удерживание в уме ограниченного количества информации во время оперирования ею, также зависит от сохранности функции лобных долей [40]. Нарушения рабочей памяти могут приводить к снижению декларативной памяти за счет ограничения количества информации, которое воспринимается первоначально. Несмотря на то что лобная кора принимает участие в протекании различных процессов памяти, нарушение запоминания новой информации наблюдается более часто при повреждении височных долей (см. ниже).
Нарушение внимания
Префронтальная кора интимно вовлечена в способность фокусировать и переключать внимание при изменении предъявляемых задач [73, 74]. Повреждение префронтальной коры может приводить к большому количеству видов нарушений внимания. Например, пациенты могут медленно реагировать на стимулы и иметь нарушение внимания, которое характеризуется отсутствием способности удерживать фокус, неспособностью менять психологические установки и плохой когнитивной гибкостью. Пациентов с префронтальными повреждениями в целом можно описать как имеющих «ригидный» подход к решению проблем и часто неспособных извлечь пользу из контекстных подсказок или даже прямых инструкций, которые направляют их к правильному решению. Опять же их когнитивный профиль может быть охарактеризован большим количеством ошибок персеверации — нарушение, которое может быть видно при решении самых разных умственных задач. Крайним случаем этого является, например, ситуация, когда пациент не способен прекратить давать одни и те же ошибочные персеверативные ответы, несмотря на то что может точно определять правильный ответ.
С «ригидным» когнитивным профилем связано отсутствие способности абстрагироваться от буквальных ассоциаций. Пациенты видят события и взаимодействия в их номинальной форме и неспособны выявлять более тонкие нюансы, а следовательно, и истинное значение событий. Такое конкретное мышление приводит также к неспособности генерировать или правильно использовать абстрактные понятия, например символы, пословицы и метафоры.
Нарушение воли
Наконец, многие пациенты с префронтальными повреждениями склонны иметь трудности как с инициированием, так и с прекращением поведения — нарушение, которое может сильно нарушать когнитивные функции. Трудности в инициировании могут быть связаны с апатией, плохой спонтанностью и продуктивностью, в то время как трудности в прекращении поведения могут быть более тесно связаны с плохим контролем над побуждениями или неспособностью пользоваться механизмами обратной связи, которые бы гарантированно прекращали поведение; трудности в прекращении поведения могут быть также связаны с неспособностью побороть персеверативные ответы. Подобный тип растормаживания часто виден при повреждениях орбитофронтального круга. В то же время такие симптомы, как плохая спонтанность и апатия, более часто встречаются при повреждениях переднего цингулярного круга [25].
Височная кора
Вследствие сложной организации и большого количества разнообразных задач, решение которых опосредуется височной корой, анатомические границы и функциональная специализация височных долей относительно менее хорошо определены по сравнению с другими долями головного мозга [108]. Височная кора выполняет разнообразные функции, связанные с первичным восприятием звуков, запахов, визуальной информации, и интегрирует все аспекты наших чувств в унифицированный и значимый опыт. Височная кора, кроме того, играет ключевую роль в формировании памяти и интимно связана с лимбической системой. Следовательно, височная доля играет важную роль в связывании эмоциональных и мотивационных аспектов информации с накопленным сенсорным опытом и помогает сформировать впечатления и знания о мире. При ишемическом и геморрагическом инсульте височной коры и прилежащих медиальных структур височной доли может наблюдаться большое количество когнитивных нарушений. Однако к наиболее часто встречаемым и представляющим интерес нейроповеденческим расстройствам относят нарушение слухового, зрительного восприятия и нарушение памяти.
Нарушение слухового восприятия
К одному из наиболее значимых и инвалидизирующих расстройств слухового восприятия относят афазию Вернике (также известную как сенсорная, беглая или жаргонная афазия), возникающую вследствие повреждения левой височной ассоциативной коры (поле Бродмана 22). При этом расстройстве у пациентов наблюдается очень плохое понимание речи при относительно сохранной способности к продукции речи [41]. Подобный паттерн сохранения речи на фоне нарушенного понимания речи прямо противоположен афазии Брока — пациенты с афазией Вернике могут быть охарактеризованы как гипервербальные, несмотря на то, что их речь бессмысленна. У этих пациентов могут присутствовать даже признаки анозогнозии и неспособность распознавать свою нарушенную речь, что, следовательно, может затруднить возникновение положительного эффекта от обратной связи во время логопедической терапии. Интересно, что пациенты с такими же повреждениями правой височной коры могут переживать аналогичные проблемы с распознаванием невербальных звуков и их дискриминацией [71]. В некоторых случаях повреждения правой височной коры могут приводить к амузии (т.е. нарушению музыкального восприятия, когда пациенты неспособны дифференцировать различные музыкальные тоны или ритмы) [92].
Нарушение визуального восприятия
Повреждения височной коры могут приводить к нарушениям визуальной дискриминации, визуального распознавания слов, распознавания образов и даже распознавания объектов. Перечисленные нарушения визуального восприятия могут наблюдаться, даже несмотря на относительно нормальное выполнение стандартных визуально-пространственных задач. Например, пациенты с повреждениями правой височной доли могут иметь трудности в распознавании объектов на неполностью законченных рисунках, могут быть неспособны распо-знавать значимые части картин и могут обладать относительно плохими способностями к пространственному мышлению [108].
Модально-специфическое нарушение памяти
Давно известно, что повреждение височной коры и медиальных височных структур приводит к модально-специфическому нарушению памяти [32, 83]. Повреждения левой височной доли могут приводить к нарушению способности кодировать и вспоминать список представленных на слух слов, чисел или букв, нарушению семантической памяти и обучения парным вербальным ассоциациям [108]. У пациентов с повреждениями левой височной доли могут наблюдаться трудности со вспоминанием слов, что, в свою очередь, может негативно влиять на продукцию беглой речи. В тяжелых случаях говорят о развитии аномии. При повреждении этой доли также может наблюдаться нарушение понимания сложной информации. Как следствие, пациентам трудно дается изучение нового вербального материала.
У пациентов с повреждениями правой височной доли более часто наблюдаются проблемы с памятью, касающейся визуально-пространственных стимулов, таких как лица, невербализируемые дизайны и рисунки. Они также могут иметь трудности с обучением ориентации в лабиринте и ответом на любой стимул или задачу, которые с трудом поддаются вербальной маркировке. Нарушения модально-специфической памяти, связанные с односторонними повреждениями височной доли, вызывают относительно легкую когнитивную дисфункцию и могут быть замечены только с помощью нейро-психологического тестирования. Однако двусторонние повреждения височной доли могут приводить к развитию глобальной амнезии (т.е. тяжелому и глубокому нарушению формирования сознательной памяти ко всем видам раздражителей). Несмотря на то что амнезия была отмечена после односторонних повреждений височной доли (обычно на стороне доминантного полушария), наиболее вероятной причиной амнестического инсульта является двусторонний инфаркт задних мозговых артерий, повреждающий нижнемедиальные структуры височной доли, включая гиппокамп и амигдалу. Этот тип билатерального инфаркта не является редкостью, поскольку обе задних мозговых артерии берут свое начало из одной базилярной артерии [108].
Теменная кора
Теменные доли расположены между лобными, височными и затылочными долями и сочетают в себе многие функциональные их признаки. Фактически необходимо признать, что повреждение теменных долей связано с большим разнообразием когнитивных и поведенческих нарушений, чем повреждение любых других долей головного мозга. Однако в отличие от других областей мозга выявление когнитивных нарушений, связанных с париетальными повреждениями, часто требует использования специальных нейропсихологических и поведенческих методов. К наиболее очевидным нейроповеденческим расстройствам, развивающимся после ишемического или геморрагического инсульта теменной доли, относят аграфию или акалькулию, расстройство пространственной ориентации, алексию, конструкционную апраксию и анозогнозию. Если повреждение локализуется внутри ангулярной извилины, являющейся нижней долькой доминантной теменной доли (поле Бродмана 39), то часто развивается сочетанное нарушение, характеризуемое дезориентацией вправо-влево, дисграфией, акалькулией и пальцевой агнозией (синдром Герстмана).
Аграфия
Аграфия — неспособность писать — связана непосредственно с повреждениями ангулярной извилины или связей с этой областью в пределах левой теменной доли. Менее часто это нарушение может развиваться также вследствие повреждений правого полушария. Различают несколько типов аграфии. Один из них — аграфия, наблюдаемая при задних повреждениях доминантного полушария, — характеризуется хорошо выписанными буквами, соединенными вместе, но неправильным спеллингом, нарушенным порядком слов и частыми пропусками [11]. В противоположность этому более передний тип аграфии характеризуется крупным, грубым, неразборчивым почерком с плохо сконструированными и аграмматичными предложениями. Изолированная аграфия (не в контексте афазии), которая также может наблюдаться при повреждениях ангулярной извилины, может сочетаться с акалькулией.
Акалькулия
Акалькулией называют неспособность выполнять определенные математические операции. Ее появление можно наблюдать при повреждении левой теменной доли и она часто сопровождается аграфией. Различные типы аграфии и акалькулии отражают нарушение более сложных (более высокого порядка) когнитивных процессов. Одна из форм акалькулии, при которой пациенты не могут правильно понять или написать числа или даже заменяют одно число другим, наблюдается после повреждения речевых зон в доминантном полушарии. Повреждение в недоминантном теменно-затылочном соединении может приводить к проблемам с визуально-пространственной дискриминацией, что вызывает акалькулию, характеризуемую плохим пространственным размещением цифр: цифры не выстроены в ряд, что препятствует выполнению сложных вычислений. При этой форме акалькулии пациенты могут понимать числа, символы, вычислительные знаки и даже способны успешно выполнять большинство математических операций.
Пространственное игнорирование и нарушение пространственной ориентации
Расстройства пространственной ориентации, включая контралатеральное игнорирование, наблюдаются после повреждений правой теменной доли. Контралатеральное игнорирование включает игнорирование визуальных, тактильных и звуковых стимулов, идущих от тела или половин полей зрения, и характеризуется тем, что носит контралатеральный к месту повреждения характер. Allegri [3] сообщил, что левостороннее игнорирование после повреждений правого полушария наблюдается более часто (от 31 до 46 %), чем правостороннее игнорирование после повреждений левого полушария (от 2 до 12 %). Таким образом, одностороннее игнорирование может наблюдаться после инфарктов левой теменной доли, что встречается относительно редко по сравнению с большинством пациентов, у которых наблюдается левостороннее игнорирование вследствие повреждений правой теменной доли. Одностороннее игнорирование наблюдали также после фронтальных и субкортикальных сосудистых повреждений. У пациентов с париетальными повреждениями могут также наблюдаться проблемы с нахождением пути и неспособность распознавать объекты, которые обычно служили ориентирами (топографическая агнозия). Кроме того, у пациентов с повреждениями левой теменной доли могут наблюдаться выраженные трудности с пространственной ориентацией вправо-влево.
Более полные знания об ориентирах и направлении перемещения связывают с функцией нахождения пути. Нахождение пути, по-видимому, включает много нервных механизмов, и точный нервный круг, поражаемый при расстройствах нахождения пути, продолжает обсуждаться. В одной из последних опубликованных работ Asselen и соавт. [105] изучали нейроанатомические корреляты нахождения пути у 31 пациента с односторонними инсультами, расположение которых уточнялось с помощью магнитно-резонансной томографии (МРТ). Всех включенных в исследование пациентов тестировали с помощью серии заданий, включающих распознавание ориентиров, упорядочивание ориентиров, прохождение пути в обратном направлении и рисование маршрута. Данные свидетельствуют о том, что распознавание ориентиров нарушалось при повреждении правой гиппокампальной формации. Относительно более слабая связь была обнаружена между нарушением упорядочивания ориентиров и повреждением дорсолатеральной префронтальной коры. Нарушение рисования пути было связано с повреждением правой височной области. Обратное прохождение пути нарушалось при повреждении нескольких мозговых областей, включая правую гиппокампальную формацию, правую заднюю париетальную кору, правую дорсолатеральную префронтальную кору и правую височную долю.
Апраксия
Апраксия может быть определена как неспособность выполнять целенаправленные движения при отсутствии ряда моторных нарушений, таких как паралич. Существует множество различных видов апраксии. Одной из наиболее значимых форм является конструкционная апраксия, или неспособность выполнять привычные последовательности движений при делании или приготовлении чего-либо [108]. Интересно, что при этом пациент все еще может выполнять каждое из отдельных действий или шагов, составляющих упомянутую последовательность. Например, пациент может быть способен выполнять каждое из отдельных действий, необходимых для отправки письма (например, наклеить марку и запечатать конверт), но не способен сделать всю цепочку действий, чтобы в действительности справиться с задачей отправления письма. Конструкционные нарушения, характеризуемые неспособностью нарисовать или сконструировать объекты или формы, также наблюдались при повреждениях обоих полушарий. При этом обнаруживалась разница в процессе и продукте конструирования, давая ценный ключ к установлению стороны повреждения. Например, рисунки пациентов с повреждением правого полушария часто выглядят фрагментированными и характеризуются плохими пространственными соотношениями. Эти рисунки также могут характеризоваться плохой или неправильной ориентацией. Напротив, пациенты с повреждениями левого полушария могут лучше передавать пространственную ориентацию и связи, но их рисунки могут быть слишком простыми, лишенными деталей и формируются с большими усилиями. Совсем недавно было высказано предположение, что в действительности имеется две различные, но комплементарные системы для кодирования пространственных связей (категориальная и координатная). Следовательно, на самом деле могут иметься две качественно разные формы конструкционной апраксии, вызванные односторонними повреждениями [64]. Отсюда может стать понятным, почему одни авторы, такие как Sunderland и соавт. [102], пишут, что конструкционная апраксия является очень резистентной к лечению, в то время как другие, такие как Nys и соавт. [80], сообщают о хорошем прогнозе для данной патологии.
Анозогнозия
Анозогнозия в общем может быть определена как отсутствие ощущения болезни. Существуют различные типы анозогнозии. Асоматогнозия, или утрата знаний о теле и его состоянии, является расстройством, которое наблюдается при повреждении теменной коры любого из полушарий, существует множество форм этого расстройства. Анозодиафория проявляется общей индифферентностью к болезни. Неспособность называть и локализовывать части тела называют аутотопагнозией. Все перечисленные агнозии развиваются при повреждениях левой теменной коры. Пациенты с правопариетальными и фронтальными инфарктами имеют достоверно меньше интроспективных способностей и меньше переживают по поводу своей болезни по сравнению с пациентами с инфарктами в других областях мозга, несмотря на одинаковую степень когнитивных нарушений [52].
Затылочная кора
Небольшие повреждения зрительной коры часто могут вызывать дефекты, или «слепые пятна», в полях зрения. Однако патология данной области мозга, как правило, не приводит к нарушению высших когнитивных функций, хотя они и связаны со зрительным восприятием и пониманием. Если же в процесс вовлечены другие субкортикальные структуры и ассоциативная кора, то может развиваться ряд нейроповеденческих нарушений. К ним относят церебральную слепоту, синдром Антона и зрительную агнозию.
Церебральная слепота и синдром Антона
Окклюзия задней мозговой артерии приводит к двустороннему повреждению зрительной коры и может вызывать состояние, известное как церебральная, или корковая, слепота. Оно характеризуется неспособностью распознавать формы и образы, несмотря на сохранение светоощущения [68]. Церебральная слепота может сопровождаться периодами спутанности сознания, амнезией или даже отсутствием сознания. Удивительно, что пациенты с церебральной слепотой (более часто называемой корковой слепотой) могут демонстрировать визуальные ответы и могут быть способны определять визуальные стимулы в слепом поле без переживания опыта зрения как такового [85]. Этот феномен получил название «слеповидения». Hartmann и соавт. [48] описали пациента с церебральной слепотой вследствие двусторонних затылочных и левопариетальных повреждений, который, хотя и отрицал наличие зрительного восприятия, правильно называл объекты, цвета и известные лица, распознавал эмоции и читал разные типы одиночных слов с более чем 50% точностью, если они располагались в правом верхнем зрительном поле. Когда пациента спрашивали о его визуальных способностях, он продолжал отрицать наличие визуального восприятия, говоря: «Я чувствую это». Авторы предположили, что данный вид отрицания визуального восприятия лучше всего может быть объяснен разобщением системы внимания теменных долей и областей, контролирующих визуальное восприятие. Пациенты с синдромом Антона, в отличие от «слеповидения», напротив, не осознают тот факт, что они слепы. У них формируются конфабуляции и рационализации касательно их нарушенных возможностей. Синдром Антона развивается обычно при повреждении двух затылочных долей и, по всей вероятности, связан с нарушением кортикоталамических соединений [27].
Зрительная агнозия
Зрительная агнозия характеризуется дефектным восприятием зрения или искажением зрительных стимулов, несмотря на нормальный вход зрительной информации. Она может наблюдаться при инфарктах зрительных ассоциативных областей [10]. Например, зрительная агнозия объектов характеризуется сохранением восприятия зрительных стимулов, но неспособностью распознать объект. Пациенты с данным нейроповеденческим расстройством часто могут нарисовать объект или скопировать его изображение, что подтверждает сохранность способностей к зрительному восприятию. Данный вид агнозии развивается после повреждений доминантной затылочной доли [108]. Симультагнозия (синдром Балинта) характеризуется неспособностью одновременно воспринимать более одного аспекта стимула, несмотря на сохранение способности идентифицировать и помнить отдельные аспекты признаков объекта. Этот нейроповеденческий дефицит отчасти может быть связан с неспособностью перемещать фокус внимания и прямой пристальный взгляд [10]. Следующий более редкий вид зрительной агнозии характеризуется неспособностью узнавать знакомые лица. Это расстройство называют прозопа-гнозией, и в тяжелых случаях некоторые пациенты не узнают даже своего собственного отражения в зеркале. Нейроанатомическая основа этого расстройства все еще продолжает выясняться. Однако прозопагнозия была связана с двусторонними (в правом и левом полушарии) повреждениями теменной и затылочной доли [67]. Существует ряд предположений об относительно большей частоте двусторонних и недоминантных повреждений, протекающих более тяжело [33], равно как и об относительно большей степени дисфункции при поражениях правого полушария по сравнению с левым [66]. Наконец, следующий вид зрительной агнозии — в отношении цвета — также связан с повреждениями затылочной доли. Это нейроповеденческое расстройство может манифестировать по-разному, включая неспособность различать цветовые оттенки (ахроматопсия), неспособность называть цвета (цветовая аномия) и неспособность связывать определенный цвет с объектом и наоборот (цветовая агнозия) [60].
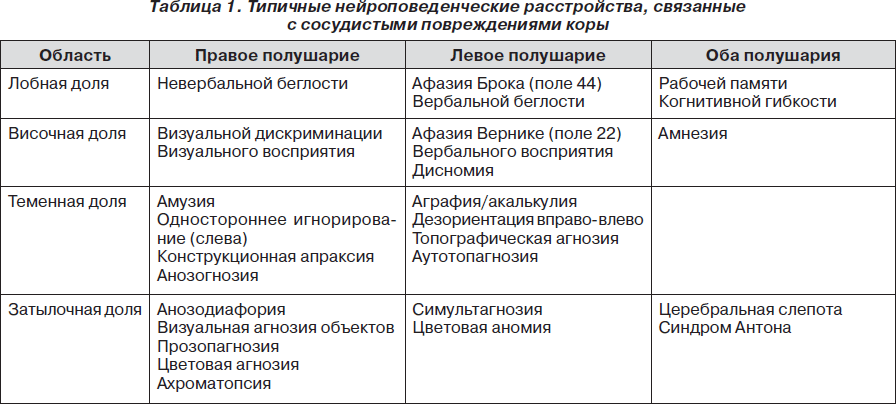
В табл. 1 приведены некоторые из наиболее частых нейроповеденческих расстройств, возникающих при ишемических и геморрагических инсультах коры, которые более детально были описаны выше. Анатомическая локализация некоторых из этих расстройств не всегда однозначна; подразумевается, что доминирующим является левое полушарие.
Когнитивные эффекты подкорковых повреждений
Мультиинфарктная деменция
Сосудистая деменция может быть вызвана как ишемией белого вещества, так и множественной окклюзией кровеносных сосудов (серия маленьких инсультов), что приводит к фокальной гибели участков ткани. Hachinski и соавт. [45] ввели термин «мультиинфарктная деменция» и пришли к выводу, что большая часть инфарктов была вторичной по отношению к заболеваниям сердца и внечерепных кровеносных сосудов. Клиническая деменция может быть вызвана мультиинфарктным состоянием, но невропатология часто осложняется наличием более чем одного заболевания. Гистопатологические исследования свидетельствуют о том, что сосудистые факторы вовлекаются в 10–40 % случаев [93]. Распространенность сосудистой деменции трудно установить, поскольку критерии ее диагностики неточны; когда же она диагностируется, необходимо исключить наличие болезни Альцгеймера.
Помимо этого, у пациентов может наблюдаться снижение когнитивных функций сосудистого генеза, но не явная деменция. Пациенты с нейропсихологическими расстройствами вследствие сосудистых когнитивных нарушений без деменции (КНБД) были охарактеризованы Nyenhuis и соавт. [78], которые сравнили когнитивные и поведенческие функции у 41 пациента после инсульта с сосудистыми КНБД и у 62 пациентов после инсульта без каких-либо когнитивных нарушений. Результаты построения моделей с помощью многофакторной логистической регрессии показали, что немедленное припоминание (оперативная память) и состояние психомоторных функций лучше всего дискриминируют эти группы. Однако, поскольку эти нарушения встречаются также при сосудистой деменции, вполне может быть, что сосудистые КНБД занимают промежуточное положение между нормальными когнитивными функциями и сосудистой деменцией.
Церебральная аутосомно-доминантная артериопатия с субкортикальными инфарктами и лейкоэнцефалопатией
Церебральная аутосомно-доминантная артериопатия с субкортикальными инфарктами и лейкоэнцефалопатией (ЦАДАСИЛ) является примером чистой сосудистой деменции, но ее когнитивный профиль не полностью описан. Самое последнее исследование этой патологии было выполнено Buffon и соавт. [17], которые оценили 42 последовательных (взятых подряд) пациента с ЦАДАСИЛ в возрасте 35–73 лет во множестве когнитивных доменов и сравнили пациентов с деменцией и без таковой. У более молодых пациентов наблюдалось расстройство внимания (69 %), памяти (70 %) и исполнительных функций (100 %). В противоположность этому визуально-пространственные способности нарушались с возрастом, главным образом после 60 лет. Несмотря на то что четверть пациентов имела деменцию (характеризуется относительным сохранением кодирования в эпизодической памяти), не было обнаружено какой-либо связи с количеством ишемических атак.
Лакунарные инсульты
Небольшие инфаркты в глубине полушарий и ствола мозга, вызванные окклюзией перфорирующих конечных артерий, отходящих от виллизиева круга, проксимальной части средней, задней мозговой и базилярной артерии, часто описывают как лакуны [36]. Наиболее часто встречающийся лакунарный синдром представляет собой чистую моторную гемиплегию, которая поражает лицо, руку и ногу как следствие инфаркта во внутренней капсуле или в основании моста [93]. По определению, афазия, визуально-пространственное игнорирование, агнозия, апраксия и дефекты поля зрения не встречаются при лакунарных синдромах, но могут появляться в результате более крупных стриатокапсулярных инфарктов, которые, возможно, имеют другую причину.
Лакунарное состояние связывают с появлением множества лакун, которые обычно приводят к моторной и интеллектуальной дисфункции. Большинство пациентов с лакунарным состоянием описывают серию дискретных когнитивных и поведенческих эпизодов, каждый из которых отражает новый сосудистый инфаркт, сопровождающийся появлением новых симптомов. Однако у одной трети пациентов с подтвержденным лакунарным инфарктом нарушения развиваются постепенно, поэтому выявляемые синдромы часто ошибочно связывают с дегенеративным процессом [109]. Клиническая картина множественных лакунарных инфарктов обычно включает выраженную моторную дисфункцию и менее выраженные соматосенсорные и зрительные нарушения. Часто встречаются пирамидные симптомы, которые включают мышечную спастичность, нарушения походки, гиперрефлексию и симптом Бабинского. Могут также наблюдаться псевдобульбарный паралич с дизартрией, дисфагия, парез лица, гиперрефлекторный рвотный ответ и эмоциональная несдержанность [53]. Экстрапирамидные симптомы часто смешаны с признаками поражения центрального мотонейрона.
Субкортикальная ишемическая болезнь сосудов
Субкортикальная ишемическая болезнь сосудов (СИБС) характеризуется обширными повреждениями белого вещества и множественными лакунами и до недавнего времени не имела хорошо охарактеризованного паттерна когнитивных нарушений. Однако было выполнено новое исследование Jokinen и соавт. [54], в рамках которого оценили состояние 323 последовательных (включенных подряд) пациентов с ишемическим инсультом в возрасте 55–85 лет с помощью набора когнитивных тестов. Восемьдесят пять пациентов, соответствующих критериям СИБС по данным МРТ, сравнили с 238 пациентами, не соответствующими критериям СИБС, и 38 здоровыми лицами. Авторы сообщили, что пациенты с СИБС выполняли тесты хуже по сравнению со здоровыми лицами во всех когнитивных доменах. По сравнению с пациентами без СИБС у пациентов с СИБС была ухудшена исполнительная функция и отсроченное припоминание (последнее было больше связано с величиной атрофии височной доли). Таким образом, отличительной чертой этого плохо охарактеризованного подтипа сосудистых когнитивных нарушений является, по-видимому, ухудшение исполнительных функций.
Одиночные инфаркты
Небольшие субкортикальные инфаркты могут приводить к нарушению множества когнитивных доменов, в зависимости от их локализации. Ограниченные повреждения в таламусе, хвостатом ядре или бледном шаре могут вызывать многогранные когнитивные нарушения вследствие повреждения специфических субкортикально-кортикальных кругов. Хвостатое ядро, бледный шар и таламус нейроанатомически соединены с дорсолатеральной префронтальной корой. Повреждение любой части этого круга приводит к развитию нарушений, главным образом в исполнительных функциях и моторном программировании. Точная природа поведенческих изменений зависит от того, какая структура повреждена в круге. Одиночные инфаркты в хвостатом или паллидарных ядрах у людей встречаются редко, поэтому о них известно очень мало. В противоположность этому, во многих исследованиях изучали влияние таламических повреждений на нейропсихологические функции.
Таламический инсульт
Нейропсихологические синдромы, возникающие при таламических инфарктах, очень широко варьируют и определяются главным образом вовлекаемыми спе-цифическими ядрами таламуса. В таламусе находится по крайней мере три основных типа ядер, отдающих проекции к коре (специфические сенсорные, неспе-цифические и ассоциативные), а также ядра, отдающие проекции к лимбической системе и лобным долям [1, 70, 75]. Несмотря на большой диапазон нейроповеденческих нарушений, связанных с таламическими инфарктами, в целом было сообщено о трех основных клинических признаках геморрагического инсульта в таламусе [37]. В доминантном полушарии больше выражено сенсорное, нежели моторное снижение, имеются глазодвигательные нарушения (особенно нарушение вертикального взгляда глазами, отклоненными вниз или внутрь) и умеренная дисфазия. Может наблюдаться транскортикальная сенсорная афазия и нарушение памяти. Учитывая выраженность таламокортикальных взаимосвязей (почти вся кора и стриатум получают волокна от таламуса), не удивительно, что многие нейроповеденческие расстройства, возникающие при повреждениях таламуса, качественно подобны по своей природе ряду нейроповеденческих нарушений, возникающих при повреждениях коры. Некоторые из этих расстройств, встречающиеся наиболее часто, — нарушение активации и внимания, исполнительных функций, речи и памяти — описаны ниже.
Нарушение активации и внимания
Расстройства активации, включая утрату сознания, часто наблюдаются после геморрагических инсультов в таламусе. И хотя эти расстройства отмечаются более часто после двусторонних парамедиальных инфарктов таламуса, кома и выраженные нарушения сознания могут быть также при односторонних нарушениях [38, 42, 101]. У пациентов с начальными нарушениями сознания со временем, как правило, наблюдается улучшение, характеризуемое значительными колебаниями уровня активности [8, 44, 58]. По мере восстановления пациенты с геморрагическим инсультом таламуса могут полностью вернуться к бодрствованию, однако они медленно отвечают на раздражители, апатичны и подвержены гиперсомнии, если их не стимулировать [58, 106]. Считается, что гиперсомния, наблюдаемая у этих пациентов, является следствием локального давления на ретикулярную активирующую систему рострального отдела ствола мозга [18, 42, 58]. Лица с повреждениями таламуса могут также иметь нарушения внимания, которые легко обнаруживаются, когда они пытаются выполнить менее структурированные задачи (например, запоминание цифр может быть не нарушено, но ориентация в лабиринте нарушена [101]).
Нарушение исполнительных функций
У пациентов с повреждениями таламуса часто наблюдаются поведенческие нарушения, сопоставимые с теми, которые были описаны выше для повреждений лобных долей или фронтолимбического круга [14, 28, 98, 99]. Например, могут присутствовать конфабуляции или редупликативная парамнезия [16, 101, 103]. Были описаны различные изменения настроения, включая апатию, акинезию, отсутствие заинтересованности и эйфорию [58, 72, 96]. Среди других нарушений исполнительных функций сообщалось о персеверациях, повышенной чувствительности к интерференциям, проблемах с упорядочиванием информации и неспособности поддерживать интерес к какой-либо теме или задаче.
Речевые нарушения
Речевые нарушения присутствуют практически всегда при повреждениях левого таламуса [9, 57], хотя нет однозначного мнения о том, где именно должны находиться эти повреждения внутри таламуса. Большинство исследований указывает на то, что требуется вовлечение заднего бугорка таламуса [23] или вентролатерального ядра [30, 42]. Речевые расстройства при повреждениях таламуса весьма разнообразны и являются результатом нарушения корково-подкорковой интеграции [24].
Расстройства речи при таламическом инфаркте могут быть связаны со многими дисфункциями, включая изменение бдительности, активности и контроля. Однако, как правило, вначале появляется мутизм, за которым следует плохое инициирование речи, с ограниченным количеством слов и большим количеством пауз. Формирование списка слов может быть умеренно или тяжело нарушено, речь может характеризоваться уменьшением ее объема, нарушением просодии и вариабельной дизартрией. Могут также присутствовать персеверации, ошибки восприятия, искажения и неафазические ошибки в наименовании объектов.
Расстройства памяти
Выраженные расстройства памяти после таламических инсультов встречаются довольно часто и характеризуются главным образом нарушением антероградной памяти [69, 111]. Как и при кортикальных повреждениях, нарушение памяти является гемисфероспецифичным. Билатеральные повреждения приводят к тяжелым и персистирующим нарушениям памяти, в то время как односторонние повреждения слева и справа вызывают вербальные и невербальные нарушения памяти соответственно [96, 101]. У пациентов с двусторонними повреждениями таламуса может также наблюдаться синдром субкортикальной деменции с нарушениями памяти, внимания, речи, визуально-пространственных функций и персонализации. Этот синдром более сопоставим с нарушениями, видимыми при других «субкортикальных» деменциях, нежели с болезнью Альцгеймера, вследствие отсутствия апраксии, агнозии или определенной афазии и наличия медленной скорости процессирования информации, инерции и апатии [26]. В отличие от других субкортикальных деменций дементный синдром, возникающий вследствие двустороннего таламического инсульта, характеризуется сочетанием фронтосубкортикальной дисфункции и тяжелого расстройства памяти [101].
Мозжечковый инсульт
Давно известно, что мозжечок важен для координации движений. Вместе с тем новые данные свидетельствуют о том, что мозжечок также вовлечен в когнитивные функции более высокого порядка [49, 91]. При исследовании пациентов с повреждениями, локализующимися внутри мозжечка (дегенерация мозжечка или инсульт мозжечка), были выявлены нейроповеденческие нарушения, связанные с самим мозжечком [7, 43, 65]. Однако в новых исследованиях с функциональной нейровизуализацией была выявлена активация мозжечка во время выполнения немоторных задач [4, 5, 35]. Это указывает на то, что он играет роль в реализации других когнитивных функций, таких как обучение, память, внимание и речь.
Мозжечковый когнитивный аффективный синдром
Schmahmann [90] и Schmahmann и Sherman [91] описали спектр поведенческих и когнитивных нарушений, являющихся следствием инсульта мозжечка и называемых мозжечковым когнитивным аффективным синдромом (МКАС). Данный синдром включает нарушение исполнительных функций и характеризуется персеверациями, рассеянностью или невниманием, визуально-пространственными нарушениями, трудностями речевой продукции и изменениями личности. Отдаленная эпизодическая и семантическая память сохранена, способность к обучению новому затронута лишь в незначительной степени. Результирующее влияние перечисленных нейроповеденческих нарушений сводится к общему снижению интеллектуальных способностей, несмотря на то, что уровень активности и бодрствования не изменен [91]. Эти ключевые признаки позволяют отделить этот синдром от неспецифических состояний спутанного сознания и разных видов деменции. Например, симптомы, более характерные для кортикальной деменции (афазия, апраксия, агнозия), чаще всего отсутствуют [91]. Кроме того, деменция обычно обнаруживается у пациентов с наличием признаков более обширного вовлечения в процесс центральной нервной системы (например, мозжечковые симптомы, а также расстройства экстрапирамидного и пирамидного тракта), нежели у пациентов, страдающих только от спинального и мозжечкового синдромов [50].
Поведенческие изменения, связанные с повреждением мозжечка, характеризуются изменением личности с притуплением эмоциональной сферы, растормаживанием поведения или неадекватным поведением, нарушением многих исполнительных функций, включая планирование, способность менять установки, трудности с абстрактным мышлением. Когнитивные нарушения, связанные с повреждениями задней доли мозжечка и червя, затрагивают другие исполнительные функции (например, снижалась беглость речи и нарушалась рабочая память; возникали проблемы с пространственным познанием, включая визуально-пространственную организацию и память [15, 91]; возникали речевые нарушения, включая аграмматизм, диспросодию и некоторую аномию [91, 94]).
Совсем недавно Schmahmann [89] предположил, что когнитивные и психиатрические компоненты МКАС вместе с атаксическими моторными нарушениями при мозжечковых расстройствах могут быть лучше концептуализированы как «дисметрия мышления». Эта концепция утверждает, что универсальная мозжечковая трансформация помогает модуляции поведения вокруг некоторого исходного уровня и что поведение, будучи модулированным, детерминируется специфичностью анатомических путей индивидуума внутри церебромозжечковой системы. Любое повреждение мозжечкового компонента распределенной нервной петли, необходимой для сенсомоторного, когнитивного и эмоционального процессирования, нарушает эту универсальную трансформацию. Подобное нарушение характеризуется атаксией, если вовлекается сенсомоторный мозжечок, и МКАС, если повреждение локализуется в латеральной части полушарий задних отделов мозжечка или в черве. В соответствии с данными Schmahmann [89], когнитивные и аффективные расстройства могут сопровождать мозжечковые нарушения или могут быть их основным клиническим проявлением, что имеет значение для диагностики и лечения когнитивных дисфункций.
Прогноз, реабилитация и фармакотерапия
Прогностические факторы
Улучшение подходов к лечению вместе с образовательными программами, направленными на сокращение времени между первыми признаками инсульта и назначением лечения, существенно сократили смертность, связанную с ишемическими и геморрагическими инсультами. Однако повышение выживаемости означает, что прогрессивно большее количество пациентов нуждается в проведении программ реабилитации [95]. Учитывая актуальность проблемы, в последние 10 лет возросло количество научных исследований, фокусирующихся на функциональных исходах после ишемических и геморрагических инсультов. Однако в очень малом количестве работ была изучена взаимосвязь между когнитивными функциями и исходами инсульта. Это удивительно, поскольку известно, что когнитивная и эмоциональная сфера вносят важный вклад в качество жизни.
Попытка выявить клинические факторы, которые определяют прогноз острой когнитивной дисфункции после инсульта, была выполнена Nys и соавт. [80]. Исследователи дали 2 набора тестов когнитивной сферы 111 пациентам после инсульта и 77 здоровым людям. Тестирование проводили исходно в течение 3 недель после инсульта и затем спустя 6–10 месяцев. Полученные данные свидетельствуют о том, что относительно более плохое восстановление когнитивных функций было связано с более старшим возрастом, более низкими исходными (до инсульта) вербальными способностями, наличием повреждений в некоторых из долей (височная, лобная и затылочная), большим объемом повреждений, наличием сахарного диабета. Когнитивные нарушения и сосудистые факторы риска являются также важными предикторами симптомов депрессии и качества жизни спустя 6–10 месяцев.
Результаты других исследований подтверждают полезность четкого определения подтипа инсульта во время госпитализации на основе выполнения когнитивных тестов и определения стороны локализации повреждения. Подобный подход предполагает, что программа реабилитации будет специально подобрана для того или иного подтипа инсульта, чтобы максимизировать функциональный исход. Hajek и соавт. [46] полагают, что исход реабилитации лучше прогнозируем, если результаты функциональных оценок соотносятся с результатами всесторонней оценки когнитивных функций. Следовательно, возникает неизбежная необходимость в проведении глубокого и стандартизированного нейропсихологического оценивания всех пациентов с инсультами во время госпитализации и затем периодически во время процесса выздоровления.
Несмотря на то что некоторые исследователи [62] не смогли обнаружить достоверное влияние когнитивных нарушений на качество жизни у пациентов после инсульта, результаты крупных исследований [104] подтверждают, что когнитивные нарушения являются значимым независимым предиктором функциональных исходов (после поправки на возраст и физические нарушения). В частности, исследователи сообщили, что степень когнитивных нарушений была связана с увеличением функциональных нарушений и что отсутствие когнитивных нарушений было связано с увеличением числа пациентов, живущих без посторонней помощи после выписки из стационара. В другом исследовании (59 пациентов в возрасте 75 лет и старше) Kong и соавт. [61] сообщили, что количество баллов, набранное во время госпитализации по когнитивным тестам и модифицированному индексу Бартел, предсказывало величину модифицированного индекса Бартел при выписке из стационара. Feigenson и соавт. [34] выполнили ретроспективный анализ 248 пациентов, перенесших инсульт, и сообщили, что наличие тяжелых когнитивных нарушений и дисфункции восприятия, или гомонимной гемианопии, в дополнение к моторному дефициту было связано с неблагоприятным исходом и более длительным временем госпитализации. В рамках другого исследования, включавшего 199 пожилых пациентов с инсультом, получавших реабилитационную терапию, Kanemaru и соавт. [56] изучали влияние различных факторов на выписку пациентов. Был выполнен множественный регрессионный анализ, в ходе которого в качестве зависимой переменной было выбрано место выписки пациентов. Исследователи сообщили, что более высокие баллы по шкале интеллекта взрослых Векслера (позволяет измерить IQ) вместе с более старшим возрастом и более высоким уровнем повседневной активности (УПА) были достоверно связаны с большей вероятностью выписки из дома престарелых.
В популяционном исследовании инсультов Appelros и соавт. [6] оценили влияние места жительства, пола, тяжести инсульта, когнитивных нарушений и депрессии на 377 пациентов, перенесших инсульт, за 1 год до инсульта и спустя 1 год после инсульта. Все перечисленные факторы увеличивали вероятность госпитализации пациентов в специализированные заведения. Авторы сообщили, что вероятность попадания в дома престарелых увеличивалась с 13 до 20 %; потребность в помощи, необходимой для выполнения повседневных навыков, увеличивалась с 21 до 36 %. Авторы также отметили, что супруги-женщины более активно включались в заботу о заболевшем супруге.
У пациентов с инсультом в возрасте до 65 лет когнитивные функции и УПА демонстрируют сходный паттерн улучшения спустя 1 год после инсульта [51]. Однако у 83 % из 58 пациентов все еще наблюдалась когнитивная дисфункция, а 20 % все еще требовалась помощь лиц, ухаживающих за ними, чтобы выполнить повседневные навыки. Поразительно, что лишь немногие пациенты возвращались к работе — спустя 3 года после инсульта только 20 % пациентов возвращалось к оплачиваемой работе. Хотя неврологический статус влиял на восстановление когнитивных функций, он не был достоверно связан с возвращением к работе.
Del Ser и соавт. [31] оценили влияние длительно персистирующих факторов риска на восстановление когнитивных функций после инсульта. Для этого они исследовали 193 последовательных (взятых подряд) пациента спустя 3 и 24 месяца после развития инсульта. Всех пациентов тестировали с помощью большого количества нейропсихологических тестов и клинической шкалы оценки тяжести деменции (для того, чтобы выявить у пациентов наличие деменции). В результате было обнаружено, что возраст, наличие предшествующего снижения когнитивных функций, полипрагмазия и наличие гипотензии во время госпитализации были факторами риска, связанными с прогрессированием снижения когнитивных функций. Авторы также сообщили, что спустя 24 месяца когнитивный статус был стабильным у 78 % пациентов, ухудшение наблюдалось у 14 % пациентов, улучшение — у 7,8 % пациентов.
Reitz и соавт. [87] изучали взаимосвязь между инсультом и изменением когнитивных функций у 1271 пожилого пациента без признаков деменции в исходных условиях. Длительность исследования составила 5 лет. Авторы использовали обобщенные уравнения для оценки связи между инсультом и выполнением когнитивных функций в каждом из когнитивных доменов. В результате было обнаружено, что с течением времени память снижалась, а абстрактная/визуально-пространственная и речевая функции оставались относительно стабильными. Взаимосвязь между инсультом и снижением памяти была более выраженной у мужчин и тех лиц, у которых не было аллели аполипопротеина е4.
Учитывая важность латерализации когнитивных функций, кажется неожиданным тот факт, что лишь в небольшом количестве исследований, выполненных к сегодняшнему дню, обнаружено влияние латерализации инсультов на функциональные исходы. В то время как одни исследователи сообщают, что латерализация не влияет на исходы инсульта, другие говорят о том, что подобное влияние есть. В одном таком исследовании Sisson [95] сообщает, что пациенты с инсультами правой теменной и височной доли имеют наибольшие трудности с памятью, концентрацией и умственной усталостью спустя 10 дней и 1, 3, 6 месяцев после инсульта. Sisson [95] также сообщил о наличии положительной взаимосвязи между когнитивными функциями и физическими способностями, которая сохранялась в течение всего времени исследования. Chae и Zorowitz [19] исследовали влияние коркового и подкоркового негеморрагического инсульта и латерализации повреждения на функциональные исходы у пациентов с инсультами. Они сообщили, что оба параметра — уровень повреждения (корковый или подкорковый) и латерализация — являются важными детерминантами исходов при реабилитации пациентов в стационаре. В частности, у пациентов с подкорковым инсультом наблюдалась более высокая способность к самообслуживанию, лучшая подвижность, более выраженные коммуникативные навыки и социальное познание по сравнению с пациентами с корковым инсультом. Однако подобная картина наблюдалась только у пациентов с повреждениями левого полушария. Авторы сообщили также о том, что у пациентов с инсультом левого полушария наблюдалась тенденция к относительно более плохим коммуникативным навыкам и социальному познанию по сравнению с пациентами с инсультом правого полушария.
Нейровизуализация
Относительно недавно для оценки и прогноза восстановления когнитивных функций после ишемического и геморрагического инсульта стали использовать метод функциональной нейровизуализации. При использовании данной технологии во время сканирования пациентам назначают специальные когнитивные пробы и паттерны активации, зарегистрированные у пациентов, восстанавливающихся после ишемических и геморрагических инсультов, сравнивают с паттернами активации у сопоставимых по возрасту здоровых пациентов. При этом выраженность паттернов активации отражает степень восстановления когнитивных функций.
Например, Crinion и Price [22] использовали функциональную МРТ (фМРТ) для исследования повествовательной речи у пациентов с инсультом в левом полушарии и афазией (по сравнению с 18 здоровыми пациентами). Они обнаружили, что независимо от места повреждения понимание предложений на слух коррелировало с активностью кпереди от первичной слуховой коры в латеральном отделе правой верхней височной извилины. Это предполагает пространственное вовлечение контралатерального полушария в процессы восстановления. Эти данные подтверждаются также обзором других доступных исследований понимания речи на слух, в которых было показано, что восстановление связано с активацией как левой, так и правой височной доли [86]. В дополнение к этому Crinion и Price [22] сообщили, что если височная кора не вовлекалась в инсульт, то выполнение упомянутой задачи коррелировало с активностью задних отделов левой верхней височной извилины (поле Вернике). В противоположность этому способность узнавать рассказ была связана с активацией нижних отделов левой лобной доли и правого мозжечка.
Визуализационные исследования речевой продукции у пациентов с афазией после инсульта в левом полушарии свидетельствуют о том, что восстановление зависит от медленно развивающейся активации в левом полушарии. Изменения в правом полушарии не связаны с восстановлением и являются результатом транскаллезного растормаживания [86].
Strangman и соавт. [97] исследовали пригодность спектроскопии в ближней инфракрасной области для оценки процесса реабилитации. Исследование носило длительный характер и было выполнено на здоровых людях. В результате была выявлена надежность метода при повторном тестировании во время выполнении задачи моторного контроля. Это свидетельствует о том, что данная техника визуализации может быть надежным инструментом при оценке процесса реабилитации и длительного восстановления после инсульта. Для знакомства с основными положениями, касающимися визуализации изменения нервных функций в процессе восстановления пациентов, смотрите работу Unoz-Cespedes и соавт. [76].
Фармакотерапия
В настоящее время нет лекарственных средств, которые бы Управление по контролю за продуктами и лекарствами США (FDA) одобрило для лечения инсультов и их последствий.
Для изучения влияния препаратов на когнитивные функции после инсульта используют два подхода. В первом случае нейропротективное средство вводят в очень короткие сроки после инсульта и затем наблюдают за пациентами продолжительное время, чтобы оценить острые исходы. Второй подход сводится к оценке изменений когнитивных функций в течение заданного периода времени у пациентов с хроническим паттерном когнитивных нарушений. Его используют обычно у пациентов, у которых предполагают сосудистую этиологию когнитивных дисфункций (например, сосудистую деменцию).
Средства для острой нейропротективной терапии
Поскольку избыточная активация N-метил-D-аспартатного (NMDA) подкласса глутаматных рецепторов является ключевым шагом в повреждении мозга во время ишемического инсульта, то эти рецепторы стали мишенью для многих новых соединений. Несмотря на многообещающие результаты в ряде экспериментов на животных, применение первых блокаторов NMDA-рецепторов (например, селфотела, также известного как CGS 19755) у людей приводило к развитию тяжелых побочных эффектов [29]. Для активации NMDA-рецепторов также необходим глицин. Антагонисты глицина на NMDA-рецепторах, такие как аптиганель и гавестинель, проявили себя как многообещающие нейропротективные средства в экспериментах на животных с фокальной ишемией мозга. В клинических исследованиях эти препараты переносились намного лучше, однако они оказались неэффективными при их оценке с помощью традиционных шкал (индекс Бартел, шкала тяжести инсульта Национального института здравоохранения США, модифицированная шкала Ранкина и др.), принимающих в расчет общий уровень когнитивного функционирования, но не дающих ему точную оценку. По состоянию на сегодняшний день нет клинических исследований средств, влияющих на NMDA-рецепторы, в которых бы когнитивные функции оценивали в качестве первичных или ключевых вторичных конечных точек исследования (с помощью стандартизированных нейропсихологических тестов) у пациентов с острым и подострым ишемическим инсультом.
Другие препараты, такие как ноотропное средство Церебролизин (Ebewe Pharma, Унтерах, Австрия), также были положительно оценены в доклинических исследованиях. Церебролизин является нейропротективным средством, содержащим пептиды, которые обладают уникальной биологической активностью — защищают нервные клетки от влияния ишемического каскада. Церебролизин снижает выраженность эксайтотоксического повреждения, предотвращает избыточную активацию кальцийзависимых протеаз, улавливает свободные радикалы кислорода. В результате всех перечисленных эффектов Церебролизин увеличивает жизнеспособность нейронов и их выживаемость во время и после ишемических инсультов. Несмотря на обилие положительных доклинических данных, в единственном плацебо-контролируемом исследовании Церебролизина у пациентов с острым инсультом [63] не было обнаружено достоверных улучшений по Канадской неврологической шкале, индексу Бартел и шкале общего клинического впечатления (CGI) в разные отметки времени, вплоть до 90-го дня после инсульта. Однако у пациентов в группе с Церебролизином наблюдалось достоверное улучшение когнитивных функций по краткому синдромальному тесту (оценивает внимание и память) по сравнению с пациентами из плацебо-группы.
В рамках другого исследования оценили, будет ли внутривенное введение рекомбинантного тканевого активатора плазминогена (rtPA), выполненное после острого ишемического инсульта, оказывать положительное влияние на когнитивные и функциональные исходы спустя 6 месяцев после инсульта. Исследование не было плацебо-контролируемым, однако в нем использовали когорту нелеченых пациентов в качестве контрольной группы. К сожалению, хотя исследование и предполагало положительное влияние препарата на функциональные исходы, о чем свидетельствовало соответствующее изменение УПА, каких-либо влияний на показатели нейропсихологических тестов обнаружено не было.
В исследовании The Women’s Estrogen for Stroke Trial (Исследование женского эстрогена для лечения инсультов) [107] вели наблюдение за 664 женщинами в постменопаузе, недавно перенесшими инсульт или транзиторную ишемическую атаку, чтобы определить, будет ли терапия эстрогеном снижать риск развития когнитивного снижения по сравнению с плацебо. В целом эстроген не оказывал достоверного влияния на выраженность когнитивных нарушений в среднем в течение 3 лет наблюдения. Однако результаты исследования свидетельствуют о том, что в подгруппе женщин с исходно нормальными когнитивными функциями терапия эстрогеном может уменьшать риск развития последующего когнитивного снижения (относительный риск 0,46; 95% ДИ 0,24–0,87).
Средства для лечения хронической сосудистой деменции
Результаты разных рандомизированных контролируемых исследований свидетельствуют о том, что ингибиторы ацетилхолинэстеразы являются эффективными средствами для лечения сосудистой деменции, однако их использование при данной патологии пока не лицензировано. В двух идентичных рандомизированных двойных слепых плацебо-контролируемых исследованиях донепезила [13, 110] (в общей сложности 1219 пациентов, включенных в исследование в 109 исследовательских центрах США, Канады, Европы и Австралии) были обнаружены положительные результаты. Пациенты в этих исследованиях были рандомизированы в соотношении 1 : 1 : 1 к получению донепезила 5 мг, донепезила 10 мг или плацебо. Первичные конечные точки исследований включали оценку по двум шкалам: по когнитивной подшкале шкалы оценки тяжести болезни Альцгеймера (ADAS-cog) и по шкале оценки состояния пациентов на основании впечатления врача и лиц, ухаживающих за пациентами (CIBIC-plus). Спустя 24 недели лечения в обеих группах с донепезилом в обоих исследованиях было отмечено статистически достоверное улучшение ко-гнитивных функций по шкале ADAS-cog по сравнению с пациентами, получавшими плацебо. В исследовании Wilkinson и соавт. [110] значения по шкале CIBIC-plus также были достоверно лучше в двух группах с донепезилом по сравнению с плацебо. В исследовании Black и соавт. [13] изменения по шкале CIBIC-plus не были однозначными. Достоверный лечебный эффект наблюдался в группе с донепезилом 5 мг, но не в группе с донепезилом 10 мг. Стоит отметить, однако, что группа, получавшая донепезил 10 мг, отличалась от плацебо по другим функциональным исходам, измеренным по шкале клинической оценки деменции с суммированием баллов по отдельным доменам (CDR-SB) и шкале функциональной оценки и изменений болезни Альцгеймера (ADFACS). В открытых исследованиях ривастигмина был выявлен ряд положительных эффектов, и в настоящее время ведется крупное проспективное двойное слепое исследование данного препарата у пациентов с сосудистой деменцией.
Xiao и соавт. [112] исследовали эффективность Церебролизина у пациентов с сосудистой деменцией. Было проведено двойное слепое плацебо-контролируемое исследование, в ходе которого пациентам внутривенно вводили 30 мл/день Церебролизина в течение 5 дней в неделю, длительность лечения составила 4 недели. Первичными конечными точками исследований служили оценки по краткой шкале оценки психического статуса (MMSE) и CGI. В группе с Церебролизином наблюдалось статистически достоверное улучшение по шкале MMSE по сравнению с плацебо-группой спустя 4 недели лечения. По шкале CGI достоверных различий не было. Достоверные различия в пользу Церебролизина были обнаружены также по обоим видам теста на построение маршрута. Достоверные различия между группами по всем другим показателям клинических и функциональных исходов, использованным в исследовании, отсутствовали.
Ряд других соединений также оценили в отношении их потенциальных влияний на когнитивную сферу у пациентов с сосудистой деменцией, подтвержденной формальными диагностическими критериями, или у стабильных пациентов с наличием в анамнезе множественных инфарктов. В целом в этих исследованиях не удалось обнаружить положительные эффекты при проведении первичного анализа, но в ряде случаев апостериорный анализ в отдельных субпопуляциях пациентов выявлял наличие некоторой эффективности. Были опубликованы исследования следующих препаратов: пентоксифиллина — гемореологического средства, используемого для лечения перемежающейся хромоты [12], винпоцетина (этил-аповинкамин) — препарата, который избирательно стимулирует мозговое кровообращение и потребление кислорода, ингибирует агрегацию тромбоцитов и, предположительно, оказывает нейропротективное действие [59], и цитиколина — формы холина (витамин группы В), которая может уменьшать ишемические повреждения ЦНС путем сохранения мембранных фосфолипидов. В виде свободного основания цитиколин продается как диетическая добавка в США и как лекарство в Японии. Натриевая соль цитиколина — форма, используемая в клинических исследованиях, продается в виде препарата в Европе [20, 21].
Наконец, интересные данные из исследования Nyenhuis и соавт. [78] свидетельствуют о том, что статины могут снижать риск развития когнитивных нарушений после инсульта. Авторы исследовали 103 последовательных (взятых подряд) пациента (41 пациент после инсульта с сосудистыми когнитивными нарушениями без деменции и 62 пациента после инсульта без каких-либо когнитивных нарушений). Было выявлено, что тремя наиболее значимыми предикторами когнитивных нарушений являются уровень образования пациентов (когнитивный резерв), наличие заболеваний сердца и гиперхолестеринемия. После поправки на уровень образования только гиперхолестеринемия оставалась в числе значимых факторов. Лечение гиперхолестеринемии, таким образом, способствует снижению риска развития когнитивной дисфункции.
Глава из книги «Clinical neurology of the older adult» (Клиническая неврология пожилого возраста) под редакцией Joseph I. Sirven (Department of Neurology College of Medicine, Neurology Phoenix, Arizona) и Barbara L. Malamut (Institute for Graduate Clinical Psychology Widener University Chester, Pennsylvania)
Перевод к.м.н. А.В. Савустьяненко
1. Aggleton J.P., Mishkin M. Visual recognition impairment following medial thalamic lesions in monkeys // Neuropsychologia. 1983; 21: 189-197.
2. Albers G.W., Goldstein L.B., Hall D. Aptiganel hydrochloride in acute ischemic stroke // J. Am. Med. Assoc. 2001; 286: 2673-2682.
3. Allegri R.F. Attention and neglect: neurological basis, assessment and disorders // Rev. Neurol. 2000; 30: 491-494.
4. Allen G., Buxton R.B., Wong E.C. et al. Attentional activation of the cerebellum independent of motor involvement // Science. 1997; 275: 1940-1943.
5. Andreasen N.C., O’Leary D.S., Arndt S. et al. Neural substrates of facial recognition // J. Neuropsychiatry Clin. Neurosci. 1995; 8: 13: 9-146.
6. Appelros P., Nydevik I., Terent A. Living setting and utilisation of ADL assistance one year after a stroke with special reference to gender differences // Disabil. Rehabil. 2006; 28: 43-49.
7. Appollonio I.M., Grafman J., Schwartz V. et al. Memory in patients with cerebellar degeneration // Neurology. 1993; 43: 1536-1544.
8. Archer C.R., Ilinsky I.A., Goldfader P.R. et al. Aphasia in thalamic stroke: CT stereotactic localization // J. Comput. Assist. Tomogr. 1981; 5: 427-432.
9. Barraguer-Bordas L., Ilia I., Escartin A. et al. Thalamic hemorrhage. A study of 23 patients with diagnosis by computed tomography // Stroke. 1981; 12: 524-527.
10. Benson D.F. Disorders of visual gnosis // Brown J.W., ed. Neuropsychology of visual perception. New York: The IRBN Press; 1989.
11. Benson D.F., Geschwind N. Aphasia and related disorders: a clinical approach // Mesulam M., ed. Principles of behavioral neurology. Philadelphia: FA Davis Co; 1985: 193-238.
12. Black R.S., Barclay L.L., Nolan K.A. et al. Pentoxifylline in cerebrovascular dementia // J. Am. Geriatr. Soc. 1992; 40: 237-244.
13. Black S., Roman G.C., Geldmacher D.S. et al. Efficacy and tolerability of donepezil in vascular dementia: positive results of a 24-week, multicenter, international, randomized, placebo-controlled clinical trial // Stroke. 2003; 34; 2323-2330.
14. Bogousslavsky J., Regli F., Uske A. Thalamic infarcts: clinical syndromes, etiology and prognosis // Neurology. 1988; 38: 837-848.
15. Botez-Marquard T., Leveille J., Botez M.I. Neuropsychological functioning in unilateral cerebellar damage // Can. J. Neurol. Set. 1994; 21: 353-357.
16. Brion S., Mikol J., Plas J. Memoire et specialization fаnctionnelle hemispherique. Rapport anatomo-clinique // Rev. Neurol. 1983; 139: 39-43.
17. Buffon F., Porcher R., Hernandez K. et al. Cognitive profile in CADASIL // J. Neurol. Neurosurg. Psychiatry. 2006; 77: 175-180.
18. Castaigne P., Lhermitte F., Buge A. et al. Paramedian thalamic and midbrain infarcts: clinical and neuropathological study // Ann. Neurol. 1981; 10: 127-148.
19. Chae J., Zorowitz R. Functional status of cortical and subcortical nonhemorrhagic stroke survivors and the effect of lesion laterality // Am. J. Phys. Med. Rehabil. 1998; 77: 415-420.
20. Cohen R.A., Browndyke J.N., Moser D.J. et al. Long-term citicoline (cytidine diphosphate choline) use in patients with vascular dementia: neuroimaging and neuropsychological outcomes // Cerebrovasc. Dis. 2003; 16: 199-204.
21. Conant R., Schauss A.G. Therapeutic applications of citicoline for stroke and cognitive dysfunction in the elderly: a review of the literature // Altern. Med. Rev. 2004; 9: 17-31.
22. Crinion J., Price C.J. Right anterior superior temporal activation predicts auditory sentence comprehension following aphasic stroke // Brain. 2005; 128: 2858-2871.
23. Crosson B. Role of the dominant thalamus in language: a review // Psychol. Bull. 1984; 96: 491-517.
24. Crosson B. Subcortical functions in language: a working model // Brain Lang. 1985; 25: 257-292.
25. Cummings J.L. Frontal-subcortical circuits and human behavior // Arch. Neurol. 1993; 50: 873-880.
26. Cummings J.L., Benson D.F. Dementia: A Clinical Approach. Boston: Butterworth-Heineman; 1983.
27. Damasio A.R. Disorders of complex visual processing: agnosias, achromatopsia, Balint’s syndrome, and related difficulties of orientation and construction // Mesulam M., ed. Principles of behavioral neurology. Philadelphia: FA Davis Co; 1985: 259-288.
28. Damasio A.R. The frontal lobes // Heilman K.M., Valenstein E., eds. Clinical neuropsychology. New York: Oxford University Press; 1985: 339-375.
29. Davis S.M., Lees K.R., Albers G.W. et al. Selfotel in acute ischemic stroke: possible neurotoxic effects of an NMDA antagonist // Stroke. 2000; 31: 347-354.
30. Davous P., Bianco C., Duval-Lota A.M. et al. Aphasie par infarctus thalamique paramedian gauche. Observation anatomo-clinique // Rev. Neurol. 1984; 140: 711-719.
31. Del Ser T., Barba R., Morin M.M. et al. Evolution of cognitive impairment after stroke and risk factors for delayed progression // Stroke. 2005; 36: 2670-2675.
32. De Renzi E. Memory disorders following focal neocortical damage. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 1982; 298: 73-83.
33. De Romanis F., Benfatto B. Presentazione e discussione di quattro casi di prosopagosia // Riv. Neurol. 1973; 43: 111-132.
34. Feigenson J.S., McDowell F.H., Meese P. et al. Factors influencing outcome and length of stay in a stroke rehabilitation unit. Part 1. Analysis of 248 unscreened patients — medical and functional prognostic indicators // Stroke. 1977; 8: 651-656.
35. Fiez J.A., Raichle M.E. Linguistic processing // Int. Rev. Neurobiol. 1997; 41: 233-254.
36. Fisher C.M. Lacunar strokes and infarct: a review // Neurology. 1982; 32: 871-876.
37. Fisher C.M. The pathologic and clinical aspects of thalamic hemorrhage // Trans. Am. Neurol. Assoc. 1959; 84: 56-59.
38. Friedman J.H. Syndrome of diffuse encephalopathy due to nondominant thalamic infarction // Neurology. 1985; 35: 1524-1526.
39. Gamaldo A., Moghekar A., Kilada S. et al. Effect of a clinical stroke on the risk of dementia in a prospective cohort // Neurology. 2006; 67: 1363-1369.
40. Goldman-Rakic P.S. Specification of higher cortical functions // J. Head Trauma Rehabil. 1993; 8: 13-23.
41. Goodglass H. Phonological factors in aphasia // Brookshire R.H., ed. Clinical aphasiology. Minneapolis: BRK Publishers; 1975: 28-44.
42. Graff-Radford N.R., Damasio H., Yamada T. et al. Nonhemorrhagic thalamic infarction. Clinical, neuropsychological, and electrophysiological findings in four anatomical groups defined by computed tomography // Brain. 1985; 108: 485-516.
43. Grafman J., Litvan I., Massaquoi S. et al. Cognitive planning deficit in patients with cerebellar atrophy // Neurology. 1992; 42: 1493-1496.
44. Guberman A., Stuss D. The syndrome of bilateral paramedian thalamic infarction // Neurology. 1983; 33: 540-546.
45. Hachinski V.C., Iliff L.D., Zilhka E. et al. Cerebral blood flow in dementia // Arch. Neurol. 1975; 32: 632-637.
46. Hajek V.E., Gagnon S., Ruderman J.E. Cognitive and functional assessments of stroke patients: an analysis of their relation // Arch. Phys. Med. Rehabil. 1997; 78: 1331-1337.
47. Haley E.C. Jr., Thompson J.L.P., Levin B. et al. Gavestinel does not improve outcome after acute intracerebral hemorrhage: an analyse from the GAIN International and GAIN American studies // Stroke. 2005; 36; 1006-1010.
48. Hartmann J.A., Wolz W.A., Roeltgen D.P. et al. Denial of visual perception // Brain Cogn. 1991; 16: 29-40.
49. Heath R.G., Franklin D.E., Shraberg D. Gross pathology of the cerebellum in patients diagnosed and treated as functional psychiatric disorders // J. Nerv. Ment. Dis. 1979; 167: 585-592.
50. Hier D.B., Cummings J.L. Rare acquired and degenerative subcortical dementias // Cummings J.L., ed. Subcortical dementia. New York: Oxford University Press; 1990: 199-217.
51. Hofgren C., Bjorkdahl A., Esbjornsson E. et al. Recovery after stroke: cognition, ADL function and return to work // Acta Neurol. Scand. 2007; 115: 73-80.
52. Hutter B.O., Gilsbach J.M. Introspective capacities in patients with cognitive deficits after subarachnoid hemorrhage // J. Clin. Exp. Neuropsychol. 1995; 17: 499-517.
53. Ishii N., Nishahara Y., Imamura T. Why do frontal lobe symptoms predominate in vascular dementia with lacunes? // Neurology. 1986; 36: 340-345.
54. Jokinen H., Kalska H., Mantyla R. et al. Cognitive profile of subcortical ischaemic vascular disease // J. Neurol. Neurosurg. Psychiatry. 2006; 77: 28-33.
55. Jones-Gotman M., Milner B. Design fluency: the invention of nonsense drawings after focal cortical lesions // Neuropsychologia. 1977; 15: 653-674.
56. Kanemaru A., Takahashi R., Yamanaka T. et al. Relationship between cognitive function and discharge place among stroke patients after rehabilitation // Nippon Ronen Igakkai Zasshi. 1998; 35: 307-312.
57. Karussis D., Leker R.R., Abramsky O. Cognitive dysfunction following thalamic stroke: a study of 16 cases and review of the literature // J. Neurol. Sci. 2000; 172: 25-29.
58. Katz D.I., Alexander M.P., Mandell A.M. Dementia following strokes in the mesencephalon and diencephalon // Arch. Neurol. 1987; 44: 1127-1133.
59. Kemeny V., Molnar S., Andrejkovics M. et al. Acute and chronic effects of vinpocetine on cerebral hemodynamics and neuropsychological performance in multi-infarct patients // J. Clin. Pharmacol. 2005; 45: 1048-1054.
60. Kolb B, Whishaw I.Q. Fundamentals of Human Neuropsychology. New York: WH Freeman and Company; 1985.
61. Kong K.H., Chua K.S., Tow AP. Clinical characteristics and functional outcome of stroke patients 75 years old and older // Arch. Phys. Med. Rehabil. 1998; 79: 1535-1539.
62. Kwa V.I., Linburg M., de Haan R.J. The role of cognitive impairment in the quality of life after ischaemic stroke // J. Neurol. 1996; 243: 599-604.
63. Ladurner G., Kaivach P., Moessler H. Neuroprotective treatment with cerebrolysin in patients with acute stroke: a randomised controlled trial // J. Neural Transm. 2005; 112: 415-428.
64. Laeng B. Constructional apraxia after left or right unilateral stroke // Neuropsychologia. 2006; 44: 1595-1606.
65. Levisohn L., Cronin-Golomb A., Schmahmann J.D. Neuropsychological sequelae of cerebellar tumors in children // Soc. Neurosci. Abstr. 1997; 23: 496.
66. Lezak M.D. Neuropsychological Assessment. New York: Oxford University Press; 1995.
67. Lopera F. Processing of faces: neurological bases, disorders and evaluation // Rev. Neurol. 2000; 30: 486-490.
68. Luria A.R. Higher Cortical Functions in Man. New York: Basic Books; 1966.
69. Markowitsch H.J. Thalamic mediodorsal nucleus and memory: a critical evaluation of studies in animals and man // Neurosci. Biobehav. Rev. 1982; 6: 351-380.
70. Martin J.J. Thalamic syndromes // Vincken P.J., Bruyn G.W., eds. Handbook of clinical neurology. Vol. 2. Amsterdam: North Holland Press; 1968: 469-496.
71. McGlone J., Young B. Cerebral localization // Baker A.B., ed. Clinical neurology. Philadelphia: Harper & Row; 1986.
72. Mills R.P., Swanson P.D. Vertical oculomotor apraxia and memory loss // Ann. Neurol. 1978; 4: 149-153.
73. Milner B. Effects of different brain lesions on card sorting // Arch. Neurol. 1963; 9: 90-100.
74. Mirsky A.F. The neuropsychology of attention: elements of a complex behavior // Perecman E., ed. Integrating theory and practice in clinical neuropsychology. Hillsdale, NJ: Laurence Erlbaum; 1989.
75. Mishkin M. A memory system in the monkey // Broadbent D.E., Weiskrantz L., eds. The neuropsychiatry of cognitive function. London: The Royal Society; 1982: 85-95.
76. Munoz-Cespedes J.M., Rios-Lago M., Paul N. et al. Functional neuroimaging studies of cognitive recovery after acquired brain damage in adults // Neuropsychol. Rev. 2005; 15: 169-183.
77. National Stroke Association. Be stroke smart (Newsletter). Englewood, CO: National Stroke Association; 1995.
78. Nyenhuis D.L., Gorelick P.B., Geenen E.J. et al. The pattern of neuropsychological deficits in vascular cognitive impairment — no dementia (vascular CIND) // Clin. Neuropsychol. 2004; 18: 41-49.
79. Nys G.M., van Zandvoort M.J., Algra A. et al. Cognitive and functional outcome after intravenous recombinant tissue plasminogen activator treatment in patients with a first symptomatic brain infarct // J. Neurol. 2006; 253: 237-241.
80. Nys G.M., Van Zandvoort M.J., De Kort P.L. et al. Domain-specific cognitive recovery after first-ever stroke: a follow-up study of 111 cases // J. Int. Neuropsychol. Soc. 2005; 11: 795-806.
81. Nys G.M., van Zandvoort M.J., van der Worp H.B. et al. Early cognitive impairment predicts long-term depressive symptoms and quality of life after stroke // J. Neurol. Sci. 2006; 247: 149-156.
82. Pasquini M., Leys D., Rousseaux M. et al. Influence of cognitive impairment on the institutionalisation rate 3 years after a stroke // J. Neurol. Neurosurg. Psychiatry. 2007; 78: 56-59.
83. Pillon B., Bazin B., Deweer B. et al. Specificity of memory deficits after right or left temporal lobectomy // Cortex. 1999; 34: 561-571.
84. Pohjasvaara T., Mantyla R., Aronen H.J. et al. Clinical and radiological determinants of prestroke cognitive decline in a stroke cohort // J. Neurol. Neurosurg. Psychiatry. 1999; 67: 742-748.
85. Poppel E., Held R., Front D. Residual visual function after brain wounds involving the central visual pathways // Nature. 1973; 243: 295-296.
86. Price C.J., Crinion J. The latest on functional imaging studies of aphasic stroke // Curr. Opin. Neurol. 2005; 18: 429-434.
87. Reitz C., Luchsinger J.A., Tang M.X. et al. Stroke and memory performance in elderly persons without dementia // Arch. Neurol. 2006; 63: 571-576.
88. Robinson R.G. The Clinical Neuropsychiatry of Stroke: Cognitive, Behavioral, and Emotional Disorders following Vascular Brain Injury. Cambridge, United Kingdom: Cambridge University Press; 1998.
89. Schmahmann J.D. Disorders of the cerebellum: ataxia, dysmetria of thought, and the cerebellar cognitive affective syndrome // J. Neuropsychiatry Clin. Neurosci. 2004; 16: 367-378.
90. Schmahmann J.D. Rediscovery of an early concept // Int. Rev. Neurobiol. 1997; 41: 3-27.
91. Schmahmann J.D., Sherman J.C. The cerebellar cognitive affective syndrome // Brain. 1998; 121: 561-579.
92. Schuppert M., Munte T.F., Wieringa B.M. et al. Receptive amusia: evidence for cross-hemispheric neural networks underlying music processing strategies // Brain. 2000; 123: 546-549.
93. Semple P.F. An Atlas of Stroke. New York: The Parthenon Publishing Group; 1998.
94. Silveri M.C., Leggio M.G., Molinari M. The cerebellum contributes to linguistic production: a case of agrammatic speech following a right cerebellar lesion // Neurology. 1994; 44: 2047-2050.
95. Sisson R.A. Cognitive status as a predictor of right hemisphere stroke outcomes // J. Neurosci. Nurs. 1995; 27: 152-156.
96. Speedie L.J., Heilman K.M. Amnestic disturbance following infarction of the left dorsomedial nucleus of the thalamus // Neuropsychologia. 1982; 20: 597-604.
97. Strangman G., Goldstein R., Rauch S.L. et al. Near-infrared spectroscopy and imaging for investigating stroke rehabilitation: test-retest reliability and review of the literature // Arch. Phys. Med. Rehabil. 2006; 87: 12-19.
98. Stuss D.T., Benson D.F. Neuropsychological studies of the frontal lobes // Psychol. Bull. 1984; 95: 3-28.
99. Stuss D.T., Benson D.F. The Frontal Lobes. New York: Raven Press; 1986.
100. Stuss D.T., Cummings J.L. Subcortical vascular dementias // Cummings J.L., ed. Subcortical dementia. New York: Oxford University Press; 1990: 145-163.
101. Stuss D.T., Guberman A., Nelson R. et al. The neuropsychology of paramedian thalamic infarcts // Brain Cogn. 1988; 8: 348-378.
102. Sunderland A., Tinson D., Bradley L. Differences in recovery from constructional apraxia after right and left hemisphere stroke? // J. Clin. Exp. Neuropsychol. 1994; 16: 916-920.
103. Swanson R.A., Schmidley J.W. Amnestic syndrome and vertical gaze palsy: early detection of bilateral thalamic infarction by CT and NMR // Stroke. 1985; 16: 823-827.
104. Tatemichi T.K., Desmond D.W., Stern Y. et al. Cognitive impairment after stroke: frequency, patterns, and relationship to functional abilities // J. Neurol. Neurosurg. Psychiatry. 1994; 57: 202-207.
105. Van Asselen M., Kessels R.P., Kappelle L.J. et al. Neural correlates of human way finding in stroke patients // Brain Res. 2006; 1067: 229-238.
106. Van Der Werf Y.D., Weerts J.G., Jolles J. et al. Neuropsychological correlates of a right unilateral lacunar thalamic infarction // J. Neurol. Neurosurg. Psychiatry. 1999; 66: 36-42.
107. Viscoli C.M., Brass L.M., Kernan W.N. et al. Estrogen therapy and risk of cognitive decline-results from the Women’s Estrogen for Stroke Trial (WEST) // Am. J. Obstet. Gynecol. 2005; 192: 387-393.
108. Walsh K. Neuropsychology: A Clinical Approach. 2nd ed. New York: Churchill Livingstone; 1987.
109. Weisberg L.A. Lacunar infarcts. Clinical and computed tomographic correlations // Arch. Neurol. 1982; 39: 37-40.
110. Wilkinson D., Doody R., Helme R. et al. Donepezil in vascular dementia: a randomized, placebo-controlled study // Neurology. 2003; 61: 479-486.
111. Winocur G., Oxbury S., Roberts R. et al. Amnesia in a patient with bilateral lesions to the thalamus // Neuropsychologia. 1984; 22: 123-143.
112. Xiao S., Yan H., Yao P. et al. The efficacy of cerebrolysin in patients with vascular dementia: results of a Chinese multicentre, randomized, double-blind, placebo-controlled trial // Hong Kong J. Psychiatry. 1999; 9: 13-19.
113. Lezak M.D. Neuropsychological Assessment. New York: Oxford University Press, 1995.
114. McCrum R. My Year Off: Rediscovering Life after a Stroke. New York: WW Norton; 1998.
115. Robinson R.G. The Clinical Neuropsychiatry of Stroke: Cognitive, Behavioral, and Emotional Disorders following Vascular Brain Injury. Cambridge, United Kingdom: Cambridge University Press; 1998.