Международный неврологический журнал 2 (40) 2011
Вернуться к номеру
Нейрон-специфическая енолаза в сыворотке крови как диагностический маркер эпилепсии
Авторы: Рахимбаева Г.С., Рашидова Н.С., Кафедра неврологии Ташкентской медицинской академии, Республика Узбекистан
Рубрики: Неврология
Версия для печати
Нейрон-специфическая енолаза (НСЕ) является маркером повреждений мозга при различных патологиях, включая эпилепсию. Использование НСЕ в качестве маркера повреждений мозга при эпилепсии помогло бы повысить точность диагностики и прогнозирования исхода эпилепсии различной этиологии. В данной работе нами проведено клинико-диагностическое обследование пациентов с посттравматической и сосудистой эпилепсией, включающее ЭЭГ и МРТ, а также проведен анализ содержания НСЕ в сыворотке (сНСЕ) крови пациентов после эпилептических припадков. В результате исследования выявлено повышенное содержание НСЕ у больных с судорожным синдромом и обнаружена зависимость содержания сНСЕ от тяжести заболевания, а именно — от частоты припадков. Обнаружена также корреляция между содержанием сНСЕ и возрастом больных. Результаты работы доказывают обоснованность применения сНСЕ в качестве дополнительного диагностического маркера повреждения мозга, вызванного припадками посттравматической и сосудистой эпилепсии.
Эпилепсия, нейрон-специфическая енолаза.
Введение
Эпилепсия на сегодняшний день остается одной из важных медицинских и социальных проблем человечества [1, 2]. Актуальность данной проблемы для медицины и здравоохранения определяется частотой встречаемости эпилепсии, недостаточной эффективностью терапии и как следствие — значительным ограничением жизнедеятельности, инвалидизацией больных и ухудшением качества их жизни [3].
Несмотря на длительный период изучения данной патологии, диагностика эпилепсии затруднена до настоящего времени в связи с отсутствием объективных маркеров заболевания, которые можно было бы обнаружить при лабораторном исследовании. Известно, что в основе эпилепсии лежит постепенная гибель нейронов. При этом отмечается выход нейроспецифических энзимов и их изоферментов из поврежденных клеток мозга во внеклеточную среду, что позволяет при их повышении выяснить глубину и интенсивность структурно-функциональных нарушений биомембран в центральной нервной системе.
В последние годы перспективным направлением в нейроиммунологии стало исследование нейроспецифических белков, в частности нейрон-специфической енолазы (НСЕ), в целях диагностики различных нейродеструктивных заболеваний центральной нервной системы, в том числе и эпилепсии. Из литературных данных [4–6] известно, что НСЕ — один из ферментов гликолиза (2-фосфо-D-глицерато-гидролиаза), существующий в виде нескольких димерных изоферментов (aa, ab, ay, bb и yy), образованных из трех субъединиц — a, b и y. Данный фермент был идентифицирован и изучен в 70–80 гг. ХХ столетия. За этот период накоплен обширный экспериментальный и клинический материал, касающийся анализа НСЕ в биологических жидкостях при различных патологических состояниях. НСЕ является единственным известным в настоящее время общим маркером всех дифференцированных нейронов и относится к внутриклеточным энзимам центральной нервной системы [4].
По одним литературным данным, при заболеваниях, сопряженных с непосредственным вовлечением нервной ткани в патологический процесс, качественные и количественные определения этого белка в сыворотке крови дают ценную информацию о степени выраженности повреждений нейронов и нарушениях общей целостности гематоэнцефалического барьера [7].
По другим сообщениям, ферментативная активность НСЕ бывает более высокой при распространении патологического процесса на оболочки мозга по сравнению с повреждением только паренхимы мозга [8].
Это позволяет считать данный энзим специфическим маркером повреждений нервной системы, в частности при эпилепсии, что и определило актуальность настоящего исследования.
Цель данного исследования — оценка информативности сывороточной НСЕ (сНСЕ) в диагностике у больных с посттравматической и сосудистой эпилепсией.
Материалы и методы исследования
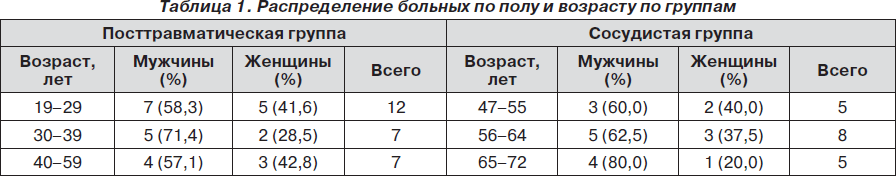
Под наблюдением было 44 больных, находившихся на амбулаторном и стационарном лечении в клинике неврологии Республиканской клинической больницы (РКБ) № 1 г. Ташкента (Республика Узбекистан). Проведен анализ 44 случаев симптоматической эпилепсии, из которых 26 больных (59 %) с посттравматической эпилепсией в возрасте от 19 до 59 лет и 18 больных (40,9 %) с сосудистой эпилепсией в возрасте от 47 до 72 лет (табл. 1). Контрольную группу составили 20 здоровых лиц, не страдающих эпилепсией и не имеющих в анамнезе эпилептические припадки, в возрасте 25–30 лет. Давность заболевания больных с посттравматической эпилепсией составила от 1 года до 15 лет, с сосудистой эпилепсией — от 3 до 10 лет.
Верификация диагноза осуществлялась на основании общепринятой Международной классификации эпилепсий и эпилептических синдромов (ILAE, 1989) [9].
Всем пациентам проводилось необходимое клинико-диагностическое обследование, включающее уточнение анамнестических данных, исследование неврологического статуса, РЭГ- и ЭЭГ-исследование, компьютерную или магнитно-резонансную томографию головного мозга (в Т2-режиме).
Определение содержания нейрон-специфической енолазы в сыворотке крови проводили с помощью Human Neuron Specific Enolase ELISA Kit (Alpha diagnostic, USA) в соответствии с инструкцией производителя. Забор проб крови производился из локтевой вены утром натощак в лаборатории РКБ № 1 при Ташкентской медицинской академии. В последующем осуществлялась сравнительная оценка результатов анализов НСЕ у больных в зависимости от возраста больных и частоты припадков.
Статистическую обработку результатов проводили с использованием параметрического t-критерия Стьюдента. Данные представлены как среднее значение ± SE.
Результаты и обсуждение
Больные I группы с посттравматической эпилепсией (26 больных (59 %)) были разделены на 3 подгруппы в зависимости от частоты приступов: 1-ю подгруппу составили 6 больных (23 %) с частотой приступов 7–9 раз в месяц, из них 4 мужчин (66,6 %) и 2 женщины (33,4 %); 2-ю подгруппу составили 9 больных (34,6 %), частота приступов — 4–6 раз в месяц, из них 5 мужчин (55,5 %) и 4 женщины (44,5 %); 3-ю подгруппу — 11 больных (42,3 %) с частотой приступов от 1 до 3 раз в месяц, из них 7 мужчин (63,6 %) и 4 женщины (45,4 %). Возраст больных посттравматической группы варьировал от 19 до 59 лет.
Больные II группы с сосудистой эпилепсией (18 больных (40,9 %)) также были разделены на 3 подгруппы с аналогичной частотой приступов: 1-я подгруппа — 5 больных (27,7 %), из них 3 мужчин (60 %) и 2 женщины (40 %); 2-я подгруппа — 9 больных (50 %), из них 6 мужчин (66,6 %) и 3 женщины (33,4 %); 3-я подгруппа — 4 больных (22,2 %) с эпилепсией сосудистого генеза, из них 3 мужчин (75 %) и 1 женщина (25 %). Возраст больных с сосудистой эпилепсией варьировал от 46 до 72 лет.
В неврологическом статусе у пациентов первой группы отмечались недостаточность 7-й и 12-й пар черепно-мозговых нервов, повышение сухожильных рефлексов преимущественно нижних конечностей, появление патологических знаков и дискоординаторных нарушений. Кроме того, были выявлены, особенно у этой категории больных, нарушения памяти, внимания и изменения в психоэмоциональной сфере.
При электроэнцефалографическом исследовании больных I группы были обнаружены нарушения функционального состояния головного мозга различной степени выраженности: острые волны или пик-волновые комплексы, преимущественно теменно-височной локализации, замедление альфа-ритма, диффузные тета-волны, превышающие определенный критериальный уровень, разряды билатерально-синхронных высокоамплитудных тета-волн.
МРТ головного мозга больных с посттравматической эпилепсией характеризовались наличием множественных кист, участков кальцинации, церебральной атрофией с расширением желудочковой системы и корковых борозд (89,9 %).
Исследование сНСЕ у больных в I группе коррелировало c возрастом больных и частотой приступов.
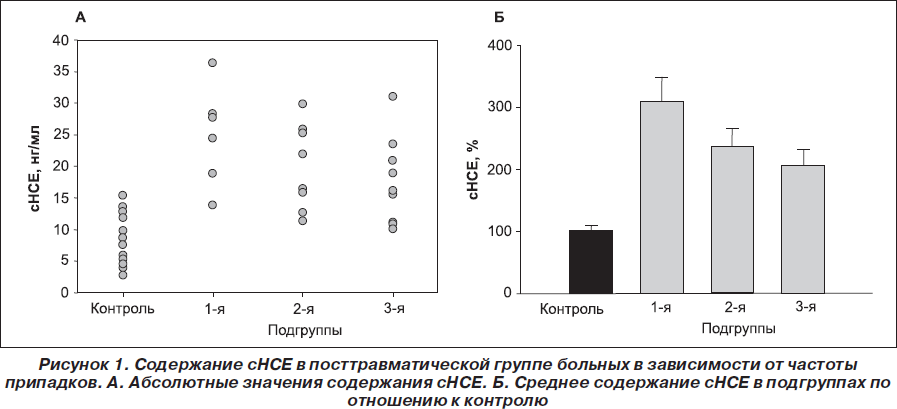
Повышение НСЕ в сыворотке крови больных I группы отмечено по подгруппам: в 1-й подгруппе обнаружено значительное увеличение уровня сНСЕ после припадков у 5 больных (83,3 %), содержание — 24,9 ± 3,2 нг/мл. Во 2-й подгруппе повышение сНСЕ было обнаружено у 6 больных (66,6 %), среднее значение концентрации — 19,1 ± 2,3 нг/мл. В 3-й подгруппе у 6 больных (54,5 %) отмечалось повышение сНСЕ, концентрация сНСЕ в этой подгруппе — 16,8 ± 2,0 нг/мл (рис. 1). Колебание уровня сНСЕ у больных в группе было в пределах от 9,8 до 36,4 нг/мл в зависимости от частоты приступов. Чаще повышенный уровень сНСЕ наблюдался у пациентов 1-й подгруппы, у которых частота приступов самая высокая.
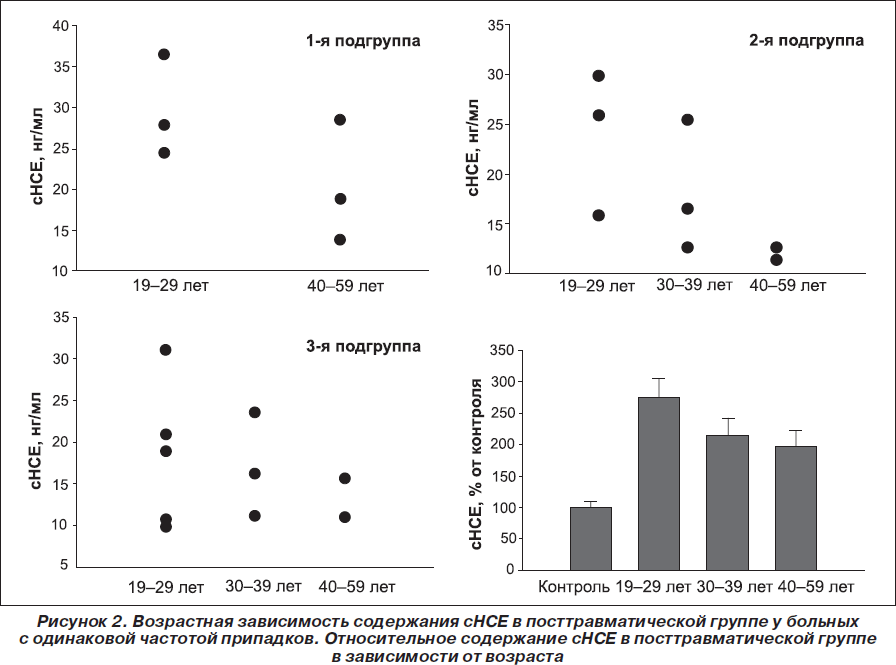
Для выявления возрастной зависимости нейронального повреждения, вызванного эпилептическими припадками, нами был проведен сравнительный анализ содержания сНСЕ у пациентов различных возрастных групп: 19–29 лет, 30–39 лет, 40–59 лет. Полученные результаты свидетельствуют об относительно более высоком содержании сНСЕ после припадков у молодых пациентов по отношению к более старшим и, следовательно, о более серьезных повреждениях мозга у пациентов молодого возраста: 22,3 ± 2,4 нг/мл, 17,3 ± 2,0 нг/мл и 15,9 ± 2,3 нг/мл у пациентов 19–29, 30–39 и 40–59 лет соответственно (рис. 2).
У больных II группы в неврологическом статусе отмечалась рассеянная органическая микросимптоматика с характерной асимметрией черепно-мозговой иннервации, выражающаяся ослаблением конвергенции и зрачковых реакций, асимметрией носогубных складок и девиацией языка. Также у больных II группы обнаружены нарушения статики и координации, асимметрия сухожильных рефлексов и расстройства чувствительности. Помимо вышеописанных симптомов установлена псевдобульбарная симптоматика.
На РЭГ у больных II группы (77,7 %) отмечались: снижение объемного кровенаполнения церебральных сосудов, повышение сосудистого тонуса и периферического сосудистого сопротивления, затруднение венозного оттока в бассейне средней мозговой артерии.
При ЭЭГ-исследовании у больных II группы доминировала альфа-активность, представленная наличием альфа-волн, умеренно дезорганизованная активность, а также регистрировались низкоамплитудные медленноволновые комплексы.
На МРТ головного мозга у больных II группы отмечены признаки расширения боковых и ІІІ желудочков, признаки сосудистой энцефалопатии (73,8 %), атрофии мозговой ткани с расширением субарахноидальных пространств (26,2 %).
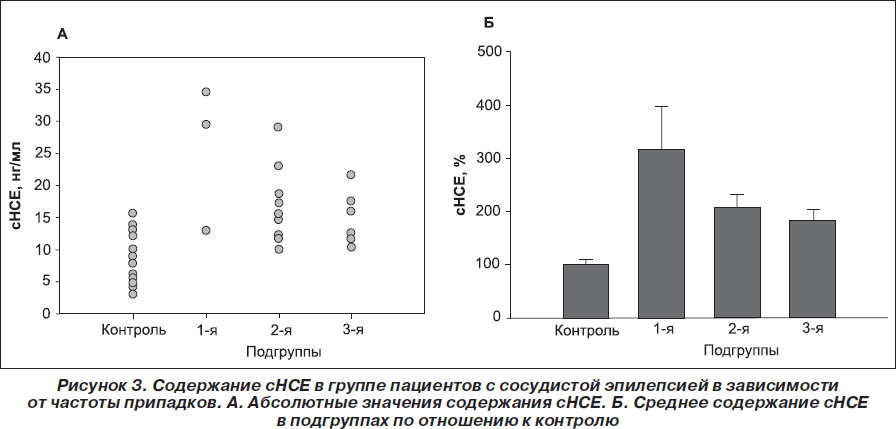
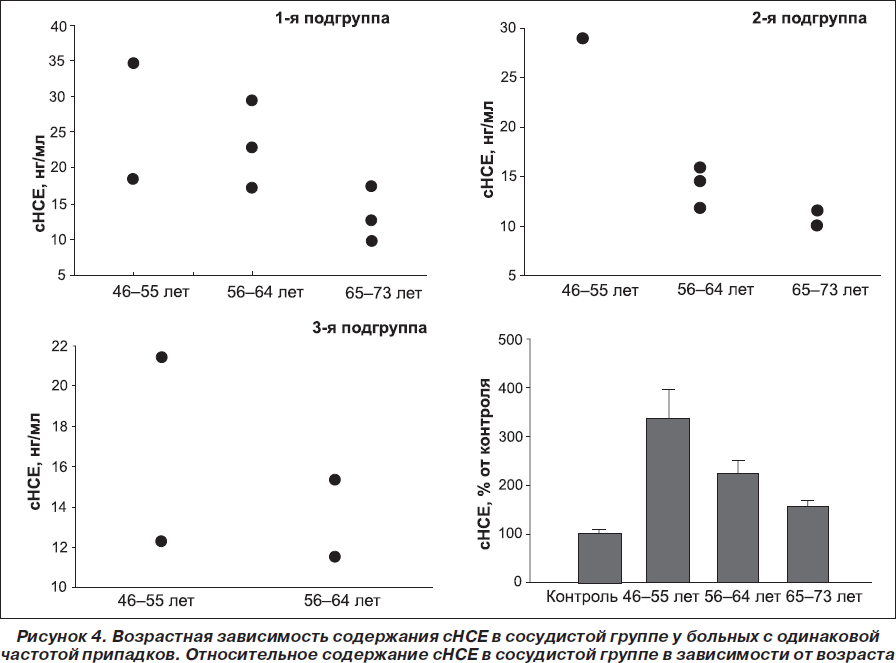
Был проведен сравнительный анализ содержания сНСЕ у больных II группы по подгруппам: повышенное содержание сНСЕ было обнаружено у 3 (60 %) больных 1-й подгруппы, у 6 (66,6 %) больных 2-й подгруппы, 2 (50 %) больных 3-й подгруппы. Колебание уровня сНСЕ в данной группе больных составляло от 9,7 до 34,5 нг /мл в зависимости от частоты приступов. Содержание сНСЕ во II группе составило 25,5 ± 6,2 нг/мл, 16,7 ± 2,0 нг/мл и 14,7 ± 1,8 нг/мл в 1-й, 2-й и 3-й подгруппах соответственно (рис. 3).
Определение сНСЕ в зависимости от возраста больных II группы распределялось по следующим возрастным критериям: 47–55 лет, 56–64 года, 65–73 года. Результаты исследований показали, что наибольшее повышение сНСЕ отмечается у больных в возрасте 47–55 лет по сравнению с более старшими возрастными категориями, а именно: 27,3 ± 4,7 нг/мл, 18,1 ± 2,1 нг/мл и 12,6 ± 1,1 нг/мл в возрастных категориях 47–55 лет, 56–64 года, 65–73 года соответственно (рис. 4).
В контрольной группе повышение уровня НСЕ зарегистрировано только в одном случае (5 %), содержание сНСЕ составило 8,09 ± 0,90 нг/мл. Содержание сНСЕ в контрольной группе варьировало от 2,9 нг/мл до 13,6 нг/мл, в одном случае содержание сНСЕ оказалось выше нормы и составило 15,4 нг/мл. Среднее значение концентрации сНСЕ в контроле 8,09 ± 0,90 нг/мл.
На основании полученных данных можно заключить, что повышенный уровень НСЕ отмечается у 65,3 % больных с посттравматической эпилепсией; увеличенное содержание сНСЕ чаще встречалось у больных с относительно высокой частотой приступов, что вызывает более серьезные повреждения головного мозга. У пациентов I группы обнаружена тенденция к снижению уровня сНСЕ у пациентов старших возрастных групп по отношению к более молодым при одинаковой частоте припадков, что свидетельствует о более серьезных повреждениях мозга у пациентов сравнительно молодого возраста. Причина этому в настоящий момент полностью не ясна. Возможно, в период между травматическим повреждением мозга и дебютом эпилептических припадков происходит патофизиологический процесс структурной реорганизации нейрональной сети, клетки мозга образуют новые синапсы и аксоны [10, 11], что может приводить к повышению возбудимости участков мозга, непосредственно не пострадавших от травмы [12], то есть к расширению очага гипервозбудимости и, следовательно, к большим повреждениям нервной ткани, вызванным эпилептическими припадками [13]. Очевидно, что процесс нейропластичности наиболее интенсивен в молодом мозге и несколько замедляется с возрастом, что в случае данной патологии может препятствовать расширению участков мозга, подверженных эпилептическому повреждению [14]. Предположительной причиной данной тенденции могут быть также количественные или определенные функциональные различия в тормозных синапсах (или нейронах), основной ролью которых является защита нейронов от гипервозбудимости [15]. Исследование данного вопроса требует дальнейшего детального подхода в изучении.
В группе пациентов с сосудистой эпилепсией проводился аналогичный сравнительный анализ по возрасту больных, где был отмечен наиболее высокий уровень сНСЕ у больных сосудистой группы первой возрастной категории 47–55 лет. Возможно, что различная возрастная зависимость содержания енолазы при посттравматической и сосудистой эпилепсии объясняется различной этиологией заболеваний и в случае сосудистой эпилепсии определяется специфическим для данного заболевания функционированием сосудов гематоэнцефалического барьера.
Таким образом, анализ сНСЕ может использоваться в качестве одного из дополнительных методов диагностики при симптоматической эпилепсии различной этиологии.
Выводы
1. Анализ сывороточной НСЕ у больных с симптоматической эпилепсией является информативным диагностическим критерием оценки нейронального повреждения головного мозга.
2. Сравнительный анализ содержания сНСЕ после припадков, вызванных посттравматической и сосудистой эпилепсией, показал относительно повышенный уровень НСЕ при посттравматической эпилепсии по сравнению с сосудистой формой заболевания.
3. Наиболее высокое содержание сНСЕ наблюдается у больных с относительно высокой частотой припадков.
4. При одинаковой частоте припадков содержание сНСЕ при посттравматической эпилепсии у пациентов старших возрастных групп в среднем сравнительно ниже, чем у молодых, хотя и повышено по отношению к контрольной группе.
5. Анализ сывороточной сНСЕ у больных сосудистой группы выше в первой возрастной категории, чем у больных относительно старших возрастных категорий.
1. Вилков Г.А., Нестеренко Э.Н., Колмакова Т.С. и др. // Журн. неврол. и психиатрии им. С.С. Корсакова. — 1994. — Т. 94, № 4. — С. 6-9.
2. Карлов В.А. Судорожный эпилептический статус. — М.: МЕДпрессинфо, 2003. — 160 с.
3. Карлов В.А. Эпилепсия. — М., 1990.
4. Persson L., Hardemark H.G., Gustafsson J., Rundstrom G., Mendel-Hartvig I., Esscher T. S-100 protein and neuron-specific enolase in cerebrospinal fluid and serum: markers of cell damage in human central nervous system // Stroke. — 1987. — 18. — 911-918.
5. Royds J.A., Timperley W.R., Taylor C.B. Levels of enolase and other enzymes in the cerebrospinal fluid as indices of pathologic change // J. Neurol. Neurosurg. Psychiatry. — 1988. — 19. — 1140-4.
6. Royds J.A., Aelwyn G., Davies-Jones B., Lewtas N.A., Timperley W.R., Taylor C.B. Enolase isoenzymes in the cerebrospinal fluid of patients with diseases of the nervous system // J. Neurol. Neurosurg. Psychiatry. — 1983. — 46. — 1031-6.
7. Garga N., Lowenstein D.H. Posttraumatic epilepsy: A major problem in desperate need of major advances // Epilepsy Currents. — 2006. — 6(1). — 1-5.
8. DeGeorgio C.M., Correale J.D., Gott P.S. et al. Serum neuronspecific enolase in human status epilepticus // Neurology. — 1995. — 45. — 1134-7.
9. Commission of ILAE, 1989 Commission on Classification and Terminology of the International League Against Epilepsy, Proposal for revised classification of epilepsies and epileptic syndromes // Epilepsia. — 1989. — 30. — Рp. 389-399.
10. Rabinowicz A.L., Correale J., Boutros R.B., Couldwell W.T., Henderson C.W., and DeGiorgio C.M. Neuron-Specific Enolase Is Increased after Single Seizures during Inpatient Video/EEG Monitoring // Epilepsia. — 1996. — 37(2). — 122-125.
11. Woertgen C., Rothoerl R.D., and Brawanski A. Neuron-Specific Enolase Serum Levels After Controlled Cortical Impact Injury in the Rat // Journal of Neurotrauma. — 2001. — 18(5). — 569-574.
12. Carney D.N., Marangos D.J., Ihde D.C. et al. Serum neuronspecific enolase: a marker for disease extent and response to therapy of small cell lung cancer // Lancet. — 1982. — 1. — 583-5.
13. Ariyoshi Y., Kato K., Ishiguro Y. et al. Evaluation of serum neuron — specific enolase as a tumor marker far carcinoma of the lung // Gann. — 1983. — 74. — 219-25.
14. Mani J., Barry E. Posttraumatic epilepsy // The Treatment of Epilepsy: Principles and Practice / Е. Wyllie, А. Gupta, D.K. Lachhwani. — Hagerstown, MD: Lippincott Williams & Wilkins, 2006. — Р. 521-524.
15. Iudice A., Murri L. Pharmacological prophylaxis of post-traumatic epilepsy // Drugs. — 2000. — 59(5). — 1091-1019.