Журнал «» 2(16) 2011
Вернуться к номеру
Ультрасонографія в діагностиці гіпертонічної ангіопатії магістральних артерій голови і шиї та прогнозуванні ризику церебральної ішемії
Авторы: Глоба М.В., Костюк М.Р., ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України», м. Київ
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
За результатами комплексного клініко-інструментального обстеження у 152 хворих на артеріальну гіпертензію встановлені ультрасонографічні еквіваленти гіпертонічної ангіопатії магістральних артерій голови і шиї. Структурні зміни у вигляді деформацій сонних, хребтових артерій та супутніх гемодинамічно значущих атеросклеротичних стенозів супроводжувалися локальними та системними порушеннями мозкового кровоплину. Ці дані враховувалися при визначенні показань до хірургічного лікування з метою профілактики ішемічного інсульту і для запобігання розвитку хронічної недостатності мозкового кровообігу.
Магістральні артерії голови і шиї, гіпертонічна ангіопатія, ультрасонографія, порушення мозкового кровообігу.
Вступ
Згідно з сучасним уявленням, термін «гіпертонічна ангіопатія головного мозку» об’єднує комплекс деструктивних, репаративних та адаптивних процесів в судинах, який розвивається при артеріальній гіпертензії (АГ). Патологічні зміни, що формуються на всіх трьох структурно-функціональних рівнях судинної системи мозку (інтрацеребральному, екстрацеребральному, екстракраніальному), призводять до перебудови м’язових та еластичних елементів судинної стінки, перекалібрування просвіту артерій, формування деформацій магістральних артерій голови і шиї (МАГШ) [1–3]. Набуті деформації розцінюють як адаптивні механізми підтримки церебральної гемоперфузії на достатньому рівні, однак з часом вони можуть трансформуватись у перегини з утворенням септальних стенозів, які вже розглядаються як фактор ризику ішемічних порушень мозкового кровообігу (ПМК). Ймовірність розвитку ішемічного інсульту підвищується при поєднанні гіпертонічного та атеросклеротичного ураження МАГШ.
Структурні зміни в стінці судини на різних стадіях гіпертонічної ангіопатії (ГА) мають ряд ультразвукових еквівалентів [4–6]. У хворих з тривалістю захворювання понад 5 років при тяжкому клінічному перебігу АГ реєструється підвищення ехогенності комплексу інтима-медіа загальних сонних артерій та втрата диференціювання його на шари. Результатом сукупного впливу АГ, атеросклерозу та вікових змін є потовщення комплексу інтима-медіа до 1,09–1,18 мм, за нормою до 1,0 мм. Водночас відбувається збільшення діаметрів сонних артерій, що є наслідком включення компенсаторних механізмів, спрямованих на забезпечення адекватного кровопостачання мозкової тканини. Методика ультрасонографії (УС) дозволяє об’єктивізувати наявність атеросклеротичного ураження сонних і хребтових артерій, визначати структурні особливості бляшки (розміри, щільність, характер поверхні та ін.), які дозволяють прогнозувати ризик розвитку ішемічного інсульту. Дані моделей пропорційного ризику Кокса (серед 2181 чоловіків при середньому терміні спостереження 4 роки) свідчать, що потовщення інтима-медіа пов’язане з підвищенням ризику інсульту в 1,4 раза, наявність дрібних бляшок підвищувала ризик в 2,2 раза, великих бляшок — в 4,7 раза [6]. За допомогою УС вірогідно можуть бути виявлені деформації екстракраніальних відділів брахіоцефальних артерій та початкових сегментів базальних артерій мозку, що є найбільш раннім та характерним проявом ГА. За даними дослідження В.Г. Лелюк, С.Э. Лелюк (2004), деформації сонних та хребтових артерій виявлено у 93 % хворих на артеріальну гіпертензію та лише у 8 % хворих, в яких немає цього захворювання.
Цінністю УС-діагностики є унікальна можливість поєднання оцінки структурних уражень та гемодинамічних змін кровоплину як у зоні деформації та стенозування, так і дистально від зони ураження із можливістю спостереження в динаміці. Суттєве прогностичне значення має визначення стану природних шляхів колатерального кровопостачання мозку, а також оцінка цереброваскулярної реактивності за допомогою транскраніальної допплерографії. Комплекс морфофункціональних змін, що виявляються за допомогою ультрасонографії при ГА МАГШ, дозволяє вчасно спланувати адекватне лікування з метою профілактики ішемічного інсульту.
Мета дослідження — встановити діагностичне та прогностичне значення УС-критеріїв ГА у хворих на артеріальну гіпертензію.
Матеріал та методи дослідження
Проаналізовані результати обстеження 152 хворих на артеріальну гіпертензію ІІ–ІІІ стадії та з клінічними проявами ПМК за ішемічним типом віком від 44 до 69 років (середній вік — 52,8 ± 1,5 року, жінок — 58, чоловіків — 94), які перебували на лікуванні у відділенні судинної нейрохірургії інституту в 2005–2009 роках. Діагностичний комплекс досліджень включав клінічні методи обстеження, комп’ютерну або магнітно-резонансну томографію головного мозку, селективну церебральну ангіографію і УС-обстеження. Останнє складалося з ультразвукового дуплексного сканування брахіоцефальних артерій та транскраніального дуплексного сканування мозкових судин (Sonoline G-50, Німеччина).
Результати та їх обговорення
За результатами проведеного обстеження в усіх хворих були виявлені УС-ознаки ГА, зокрема деформації МАГШ — у 139 (91,4 %) хворих, комбіновані атеросклеротичні та гіпертонічні ураження — у 98 (64,4 %) хворих. Пацієнтів під час спостереження розподілено на дві групи: в 1-шу групу включені 54 хворих з ознаками ГА МАГШ, у 2-гу групу — 98 хворих із комбінованими гіпертонічними та атеросклеротичними ураженнями. Аналіз клінічних проявів свідчив про наявність у хворих хронічних форм ПМК, що проявлялись стабільною або прогресуючою неврологічною симптоматикою в одному або в суміжних басейнах кровопостачання. Встановлено, що клінічні прояви характеризувалися дисциркуляторною енцефалопатією в 1-й групі у 16 (29,6 %) хворих, у 2-й групі — у 29 (29,5 %); транзиторним ішемічним нападом в 1-й групі у 26 (48,1 %) хворих, у 2-й групі — у 26 (26,5 %); наслідками перенесеного інсульту, частота яких була більшою в 2-й групі — у 43 хворих (43,8 %) порівняно з 1-ю групою — 12 (22,2 %). Повторні ішемічні розлади також частіше зафіксовані в 2-й групі (у 17 хворих — 17,3 %), ніж у 1-й (у 3 — 5,5 %).
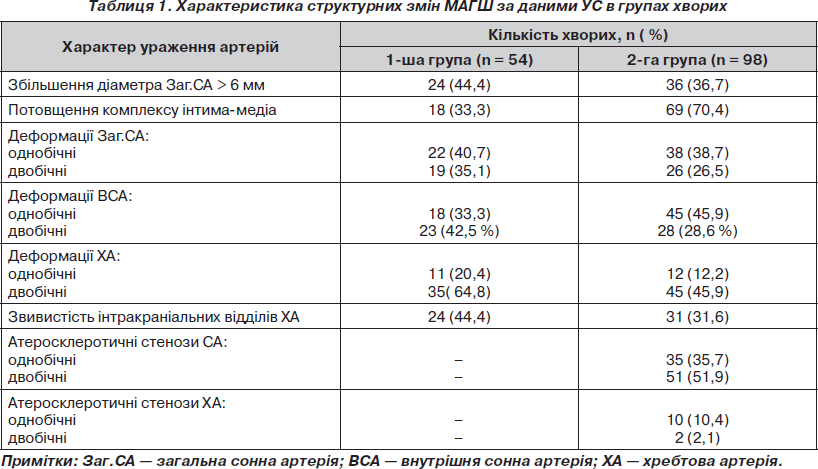
Аналіз УС-обстеження свідчить, що у всіх хворих виявлені зміни, які відповідають ультразвуковим еквівалентам ГА МАГШ, а саме: зміни ехоструктури та зниження пульсації судинної стінки, збільшення діаметрів сонних артерій, деформації анатомічного ходу сонних та хребтових артерій, а також звивистості початкових сегментів базальних артерій мозку. Деформації локалізувалися над гирлом внутрішньої сонної артерії, перед входом внутрішньої сонної артерії у порожнину черепа, в початковому сегменті хребтової артерії та в її канальному відділі. Переважав C- та S-подібний тип деформацій (за J. Wiebel, W. Fields), що було діагностовано у 64 % спостережень. У хворих із комбінованими гіпертонічними та атеросклеротичними ураженнями виявлені ендовазальні утворення в сонних артеріях у вигляді атеросклеротичних бляшок, які локалізувалися найчастіше в зоні біфуркації загальної сонної артерії або переходили в гирло внутрішньої сонної артерії, мали різну ехогенність, здебільшого гетерогенну структуру та спричиняли різний ступінь стенозування просвіту артерії. Морфологічні зміни, що притаманні ГА, мали системний і множинний характер проявів в обох групах хворих. Патологія однієї магістральної артерії визначена в 26 % спостережень, двох артерій — в 34 %, трьох — в 38 %, а усіх чотирьох судин — в 2 % спостережень (табл. 1).
При порівнянні результатів УС та ангіографічного дослідження встановлено високу інформативність ультразвукового методу щодо виявлення деформацій екстракраніальних відділів МАГШ, його чутливість становила 94 %. Проте особливості типу деформацій краще виявляли за допомогою селективної церебральної ангіографії. Покращити якість виявлення деформацій важкодоступних сегментів сонних та хребтових артерій вдавалося за допомогою додаткового до звичайної методики застосування конвексного випромінювача з частотою сканування 5 МГц. Чутливість УС у діагностиці ендовазальних стенозів екстракраніальних відділів МАГШ будь-якого ступеня становила 96 % порівняно з ангіографією. УС-діагностика стенозів інтракраніальних відділів була можливою лише при їх гемодинамічно значущих ступенях звуження (понад 50 % просвіту), чутливість методики у цих випадках досягала лише 80 %.
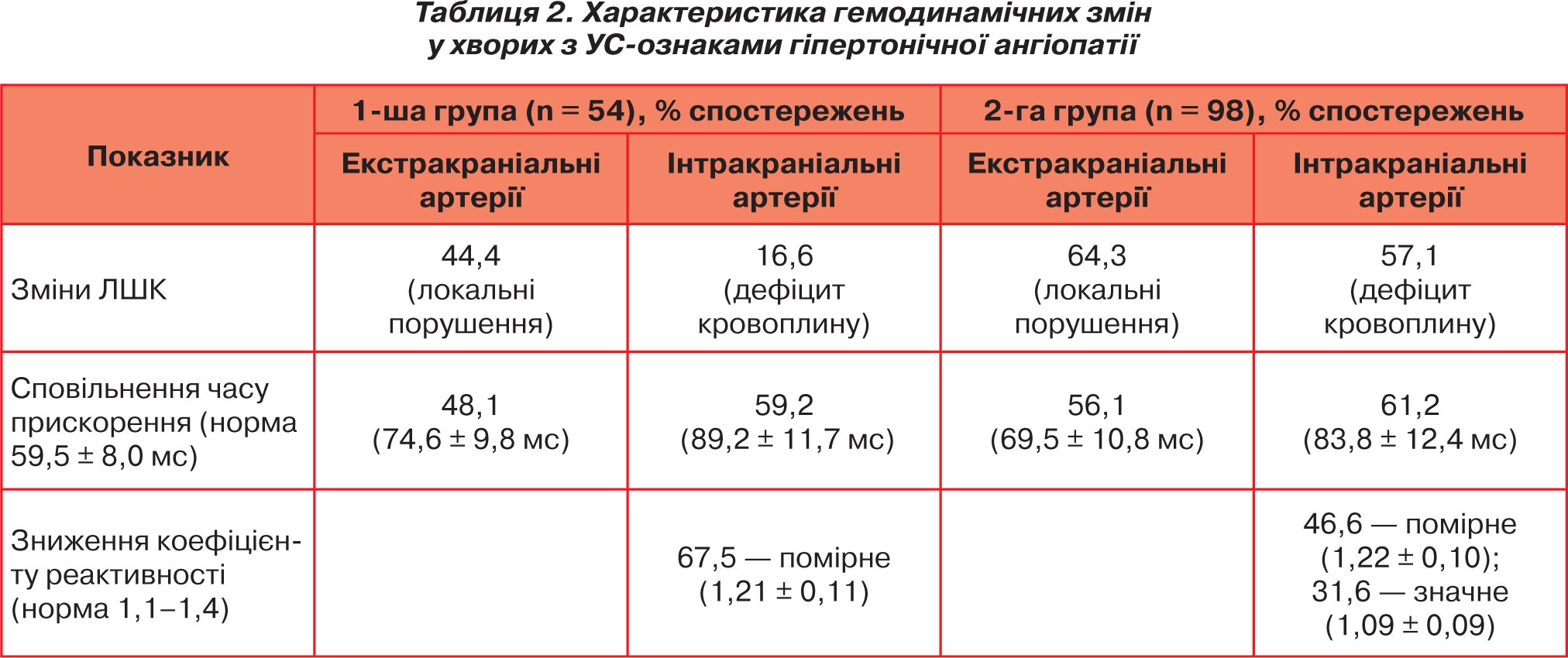
Локальні якісні та кількісні зміни допплерівського спектра виявлено у 24 (44,4 %) хворих 1-ї групи: спостерігалося підвищення лінійної швидкості кровотоку (ЛШК) у зоні деформації з формуванням гемодинамічного перепаду, турбулентність кровоплину, зміни індексів резистивності (рис. 1, 2). Дистальний гемодинамічний дефіцит виявлено лише у 9 (16,6 %) хворих. У системі каротидного басейну він проявлявся асиметрією ЛШК в інтракраніальних відділах внутрішніх сонних артерій та їх очних та/або надблокових гілках понад 30 %, асиметрією в середніх мозкових артеріях понад 15 %. У системі вертебробазилярного басейну дистальний гемодинамічний дефіцит проявлявся зниженням ЛШК на боці ураження, відсутністю фізіологічної реакції кровотоку при ротаційних пробах. Загальні зміни спектрограми у хворих з ознаками ГА відзначалися підвищенням показника часу прискорення, що характеризує швидкість поширення пульсової хвилі, і розширенням систолічного піка. Спостерігалося сповільнення часу прискорення до 74,6 ± 9,8 мс в екстракраніальних відділах (середній нормативний показник для загальної сонної артерії — 59,5 ± 8,0 мс, для хребтової артерії — 58,7 ± 10,0 мс) та до 89,2 ± 11,7 мс в інтракраніальних сегментах. Показники цереброваскулярної реактивності були несуттєво знижені у 35 (67,5 %) хворих 1-ї групи: при проведенні гіперкапнічних тестів середній коефіцієнт реактивності в цій групі становив 1,21 ± 0,11 (нормативні межі — 1,1–1,4).
У 2-й групі хворих з комбінованими гіпертонічними та атеросклеротичними ураженнями локальні якісні та кількісні зміни допплерівського спектра виявлено у 63 (64,3 %) хворих у зонах гемодинамічно значущого стенозування — понад 50 % діаметра судини (рис. 3). Дистальний гемодинамічний дефіцит у басейні кровопостачання ураженої артерії реєструвався у 56 (57,1 %) хворих, переважно при наявності високого ступеня стенозу або при оклюзії магістральної артерії, а також при множинних ураженнях МАГШ. У хворих із гемодинамічно значущим ураженням двох або трьох магістральних артерій мало місце значне напруження механізмів колатеральної компенсації кровообігу. Вірогідне зниження показників цереброваскулярної реактивності в басейні ураженої артерії відзначено у випадках стенозування понад 70 % за діаметром судини, при проведенні гіперкапнічних тестів коефіцієнт реактивності становив 1,09 ± 0,09. У хворих 2-ї групи також реєструвалося сповільнення часу прискорення до 69,5 ± 10,8 мс в екстракраніальних відділах та до 83,8 ± 12,4 мс в інтракраніальних сегментах.
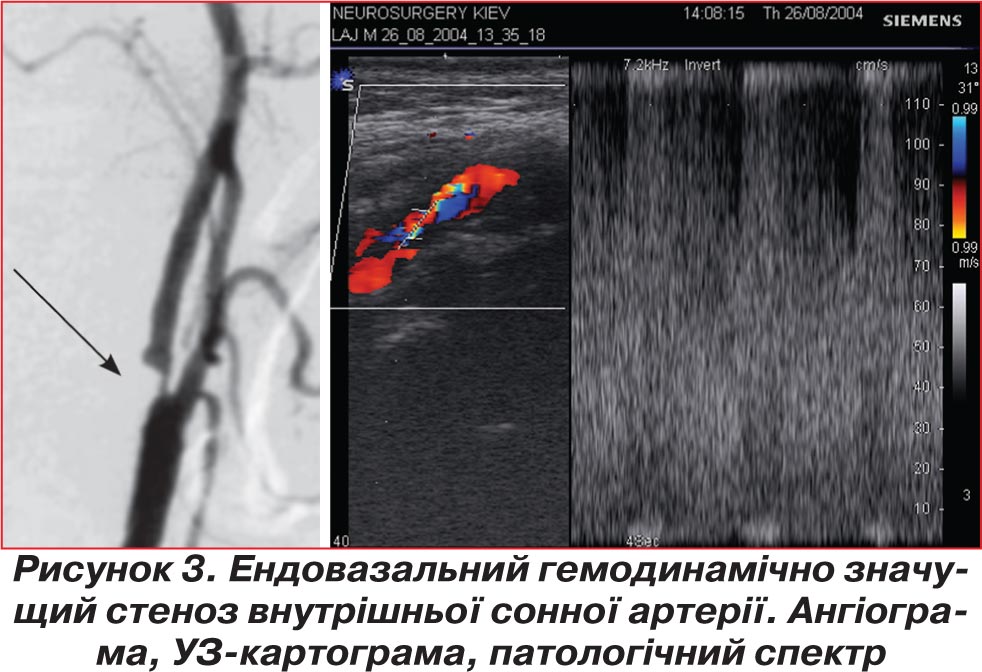
Отримані результати дозволили визначити ультрасонографічні критерії значущості уражень МАГШ, що враховувалися при встановленні показань до хірургічного лікування хворих на ГА:
— наявність локального гемодинамічного перепаду в зоні ураження (патологічне підвищення ЛШК із наступним її падінням, відповідно в цих ділянках — підвищення та зниження індексів пульсації);
— ознаки колатералізації кровоплину дистально від зони ураження (зміни допплерівського спектра, зниження індексу пульсації);
— наявність системного гемодинамічного дефіциту у відповідному басейні кровопостачання (асиметрія ЛШК > 15 % по середніх мозкових артеріях, > 30 % в інтракраніальних ділянках хребтових артерій);
— наявність атеросклеротичного стенозу артерії > 70 %, наявність симптомної гіпоехогенної («м’якої») бляшки, а також симптомної бляшки з виразками при помірному ступені звуження артерії (40–70 %).
Хірургічне лікування проведене 106 хворим: усунення деформацій анатомічного ходу — 8 операцій, каротидна ендартеректомія — 7 операцій. Ураховуючи множинний характер оклюзійно-стенотичних уражень з верифікованою недостатністю колатерального кровообігу та обтяжливість супутніх соматичних уражень, 91 хворому проведено ендоваскулярні втручання — ангіопластика та стентування внутрішньої сонної (78 спостережень) та хребтової (13 спостережень) артерій.
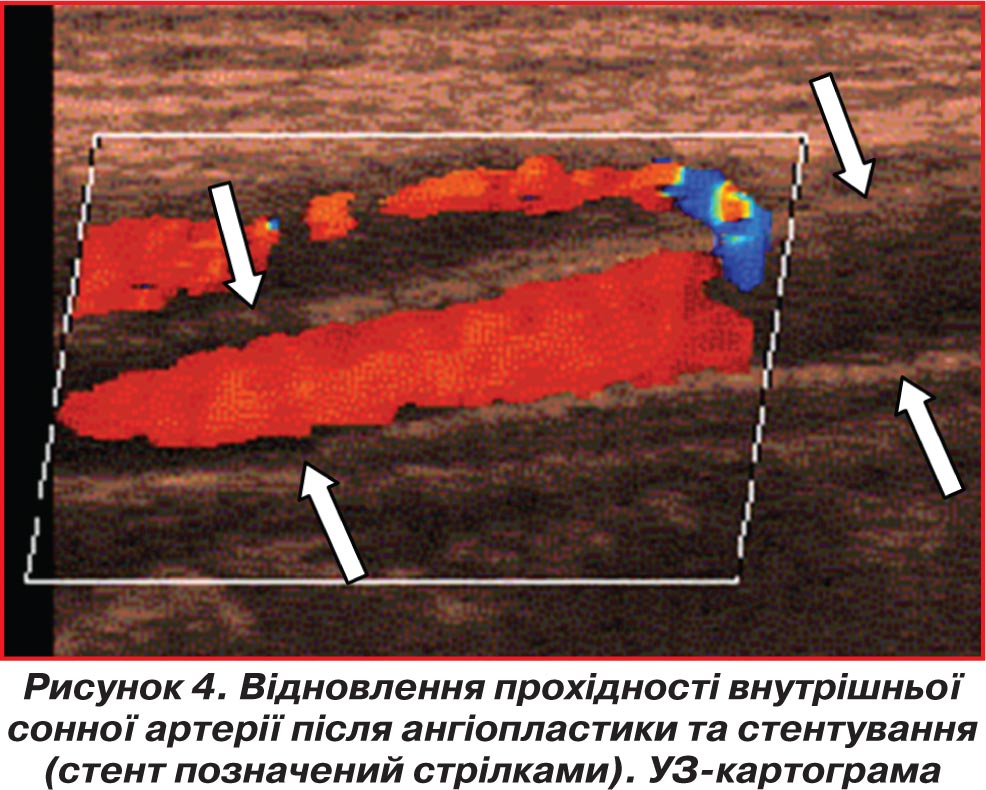
Контрольна УС у післяопераційному періоді свідчила про усунення локальних порушень кровоплину та наростання показників ЛШК у відповідному басейні кровопостачання після хірургічної корекції (рис. 4). Крім цього, реєструвалася повна або часткова нормалізація кровоплину в артеріях суміжних басейнів кровопостачання, включених у колатеральну компенсацію, нівелюєщо явища обкрадання в суміжних зонах кровообігу. У 8 випадках (3 — після каротидної ендартеректомії, 5 — після стентування сонних артерій) зареєстровані явища перманентної гіперперфузії в басейні оперованої артерії. В одному випадку інтраопераційно розвинулися тромбоемболічні ускладнення. При проведенні УС-контролю через 3 місяці після операції всі хворі мали стабільні показники кровоплину в зоні оперативної корекції судинного ураження; ми спостерігали покращення (57 % оперованих хворих) або стабільність (43 %) показників ЛШК у мозкових артеріях.
Висновки
1. Патологічні зміни судинної системи у хворих на артеріальну гіпертензію формуються в гіпертонічну ангіопатію з характерними структурними змінами в судинній стінці і деформаціями анатомічного ходу МАГШ, що, як правило, поєднуються з атеросклеротичними ураженнями.
2. Ультрасонографія надає можливість здійснити вазотопічну діагностику ураження та оцінити його гемодинамічну значущість, що при множинному характері оклюзійно-стенотичного ураження дозволяє визначити артеріальний басейн із домінуючим дефіцитом кровопостачання.
3. Ультрасонографічними критеріями ризику порушень мозкового кровообігу є наявність гемодинамічно значущого ураження з ознаками дистального дефіциту кровоплину у відповідному басейні кровопостачання, а також виявлення потенційно ембологенного стенотичного ураження стінки магістральній артерії у вигляді атеросклеротичної бляшки.
1. Шулутко Б.И. Артериальная гипертензия. — С-Петербург: Ренкор, 2001. — 381 c.
2. Верещагин Н.В., Моргунов В.А., Гулевская Т.С. Патология головного мозга при атеросклерозе и артериальной гипертонии. — М.: Медицина, 1997. — С. 128-250.
3. Свищенко Е.П., Коваленко В.Н. Артериальная гипертензия: Практическое руководство. — Киев: Морион, 2001. — 527 с.
4. Лелюк В.Г., Лелюк С.Э. Ультразвуковая ангиология. — 3-е изд. — М.: Реал-Тайм, 2007. — 416 с.
5. Лелюк В.Г., Лелюк С.Э. Церебральное кровообращение и артериальное давление. — М.: Реальное время, 2004. — 304 с.
6. Кунцевич Г.И., Танашян М.М., Скрылев С.И. и др. Роль ультразвуковых методов исследования на этапах медикаментозного и хирургического лечения сосудисто-мозговой недостаточности // Клин. физиология кровообращения. — 2009. — № 4. — С. 63-69.
7. Рогоза А.Н. Современные методы оценки состояния сосудов у больных артериальной гипертонией / А.Н. Рогоза, Т.В. Балахонова, Н.М. Чихладзе и др. — М.: Атмосфера, 2008. — С. 33-35.
8. Ringer A.J., German J.W., Guterman L.R., Hopkins L.N. Follow-up of Stented Carotid Arteries by Doppler Ultrasound // J. Neurosurg. — 2002. — Vol. 51, № 3. — P. 236-244.
9. Stein J.H. Use of carotid ultrasound to identify subclinical vascular disease and evaluate cardiovascular disease risk: a consensus statement from the American Society of Echocardiography Carotid Intima-Media Thickness Task Force. Endorsed by the Society for Vascular Medicine / J.H. Stein, C.E. Korcarz, R.T. Hurst et al. // J. Amer. Soc. Echocardiogr. — 2008. — Vol. 21, № 2. — P. 93-111.