Журнал «» 2(16) 2011
Вернуться к номеру
Кашель, возникающий при применении ингибиторов ангиотензинпревращающего фермента: обманчивость информации в справочниках для врачей
Авторы: Sripal Bangalore, Brigham and Women’s Hospital, Harvard Medical School, Boston, MА, USA, Sunil Kumar, Franz H. Messerli, St. Luke’s Roosevelt Hospital, Columbia University College of Physicians & Surgeons, New York, USA
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
Предпосылки исследования. Кашель является типичным раздражающим побочным эффектом всех ингибиторов ангиотензинпревращающего фермента (АПФ). Настоящее исследование было выполнено для того, чтобы сравнить частоту кашля, приводимую в литературе, с частотой, приводимой в Physicians’ Desk Reference (PDR) (Справочник лекарственных средств для врачей. — Прим. перев.) и инструкциях к препаратам.
Методы. Поиск был выполнен в базах данных MEDLINE/EMBASE/CENTRAL за период 1990–2010 гг. Были отобраны рандомизированные контролируемые исследования (РКИ) ингибиторов АПФ, в которых данные препараты получали не менее 100 пациентов в течение не менее 3 месяцев. В работах также должна была быть указана частота развития кашля и частота прекращения терапии вследствие кашля. Эти данные вместе с исходной характеристикой исследований были использованы нами для проведения метаанализа.
Результаты. В общей сложности было отобрано 125 исследований, соответствующих нашим критериям включения (198 130 пациентов). Обобщенная взвешенная частота развития кашля для эналаприла составила 11,48 % (95% доверительный интервал (ДИ) 9,54–13,41 %), что было в 9 раз выше по сравнению с частотой, приводимой в PDR/инструкциях к препарату (1,3 %). Обобщенная взвешенная частота прекращения терапии вследствие кашля для эналаприла составила 2,57 % (95% ДИ 2,40–2,74), что было в 31 раз выше по сравнению с частотой, приводимой в PDR/инструкциях к препарату (0,1 %). По мере накопления исследований в течение последних двух десятилетий частота кашля прогрессивно увеличивалась, в то время как в PDR приводилась одна и та же частота кашля, в несколько раз меньшая по сравнению с РКИ. Аналогичные результаты были получены и для большинства других ингибиторов АПФ.
Выводы. Частота развития кашля при применении ингибиторов АПФ и частота прекращения терапии вследствие кашля (более объективный показатель) достоверно выше в литературных источниках, нежели в PDR/инструкциях к препаратам. Вероятно, в реальном мире эта частота еще больше, чем в РКИ. Таким образом, существует «провал» между данными, приводимыми в литературе, и теми данными, которые публикуются для потребителей (пациентов и врачей).
Ингибиторы ангиотензинпревращающего фермента, клинические исследования, кашель, частота развития кашля, частота прекращения терапии вследствие кашля.
Ингибиторы ангиотензинпревращающего фермента (АПФ) относятся к широко назначаемым препаратам — сегодня во всем мире их получают более 30 млн пациентов. Ингибиторы АПФ снижают заболеваемость и смертность у пациентов с сердечной недостаточностью [1] и хорошо переносятся большинством пациентов. Однако при использовании этих средств часто развивается такой побочный эффект, как сухой кашель, который в тяжелых случаях приводит к прекращению терапии. В последнем издании Physicians’ Desk Reference (PDR) (Справочник лекарственных средств для врачей. — Прим. перев.) сообщается, что при назначении эналаприла кашель развивается с частотой 1,3 % [2].
Цель настоящего исследования сводилась к тому, чтобы оценить встречаемость кашля и частоту прекращения лечения вследствие кашля по данным литературы и сравнить полученные цифры с теми, которые приведены в PDR и инструкциях к препаратам.
Пациенты и методы исследования
Стратегия поиска и отбора исследований
С 1990 г. по февраль 2010 г. мы выполнили поиск по базам данных PUBMED/EMBASE/CENTRAL с использованием ключевых слов «ингибиторы ангиотензинпревращающего фермента» и названий отдельных ингибиторов АПФ (эналаприл, лизиноприл, периндоприл, моэксиприл, рамиприл, трандолаприл и фозиноприл). Мы ограничили наш поиск исследованиями, выполненными на людях. Мы просматривали списки литературы обзорных статей, метаанализов и оригинальных исследований, найденных с помощью электронного поиска, для того чтобы идентифицировать другие исследования, потенциально пригодные для анализа. В поиске не было установлено языковых ограничений. В том случае, если результаты исследований были неясными или значимые данные не были сообщены, мы контактировали с авторами статей.
Исследования, пригодные для включения в настоящий анализ, должны были соответствовать следующим критериям: это должны быть рандомизированные клинические исследования (РКИ), в которых один из сравниваемых режимов терапии должен быть основан на использовании ингибиторов АПФ; исследования должны были включать не менее 100 пациентов в группе, получавшей ингибиторы АПФ; период наблюдения должен был продолжаться не менее 3 месяцев; должны быть приведены данные по частоте развития кашля.
Оценка качества исследований
Два автора (S.B. и S.K.) независимо друг от друга выполняли дублирующую работу — оценивали пригодность исследований и извлекали данные. Качество исследований оценивали с использованием метода, предложенного Сотрудничеством Cochrane для определения риска возникновения систематической ошибки [4] и основанного на оценке 7 компонентов. По каждому компоненту все исследования были охарактеризованы как имеющие низкий, высокий или неясный риск возникновения систематической ошибки. Исследования с низким риском систематической ошибки по 7 из 7 компонентов рассматривали как низкорисковые, по 6 из 7 компонентов — как исследования с промежуточным риском, по менее чем 6 из 7 компонентов — как высокорисковые в отношении возникновения систематической ошибки.
Извлечение данных и их объединение
Среди исходов терапии нас интересовала частота развития кашля и связанная с этим частота прекращения терапии в группе, получавшей ингибиторы АПФ, а также в остальных группах. Наличие кашля выяснялось либо путем опроса пациентов во время плановых визитов, либо с помощью специального опросника, в котором пациенты отмечали частоту, тяжесть и природу кашля.
Клиническая значимость
— Частота типичного побочного эффекта при использовании ингибиторов ангиотензинпревращающего фермента — кашля — существенно занижена в справочниках лекарственных средств для врачей и инструкциях к препаратам. По данным литературы, она в несколько раз выше.
— Необходимо предпринять меры, направленные на то, чтобы инструкции к препаратам регулярно обновлялись в отношении как безопасности препаратов, так и специфических побочных эффектов.
Справочник лекарственных средств для врачей (PDR)
Мы отыскали PDR с 1990 по 2009 г. и взяли оттуда информацию о частоте развития кашля и связанной с ним частоте прекращения терапии для каждого из ингибиторов АПФ и для каждого показания (сердечная недостаточность, артериальная гипертензия). Мы также посетили веб-сайт Food & Drug Administration (FDA; Управление США по надзору за качеством пищевых продуктов и лекарственных средств) [5] и извлекли оттуда разрешительные письма, окончательно одобренные инструкции к препаратам, информацию о количестве правок инструкций и об изменениях приводимой частоты кашля при исправлении инструкций. Неудивительно, что частота кашля, приводимая в инструкциях к лекарственным средствам, совпадала с таковой в PDR. Если в PDR сообщался диапазон частот, например «периндоприл вызывает сухой кашель с частотой 6–12 %», то мы брали большую из двух частот.
Статистический анализ
Метаанализ был выполнен в соответствии с рекомендациями Сотрудничества Cochrane и алгоритмом QUOROM/PRISMA [4, 6]. Для расчетов было использовано программное обеспечение Stata 9.0 (Stata Corporation, Колледж Стейшен, Техас) [7]. Показатели частоты развития кашля, сообщенные в разных исследованиях, объединяли путем взвешивания частоты кашля в каждом отдельном исследовании с помощью обратной дисперсии (1/(станд. откл.)2). Кумулятивная метааналитическая частота была оценена для эналаприла по каждому году в отдельности. Гетерогенность оценивали визуально с помощью Q-критерия (хи-квадрат) и/или I2-критерия. Если исследования были однородными, то для оценки величины обобщенного эффекта использовали модель с фиксированными уровнями факторов. В противном случае для расчета общей разницы применяли модель случайных эффектов Дер-Симониана и Лэирда [9].
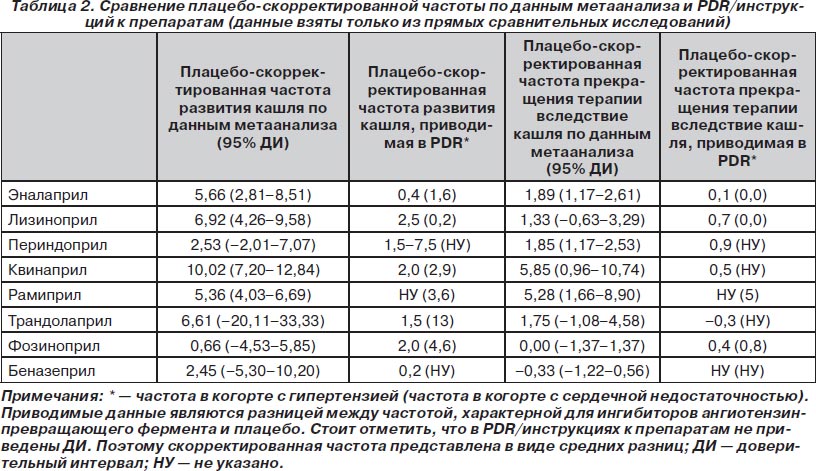
Мы также оценили плацебо-скорректированную и скорректированную по другим препаратам частоту кашля, связанную с назначением ингибиторов АПФ. Для этого находили разницу между частотой кашля при назначении ингибиторов АПФ и плацебо/других препаратов сравнения. Это было сделано только для групп из прямых сравнительных исследований для того, чтобы минимизировать систематическую ошибку между группами с ингибиторами АПФ и группами сравнения. Полученные данные мы сравнили с плацебо-скорректированной частотой из PDR/инструкций к препаратам (ее рассчитывали аналогично). Нужно отметить, что каких-либо других групп сравнения, помимо плацебо, в PDR/инструкциях к препаратам приведено не было.
Для расчета величины эффекта в прямых сравнительных исследованиях мы использовали метод Пето [10, 11]. Наличие систематической ошибки, связанной с предпочтительной публикацией положительных результатов исследования, оценивали визуально с помощью воронкообразных графиков или с помощью критерия Бегга и взвешенного регрессионного критерия Egger и соавт. [12].
Анализ чувствительности (для частоты развития кашля и частоты прекращения терапии вследствие развития кашля) выполняли путем стратификации анализа исходя из следующих данных: как пациенты сообщали о наличии кашля (опросник или сообщали сами); какие когорты пациентов были включены в исследование (с сердечной недостаточностью или без сердечной недостаточности); использование комбинированного режима терапии по сравнению с монотерапией; размер групп (при лечении ингибиторами АПФ) ≥ 1000 пациентов или < 1000; длительность терапии ≥ 12 месяцев или < 12 месяцев; качество исследований (высокий риск систематической ошибки или низкий/промежуточный риск систематической ошибки).
Результаты
Отбор исследований
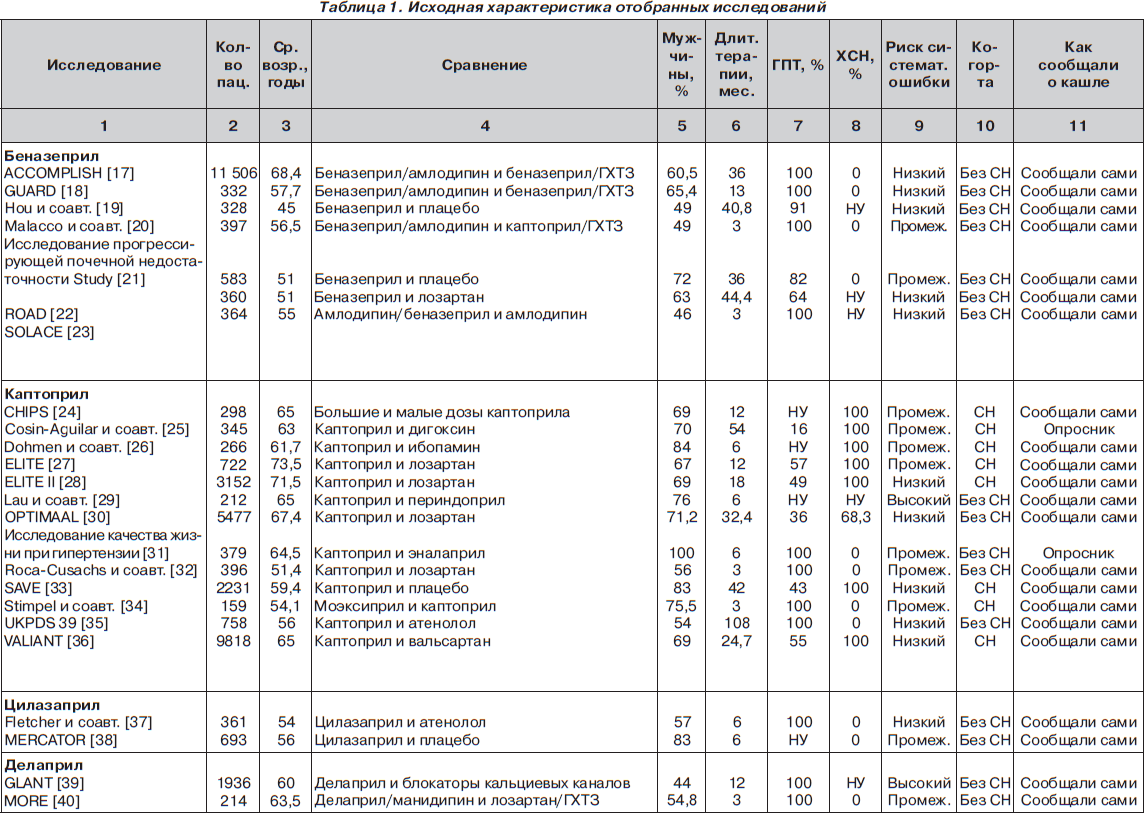
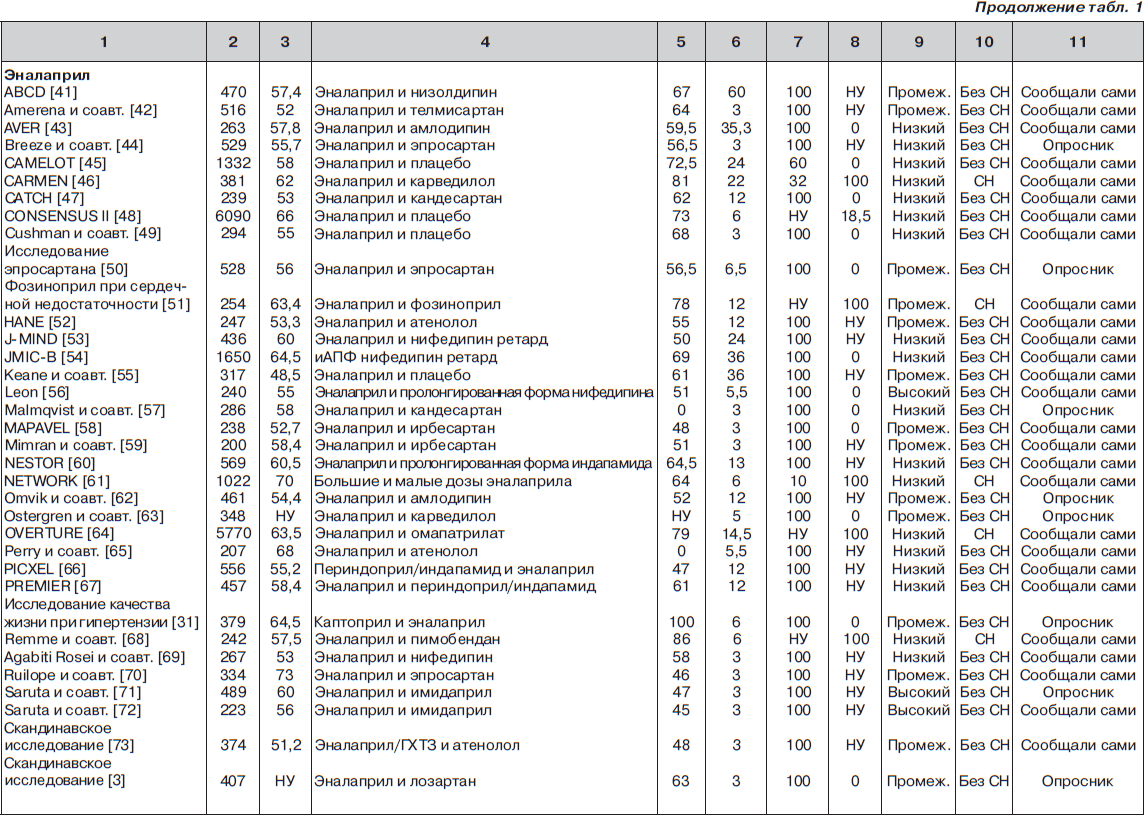
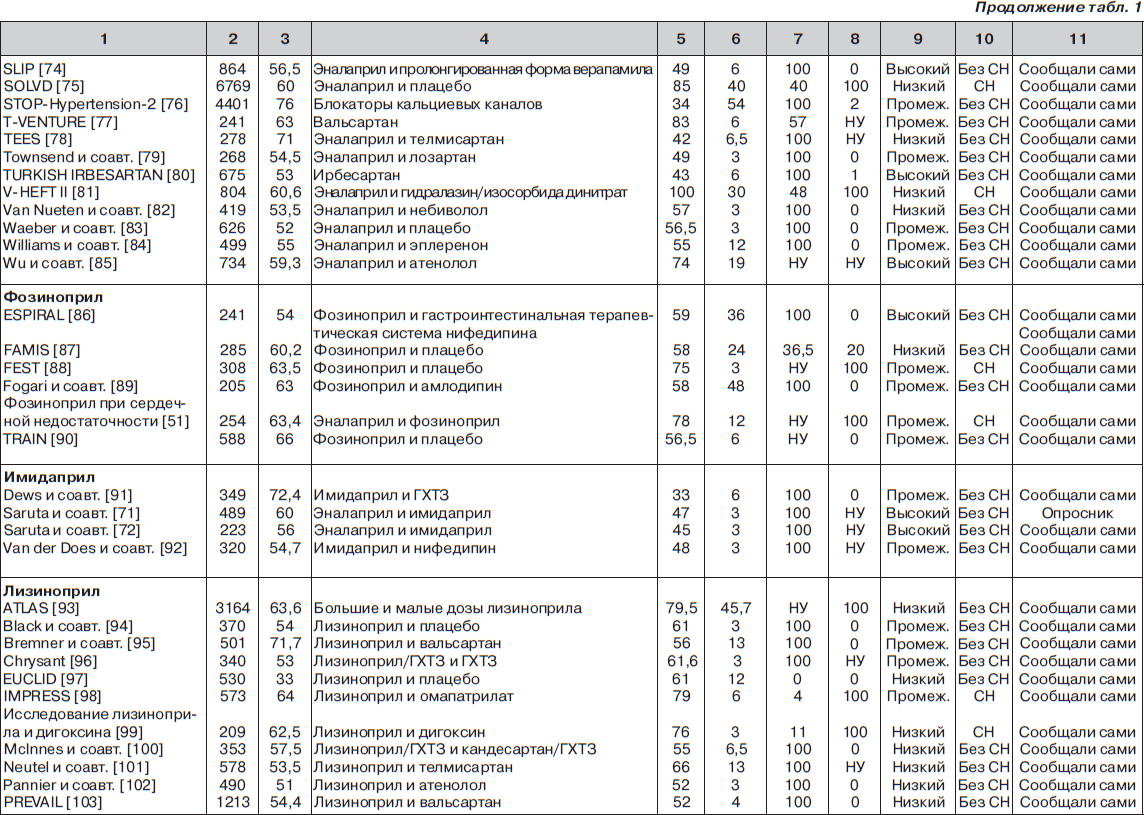
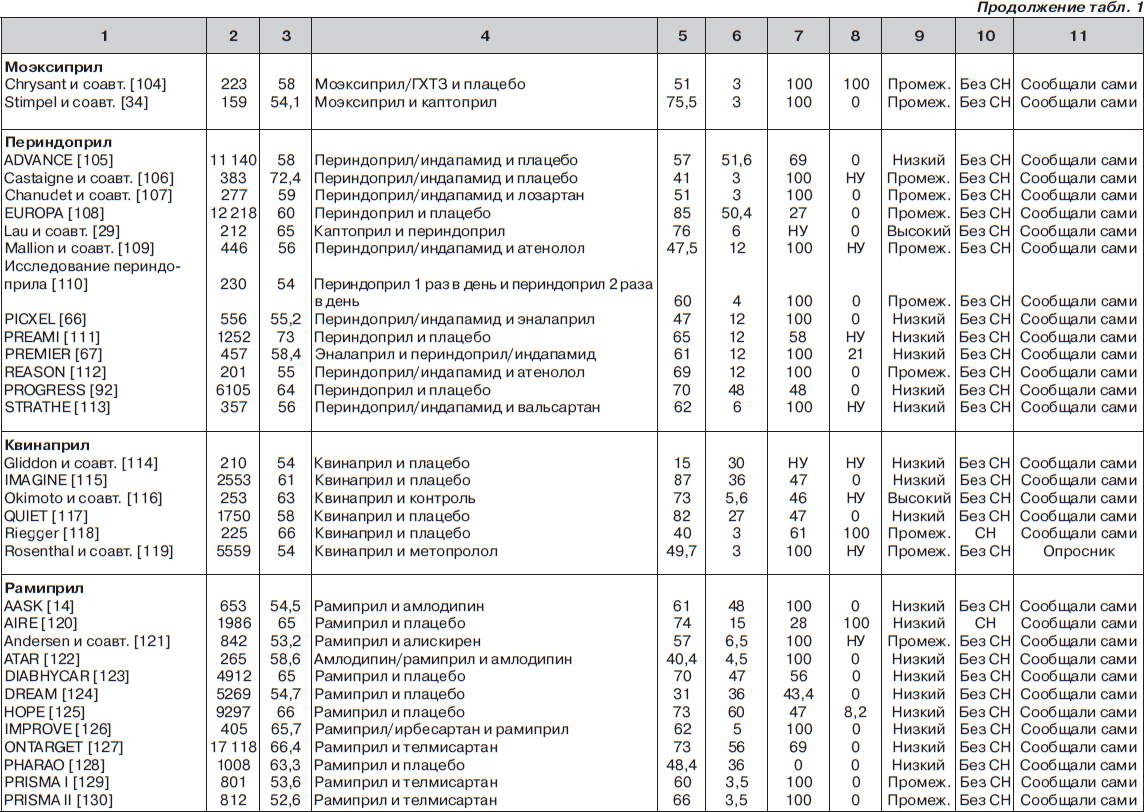
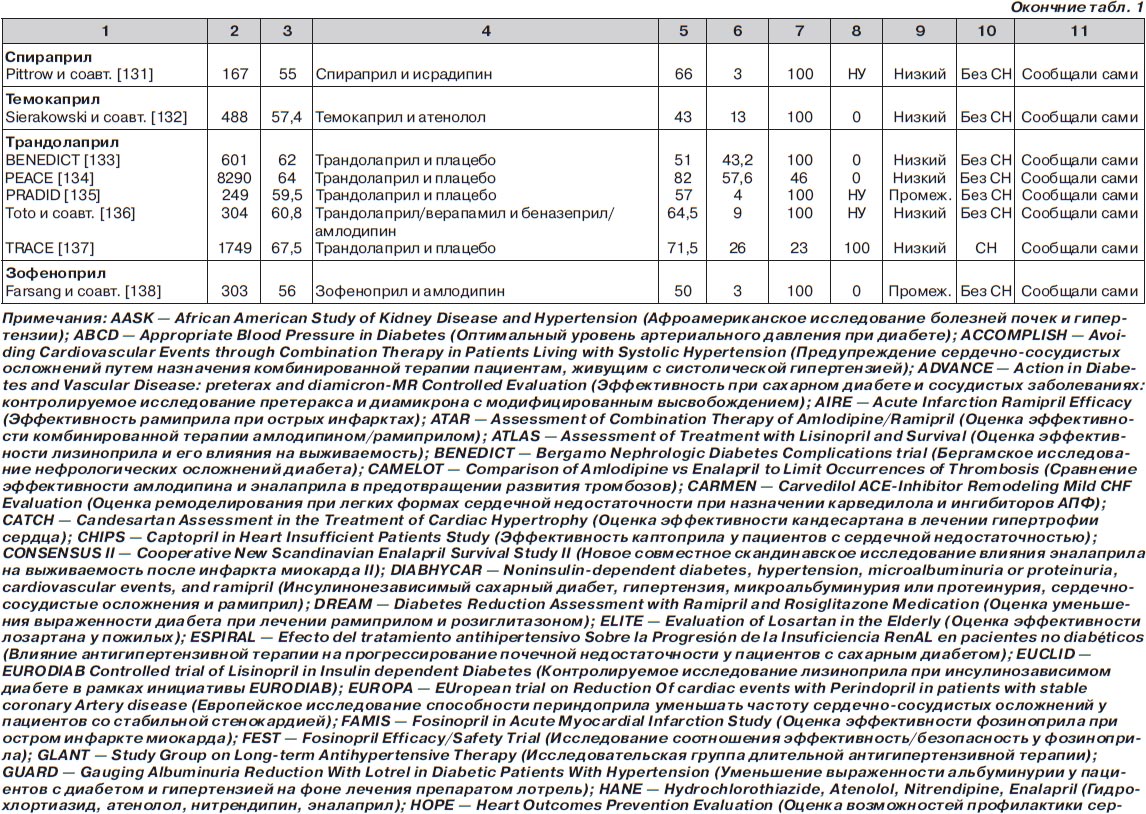
С помощью электронного поиска и поиска вручную мы идентифицировали 2811 РКИ, из которых 125 исследований (159 пар сравниваемых групп) соответствовали критериям включения и были выбраны для анализа (рис. 1, табл. 1). Мы исключили исследования, в которых назначалась комбинация ингибиторов АПФ и блокаторов ангиотензиновых рецепторов (АРБ) (например: ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial (ONTARGET) — Исследование влияния монотерапии телмисартаном и комбинации телмисартана и рамиприла на общую конечную точку исследования), и исследования, в которые включали только тех пациентов, у которых была непереносимость ингибиторов АПФ. Однако исследования, в которых назначалась комбинация ингибиторов АПФ и других средств, обычно не вызывающих кашель (не-АРБ), были включены в анализ.
Характеристика исследований
В общей сложности в 125 исследованиях приняло участие 198 235 пациентов. Из них 111 798 (56 %) было рандомизировано к получению ингибиторов АПФ, а 86 437 (44 %) к лечению другими средствами (включая плацебо). Из 159 пар сравниваемых групп только в 27 (17 %) были пациенты с сердечной недостаточностью. В большинстве же случаев (132 пары сравниваемых групп; 83 %) у пациентов не было сердечной недостаточности (присутствовала в основном гипертензия). Из 125 исследований только в 13 имелся высокий риск развития систематической ошибки, в то время как в остальных исследованиях этот риск был низким или промежуточным. Ни один из примененных нами методов не выявил наличие систематической ошибки, связанной с предпочтительной публикацией положительных результатов исследования
Частота развития кашля
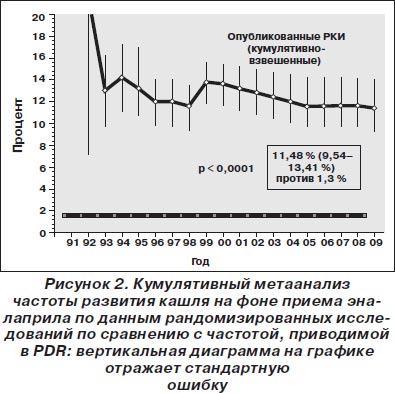
Эналаприл. Среди 55 пар сравниваемых групп 23 559 пациентов было рандомизировано к лечению эналаприлом. В этой популяции обобщенная взвешенная частота кашля (согласно модели случайных эффектов) составила 11,48 % (95% ДИ 9,54–13,41 %), что было в девять раз выше, чем сообщалось в PDR (частота 1,3 %; p < 0,0001; рис. 2). Стоит отметить, что по мере накопления данных в течение последних двух десятилетий частота кашля прогрессивно увеличивалась, а доверительный интервал сужался (большая точность оценки).
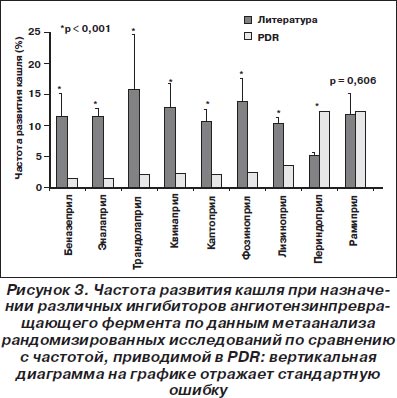
Другие ингибиторы ангиотензинпревращающего фермента. Аналогично вышеизложенному, частота кашля по данным литературы (модель случайных эффектов) была достоверно выше (кроме рамиприла и периндоприла) по сравнению с той, которая приводилась PDR (рис. 3).
Частота прекращения терапии вследствие кашля
Эналаприл. Обобщенная взвешенная частота прекращения терапии вследствие кашля при лечении эналаприлом составила 3,08 % (95% ДИ 2,23–3,93 %), что было в 31 раз выше по сравнению с той частотой, которая приводилась в PDR (частота прекращения терапии 0,1 %; p < 0,001; рис. 4). Необходимо отметить, что если частота, приводимая в PDR, оставалась неизменной, то кумулятивная частота по мере накопления литературных данных постоянно увеличивалась, доверительный интервал сужался (более точная оценка), пока в конце концов к началу последней декады не было достигнуто плато.
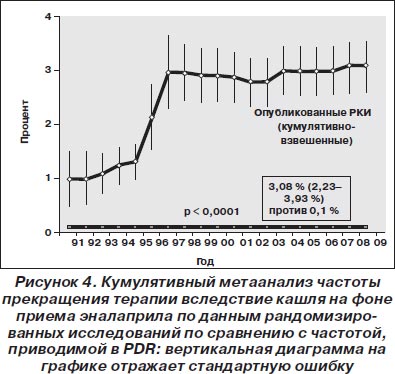
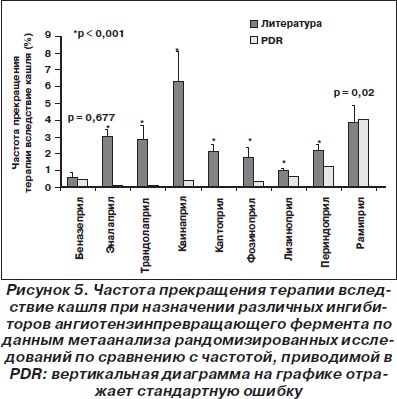
Другие ингибиторы ангиотензинпревращающего фермента. Аналогично вышеприведенным данным, частота прекращения терапии вследствие кашля (модель случайных эффектов) по литературным данным была достоверно выше (кроме беназеприла и рамиприла), чем приводимая в PDR (рис. 5).
Прямые сравнительные исследования
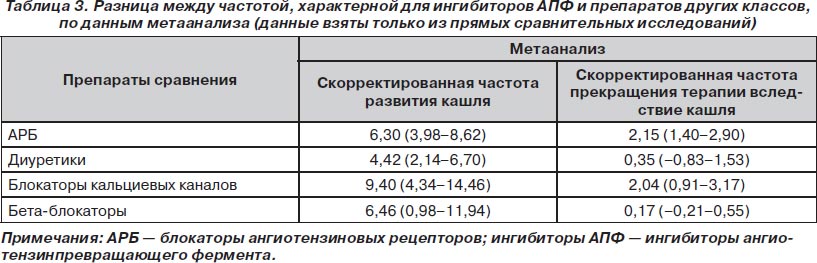
Частота развития кашля. Обобщенная взвешенная частота развития кашля (от меньшей к большей) при лечении блокаторами кальциевых каналов составила 2,72 % (1,15–4,29 %), диуретиками — 3,25 % (1,93–4,57 %), АРБ — 3,50 % (2,35–4,65 %), плацебо — 5,33 % (2,79–7,87 %) и бета-блокаторами — 5,86 % (1,82–9,90 %). Она была достоверно меньше по сравнению с обобщенной частотой для всех ингибиторов АПФ (10,60 % [9,14–12,07 %; p < 0,001 для всех сравнений]).
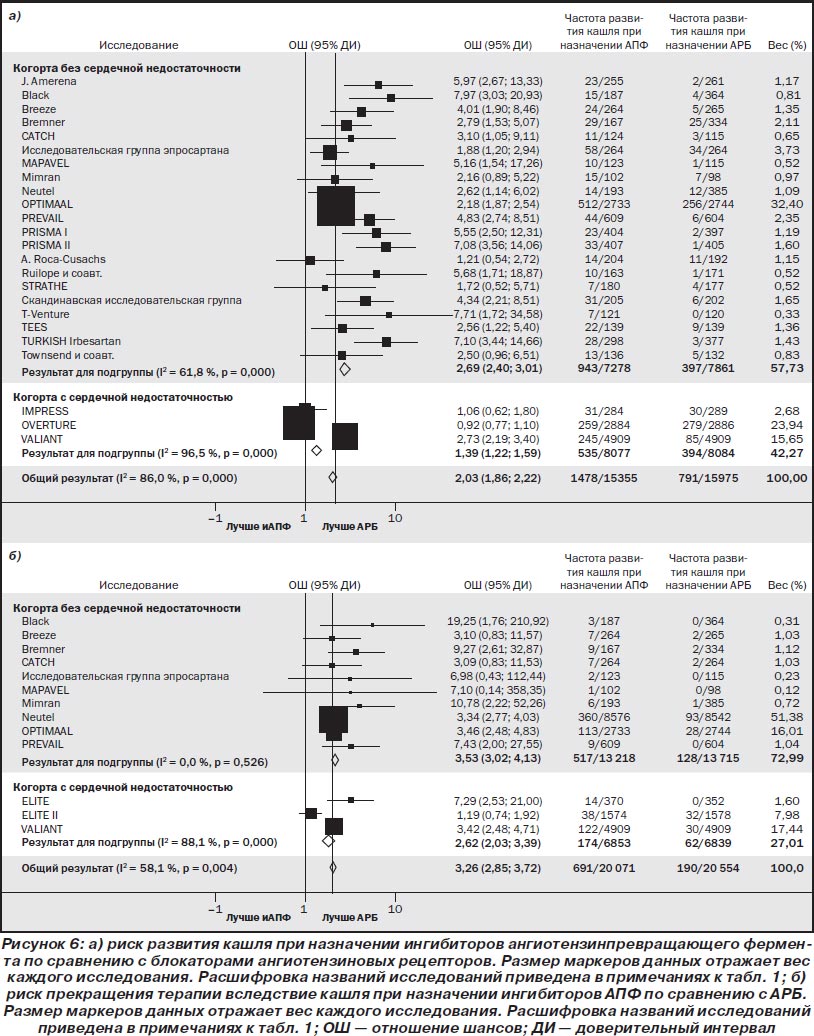
В прямых сравнительных исследованиях назначение ингибиторов АПФ было связано с достоверно более высоким риском развития кашля по сравнению с АРБ (рис. 6), блокаторами кальциевых каналов (отношение шансов (ОШ) 4,35; 95% ДИ 3,89–4,87; I2 = 77,8 %), плацебо (ОШ 1,91; 95% ДИ 1,79–2,04; I2 = 47,5 %), диуретиками (ОШ 2,29; 95% ДИ 1,48–3,54; I2 = 0,0 %) и бета-блокаторами (ОШ 1,81; 95% ДИ 1,56–2,12; I2 = 65,5 %).
Сравнение плацебо-скорректированной частоты кашля, приводимой в литературе и в PDR/инструкциях к препаратам, для ингибиторов АПФ представлено в табл. 2. Разница между частотой кашля при назначении ингибиторов АПФ и препаратов других классов представлена в табл. 3.
Частота прекращения терапии вследствие кашля. Обобщенная взвешенная частота прекращения терапии вследствие кашля (модель случайных эффектов; частота приведена в порядке от меньшей к большей) при лечении бета-блокаторами составила 0 %, диуретиками — 0,35 % (0,06–1,04 %), плацебо — 0,64 % (0,40–0,88 %), АРБ — 0,35 % (0,18–0,52 %) и блокаторами кальциевых каналов — 1,08 % (0,09–2,06 %). Это было достоверно меньше, чем обобщенная взвешенная частота прекращения терапии для всех ингибиторов АПФ (2,54 % [2,10–2,99 %; p < 0,001 для всех сравнений]).
В прямых сравнительных исследованиях назначение ингибиторов АПФ было связано с достоверно более высоким риском прекращения терапии вследствие кашля по сравнению с плацебо (ОШ 3,37; 95% ДИ 3,06–3,72; I2 = 48,3 %), АРБ (рис. 6), блокаторами кальциевых каналов (ОШ 5,65; 95% ДИ 3,87–8,25; I2 = 7,9 %) или бета-блокаторами (ОШ 6,29; 95% ДИ 2,69–14,70; I2 = 0,0 %). Однако при сравнении с диуретиками (1 исследование) достоверные различия отсутствовали (ОШ 1,93; 95% ДИ 0,20–18,65).
Анализ чувствительности
Частота развития кашля была достоверно выше в исследованиях, в которых для оценки кашля использовали опросник, и среди пациентов с явлениями сердечной недостаточности по сравнению с исследованиями, в которых пациенты сами сообщали о наличии кашля, и пациентами без сердечной недостаточности. Однако частота прекращения терапии вследствие кашля была одинаковой (данные не представлены).
Вместе с тем частота прекращения терапии вследствие кашля была больше в исследованиях с монотерапией ингибиторами АПФ, особенно при наличии большого количества пациентов и длительном сроке терапии, по сравнению с соответствующими группами сравнения (данные не представлены).
Не было обнаружено достоверных различий в частоте возникновения кашля (10,59 % [9,03–12,15 %] против 10,81 % [6,54–15,07 %; p = 0,678]) и частоте прекращения терапии вследствие кашля (2,57 % [2,09–3,05 %] против 2,23 % [0,96–3,50 %; p = 0,401]) между исследованиями с низким/промежуточным риском возникновения систематической ошибки и исследованиями с высоким риском.
Обсуждение
Результаты настоящего исследования, включавшего почти 200 000 пациентов, свидетельствуют о том, что частота типичного побочного эффекта при назначении ингибиторов АПФ — кашля — значительно занижена в PDR/инструкциях к препаратам. По данным литературы, она в несколько раз выше.
Частота развития кашля
Частота кашля, приводимая в литературе, широко варьирует [13, 14]. Причиной тому может быть много факторов: размер групп, длительность лечения, когорты включенных пациентов, способы, с помощью которых пациенты сообщали о наличии кашля. Результаты настоящего исследования свидетельствуют о том, что перечисленные факторы оказывают влияние на приводимую частоту. Например, наблюдалась меньшая частота кашля и меньшая частота прекращения терапии вследствие кашля в тех исследованиях, где ингибиторы АПФ назначались в комбинации с не-АРБ-средствами. Несмотря на то что пока нет оснований предполагать, что частота этих побочных эффектов ослабляется в присутствии других средств, подобная возможность не может быть исключена. Поэтому нужно проводить дополнительные исследования, чтобы проверить эту гипотезу. Частота кашля была выше в когорте пациентов с сердечной недостаточностью. В когорте пациентов с сердечной недостаточностью кашель мог иметь многофакторную природу (отек легких, обострение сердечной недостаточности), что может обусловить ошибочное диагностирование как кашля вследствие назначения ингибиторов АПФ. Частота прекращения терапии вследствие кашля не различалась между двумя когортами (с сердечной недостаточностью и без нее). Это свидетельствует о том, что более высокая частота развития кашля отражает либо трудности в дифференцировании кашля, причиной которого является сама сердечная недостаточность, либо наличие более высокого порога для прекращения терапии ингибиторами АПФ вследствие хорошо известной способности этих средств уменьшать заболеваемость и смертность у пациентов с данной патологией. Аналогично частота кашля была выше среди пациентов, сообщавших о его наличии с помощью опросника. В то же время частота прекращения терапии вследствие кашля была одинаковой среди пациентов, сообщавших о наличии кашля с помощью опросника или делавших это самостоятельно. Это свидетельствует о том, что частота прекращения терапии вследствие кашля является более объективной мерой побочного действия, нежели частота развития кашля [15]. Следует отметить, что плацебо-скорректированная частота из метаанализа была больше, чем соответствующая плацебо-скорректированная частота из PDR/инструкций к препаратам. Это свидетельствует о том, что независимо от того, как представлены данные (исходная частота или плацебо-скорректированная частота), частота в PDR/инструкциях к препаратам является более низкой, чем соответствующая частота в литературе.
Управление США по надзору за качеством пищевых продуктов и лекарственных средств, инструкции к препаратам и Справочник лекарственных средств для врачей (PDR)
Процесс разрешения любого нового препарата включает данные из доклинических исследований и по крайней мере двух исследований фазы 3 — РКИ у пациентов с определенным заболеванием. Эксперты FDA оценивают эти данные с клинической, эпидемиологической, статистической, токсикологической и фармакологической точки зрения, взвешивают возможные риски и выгоды и принимают решение об одобрении препарата. FDA помогает донести информацию до врачей с помощью составления инструкций к препаратам. Раздел 201(n) Федерального закона о продуктах питания, лекарственных и косметических средствах требует, чтобы в инструкциях к препаратам не было ошибок за счет как включения лишней, так и пропуска нужной информации. Инструкции к препаратам публикуются в PDR и других электронных справочниках и служат источником информации для врачей и пациентов.
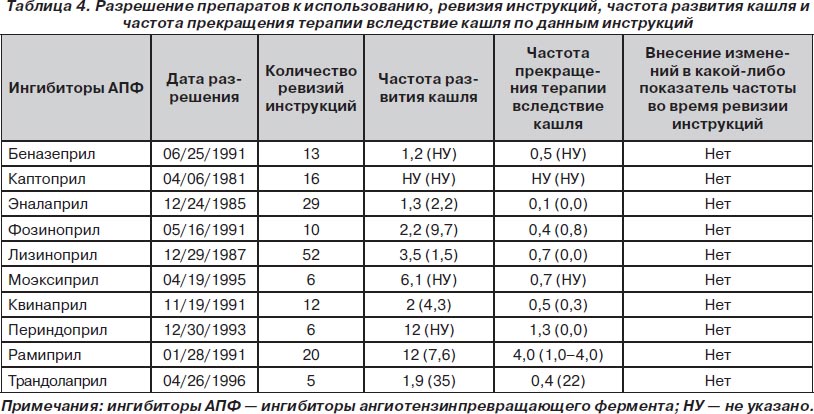
Результаты настоящего анализа выявили разницу между литературными данными и данными, предоставляемыми врачам и пациентам. В табл. 4 приведены даты первого разрешения к применению каждого ингибитора АПФ, количество ревизий инструкций, частота развития кашля и частота прекращения терапии вследствие кашля по данным инструкций. Удивительно, что во время многочисленных ревизий инструкций не было внесено каких-либо изменений в частоту кашля или частоту прекращения терапии. В итоге риск развития побочных эффектов оказывается занижен — иногда в PDR он в 31 раз ниже по сравнению с данными, приводимыми в литературе. К чему приводит подобное занижение фактических показателей? Во-первых, сообщение о низкой частоте создает ложное впечатление безопасности у врачей и пациентов. Во-вторых, это приводит к поиску других причин кашля, что влечет за собой диагностические ошибки и назначение ненужной терапии. Vegter и соавт. [16] проанализировали данные 27 446 пациентов, принимающих ингибиторы АПФ, и показали, что частота назначения противокашлевой терапии по поводу кашля, связанного с приемом ингибиторов АПФ, составляет около 15 %. Неспособность распознать кашель как побочный эффект ингибиторов АПФ может привести к дополнительным обследованиям, диагностическим тестам и даже назначению эмпирической терапии антибиотиками и противокашлевыми средствами. В-третьих, для неинформированных врачей и неподготовленной публики частота, приводимая в PDR, может служить основанием для более широких рекомендаций одних препаратов по сравнению с другими. Например, в PDR сообщается, что частота развития кашля на фоне приема эналаприла составляет 1,3 %, а при использовании рамиприла — 12 %. Отсюда делается ложный вывод о том, что эналаприл переносится лучше, чем рамиприл. Результаты же нашего анализа свидетельствуют о том, что частота развития кашля одинакова для всех ингибиторов АПФ (эналаприл 11,48 %, рамиприл 11,72 %; p = 0,679). Данные большого количества исследований однозначно свидетельствуют о том, что кашель является общеклассовым эффектом данной группы лекарственных средств. Необходимо отметить, что кашель не был распознан как классоспецифичный побочный эффект при изучении старых ингибиторов АПФ до тех пор, пока в исследованиях, выполненных после поступления данных препаратов на рынок, не было показано, что кашель встречается достаточно часто. Данный факт является одной из наиболее вероятных причин низкой частоты кашля для более старых ингибиторов АПФ по сравнению с новыми. Однако нужно заметить, что в первой одобренной инструкции к эналаприлу (разрешен к применению 24 декабря 1985 г.) сообщалось, что частота развития кашля при применении данного препарата составляет 1,3 %. С того времени в течение 23 лет инструкция подвергалась ревизии 29 раз. Но и после последней ревизии инструкции (25 сентября 2008 г.) частота кашля, приводимая в инструкции, осталась на уровне 1,3 %.
В свете такого положения вещей необходимо обязать фармакологические компании регулярно предоставлять в FDA новые данные об эффективности и безопасности препаратов. Вероятно, невозможно и даже клинически нецелесообразно обновлять информацию обо всех неспецифических побочных эффектах препаратов. Однако сведения о побочных эффектах, специфичных для лекарственных средств, например кашле и ангиоэдеме — для ингибиторов АПФ, отеках стоп — для блокаторов кальциевых каналов, миалгии и миозите — для статинов, диспноэ — для тикагрелора, должны собираться систематически и находить отражение в инструкциях к препаратам.
Ограничения исследования
У нас не было возможности включить в анализ первичные данные, полученные на пациентах в разных исследованиях. Следовательно, мы не могли сделать поправку на дозу препаратов, сопутствующую терапию, статус курильщика, любую легочную и респираторную патологию, которая может вносить вклад в развитие кашля. Несмотря на то что мы приводим частоту развития кашля и частоту прекращения терапии вследствие кашля отдельно для каждого ингибитора АПФ, любое прямое сравнение чревато ошибками, связанными с гетерогенностью в когортах пациентов, размере групп, длительности терапии и способах сообщения о наличии кашля (заполняют ли пациенты специальный опросник или же сами сообщают о наличии кашля). Поэтому лучший способ оценки — проведение рандомизированного сравнения отдельных ингибиторов АПФ.
Выводы
Результаты настоящего метаанализа, включавшего почти 200 000 пациентов и являющегося наибольшим на сегодняшний день, свидетельствуют о том, что частота развития кашля при назначении ингибиторов АПФ и частота прекращения терапии вследствие этого кашля (более объективный показатель) по данным литературы в несколько раз выше, чем аналогичная частота, приводимая в PDR (и инструкциях к препаратам). В реальном же мире эта частота, по-видимому, еще больше, нежели в проанализированных нами РКИ. Соответственно, должны быть предприняты меры, направленные на то, чтобы инструкции к препаратам регулярно обновлялись в отношении как безопасности препаратов, так и специфических побочных эффектов.
Перевод к.м.н. А.В. Савустьяненко
Оригинал статьи опубликован в The American
Journal of Medicine, 2010, 123, 1016-1030.
Список литературы находится в редакции