Журнал «Болезни и антибиотики» 1 (04) 2011
Вернуться к номеру
Симпозиум: пробиотики
Авторы: Березняков В.И., Городская студенческая больница № 20, г. Харьков
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
Проводят: Донецкий национальный медицинский университет им. М. Горького, Ассоциация медицинского образования Украины, Украинская ассоциация за рациональное использование антибиотиков, кафедра терапии ХМАПО
Рекомендован: терапевтам, семейным врачам, педиатрам, пульмонологам, хирургам, инфекционистам.
Определение понятий
Пробиотики — это живые микроорганизмы, которые при использовании в адекватных количествах оказывают положительный эффект на здоровье организма-хозяина [1]. Первооткрывателем пробиотиков по праву считают И.И. Мечникова, который в начале прошлого века предположил, что полезные бактерии можно использовать для замещения вредных микроорганизмов [2]. Термин «пробиотики» (что означает «ради жизни») в начале 60-х гг. ХХ века предложили Lilly и Stillwell [3].
Пробиотики представляют собой диетические добавки, содержащие предположительно полезные бактерии и грибы. В клинической практике в зависимости от конкретных потребностей применяются различные виды микроорганизмов. В качестве пробиотиков обычно используются грамположительные кисломолочные бактерии (такие как Lactobacillus acidophilus, L.casei, L.lactis, L.plantarum, L.reuteri, L.rhamnosus, L.salivarius и L.johnsonii) и различные бифидобактерии (такие как Bifidobacterium animalis, B.infantis, B.lactis, B.longum и B.breve) (табл. 1) [4]. В качестве пробиотиков на рынках позиционируются и другие микроорганизмы — непатогенные штаммы Escherichia coli или Enterococcus spp., а также Saccharomyces boulardii (непатогенные дрожжи), хотя безопасность их использования в данном качестве точно не установлена [5–7]. Накопленные в настоящее время данные свидетельствуют, что пробиотики оказывают штамм-специфичные эффекты. Поэтому позитивные эффекты, оказываемые определенным штаммом, нельзя приписывать другим штаммам, даже если они принадлежат к тому же виду микроорганизмов [8].
В минувшее десятилетие были внесены изменения в номенклатуру ряда лактобацилл. Так, Lactobacillus acidophilus RC-14 и L.fermentum RC-14 переименованы, соответственно, в L.reuteri RC-14 и L.casei GR-1, а L.casei вар. rhamnosus переименован в L.rhamnosus GR-1.
Пребиотики — это неперевариваемые пищевые добавки, которые избирательно благоприятствуют пролиферации пробиотиков. Чаще других в качестве пребиотиков используются фрукто-олигосахариды, инулин, трансгалактозилированные или соевые олигосахариды [9].
Синбиотики представляют собой комбинацию пробиотика с пребиотиком.
Пробиотики и продукты питания
В соответствии с рекомендациями Организации по продовольствию и сельскому хозяйству (Food and Agriculture Organization, FAO) и Всемирной организации здравоохранения (ВОЗ) [1, 10], пробиотические микроорганизмы, которые используются в продуктах питания, должны оставаться живыми при прохождении через кишечник, то есть быть способными противостоять воздействию желудочного сока и желчи. Далее, они должны быть способными пролиферировать в пищеварительном тракте и колонизировать его. Наконец, они должны быть безопасными и эффективными и сохранять свою активность на протяжении срока годности продукта питания.
Молочные продукты, включая йогурты, продукты из ферментированного молока и сыры, остаются на переднем крае производства продовольственных товаров, содержащих пробиотики. Среди населения распространена уверенность, что йогурт per se (сам по себе) является пробиотиком. Даже среди экспертов нет единства мнений по поводу данного утверждения: является ли оно правдой или вымыслом. Например, следует ли рассматривать Lactobacillus bulgaricus и Streptococcus thermophilus — культуры, которые используются для закваски йогуртов, в качестве пробиотиков [11, 12]? Эти микроорганизмы зависимы от изменений условий в желудочно-кишечном тракте (ЖКТ) и не создают очень высоких концентраций в кишечнике, хотя при их использовании описаны некоторые позитивные эффекты, как, например, улучшение переваривания лактозы и укрепление иммунной системы [13].
Благоприятные эффекты пробиотиков на состояние здоровья
Концепция позитивного действия пробиотиков при заболеваниях человека базируется на различных механизмах. Пробиотики вырабатывают антимикробные соединения [14–16] и видоизменяют специфические рецепторы к токсинам, блокируя таким образом опосредованные токсинами реакции [17, 18]. Согласно гипотезе столкновения бактерий, колонизирующие пищеварительный тракт пробиотические микроорганизмы конкурируют с патогенными бактериями за питательные вещества или места адгезии [19–27]. Позитивные эффекты пробиотиков, выходящие за место колонизации, могут объясняться модуляцией системных иммунологических реакций. Повышение клеточного и гуморального иммунитета было продемонстрировано в исследованиях пробиотиков у животных [28, 29] и у людей [30–33], в особенности при инфекциях дыхательных путей [34–38]. В частности, установлено увеличение общего количества CD4+ и CD8+ T-лимфоцитов у больных, получавших пробиотики, по сравнению с плацебо [39, 40].
Иммунитет
Хотя способность пробиотиков модулировать иммунный ответ была продемонстрирована во многих исследованиях in vitro и in vivo, конкретные механизмы подобных эффектов остаются неясными [41], а результаты исследований с различными препаратами пробиотиков — противоречивыми. Установлено, что пробиотические бактерии влияют на многие параметры гуморального, клеточного и неспецифического иммунитета [42–47]. У лиц старшей возрастной группы пробиотики повышают активность естественных клеток-киллеров и модулируют неспецифические защитные силы организма [46, 48–50]. Иммуномодулирующие механизмы действия пробиотиков включают в себя индукцию образования слизи, активацию макрофагов лактобациллами, стимуляцию секреторного иммуноглобулина А (IgA) и нейтрофилов, угнетение высвобождения воспалительных цитокинов и другие [51–55]. Тем не менее остается неясным, являются ли эти иммуномодуляторные эффекты локализованными или системными, одинаковы ли они у здоровых людей и у пациентов с различными заболеваниями, оказывают ли все предполагаемые пробиотики сходные эффекты на иммунную систему. Имеются, например, данные, что пробиотики стимулируют фагоцитоз у здоровых людей, но угнетают его у лиц с аллергическими реакциями [56]. Предполагается, что иммуномодулирующие эффекты пробиотиков могут зависеть от состояния иммунитета человека и дозы препарата, а также различаться у разных штаммов пробиотиков [37, 43, 47, 52, 57].
Фармакология
Для объяснения действия пробиотиков было предложено несколько механизмов, причем в большинстве случаев задействовано несколько механизмов действия одновременно. При профилактике и лечении инфекций ЖКТ, по всей видимости, имеет место сочетание прямого антагонизма между пробиотическими и патогенными бактериями в кишечнике с иммуномодулирующим действием и усилением иммунитета. У детей с атопическим дерматитом механизм действия пробиотиков, скорее всего, связан с влиянием на раннее развитие иммунотолерантности в течение первого года жизни. Пробиотики могут снижать неадекватные иммунные реакции на чужеродные антигены, ведущие к атопии у некоторых детей [58]. Они также способствуют уменьшению выраженности воспалительных процессов посредством уравновешивания образования про- и противовоспалительных цитокинов. Кроме того, они снижают пищевую антигенную нагрузку путем разрушения и модификации макромолекул в кишечнике [59]. Было показано, что пробиотики уменьшают повышенную проницаемость стенки кишечника у детей с пищевой аллергией и увеличивают секрецию специфического плазменного IgA, которая у этих детей нередко нарушена [60].
Для достижения наилучшего эффекта пробиотики должны обладать устойчивостью к действию соляной кислоты и желчи при прохождении через верхние отделы ЖКТ. Большинство пробиотиков не способны надолго заселять нижние отделы ЖКТ. Даже наиболее жизнестойкие виды высеваются из кала лишь в течение 1–2 недель после приема [59]. Поэтому для поддержания колонизации ЖКТ требуется регулярный прием пробиотиков.
Использование и эффективность
Большинство своих положительных эффектов пробиотики оказывают при заболеваниях ЖКТ, включая вызванную приемом антибиотиков диарею, острую инфекционную диарею, а также синдром раздраженного кишечника (СРК) (табл. 2). В некоторых исследованиях установлена польза от применения пробиотиков при лечении атопического дерматита у детей. Пробиотики часто используются при лечении заболеваний с недостаточной доказательной базой в пользу того или иного вмешательства, таких как вагинальный кандидоз, болезни желудка, ассоциирующиеся с инфекцией Helicobacter pylori, СРК, опухолевые заболевания, а также инфекции верхних дыхательных и мочеполовых путей [4, 61–65].
С другой стороны, целесообразность применения пробиотиков подтверждена не при всех клинических состояниях. У взрослых больных, госпитализированных в отделения реанимации и интенсивной терапии (ОРИТ), использование пробиотиков/пребиотиков и синбиотиков не способствует снижению заболеваемости нозокомиальными инфекциями, сокращению длительности пребывания в ОРИТ и снижению госпитальной летальности [66]. Кроме того, применение синбиотиков у больных в критических состояниях не приводило к уменьшению септических осложнений или снижению летальности по сравнению с плацебо [67]. Противоречивые данные получены при использовании пробиотиков у больных с тяжелым острым панкреатитом. В 1 рандомизированном контролируемом исследовании (РКИ) применение препарата, содержащего L.plantarum, снижало заболеваемость инфицированным панкреонекрозом и абсцессами поджелудочной железы [68], в то время как в другом РКИ у больных, получавших препарат, содержащий многие виды пробиотиков, установлено увеличение числа инфекционных осложнений и смертности по сравнению с плацебо [69].
Антибиотико-ассоциированная диарея
В недавнем метаанализе 19 исследований установлено, что пробиотики снижают риск возникновения антибиотико-ассоциированной диареи (ААД) на 52 % (95% доверительный интервал (ДИ) 0,35–0,65; p < 0,001) (рис. 1) [70]. Наилучший эффект от применения пробиотиков отмечался в случае их использования в первые 72 ч от начала антибиотикотерапии. Представленные данные получены в исследованиях со следующими микроорганизмами: L.rhamnosus, L.acidophilus, S.boulardii, причем выраженность эффекта при использовании разных штаммов различалась незначительно, несмотря на ограниченное количество протестированных штаммов [70].
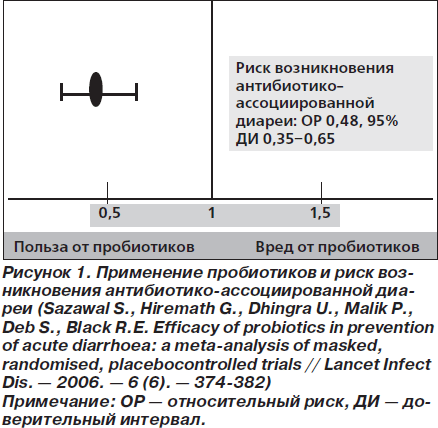
В другом метаанализе 25 РКИ с общим числом включенных больных 2810 чел. оценивалась эффективность пробиотиков для профилактики и лечения ААД [71]. Относительный риск (ОР) возникновения ААД при использовании пробиотиков по сравнению с плацебо оказался равным 0,43 (95% ДИ 0,31–0,58; p < 0,0001). В исследовании было также установлено, что L.rhamnosus, S.boulardii и смеси из двух и более видов пробиотиков в равной степени эффективны в предотвращении возникновения ААД. Средняя суточная доза бактерий в этих исследованиях составляла 3 млрд КОЕ, однако в исследованиях с использованием более 10 млрд КОЕ в сутки эффективность пробиотиков была существенно выше. S.boulardii дозировались из расчета 250–500 мг в сутки [71].
В этом же метаанализе оценивались перспективы использования пробиотиков для профилактики и лечения инфекций, вызванных Clostridium difficile. Согласно данным 6 РКИ, риск развития инфекции снижался у людей, принимавших пробиотики (ОР 0,59; 95% ДИ 0,41–0,85; p = 0,005). Снижение частоты рецидивов продемонстрировано только при использовании S.boulardii.
К противоположному выводу пришли авторы Кокрейновского сотрудничества [72]. Они проанализировали 4 РКИ, в которых пробиотики использовались вместе с общепринятыми антибиотиками (ванкомицин, метронидазол) для лечения первого эпизода или рецидивов колита у взрослых, вызванного C.difficile. К недостаткам всех РКИ следует отнести малое количество включенных больных и невысокий методологический уровень. Статистически значимая польза от применения пробиотиков была установлена только в 1 исследовании с S.boulardii, выполненным, кстати, группой исследователей во главе с автором упомянутого выше метаанализа. В других РКИ какой-либо пользы от применения пробиотиков выявлено не было.
Резюмируя изложенное, авторы заключили, что нет достаточных аргументов в пользу использования пробиотиков вместе с антибиотиками для лечения колита, вызванного C.difficile, и нет оснований применять пробиотики с этой целью самостоятельно [72].
В фокусе еще одного метаанализа 6 РКИ с общим количеством включенных пациентов 766 чел. находилась профилактика ААД у детей. Установлено, что у лиц, принимавших пробиотики, риск возникновения ААД снизился с 28,5 до 11,9 % (ОР 0,44; 95% ДИ 0,25–0,77) [73]. Не выявлено различий при использовании L.rhamnosus GG, S.boulardii и комбинации Bifidobacterium lactis и Streptococcus termophilus. Тем не менее авторы Кокрейновского обзора отметили, что, несмотря на положительный эффект в предотвращении ААД у детей, установленный в ходе «анализа согласно протоколу» 10 РКИ, подтвердить его при более чувствительном «анализе согласно намерению лечиться» не удалось [74]. Не выявлено и различий между разными дозами препаратов (> 5 млрд КОЕ/сут и < 5 млрд КОЕ/сут) вне зависимости от типа пробиотика.
Предварительные данные свидетельствуют, что прием пробиотиков в виде йогурта, содержащего L.casei DN-114 001, L.bulgaricus и S.thermophilus, на протяжении курса антибактериальной терапии и в течение недели после его окончания может быть полезным компонентом диеты и снижать риск развития ААД и образования токсинов C.difficile у госпитализированных больных старшей возрастной группы [75].
Острая инфекционная диарея
В Кокрейновском обзоре (дата поиска — до июля 2010 г. включительно) проанализированы 63 исследования (всего 8014 пациентов), в которых для лечения острой инфекционной диареи использовались различные варианты пробиотиков [76]. 56 РКИ выполнены у детей. Определение диареи и исходы заболевания в исследованиях варьировали. Авторы пришли к заключению, что в случае приема пробиотиков риск диареи длительностью і 4 дня снижался примерно в 2,5 раза (ОР = 0,41; 95% ДИ 0,32–0,53), средняя продолжительность заболевания сокращалась на 24,76 ч (95% ДИ 15,9–33,6 ч), а частота стула на 2-й день лечения уменьшалась на 0,8 раза/сут (95% ДИ 0,45–1,14). В данный анализ вошли исследования у больных с инфекционными диареями любого генеза (в том числе вирусной диареей и диареей путешественников). Авторы заключили, что пробиотики являются важным и полезным дополнением к регидратационной терапии при лечении острой инфекционной диареи у взрослых и детей. Тем не менее еще предстоит изучить, каким именно группам больных и какие именно пробиотики следует назначать, а также проанализировать стоимость и эффективность вмешательства [76].
В метаанализ исследований эффективности S.boulardii при лечении острой диареи у детей вошли данные 4 РКИ (всего 619 пациентов) [77]. Установлено, что S.boulardii значительно снижает продолжительность диареи по сравнению с контрольной группой: усредненная разница составила 1,1 дня (95% ДИ 0,8–1,3). Однако в крупном исследовании (включен 571 ребенок), в котором сравнивались несколько препаратов пробиотиков и раствор для пероральной регидратации (контрольная группа), продемонстрировано превосходство L.rhamnosus GG и комбинации Lactobacillus delbrueckii подвид bulgaricus, S.thermophilus, L.acidophilus и Bifidibacterium bifidum над S.boulardii или просто пероральной регидратацией, выражавшееся в уменьшении длительности и тяжести острой инфекционной диареи у детей [78].
В многоцентровом двойном слепом плацебо-контролируемом РКИ изучали возможную пользу от приема пробиотиков для профилактики инфекций ЖКТ у детей [79]. Детям в возрасте от 4 до 10 месяцев (всего 201 чел.) в течение 12 недель давали питательные смеси с добавлением L.reuteri SD2112, B.lactis Bb-12 либо не содержащие пробиотики. Обе группы детей, получавших пробиотики, характеризовались меньшим количеством случаев возникновения диареи и меньшей ее продолжительностью. Изменения в частоте заболеваний дыхательных путей отсутствовали. Эффект был более выражен у детей, получавших L.reuteri: в этой группе количество посещений врачей и назначений антибиотиков на протяжении исследования было наименьшим.
В ряде исследований изучали также перспективы использования терапевтических йогуртов для профилактики и лечения внебольничной диареи у детей [80, 81]. Несмотря на многообещающие результаты, необходимы дополнительные исследования для подтверждения эффективности терапевтических йогуртов.
Пробиотики используются и для предупреждения возникновения диареи путешественников. В метаанализе 12 исследований (всего 4709 чел.) у пациентов, принимающих пробиотики, установлено умеренное снижение риска развития диареи путешественников (ОР 0,85; 95% ДИ 0,79–0,91; p < 0,0001) [82]. Не было выявлено различий в эффективности между тестировавшимися микроорганизмами, включая S.boulardii или смеси из видов Lactobacillus и Bifidobacterium.
С другой стороны, в настоящее время нет достаточных данных, чтобы рекомендовать пробиотики для лечения диареи путешественников [83].
Синдром раздраженного кишечника
Интерес к применению пробиотиков при СРК во многом обусловлен тем, что состояние микрофлоры кишечника играет важную роль для его нормального функционирования, а у больных с СРК были выявлены существенные изменения в кишечной микробиоте [84, 85]. Являются эти изменения причиной или следствием СРК, остается неясным [86]. Вероятность того, что отклонения в содержании кишечных бактерий-комменсалов играют причинную роль у некоторых больных с СРК, подтверждается наблюдениями, что симптомы заболевания нередко возникают после инфекционного гастроэнтерита [87], и эта ассоциация может персистировать на протяжении ряда лет [88].
В патогенезе СРК существенную роль играют нарушения моторики и висцеральная гиперчувствительность [89]. В экспериментах на мышах было показано, что Lactobacillus paracasei NCC2461 ослабляет постинфекционные нарушения моторики кишечника [90]. В ряде экспериментальных исследований продемонстрировано, что пробиотики улучшают висцеральную гиперчувствительность [91–93]. Последнее, возможно, объясняется способностью некоторых пробиотиков (в частности, Lactobacillus acidophilus NCFM) индуцировать экспрессию опиоидных и каннабиноидных рецепторов на клетках кишечника [94]. Не вызывает сомнений и значимость воспаления в патогенезе СРК. Противовоспалительные эффекты пробиотиков продемонстрированы во многих исследованиях [95], в том числе у больных с СРК. В частности, Bifidobacterium infantis 35624 нормализуют уровни циркулирующих интерлейкинов (ИЛ)-10 и ИЛ-12 [96].
Несмотря на недостаток данных о терапевтической эффективности пробиотиков при СРК, в нескольких исследованиях продемонстрирован положительный эффект от их применения при данном заболевании, в частности уменьшение болей и вздутия в животе. Так, в одном из исследований у 362 больных установлено снижение всех симптомов СРК примерно на 20 % при использовании Bifidobacterium infantis 35624 в дозировке 1 ∙ 108 КОЕ по сравнению с плацебо [97]. В другом исследовании у 50 детей (СРК верифицировали в соответствии с Римскими критериями II) назначали L.rhamnosus GG или плацебо в течение шести недель [98]. Не выявлено различий между L.rhamnosus GG и плацебо по способности уменьшать боли в животе, однако пробиотик эффективнее плацебо снижал частоту случаев вздутия живота (p = 0,02).
Для лечения симптомов СРК может также использоваться добавление определенных компонентов к диете. Употребление одного из йогуртов, содержащего Bifidibacterium animalis DN-173 010, сопровождалось улучшением качества жизни и снижением частоты возникновения симптомов вздутия живота у больных с СРК [99].
В систематический обзор исследований пробиотиков у взрослых больных с СРК было включено 19 РКИ, опубликованных до июня 2008 г. (всего 1650 пациентов) [100]. Прием пробиотиков (длительность лечения и последующего наблюдения не менее 7 сут.) сравнивали с плацебо или отсутствием лечения. Пробиотики статистически значимо снижали персистирование симптомов СРК, улучшали течение заболевания, уменьшали выраженность болей в животе и метеоризм (рис. 2). Тенденция к уменьшению вздутия живота не достигла статистической значимости (p = 0,058). Количество больных, которых необходимо пролечить пробиотиками (NNT, то есть number needed to treat) для исчезновения симптомов СРК, равнялось 4 (95% ДИ 3–12,5).
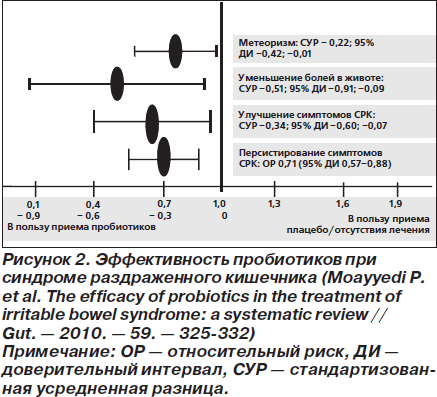
В то же время при анализе исследований, проведенных на самом высоком методическом уровне, различия в персистировании симптомов СРК утрачивали статистическую значимость, а во влиянии на течение заболевания — сохранялись.
Сведения о нежелательных лекарственных явлениях (НЛЯ) содержались лишь в 9 РКИ, причем авторы 6 РКИ сообщили об их отсутствии как в группе плацебо, так и в группе активного лечения. В 3 РКИ приведены данные о НЛЯ у 407 пациентов. Относительный риск возникновения НЛЯ при использовании пробиотиков составил 0,93 (95% ДИ 0,64–1,36), то есть переносимость пробиотиков и плацебо была сопоставимой.
Полученные данные свидетельствуют о позитивных эффектах комбинаций пробиотиков (обычно представителей родов Bifidibacterium и Lactobacillus). При раздельном тестировании лактобактерии не оказывали влияния на симптоматику СРК, в то время как имела место тенденция к позитивному воздействию бифидобактерий (впрочем, не достигшая статистической значимости). Остается неясным, являются ли бифидобактерии активным компонентом комбинаций пробиотиков либо же оба компонента проявляют синергизм (то есть взаимно усиливают эффекты друг друга) [100].
Атопический дерматит
Пробиотики использовались для профилактики развития атопического дерматита у детей. В двойном слепом плацебо-контролируемом РКИ (n = 132) у детей с отягощенным семейным анамнезом по атопическому дерматиту L.rhamnosus GG (1 • 1010 КОЕ/сут) или плацебо назначали сначала матерям на срок 2–4 недели пренатально и затем новорожденным в течение последующих 6 мес. [101]. Ко времени достижения 2-летнего возраста частота диагностированной экземы снизилась наполовину (23 % в группе детей, получавших пробиотики, по сравнению с 46 % в группе принимавших плацебо; ОР = 0,51; 95% ДИ 0,32–0,84). При повторных осмотрах детей в возрасте 4 и 7 лет не выявлено снижения частоты случаев возникновения астмы, пищевой аллергии, аллергических ринитов, что позволяет предположить, что данное вмешательство не предотвращает другие проявления атопии [102, 103].
В более крупном исследовании (n = 925), где использовали L.rhamnosus GG в сочетании с L.rhamnosus LC 705, Bifidobacterium breve Bb99, Propionibacterium freudenreichii, подвид shermanii JS, и 0,8 г галактоолигосахаридов (только у новорожденных), ко времени достижения детьми 2-летнего возраста получены сходные результаты по профилактике атопического дерматита [104]. С другой стороны, в плацебо-контролируемом исследовании L.acidophilus LAVRI-A1 у 232 новорожденных с высоким риском развития атопического дерматита повторить эти данные не удалось, что, вероятно, связано с применением другого штамма или дозы пробиотика [105].
В нескольких небольших РКИ у детей с диагностированным атопическим дерматитом продемонстрирован положительный эффект при лечении пробиотиками [106–108]. Еще в одно двойное слепое плацебо-контролируемое РКИ были включены 56 детей в возрасте от 6 до 18 месяцев со среднетяжелым или тяжелым атопическим дерматитом [109]. Дети получали пробиотик (1 • 109 Lactobacillus fermentum VRI-033) или равный объем плацебо дважды в день на протяжении 8 недель. При завершающей оценке эффективности вмешательства по истечении 16 недель установлено значительное снижение индекса тяжести атопического дерматита (SCORAD) у детей, получавших пробиотик (p = 0,03), в отличие от группы плацебо. Улучшение индекса SCORAD по прошествии 16 недель по сравнению с исходным зарегистрировано у значительно большего количества детей, принимавших пробиотики (92 %), нежели в группе плацебо (63 %, p = 0,01). Однако другие вмешательства с целью облегчения аллергических симптомов не были успешными.
Отрицательный вывод о целесообразности применения пробиотиков для лечения экземы сделали и авторы Кокрейновского сотрудничества [110]. В систематический обзор были включены 12 РКИ у детей (всего 781 пациент с экземой). Пробиотики не уменьшали выраженность проявлений экземы (в частности, зуда) и не снижали тяжесть заболевания (как по мнению пациентов, так и по суждениям врачей). При анализе по подгруппам в зависимости от возраста пациентов, тяжести заболевания, наличия атопии или пищевой аллергии не удалось выделить какую-либо популяцию больных, результаты лечения в которой отличались бы от результатов лечения во всей популяции. С другой стороны, результаты отдельных исследований различались, что указывает на целесообразность продолжения работы в этой области, поскольку другие типы пробиотиков могут быть более эффективными в терапии экземы, нежели изученные до настоящего времени.
Авторы также отметили, что лечение пробиотиками ассоциируется с невысоким риском НЛЯ, представленных инфекциями и ишемией кишечника [110].
В настоящее время нет достаточных оснований, чтобы рекомендовать применение пробиотиков у детей раннего возраста для профилактики аллергических заболеваний и пищевой аллергии. К такому выводу пришли авторы Кокрейновского сотрудничества, проанализировав 12 РКИ [111]. Правда, с существенной оговоркой: к результатам анализа следует относиться с осторожностью из-за большого количества пациентов, не завершивших исследования (17–61 %). В метаанализе 5 РКИ (всего 1477 детей), в которых были представлены данные об исходах вмешательства, установлено статистически значимое снижение заболеваемости экземой у детей (ОР 0,82; 95% ДИ 0,70–0,95). Однако в случае ограничения анализа исследованиями, в которых изучали атопическую экзему, подтвержденную кожным прик-тестом или определением специфического иммуноглобулина Е, различия утрачивали статистическую значимость. Во всех исследованиях, где была установлена польза от применения пробиотиков, использовали L.rhamnosus, а в сами исследования включали детей с высоким риском аллергии. Не сообщалось ни о каких данных в пользу применения пробиотиков для предупреждения других аллергических заболеваний или пищевой аллергии [111].
Инфекции дыхательных путей
Экспериментальные данные указывают на возможность позитивного действия пробиотиков при заболеваниях дыхательных путей у человека посредством стимуляции клеточных и гуморальных иммунологических функций [34–38]. В недавнем исследовании была предпринята попытка оценить возможную пользу от применения пробиотиков для предупреждения или улучшения состояния при инфекциях дыхательных путей (ИДП). В него включались РКИ, посвященные изучению клинической эффективности и безопасности использования пробиотиков для предупреждения инфекций верхних (простуда, острый средний отит, тонзиллит/тонзиллофарингит, синусит и рецидивирующий синусит) или нижних (бронхит, пневмония) дыхательных путей. В окончательный анализ вошли 14 РКИ: 6 РКИ были выполнены у здоровых детей раннего и старшего возраста, 6 РКИ — у здоровых взрослых, по 1 РКИ — у детей и взрослых с ИДП. В 7 РКИ тестировались штаммы Lactobacillus spp., в 1 РКИ — штамм Bifidobacterium longum, в 5 РКИ — различные комбинации штаммов лактобацилл и бифидобактерий, в 1 РКИ — непатогенный штамм Enterococcus faecalis. Длительность применения пробиотиков колебалась от нескольких дней до 7 мес. Сопутствующее лечение включало антибиотики (в 2 РКИ), пребиотики (в 1 РКИ), пищевые добавки (минералы, витамины) — в 2 РКИ [9].
Были получены следующие результаты. Заболеваемость ИДП изучали во всех 14 РКИ. При этом в 10 РКИ она не различалась между группами обследованных, которые получали пробиотики и плацебо, в 4 РКИ — была существенно ниже в группе получавших лечение пробиотиками (из них в 2 РКИ оценивали заболеваемость инфекциями нижних дыхательных путей (пневмония, бронхит, рецидивирующий обструктивный бронхит, в 1 РКИ — обострения хронического рецидивирующего гипертрофического синусита, в 1 РКИ — пребывание на больничном листе по поводу инфекций дыхательных путей и ЖКТ).
В 5 из 6 РКИ, в которых оценивали тяжесть симптомов ИДП, существенное улучшение отмечено у леченных пробиотиками, в 1 РКИ различий с плацебо не выявлено. В 1 РКИ клиническое течение заболевания было легче у больных, принимавших L.reuteri, по сравнению с лицами, принимавшими бифидобактерии или плацебо.
Длительность клинических проявлений ИДП оценивали в 9 РКИ. В 3 из них установлено превосходство лечения пробиотиками, в 6 — различий не выявлено.
Данные о НЛЯ содержались в 10 РКИ. В 6 из них НЛЯ не были связаны с тестируемым продуктом, в 3 — описаны легкие НЛЯ (тошнота, рвота, вздутие живота, диарея). Еще в 1 РКИ диспепсия (включая вздутие живота, метеоризм, тошноту) зарегистрирована у 31,7 % мужчин и 21,7 % женщин, что повлекло за собой снижение дозы пробиотика в 2 раза.
Авторы пришли к следующим выводам:
1) профилактический прием пробиотиков здоровыми людьми и больными с ИДП не уменьшает заболеваемость ИДП;
2) пробиотики оказывают позитивное влияние на тяжесть и (вероятно) длительность последующих ИДП;
3) пробиотики обладают хорошим профилем безопасности [9].
К ограничениям исследования следует отнести невозможность проведения метаанализа из-за гетерогенности включенных в него РКИ с точки зрения популяции больных, использованных пробиотиков, длительности лечения и анализируемых исходов. Воздействие различных пробиотических микроорганизмов при разных заболеваниях человека может значительно различаться.
Применение пробиотиков с целью снижения заболеваемости и тяжести ИДП оценивалось и в других КИ, дизайн которых не позволял включить их в систематический обзор. Так, в двойном слепом рандомизированном перекрестном исследовании профилактическое применение внутрь Lactobacillus fermentum VRI-003 у тренированных спортсменов приводило к существенному сокращению продолжительности ИДП и тяжести их проявлений [112]. В ретроспективном исследовании установлено уменьшение повторных ИДП (в подавляющем большинстве случаев — инфекций верхних дыхательных путей) спустя 10 (но не 20) лет после умышленной колонизации недоношенных детей пробиотическим штаммом Escherichia coli по сравнению с контролем [113].
Некротизирующий колит у недоношенных
Среди основных причин заболеваемости и смертности у недоношенных детей следует упомянуть некротизирующий энтероколит (НЭ), поздний сепсис и затруднения в питании. Применение пробиотиков способствует колонизации кишечника полезными и предупреждает колонизацию патогенными микроорганизмами, улучшает созревание и функцию слизистого барьера кишечника, благотворно модулирует иммунную систему (например, TLR4-рецептор, нуклеарный фактор-kB, воспалительные цитокины) [114, 115], что может способствовать профилактике НЭ.
В систематическом обзоре, подготовленном авторами Кокрейновского сотрудничества, проанализированы 9 РКИ (поиск данных — до декабря 2006 г. включительно; всего 1425 недоношенных детей с гестационным возрастом < 37 нед. и/или массой тела при рождении < 2,5 кг), в которых назначение пробиотиков внутрь сравнивали с плацебо или отсутствием лечения. Применение пробиотиков существенно снижало заболеваемость тяжелым (стадия II и выше) НЭ (ОР 0,32 (95% ДИ 0,17–0,60) и смертность (ОР 0,43 (95% ДИ 0,25–0,75)), однако не влияло на заболеваемость нозокомиальным сепсисом (ОР 0,93 (95% ДИ 0,73–1,19)) и число дней, когда ребенок находился только на парентеральном питании: усредненная разница –1,9 сут (95% ДИ (–4,6) – (+0,77)). Применение пробиотиков не приводило к возникновению системных инфекций [116].
Полученные данные свидетельствуют в пользу применения пробиотиков для снижения смертности и предупреждения НЭ у недоношенных детей с массой тела при рождении свыше 1,0 кг. Целесообразность применения пробиотиков у детей с массой тела при рождении Ј 1,0 кг, по мнению авторов обзора, еще предстоит изучить [116].
Сходные результаты получены в недавнем метаанализе 11 РКИ (поиск данных — до марта 2009 г. включительно; всего 2176 недоношенных детей с гестационным возрастом < 34 нед. и массой тела при рождении < 1,5 кг) (рис. 3) [117]. Пробиотики назначали в один из первых 10 дней жизни, длительность лечения составляла Ј 7 дней. Для предупреждения 1 случая НЭ необходимо пролечить пробиотиками 25 младенцев (NNT = 25, 95% ДИ 17–34), а для предупреждения смерти от любой причины — 20 малышей (NNT = 20, 95% ДИ 14–34). В то же время различия в смертности от НЭ между группами, получавшими и не получавшими пробиотики, не достигли статистически значимой разницы: ОР 0,30 (95% ДИ 0,08–1,08).

Полученные данные указывают на безосновательность опасений транслокации пробиотических бактерий с последующим развитием сепсиса, как и возникновения сепсиса из-за других причин при приеме пробиотиков. Авторы исследования высказали уверенность в отсутствии необходимости продолжать плацебо-контролируемые исследования у данной категории пациентов и присоединились к выводу о, по сути дела, неэтичности неназначения пробиотиков таким детям [118]. В ходе последующих проспективных обсервационных исследований предстоит получить ответы на следующие вопросы: какой продукт/штамм(ы) пробиотиков, в какой дозе, как долго следует назначать недоношенным детям для снижения риска смертности и профилактики НЭ?
Инфекционный мастит во время лактации
Инфекционный мастит развивается у 3–33 % кормящих женщин и является одной из основных причин отлучения от груди. В этиологии заболевания ключевую роль играют стафилококки (прежде всего S.aureus), за ними следуют стрептококки и коринебактерии. В ряде исследований последних лет продемонстрирована высокая эффективность перорального применения пробиотических штаммов L.fermentum CECT5716 и L.salivarius CECT5713, выделенных из грудного молока здоровых кормящих женщин, которые использовались при мастите либо в случаях неэффективности антибиотиков [119], либо вместо антибиотиков [120].
Инфекции мочеполовых путей
В состав урогенитальной флоры здоровых женщин входят многие виды микроорганизмов, причем до наступления менопаузы среди них доминируют лактобациллы (в особенности L.crispatus [121, 122], L.jensenii [121] и L.iners [122, 123]). В вагинальной флоре женщин, никогда не страдавших инфекциями мочевыводящих путей (ИМП), также установлено высокое содержание лактобацилл [124]. Лактобациллы и другие микроорганизмы, которые преобладают во флоре влагалища здоровых женщин (Atopobium spp., Megasphaera spp. и Leptotrichia spp. [122]), вырабатывают молочную кислоту и другие вещества, способствующие подержанию низкого pH во влагалище и предупреждению рецидивов ИМП. Позитивное влияние на колонизацию влагалища лактобациллами и снижение в нем pH оказывают эстрогены, противодействуя таким образом размножению патогенных микроорганизмов [125]. В этом, как полагают, основная причина того, что женщины после наступления менопаузы становятся более чувствительными к урогенитальным инфекциям. С другой стороны, микрофлора во влагалище зачастую значительно изменяется во время менструального цикла, даже у женщин, никогда не страдавших ИМП [126].
Мочеиспускательный канал и влагалище женщин с ИМП колонизируются главным образом уропатогенами, в особенности Escherichia coli и другими представителями семейства Enterobacteriaceae. Уропатогены вырабатывают многие факторы вирулентности, включая адгезины, гемолизин и сидерофоры. Способность уропатогенов вызывать инфекции ассоциируется с адгезией к эпителиальным клеткам мочеполовых путей, друг к другу (аутоагрегация) и, возможно, к другим микроорганизмам (коагрегация) [127]. Хотя адгезия уропатогенов к эпителию мочеполовых путей продемонстрирована во многих исследованиях, остается не до конца понятным, как им удается выживать при прохождении через естественную микрофлору.
Поскольку в урогенитальной флоре здоровых женщин до наступления менопаузы преобладают лактобациллы, было высказано предположение, что восстановление нормального соотношения разных видов микроорганизмов способно предупреждать возникновение ИМП. Во многих исследованиях: in vitro, на животных, микробиологических у здоровых женщин и клинических у женщин с ИМП — оценивали эффективность пробиотиков для профилактики колонизации мочеполовых путей уропатогенами и предупреждения ИМП. В большинстве из них получены обнадеживающие результаты при использовании некоторых штаммов лактобацилл. Среди изученных штаммов наиболее эффективными с точки зрения предупреждения ИМП оказались Lactobacillus rhamnosus GR-1 и L.reuteri RC-14 (прежнее название L.fermentum RC-14). В некоторых исследованиях продемонстрирована эффективность L.casei shirota и L.crispatus CTV-05, в то время как L.rhamnosus GG, по-видимому, не столь эффективны в профилактике ИМП. Полученные в настоящее время данные свидетельствуют, что пробиотики могут быть полезными для предупреждения рецидивирующих ИМП у женщин и что они характеризуются хорошим профилем безопасности. Тем не менее прежде чем рекомендовать широкое использование пробиотиков по данному показанию, необходимо провести дополнительные исследования для подтверждения полученных ранее результатов [128].
Бактериальный вагиноз — распространенное инфекционное заболевание, которое не только сопровождается появлением выделений из влагалища с неприятным запахом, но и ассоциируется с воспалительным заболеванием органов малого таза, возникновением инфекций после гинекологических вмешательств и преждевременными родами. Поскольку содержание лактобацилл в вагинальной микробиоте у больных бактериальным вагинозом снижено по сравнению со здоровыми женщинами, именно эти микроорганизмы тестировались в исследованиях по излечению или как минимум предупреждению рецидивов заболевания.
В многочисленных исследованиях in vitro продемонстрирована способность различных штаммов лактобацилл ингибировать рост бактерий, вызывающих бактериальный вагиноз, посредством выработки перекиси водорода (H2O2), молочной кислоты и/или бактериоцинов и/или путем ингибирования адгезии Gardnerella vaginalis к эпителию влагалища. В большинстве клинических исследований установлено, что интравагинальное введение Lactobacillus acidophilus в течение 6–12 дней либо прием внутрь L.acidophilus или L.rhamnosus GR-1 и L.fermentum RC-14 на протяжении 1–2 месяцев способны увеличивать количество лактобацилл во влагалище, восстанавливать нормальное состояние вагинальной микробиоты и излечивать женщин, страдающих бактериальным вагинозом. Однако в нескольких исследованиях инстилляции лактобацилл внутрь влагалища не оказывали значимого эффекта на лечение заболевания. В большинстве исследований пробиотики сравнивали с плацебо; сравнения с антибиотиками (метронидазол) единичны.
Таким образом, хотя результаты большинства исследований позитивные, в настоящее время однозначно высказаться о перспективах использования пробиотиков для лечения бактериального вагиноза не представляется возможным [129].
Непереносимость лактозы
Непереносимость лактозы представляет собой синдром, включающий в себя диарею, боли в животе, метеоризм или вздутие живота, развивающийся после употребления с пищей лактозы. Последняя представляет собой сахар, входящий в состав молока и других молочных продуктов. Нарушение всасывания лактозы обусловлено дефицитом фермента лактазы, который разрушает лактозу с образованием двух легковсасывающихся простых сахаров — глюкозы и галактозы.
У всех детей вырабатывается достаточно лактазы для переваривания лактозы, содержащейся в материнском молоке или пищевых смесях. Однако после отлучения ребенка от груди у большинства детей имеет место генетически запрограммированное снижение образования лактазы.
Симптомы непереносимости лактозы обусловлены бактериальной ферментацией непереваренной лактозы в кишечнике. Мальабсорбцию лактозы диагностируют посредством назначения стандартной дозы лактозы натощак с последующим измерением содержания водорода в выдыхаемом воздухе: повышение его концентрации обусловлено бактериальной ферментацией непереваренной лактозы в кишечнике. Другие методы диагностики включают в себя измерение активности лактазы в биоптате кишечника или генетическое тестирование полиморфизма гена лактаза-флоризин-гидролазы. Обнаружение мальабсорбции лактозы не обязательно указывает на то, что у пациента возникнут симптомы заболевания. На возникновение симптомов влияют многие факторы: количество принятой с пищей лактозы, остаточная активность лактазы в кишечнике, прием другой пищи вместе с лактозой, способность кишечной флоры ферментировать лактозу, индивидуальная чувствительность к продуктам ферментации лактозы [130].
Доступные в настоящее время данные не позволяют рекомендовать использование пробиотиков для коррекции непереносимости лактозы. В большинстве исследований набор пациентов базировался только на результатах дыхательного теста с водородом, а сведения о возникновении симптомов заболевания после употребления лактозы с пищей отсутствовали. Кроме того, количество включенных пациентов было небольшим и колебалось от 9 до 28 человек [130, 131].
Противопоказания, побочные эффекты и взаимодействия
В настоящее время нет абсолютных противопоказаний к назначению пробиотиков, содержащих Lactobacillus spp., Bifidobacterium spp., S.thermophilus либо S.boulardii. Переносимость пробиотиков обычно хорошая; побочные эффекты отмечаются редко либо же вовсе отсутствуют. Изредка сообщается о единичных случаях метеоризма, незначительном чувстве дискомфорта в области живота. Есть отдельные публикации о бактериальном инфицировании и даже бактериемии, вызванной микроорганизмами, которые назначались внутрь в качестве пробиотиков. Такие осложнения встречаются редко у больных с тяжелыми заболеваниями, лиц с иммунодефицитными состояниями или у детей с синдромом короткого кишечника. Представляется разумным избегать применения пробиотиков у таких пациентов ввиду риска развития сепсиса. В недавнем систематическом обзоре, посвященном безопасности применения L.rhamnosus GG и Bifidobacterium spp., авторы пришли к выводу, что риск возникновения сепсиса невелик и нет ни одного случая, который был бы зарегистрирован в проспективных клинических исследованиях [132]. Не было и случаев развития сепсиса или патологической колонизации у здоровых людей, принимавших пробиотики. Также неизвестно о каких-либо видах взаимодействия с медикаментами и пищевыми добавками.
Дозировки
В клинических исследованиях был изучен широкий спектр дозировок Lactobacillus spp. и других пробиотиков — от 100 миллионов до 1,8 триллиона КОЕ/сут. В большинстве исследований тестировались дозы от 1 до 20 млрд КОЕ/сут. Как правило, применение больших доз пробиотиков (то есть более 5 млрд КОЕ/сут у детей и более 10 млрд КОЕ/сут у взрослых) ассоциировалось с более выраженными результатами исследований. Данные о небезопастности более высоких доз отсутствуют, однако такие дозы дороже и могут оказаться ненужными. Дозировки S.boulardii в большинстве исследований варьируют в пределах от 250 до 500 мг в сутки.
На рынке пробиотики представлены в виде капсул, таблеток, порошков, жидкостей либо их включают в состав пищевых продуктов. Содержание КОЕ пробиотика в разовой дозе или в составе пищевого продукта варьирует в зависимости от бренда. Пациентам следует внимательно ознакомиться с информацией на листах-вкладышах о препарате либо на упаковке пищевого продукта, для того чтобы убедиться в приеме адекватной дозы пробиотика.
В исследованиях по проверке пробиотиков, выпускаемых различными фирмами, выясняется, что более 20 % проверенных брендов не содержат того количества живых микроорганизмов, которое указано на этикетке [61]. Из-за ненадежности некоторых брендов врачам следует рекомендовать к применению только проверенные препараты либо предлагать пациентам самостоятельно оценить качество разных брендов и выбрать среди них оптимальный для себя (табл. 3). Руководства по применению пробиотиков можно также найти в Интернете.
Больным, которые не любят принимать таблетки или порошки, можно посоветовать терапевтические йогурты. Традиционные йогурты обычно не содержат тех количеств КОЕ микроорганизмов, которые изучались в клинических исследованиях. Необходимо продолжать исследования различных пищевых продуктов, содержащих пробиотики, что позволит лучше изучить их эффективность и разработать рекомендации по дозированию.
Заключение
Пробиотики — это микроорганизмы, способные оказывать положительные эффекты на здоровье пациента. Они могут использоваться для предотвращения и лечения вызванной антибиотиками диареи и острой инфекционной диареи у детей и взрослых и профилактики некротического энтероколита у недоношенных детей. Они также могут быть эффективными при синдроме раздраженного кишечника и в лечении атопического дерматита у детей, профилактике и лечении урогенитальных инфекций у женщин. Чаще других в качестве пробиотиков используются следующие виды и штаммы бактерий: Lactobacillus spp., Bifidobacterium spp., Streptococcus thermophilus и Saccharomyces boulardii. В типичных случаях дозировка варьирует в зависимости от используемого продукта, но обычная доза колеблется в пределах от 5 до 10 миллиардов КОЕ в день для детей и от 10 до 20 миллиардов КОЕ в день для взрослых. Значимые нежелательные эффекты встречаются редко; данные о межлекарственных взаимодействиях с медицинскими препаратами отсутствуют.
1. FAO/WHO. Evaluation of health and nutritional properties of powder milk and live lactic acid bacteria. Cordoba, Argentina: Food and Agriculture Organization of the United Nations and World Health Organization Expert Consultation Report, 2001; 1-34.
2. Metchnikoff E. Lactic acid as inhibiting intestinal putrefaction // The prolongation of life: optimistic studies / Ed. by Chalmers Mitchell P. — London: Heinemann, 1907; 161-183.
3. Lilly D.M., Stillwell R.H. Probiotics: growth promoting substances produced by microorganisms // Science 1965; 147: 747-748.
4. Senok A.C., Ismaeel A.Y., Botta G.A. Probiotics: facts and myths // Clin. Microbiol. Infect. 2005; 11: 958-966.
5. Ishibashi N., Yamazaki S. Probiotics and safety // Am. J. Clin. Nutr. 2001; 73: 465S-470S.
6. Donohue C., Salminen S. Safety of probiotic bacteria // Asia Pacific J. Clin. Nutr. 1996; 5: 25-28.
7. Eaton T.J., Gasson M.J. Molecular screening of Enterococcus virulence determinants and potential for genetic exchange between food and medical isolates // Appl. Environ. Microbiol. 2001; 67: 1628-1635.
8. Ibnou-Zekri N., Blum S., Schiffrin E.J., von der Weid W.T. Divergent patterns of colonization and immune response elicited from two intestinal Lactobacillus strains that display similar properties in vitro // Infect. Immun. 2003; 71: 428-436.
9. Vouloumanou E.K., Makris G.C., Karageorgopoulos D.E., Falagas M.E. Probiotics for the prevention of respiratory tract infections: a systematic review // Int. J. Antimicrob. Agents 2009; 34: 197.e1–197.e10.
10. FAO/WHO. Guidelines for the evaluation of probiotics in food. London, Ontario: Food and Agriculture Organization of the United Nations and World Health Organization Working Group Report, 2002; 1-11.
11. Pestka J.J., Ha C.L., Warner R.W., Lee J.H., Ustunol Z. Effects of ingestion of yogurts containing Bifidobacterium and Lactobacillus acidophilus on spleen and Peyer’s patch lymphocyte populations in the mouse // J. Food Prot. 2001; 64: 392-395.
12. Tejada-Simon M.V., Lee J.H., Ustunol Z., Pestka J.J. Ingestion of yogurt containing Lactobacillus acidophilus and Bifidobacterium to potentiate immunoglobulin A responses to cholera toxin in mice // J. Dairy Sci. 1999; 82: 649-660.
13. de Vrese M., Stegelmann A., Richter B., Fenselau S., Laue C., Schrezenmeir J. Probiotics — compensation for lactase insufficiency // Am. J. Clin. Nutr. 2001; 73: 421S-429S.
14. Naidu A.S., Bidlack W.R., Clemens R.A. Probiotic spectra of lactic acid bacteria (LAB) // Crit. Rev. Food Sci. Nutr. 1999; 39: 13-26.
15. Silva M., Jacobus N.V., Deneke C., Gorbach S.L. Antimicrobial substance from a human Lactobacillus strain // Antimicrob. Agents Chemother. 1987; 31: 1231-1233.
16. Strom K., Sjogren J., Broberg A., Schnurer J. Lactobacillus plantarum MiLAB 393 produces the antifungal cyclic dipeptides cyclo(L-Phe-L-Pro) and cyclo(LPhe-trans-4-OH-L-Pro) and 3-phenyllactic acid // Appl. Environ. Microbiol. 2002; 68: 4322-4327.
17. Pothoulakis C., Kelly C.P., Joshi M.A., Gao N., O’Keane C.J., Castagliuolo I. et al. Saccharomyces boulardii inhibits Clostridium difficile toxin A binding and enterotoxicity in rat ileum // Gastroenterology 1993; 104: 1108-1015.
18. Wilson K.H., Perini F. Role of competition for nutrients in suppression of Clostridium difficile by the colonic microflora // Infect. Immun. 1988; 56: 2610–2614.
19. Brook I. The role of bacterial interference in otitis, sinusitis and tonsillitis // Otolaryngol. Head Neck Surg. 2005; 133: 139-146.
20. Collado M.C., Jalonen L., Meriluoto J., Salminen S. Protection mechanism of probiotic combination against human pathogens: in vitro adhesion to human intestinal mucus // Asia Pac. J. Clin. Nutr. 2006; 15: 570-575.
21. Collado M.C., Meriluoto J., Salminen S. Role of commercial probiotic strains against human pathogen adhesion to intestinal mucus // Lett. Appl. Microbiol. 2007; 45: 454-460.
22. Ермоленко Е.И., Черныш А.И., Марцинковская И.В., Суворов А.Н. Влияние пробиотических энтерококков на рост Streptococcus agalactiae // Журн. микробиол., эпидемиол. и иммунол. 2007; 5: 73-77.
23. Lavermicocca P., Valerio F., Lonigro S.L., Di Leo A., Visconti A. Antagonistic activity of potential probiotic lactobacilli against the ureolytic pathogen Yersinia enterocolitica // Curr. Microbiol. 2008; 56: 175-181.
24. Reid G., Tieszer C., Lam D. Influence of lactobacilli on the adhesion of Staphylococcus aureus and Candida albicans to fibers and epithelial cells // J. Ind. Microbiol. 1995; 15: 248-253.
25. Rigothier M.C., Maccario J., Gayral P. Inhibitory activity of Saccharomyces yeasts on the adhesion of Entamoeba histolytica trophozoites to human erythrocytes in vitro // Parasitol. Res. 1994; 80: 10-15.
26. Sgouras D., Maragkoudakis P., Petraki K., Martinez-Gonzalez B., Eriotou E., Michopoulos S. et al. In vitro and in vivo inhibition of Helicobacter pylori by Lactobacillus casei strain Shirota // Appl. Environ. Microbiol. 2004; 70: 518-526.
27. Tagg J.R., Dierksen K.P. Bacterial replacement therapy: adapting ‘germ warfare’ to infection prevention // Trends Biotechnol. 2003; 21: 217-223.
28. Nanno M., Ohwaki M., Mutai M. Induction by Lactobacillus casei of increase in macrophage colony-forming cells and serum colony-stimulating activity in mice // Jpn. J. Cancer Res. 1986; 77: 703-710.
29. Perdigon G., de Macias M.E., Alvarez S., Oliver G., de Ruiz Holgado A.A. Effect of perorally administered lactobacilli on macrophage activation in mice // Infect. Immun. 1986; 53: 404-410.
30. Cross M.L. Microbes versus microbes: immune signals generated by probiotic lactobacilli and their role in protection against microbial pathogens // FEMS Immunol. Med. Microbiol. 2002; 34: 245-253.
31. Kaila M., Isolauri E., Soppi E., Virtanen E., Laine S., Arvilommi H. Enhancement of the circulating antibody secreting cell response in human diarrhea by a human Lactobacillus strain // Pediatr. Res. 1992; 32: 141-144.
32. Majamaa H., Isolauri E., Saxelin M., Vesikari T. Lactic acid bacteria in the treatment of acute rotavirus gastroenteritis // J. Pediatr. Gastroenterol. Nutr. 1995; 20: 333-338.
33. Miettinen M., Matikainen S., Vuopio-Varkila J., Pirhonen J., Varkila K., Kurimoto M. et al. Lactobacilli and streptococci induce interleukin-12 (IL-12), IL-18, and gamma interferon production in human peripheral blood mononuclear cells // Infect. Immun. 1998; 66: 6058-6062.
34. Villena J., Racedo S., Aguero G., Bru E., Medina M., Alvarez S. Lactobacillus casei improves resistance to pneumococcal respiratory infection in malnourished mice // J. Nutr. 2005; 135: 1462-1469.
35. Yasui H., Kiyoshima J., Hori T. Reduction of influenza virus titer and protection against influenza virus infection in infant mice fed Lactobacillus casei Shirota // Clin. Diagn. Lab. Immunol. 2004; 11: 675-679.
36. Yasui H., Kiyoshima J., Hori T., Shida K. Protection against influenza virus infection of mice fed Bifidobacterium breve YIT4064 // Clin. Diagn. Lab. Immunol. 1999; 6: 186-192.
37. Yasui H., Shida K., Matsuzaki T., Yokokura T. Immunomodulatory function of lactic acid bacteria // Antonie Van Leeuwenhoek 1999; 76: 383-389.
38. Lenoir-Wijnkoop I., Sanders M.E., Cabana M.D., Caglar E., Corthier G., Rayes N. et al. Probiotic and prebiotic influence beyond the intestinal tract // Nutr. Rev. 2007; 65: 469-489.
39. de Vrese M., Winkler P., Rautenberg P., Harder T., Noah C., Laue C. et al. Effect of Lactobacillus gasseri PA 16/8, Bifidobacterium longum SP 07/3, B. bifidum MF 20/5 on common cold episodes: a double blind, randomized, controlled trial // Clin. Nutr. 2005; 24: 481-491.
40. Winkler P., de Vrese M., Laue C., Schrezenmeir J. Effect of a dietary supplement containing probiotic bacteria plus vitamins and minerals on common cold infections and cellular immune parameters // Int. J. Clin. Pharmacol. Ther. 2005; 43: 318-326.
41. Reid G., Jass J., Sebulsky M.T., McCormick J.K. Potential uses of probiotics in clinical practice // Clin. Microbiol. Rev. 2003; 16: 658-672.
42. Matsuzaki T., Yamazaki R., Hashimoto S., Yokokura T. The effect of oral feeding of Lactobacillus casei strain Shirota on immunoglobulin E production in mice // J. Dairy Sci. 1998; 81: 48-53.
43. Matsuzaki T., Chin J. Modulating immune responses with probiotic bacteria // Immunol. Cell Biol. 2000; 78: 67-73.
44. Madsen K., Cornish A., Soper P. et al. Probiotic bacteria enhance murine and human intestinal epithelial barrier function // Gastroenterology 2001; 121: 580-591.
45. Chiang B.L., Sheih Y.H., Wang L.H., Liao C.K., Gill H.S. Enhancing immunity by dietary consumption of a probiotic lactic acid bacterium (Bifidobacterium lactis HN019): optimization and definition of cellular immune responses // Eur. J. Clin. Nutr. 2000; 54: 849-855.
46. Gill H.S., Rutherfurd K.J., Cross M.L., Gopal P.K. Enhancement of immunity in the elderly by dietary supplementation with the probiotic Bifidobacterium lactis HN019 // Am. J. Clin. Nutr. 2001; 74: 833-839.
47. Cross M.L., Mortensen R.R., Kudsk J., Gill H.S. Dietary intake of Lactobacillus rhamnosus HNOO1 enhances production of both Th1 and Th2 cytokines in antigen-primed mice // Med. Microbiol. Immunol. (Berl) 2002; 191: 49-53.
48. Holzapfel W.H., Haberer P., Geisen R., Bjorkroth J., Schillinger U. Taxonomy and important features of probiotic microorganisms in food and nutrition // Am. J. Clin. Nutr. 2001; 73: 365S-373S.
49. Sheih Y.H., Chiang B.L., Wang L.H., Liao C.K., Gill H.S. Systemic immunity-enhancing effects in healthy subjects following dietary consumption of the lactic acid bacterium Lactobacillus rhamnosus HN001 // J. Am. Coll. Nutr. 2001; 20: 149-156.
50. Gill H.S., Cross M.L., Rutherfurd K.J., Gopal P.K. Dietary probiotic supplementation to enhance cellular immunity in the elderly // Br. J. Biomed. Sci. 2001; 58: 94-96.
51. Fukushima Y., Kawata Y., Hara H., Terada A., Mitsuoka T. Effect of a probiotic formula on intestinal immunoglobulin A production in healthy children // Int. J. Food Microbiol. 1998; 42: 39-44.
52. Perdigon G., Vintini E., Alvarez S., Medina M., Medici M. Study of the possible mechanisms involved in the mucosal immune system activation by lactic acid bacteria // J. Dairy Sci. 1999; 82: 1108-1114.
53. Mack D.R., Lebel S. Role of probiotics in the modulation of intestinal infections and inflammation // Curr. Opin. Gastroenterol. 2004; 20: 22-26.
54. Miettinen M., Lehtonen A., Julkunen I., Matikainen S. Lactobacilli and streptococci activate NF-kappa B and STAT signaling pathways in human macrophages // J. Immunol. 2000; 164: 3733-3740.
55. Kaila M., Isolauri E., Soppi E., Virtanen E., Laine S., Arvilommi H. Enhancement of the circulating antibody secreting cell response in human diarrhea by a human Lactobacillus strain // Pediatr. Res. 1992; 32: 141-144.
56. Pelto L., Isolauri E., Lilius E.M., Nuutila J., Salminen S. Probiotic bacteria down-regulate the milk-induced inflammatory response in milk-hypersensitive subjects but have an immunostimulatory effect in healthy subjects // Clin. Exp. Allergy 1998; 28: 1474-1479.
57. Gill H.S., Rutherfurd K.J. Viability and dose — response studies on the effects of the immunoenhancing lactic acid bacterium Lactobacillus rhamnosus in mice // Br. J. Nutr. 2001; 86: 285-289.
58. Prescott S.L., Dunstan J.A., Hale J. et al. Clinical effects of probiotics are associated with increased interferongamma responses in very young children with atopic dermatitis // Clin. Exp. Allergy. 2005; 35 (12): 1557-1564.
59. Doron S., Snydman D.R., Gorbach S.L. Lactobacillus GG: bacteriology and clinical applications // Gastroenterol. Clin. North Am. 2005; 34 (3): 483-498.
60. Rosenfeldt V., Benfeldt E., Valerius N.H., Paerregaard A., Michaelsen K.F. Effect of probiotics on gastrointestinal symptoms and small intestinal permeability in children with atopic dermatitis // J. Pediatr. 2004; 145 (5): 612-616.
61. Kligler B., Cohrssen A. Probiotics // Am Fam Physician. 2008; 78 (9): 1073-1078.
62. Falagas M.E., Betsi G.I., Athanasiou S. Probiotics for prevention of recurrent vulvovaginal candidiasis: a review // J. Antimicrob. Chemother. 2006; 58: 266-72.
63. Falagas M.E., Betsi G.I., Athanasiou S. Probiotics for the treatment of women with bacterial vaginosis // Clin. Microbiol. Infect. 2007; 13: 657-664.
64. Falagas M.E., Betsi G.I., Tokas T., Athanasiou S. Probiotics forprevention of recurrent urinary tract infections in women: a review of the evidence from microbiological and clinical studies // Drugs 2006; 66: 1253-61.
65. Betsi G.I., Papadavid E., Falagas ME. Probiotics for the treatment or prevention of atopic dermatitis: a review of the evidence from randomized controlled trials // Am. J. Clin. Dermatol. 2008; 9: 93-103.
66. Watkinson P.J., Barber V.S., Dark P., Young J.D. The use of pre-, pro- and synbiotics in adult intensive care unit patients: systematic review // Clin. Nutr. 2007; 26: 182-192.
67. Jain P.K., McNaught C.E., Anderson A.D.G., MacFie J., Mitchell C.J. Influence of symbiotic containing Lactobacillus acidophilus La5, Bifidobacterium lactis Bb 12, Streptococcus thermophilus, Lactobacillus bulgaricus and oligofructose on gut barrier function and sepsis in critically ill patients: a randomised controlled trial // Clin. Nutr. 2004; 23: 467-475.
68. Olah A., Belagyi T., Issekutz A., Gamal M.E., Bengmark S. Randomized clinical trial of specific Lactobacillus and fibre supplement to early enteral nutrition in patients with acute pancreatitis // Br. J. Surg. 2002; 89: 1103-1107.
69. Besselink M.G.H., van Santvoort H.C., Buskens E., Boermeester M.A., van Goor H., Timmerman H.M. et al. Probiotic prophylaxis in predicted severe acute pancreatitis: a randomised, double-blind, placebo-controlled trial // Lancet 2008; 371: 651-659.
70. Sazawal S., Hiremath G., Dhingra U., Malik P., Deb S., Black R.E. Efficacy of probiotics in prevention of acute diarrhoea: a meta-analysis of masked, randomised, placebo-controlled trials // Lancet Infect. Dis. 2006; 6 (6): 374-382.
71. McFarland L.V. Meta-analysis of probiotics for the prevention of antibiotic associated diarrhea and the treatment of Clostridium difficile disease // Am. J. Gastroenterol. 2006; 101 (4): 812-822.
72. Pillai A., Nelson R.L. Probiotics for treatment of Clostridium difficile-associated colitis in adults // Cochrane Database of Systematic Reviews 2008, Issue 1. Art. No.: CD004611.
73. Szajewska H., Ruszczyński M., Radzikowski A. Probiotics in the prevention of antibiotic-associated diarrhea in children: a meta-analysis of randomized controlled trials // J. Pediatr. 2006; 149 (3): 367-372.
74. Johnston B.C., Supina A.L., Ospina M., Vohra S. Probiotics for the prevention of pediatric antibiotic-associated diarrhea // Cochrane Database Syst Rev. 2007; (2): CD004827.
75. Hickson M., D’Souza A.L., Muthu N., Rogers T.R., Want S., Rajkumar C. et al. Use of probiotic Lactobacillus preparation to prevent diarrhoea associated with antibiotics: randomised double blind placebo controlled trial // BMJ. 2007; 335 (7610): 80.
76. Allen S.J., Martinez E.G., Gregorio G.V., Dans L.F. Probiotics for treating acute infectious diarrhoea // Cochrane Database of Systematic Reviews 2010, Issue 11. Art. No.: CD003048.
77. Szajewska H., Skуrka A., Dylag M. Meta-analysis: Saccharomyces boulardii for treating acute diarrhoea in children // Aliment. Pharmacol. Ther. 2007; 25 (3): 257-264.
78. Canani R.B., Cirillo P., Terrin G. et al. Probiotics for treatment of acute diarrhoea in children: randomized clinical trial of five different preparations // BMJ. 2007; 335 (7615): 340.
79. Weizman Z., Asli G., Alsheikh A. Effect of a probiotic formula on infections in child care centers: comparison of two probiotic agents // Pediatrics. 2005; 115 (1): 5-9.
80. Pedone C.A., Arnaud C.C., Postaire E.R., Bouley C.F., Reinert P. Multicentric study of the effect of milk fermented by Lactobacillus casei on the incidence of diarrhoea // Int. J. Clin. Pract. 2000; 54 (9): 568-571.
81. Pedone C.A., Bernabeu A.O., Postaire E.R., Bouley C.F., Reinert P. The effect of supplementation with milk fermented by Lactobacillus casei (strain DN-114 001) on acute diarrhoea in children attending day care centres // Int. J. Clin. Pract. 1999; 53 (3): 179-184.
82. McFarland L.V. Meta-analysis of probiotics for the prevention of traveler’s diarrhea // Travel Med. Infect. Dis. 2007; 5 (2): 97-105.
83. Hill D.R., Ryan E.T. Management of travellers’ diarrhoea // BMJ 2008; 337: a1746.
84. Malinen E., Rinttila T., Kajander K. et al. Analysis of the fecal microbiota of irritable bowel syndrome patients and healthy controls with real-time PCR // Am. J. Gastroenterol. 2005; 100: 373-382.
85. Kassinen A., Krogius-Kurikka L., Makivuokko H. et al. The fecal microbiota of irritable bowel syndrome patients differs significantly from that of healthy subjects // Gastroenterology 2007; 133: 24-33.
86. Shanahan F. Irritable bowel syndrome: shifting the focus toward the gut microbiota // Gastroenterology 2007; 133: 340-342.
87. Thabane M., Kottachchi D.T., Marshall J.K. Systematic review and meta-analysis: incidence and prognosis of post-infectious irritable bowel syndrome // Aliment. Pharmacol. Ther. 2007; 26: 535-544.
88. Marshall J.K., Thabane M., Garg A.X. et al. Incidence and epidemiology of irritable bowel syndrome after a large waterborne outbreak of bacterial dysentery // Gastroenterology 2006; 131: 445-450.
89. Quigley E.M. Disturbances of motility and visceral hypersensitivity in irritable bowel syndrome: biological markers or epiphenomenon // Gastroenterol. Clin. North Am. 2005; 34: 221-233.
90. Verdu E.F., Bercik P., Bergonzelli G.E. et al. Lactobacillus paracasei normalizes muscle hypercontractility in a murine model of postinfective gut dysfunction // Gastroenterology 2004; 127: 826-837.
91. Verdu E.F., Bercik P., Verma-Gandhu M. et al. Specific probiotic therapy attenuates antibiotic induced visceral hypersensitivity in mice // Gut 2006; 55: 182-190.
92. Kamiya T., Wang L., Forsythe P. et al. Inhibitory effects of Lactobacillus reuteri on visceral pain induced by colorectal distension in Sprague-Dawley rats // Gut 2006; 55: 191-196.
93. Ait-Belgnaoui A., Han W., Lamine F. et al. Lactobacillus farciminis treatment suppresses stress-induced visceral hypersensitivity: a possible action through interaction with epithelial cell cytoskeleton contraction // Gut 2006; 55: 1090-1094.
94. Rousseaux C., Thuru X., Gelot A. et al. Lactobacillus acidophilus modulates intestinal pain and induces opioid and cannabinoid receptor // Nat. Med. 2007; 13: 35-37.
95. Quigley E.M., Flourie B. Probiotics and irritable bowel syndrome: a rationale for their use and an assessment of the evidence to date // Neurogastroenterol. Motil. 2007; 19: 166-172.
96. O’Mahony L., McCarthy J., Kelly P. et al. Lactobacillus and Bifidobacterium in irritable bowel syndrome: symptom responses and relationship to cytokine profiles // Gastroenterology 2005; 128: 541-551.
97. Whorwell P.J., Altringer L., Morel J. et al. Efficacy of an encapsulated probiotic Bifidobacterium infantis 35624 in women with irritable bowel syndrome // Am. J. Gastroenterol. 2006; 101 (7): 1581-1590.
98. Bausserman M., Michail S. The use of Lactobacillus GG in irritable bowel syndrome in children: a double-blind randomized control trial // J. Pediatr. 2005; 147 (2): 197-201.
99. Guyonnet D., Chassany O., Ducrotte P. et al. Effect of a fermented milk containing Bifidobacterium animalis DN-173 010 on the health-related quality of life and symptoms in irritable bowel syndrome in adults in primary care: a multicentre, randomized, double-blind, controlled trial // Aliment. Pharmacol. Ther. 2007; 26 (3): 475-486.
100. Moayyedi P., Ford A.C., Talley N.J., Cremonini F., Foxx-Orenstein A.E., Brandt L.J. et al. The efficacy of probiotics in the treatment of irritable bowel syndrome: a systematic review // Gut 2010; 59: 325-332.
101. Kalliomaki M., Salminen S., Arvilommi H., Kero P., Koskinen P., Isolauri E. Probiotics in primary prevention of atopic disease: a randomised placebo-controlled trial // Lancet 2001; 357 (9262): 1076-1079.
102. Kalliomaki M., Salminen S., Poussa T., Arvilommi H., Isolauri E. Probiotics and prevention of atopic disease: 4-year follow-up of a randomised placebo-controlled trial // Lancet 2003; 361 (9372): 1869-1871.
103. Kalliomaki M., Salminen S., Poussa T., Isolauri E. Probiotics during the first 7 years of life: a cumulative risk reduction of eczema in a randomized, placebo-controlled trial // J. Allergy Clin. Immunol. 2007; 119 (4): 1019-1021.
104. Kukkonen K., Savilahti E., Haahtela T. et al. Probiotics and prebiotic galacto-oligosaccharides in the prevention of allergic diseases: a randomized, double-blind, placebo-controlled trial // J. Allergy Clin. Immunol. 2007; 119 (1): 192-198.
105. Taylor A.L., Dunstan J.A., Prescott S.L. Probiotic supplementation for the first 6 months of life fails to reduce the risk of atopic dermatitis and increases the risk of allergen sensitization in high-risk children: a randomized controlled trial // J. Allergy Clin. Immunol. 2007; 119 (1): 184-191.
106. Viljanen M., Savilahti E., Haahtela T. et al. Probiotics in the treatment of atopic eczema/dermatitis syndrome in infants: a double-blind placebo-controlled trial // Allergy 2005; 60 (4): 494-500.
107. Sistek D., Kelly R., Wickens K., Stanley T., Fitzharris P., Crane J. Is the effect of probiotics on atopic dermatitis confined to food sensitized children? // Clin. Exp. Allergy 2006; 36 (5): 629-633.
108. Passeron T., Lacour J.P., Fontas E., Ortonne J.P. Prebiotics and synbiotics: two promising approaches for the treatment of atopic dermatitis in children above 2 years // Allergy 2006; 61 (4): 431-437.
109. Weston S., Halbert A., Richmond P., Prescott S.L. Effects of probiotics on atopic dermatitis: a randomised controlled trial // Arch. Dis. Child. 2005; 90 (9): 892-897.
110. Boyle R.J., Bath-Hextall F.J., Leonardi-Bee J., Murrell D.F., Tang M.L.K. Probiotics for treating eczema // Cochrane Database of Systematic Reviews 2008, Issue 4. Art. No.: CD006135.
111. Osborn D.A., Sinn J.K.H. Probiotics in infants for prevention of allergic disease and food hypersensitivity // Cochrane Database of Systematic Reviews 2007, Issue 4. Art. No.: CD006475.
112. Cox A.J., Pyne D.B., Saunders P.U., Fricker P.A. Oral administration of the probiotic Lactobacillus fermentum VRI-003 and mucosal immunity in endurance athletes // Br. J. Sports Med. 2010; 44 (4): 222-226.
113. Lodinova-Zadnikova R., Cukrowska B., Tlaskalova-Hogenova H. Oral administration of probiotic Escherichia coli after birth reduces frequency of allergies and repeated infections later in life (after 10 and 20 years) // Int. Arch. Allergy Immunol. 2003; 131: 209-211.
114. Schanler R.J. Probiotics and necrotising enterocolitis in premature neonates // Arch. Dis. Child. Fetal Neonatal Ed. 2006; 91 (6): F395-F397.
115. Martin C.R., Walker W.A. Probiotics: role in pathophysiology and prevention in necrotizing enterocolitis // Semin. Perinatol. 2008; 32 (2):127-137.
116. AlFaleh K.M., Bassler D. Probiotics for prevention of necrotizing enterocolitis in preterm infants // Cochrane Database of Systematic Reviews 2008, Issue 1. Art. No.: CD005496.
117. Deshpande G., Rao S., Patole S., Bulsara M. Updated meta-analysis of probiotics for preventing necrotizing enterocolitis in preterm neonates // Pediatrics 2010; 125; 921-930.
118. Daya S. Can we have too many randomized trials? // Evidence-based Obstetrics & Gynecology. 2005; 7 (4): 169-170.
119. Jimйnez E., Fernбndez L., Maldonado A., et al. Oral administration of lactobacilli strains isolated from breast milk as an alternative for the treatment of infectious mastitis during lactation // Appl. Environ. Microbiol. 2008; 74: 4650-4655.
120. Arroyo R., Martнn V., Maldonado A., Jimйnez E., Fernбndez L., Rodrнguez J.M. Treatment of infectious mastitis during lactation: antibiotics versus oral administration of lactobacilli isolated from breast milk // Clin. Infect. Dis. 2010; 50 (12): 1551-1558.
121. Antonio M., Hawes S., Hillier S. The identification of vaginal Lactobacillus species and the demographic and microbiologic characteristics of women colonised by these species // J. Infect. Dis. 1999; 180: 1950-1956.
122. Zhou X., Bent S.J. Characterization of vaginal microbial communities in adult healthy women using cultivation-independent methods // Microbiology 2004; 150: 2565-2573.
123. Burton J., Cardieux P., Reid G. Improved understanding of the bacterial vaginal microbiota of women before and after probiotic instillation // Appl. Environ. Microbiol. 2003; 69: 97-101.
124. Bruce A.W., Chadwick P., Hassan A. et al. Recurrent urethritis in women // CMAJ 1973; 108 (8): 973-976.
125. Stamm W., Raz R. Factors contributing to susceptibility of postmenopausal women to recurrent urinary tract infections // Clin. Infect. Dis. 1999; 28: 72372-5.
126. Keane F., Ison C., Taylor-Robinson D. A longitudinal study of the vaginal flora over a menstrual cycle // Int. J. STD AIDS 1997; 8: 489-94.
127. Reid G., Sobel J. Bacterial adherence in the pathogenesis of urinary tract infection: a review // Rev. Infect. Dis. 1987; 9: 470-487.
128. Falagas M.E., Betsi G.I., Tokas T., Athanasiou S. Probiotics for prevention of recurrent urinary tract infections in women. A review of the evidence from microbiological and clinical studies // Drugs 2006; 66 (9): 1253-61.
129. Falagas M.E., Betsi G.I., Athanasiou S. Probiotics for the treatment of women with bacterial vaginosis // Clin. Microbiol. Infect. 2007; 13: 657-64.
130. Shaukat A., Levitt M.D., Taylor B.C., MacDonald R., Shamliyan T.A., Kane R.L., Wilt T.J. Systematic review: effective management strategies for lactose intolerance // Ann. Intern. Med. 2010; 152 (12): 797-803.
131. Suchy F.J., Brannon P.M., Carpenter T.O., Fernandez J.R., Gilsanz V., Gould J.B. et al. National Institutes of Health consensus development conference: lactose intolerance and health // Ann. Intern. Med. 2010; 152: 792-796.
132. Hammerman C., Bin-Nun A. Safety of probiotics: comparison of two popular strains // BMJ. 2006; 333 (7576): 1006-1008.






