Международный неврологический журнал 3 (41) 2011
Вернуться к номеру
Применение in vivo 1Н МРС для количественной оценки эффективности препарата Копаксон при лечении пациентов с рецидивирующе-ремиттирующей формой рассеянного склероза
Авторы: Рожкова З.З.1, Кобысь Т.А.2, Омельченко А.Н.1, 1Клиника «Борис», г. Киев, 2Киевская городская клиническая больница № 4
Рубрики: Неврология
Версия для печати
Методом in vivo 1Н магниторезонансной спектроскопии (МРС) изучены особенности церебрального метаболизма пациентов с рецидивирующе-ремиттирующей формой рассеянного склероза (РРРС). Определены спектральные характеристики основных церебральных метаболитов, которые могут служить дифференциально-диагностическими маркерами рассеянного склероза, а также использоваться для in vivo оценки активности рассеянного склероза. Показано, что концентрация N-ацетиласпартата (NAA) — церебрального метаболита, характеризующего нейрональную и аксональную активность, может быть использована для количественной оценки эффективности препарата Копаксон (глатирамера ацетат (ГА), Teva Pharmaceutical Industries Ltd, Петах-Тиква, Израиль) при лечении пациентов с рецидивирующе-ремиттирующей формой. Обнаружено, что за 36 месяцев (при проведении МРТ и in vivo 1Н МРС-исследования 1 раз в 12 месяцев) содержание NAA, а также отношение NAA/Cr (где Cr — креатин, метаболит, ответственный за энергообеспеченность нейронов и аксонов) увеличивается. При МРС-исследовании, проведенном после завершения лечения ГА, отношение NAA/Cr в участках, содержащих как пораженную, так и интактную ткань головного мозга, на 13 % превышает значения, обнаруженные в момент начала лечения. В участках, содержащих только интактную ткань белого вещества головного мозга, среднее значение NAA/Cr на 9,6 % превышает значения, наблюдаемые в момент начала лечения. В группе сравнения, пациенты которой получали ребиф (интерферон-β-1а, Industria Farmaceutica SERONO S.p.A.), эти значения равны 6,8 и 4,3 % соответственно, что указывает на большую эффективность препарата Копаксон при лечении пациентов с РРРС. Сравнение метаболических изменений, наблюдаемых у больных спустя первый год лечения с применением ГА и ребифа и в отдаленном периоде, позволило оценить длительный эффект влияния этих препаратов на восстановление нарушенных вследствие рассеянного склероза аксональных связей, что является подтверждением нейропротекторных свойств ГА.
Рассеянный склероз, магниторезонансная томография, магниторезонансная спектроскопия, церебральный метаболизм, демиелинизация.
Введение
Предположение о том, что наблюдаемое при рассеянном склерозе (РС) нарушение целостности миелиновых оболочек нервов вызвано поражением аксонов, было высказано еще в 1868 году в работах Ж. Шарко [1, 2]. Спустя столетие гистопатологическими исследованиями было доказано, что деструктивные или дегенеративные изменения в ткани мозга, связанные с поражением аксонов, приводят к специфическим для РС нарушениям функций центральной нервной системы (ЦНС) [3]. На основе анализа изменений клинических проявлений заболевания за длительный период наблюдения проведена классификация четырех различных форм РС [3]:
— рецидивирующе-ремиттирующая форма РС (РРРС) характеризуется полным восстановлением функций ЦНС в период ремиссии или, при частичном восстановлении, остаточным дефицитом функций; при последующих обострениях отсутствует прогресс заболевания;
— первично-прогрессирующая форма РС характеризуется прогрессивным нарастанием тяжести заболевания, без обострений, без периодической стабилизации состояния при отсутствии временного, даже незначительного, улучшения;
— вторично-прогрессирующая форма РС характеризуется стабильным прогрессированием заболевания при наличии (или при отсутствии) редких, слабо выраженных рецидивов, которые чередуются с периодами незначительной ремиссии с последующим периодом стабилизации; при последующих обострениях наблюдается прогрессивное нарастание инвалидизации;
— прогрессивно-рецидивирующая форма РС характеризуется прогрессированием заболевания, но с отчетливыми обострениями, при наличии (или отсутствии) периодов полного восстановления функций.
К МРТ-признакам РС относятся обнаруживаемые на Т2-взвешенных МР-изображениях в белом (БВГМ) и в сером веществе головного мозга (СВГМ) множественные участки с увеличением интенсивности МР-сигнала, характерным для воспалительной реакции ткани мозга или для демиелинизации. Топические и временные МРТ-признаки РС, сформулированные в [4], а затем дополненные в [5], позволяют отличить РС от множества заболеваний с подобными РС клиническими проявлениями.
Несмотря на высокую чувствительность МРТ для диагностики РС, этот метод не позволяет in vivo классифицировать различные по клиническому течению формы РС. Классификация РС, основанная на гистопатологических отличиях очагов РС, обнаруживаемых в участках БВГМ, ответственных за различные функции ЦНС, не может быть использована для разработки новых схем лечения РС, оптимизированных для каждой из форм РС. Решение этой задачи требует привлечения методов, позволяющих in vivo получать информацию о физиологических и функциональных изменениях, возникающих в головном мозге при различных формах РС. Одним из таких методов является in vivo 1Н магниторезонансная спектроскопия (МРС), активно используемая в последнее десятилетие для изучения особенностей церебрального метаболизма при разнообразных поражениях ЦНС [6]. Метод 1Н МРС обладает дополнительными по сравнению с МРТ возможностями, определяющими его большую специфичность при исследовании пациентов с патологией ЦНС [7]. Благодаря данным МРС была in vivo подтверждена концепция патогенеза РС, в основе которой лежит поражение аксонов, а также доказана диффузность вовлечения в патологический процесс на различных этапах заболевания не только БВГМ, но и СВГМ [8].
Возможность регистрировать по данным МРС минимальные метаболические изменения как в пораженных, так и в интактных участках ткани головного мозга открывает новые пути клинических приложений данного метода, а именно возможность корректировки схемы лечения пациентов с РС. Поиск новых подходов к лечению РС стимулировал разработку методов ранней дифференциальной диагностики РС и одновременно маркеров, позволяющих оценивать эффективность терапии. Рекомендации по использованию концентрации N-ацетиласпартата (NAA) как маркера оценки тяжести РС приведены в [9].
Данная работа посвящена количественной оценке по данным in vivo 1Н МРС эффективности препарата Копаксон (глатирамера ацетат (ГА), Teva Pharmaceutical Industries Ltd, Петах-Тиква, Израиль) при лечении пациентов с рецидивирующе-ремиттирующей формой РС. Проведен также сравнительный анализ эффективности двух препаратов, используемых для иммуномодулирующей терапии: Копаксона (ГА) и ребифа (интерферон-b-1а, Industria Farmaceutica SERONO S.p.A.). В [10] показано, что препарат Копаксон (ГА), используемый для лечения РРРС, является лекарственным препаратом с несколькими механизмами действия. Один из механизмов состоит в активации Th2-фенотипа ГА-специфических Т-клеток, которые генерируются в периферической нервной системе и мигрируют в ЦНС через гематоэнцефалический барьер [10, 11]. В ЦНС ГА-специфические Т-клетки распознают антигены к основному белку миелина и, учитывая, что эти антигены обладают перекрестной реактивностью, секретируют Th2-цитокины, уменьшая тем самым воспалительную реакцию ткани головного мозга [11].
Материалы и методы
В исследование были включены три группы пациентов, для которых на МР-томографе (Signa Excite HD, 1.5T (GE)) получены МР-изображения и 1Н спектры in vivo. Первую группу (ГАГ) составили 18 пациентов с РРРС (10 женщин и 8 мужчин в возрасте от 24 до 46 лет), ранее не получавших специфического для РС лечения и имевших не менее одного обострения в течение предшествовавших исследованию двух лет, которым было назначено лечение ГА. Вторая группа (РГ) включала 15 пациентов с РРРС (8 женщин и 7 мужчин в возрасте от 21 до 44 лет), также ранее не получавших специфического для РС лечения и имевших не менее одного обострения в течение предшествовавших исследованию двух лет. Пациентам РГ было назначено лечение препаратом ребиф. Для изучения особенностей церебрального метаболизма пациентов с РРРС спектроскопические исследования проводились также в контрольной группе (КГ) из 20 молодых людей (12 женщин и 8 мужчин в возрасте от 23 до 40 лет) без клинических признаков неврологических расстройств.
В данной работе МРТ- и МРС-исследования проводились в три этапа. Этап 1 — перед первым приемом препарата, этап 2 — через 12 месяцев приема ГА (ГАГ) и ребифа (РГ), этап 3 — через 24 месяца с момента первого приема препарата, что соответствует 12 месяцам с момента завершения лечения с использованием ГА и ребифа. Пациенты ГАГ получали ГА в дозе 20 мг в сутки, пациенты РГ — препарат интерферон-b-1а (ребиф) 3 раза в неделю в дозе 44 мкг на прием. ГА и ребиф вводились пациентами самостоятельно, подкожно. Для всех пациентов ГАГ и РГ проводилась оценка степени инвалидизации с использованием шкалы Kurztke Expanded Disability Status Score (EDSS) [12] перед началом исследования и затем каждые 6 месяцев. В период обострения оценка неврологического статуса проводилась ежедневно на протяжении 7 дней с момента обращения пациента и зафиксированного неврологом обострения. За обострение принимали появление новых или ухудшение имеющихся неврологических расстройств длительностью не менее 48 часов. При необходимости к лечению ГА добавляли метилпреднизолон в дозе 1 г/сут с последующим переходом на пероральный прием преднизолона с постепенным снижением дозы. В этом случае проведение МРТ- и МРС-исследований откладывали и проводили спустя 6 недель с момента завершения терапии с использованием стероидов.
При проведении МР-исследований сначала получали сагиттальные Т2-взвешенные МР-изображения, которые использовались затем для планирования аксиальных МР-изображений, взвешенных по Т1, по протонной плотности и Т2 (Double Echo, PD/T2), Т2-FLAIR, а также диффузионно-взвешенных МР-изображений. Затем пациентам внутривенно вводили контрастное вещество (КВ) на основе парамагнитного иона Gd (Gadovist 1.0, Bayer Pharma) в дозе 0,1 мл на 1 кг массы тела и с интервалом не менее 5 минут, в течение которого происходит экстравазация КВ, получали аксиальные Т1-взвешенные изображения. Отметим, что на протяжении необходимого для экстравазации периода времени проводился сбор данных с использованием импульсной последовательности градиентное эхо (3DSPGR), с помощью которой получали изображения, нечувствительные к воздействию КВ, однако, благодаря высокому пространственному разрешению, исключительно информативные для обнаружения очагов РС и измерения их размеров. Спектры были получены с помощью импульсной последовательности SVS STEAM со следующими параметрами сбора данных: TR = 1500 мс, TE = 140 мс, TM = 13 мс, объем области, в которой получают спектр (ОИ), VROI = 2 2 2 см3. Для субъектов КГ спектры были получены в четырех областях: в лобных и затылочных долях обоих полушарий головного мозга. Для пациентов ГАГ и РГ спектры снимали в четырех участках обоих полушарий головного мозга: в наибольшем из обнаруженных в данном полушарии очаге активной демиелинизации и в интактной ткани полушария, содержащего этот очаг. А также симметрично в контралатеральном полушарии на уровне расположения этого очага и на уровне локализации ОИ в интактной ткани пораженного полушария.
Для оценки эффективности терапии строилась карта распределения основных церебральных метаболитов; ОИ охватывала пораженную и интактную ткань головного мозга, содержание метаболитов анализировалось в каждом вокселе спектральной матрицы. Спектры получали с помощью импульсной последовательности 2DCSI со следующими параметрами сбора данных: TR = 1500 мс, TE = 140 мс, VROI = 8 8 2 см3, и анализировали в каждом вокселе спектральной матрицы.
Результаты и обсуждение
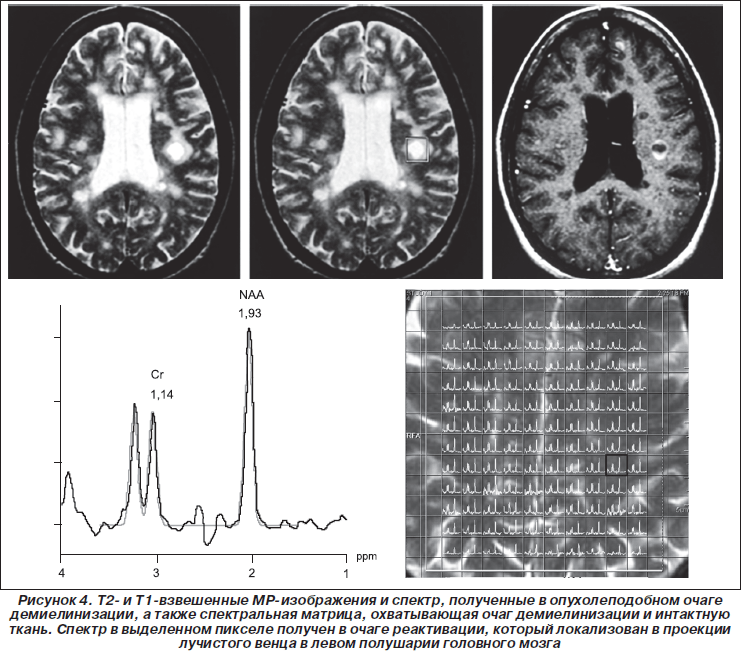
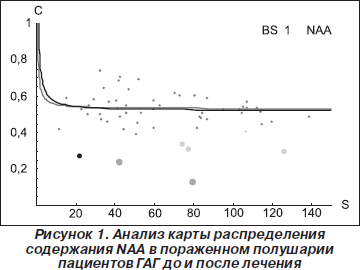
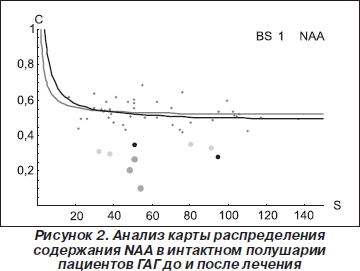
Результаты анализа карты распределения основных церебральных метаболитов для пациентов ГАГ, РГ, а также субъектов КГ при локализации ОИ в различных структурах головного мозга приведены в табл. 1. Результаты анализа изменения соотношений NAA/Cr в каждом вокселе спектральной матрицы для пациентов ГАГ в пораженном и интактном полушарии до и после лечения приведены на рис. 1, 2. Как видно из табл. 1, при сравнении данных, полученных до начала лечения, существенные отличия в содержании основных церебральных метаболитов в ГАГ и в РГ отсутствуют. За период наблюдения 24 месяца средняя частота обострений у пациентов ГАГ уменьшилась почти в 2 раза, а в РГ осталась без значительных изменений. Из сравнения значений NAA/Cr в ГАГ и РГ видно, что перед началом лечения отличия отсутствуют, что соответствует критериям включения в данное исследование, а именно формированию выборки пациентов с одинаковой формой РС, близкими значениями возраста и длительности заболевания. Исключение составляют только отличия по количеству и размерам гиперинтенсивных очагов, обнаруживаемых на Т2-взвешенных изображениях, и по количеству очагов активной демиелинизации на Т1-взвешенных изображениях, полученных после в/в введения КВ.
Среднее значение отношения NAA/Cr в ГАГ после 12 месяцев терапии препаратом Копаксон достоверно увеличивается по сравнению со значениями, полученными до начала лечения (9,3 %; 1,96 по сравнению с 2,14, p = 0,03), и через 24 месяца с момента начала лечения (10,7 %; 1,96 по сравнению с 2,17, p = 0,03). Для этих значений в РГ статистически значимые отличия отсутствуют. Средние значения NAA/Cr в интактной ткани головного мозга в участках, локализованных в пораженном полушарии, в ГАГ достоверно возрастают после 12 месяцев лечения ГА (на 5,4 %; 2,21 по сравнению с 2,08, p = 0,04) и после 24 месяцев наблюдения (на 7,4 %; 2,23 по сравнению с 2,08, p = 0,04). Для значений NAA/Cr в РГ наблюдается уменьшение в среднем на 2 % (2,07 по сравнению с 2,03, p = 0,03) после 12 месяцев наблюдения и на 8,2 % (2,07 по сравнению с 1,90, p = 0,03). Затем на протяжении последующих 12 месяцев у пациентов РГ отсутствует достоверное увеличение значений NAA/Cr. Корреляция между значениями NAA/Cr, количеством очагов, гиперинтенсивных на Т2-взвешенных изображениях, а также между размерами этих очагов отсутствует в обеих группах (ГАГ и РГ соответственно). Кроме того, на протяжении всего периода наблюдения отсутствует корреляция между средними значениями NAA/Cr и количеством, а также размерами очагов активной демиелинизации.
Как следует из рис. 1 и 2, в результате лечения концентрация NAA возрастает как в пораженном, так и в интактном полушарии. Маленькими точками обозначены значения в интактной ткани пораженного и контралатерального полушарий, а большими точками — значения содержания NAA в вокселе, локализованном в очаге активной демиелинизации, и в вокселе, локализованном в контралатеральном полушарии на уровне расположения очага демиелинизации.
Для изучения связи между спектральными характеристиками основных церебральных метаболитов и активностью процесса демиелинизации у пациентов с РРРС в период обострения мы использовали метод получения спектров, описанный в [13].
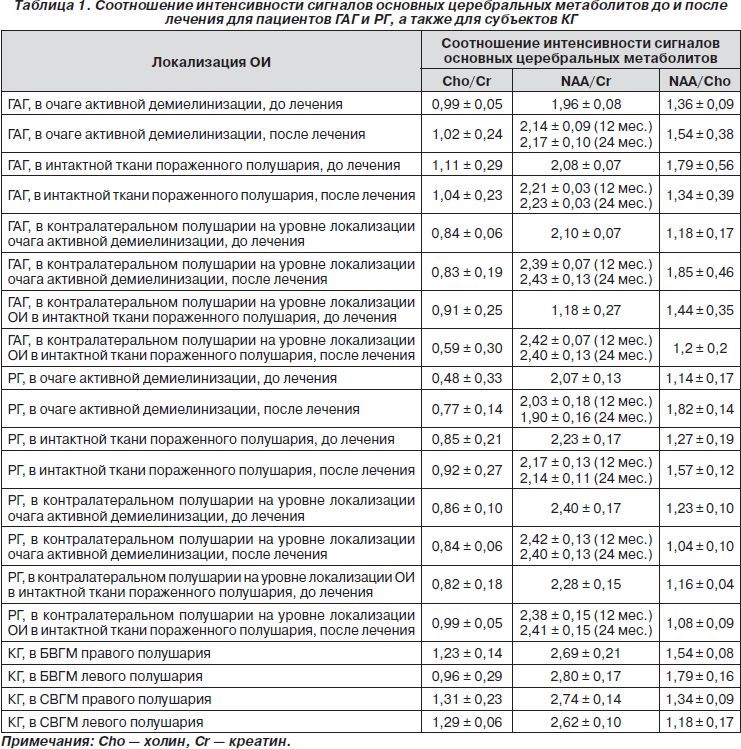
На рис. 3 приведены Т1- и Т2-взвешенные МР-изображения и спектр в очаге демиелинизации в период обострения. На Т1-взвешенном изображении, полученном после внутривенного введения 7,5 мл Gadovist 1.0 (Bayer Pharma), показана ОИ и обозначен пиксель, в котором получен спектр.
Как показано в [7], в спектре, полученном в нормальной ткани головного мозга, реализуется спектральная конфигурация с наиболее интенсивным сигналом NAA, менее интенсивным сигналом Cr и наименее интенсивным сигналом Cho. Сигналы липидов (Lip), лактата (Lac), миоинозитола (mIns), глутамина (Gln) и глутаминовой кислоты (Glu) в нормальной ткани головного мозга не наблюдаются. В соответствии с методом, описанным в [13], путем варьирования ТЕ (ТЕ — длительность интервала формирования сигнала эха) нам удалось разделить резонансные сигналы от Gln и Glu, которые обычно наблюдаются в виде уширенного суммарного сигнала (Glx).
Как видно из спектра, приведенного на рис. 3, сигналы от Gln и Glu наблюдаются в интервале от 2,0 до 3,0 м.д. По изменению интенсивности этих сигналов в различных вокселях спектральной матрицы (ОИ обозначена на рис. 3 прямоугольником) мы обнаружили зависимость между степенью поражения аксонов в очаге активной демиелинизации и нарушением метаболизма Glu. Полученные данные согласуются с приведенными в [14], где было показано, что концентрация Glu увеличивается в очагах активной демиелинизации, а также в смежной с ними интактной ткани БВГМ. Сравнение спектров, полученных в период ремиссии и при обострении, позволяет также заключить, что содержание mIns и Cho возрастает в очагах, появившихся при обострении заболевания, а концентрация NAA уменьшается в очагах, наблюдаемых как в период ремиссии, так и при обострении РС. Увеличение интенсивности сигнала Glu связано с активизацией воспалительной реакции ткани, при которой за счет активации макрофагов и клеток микроглии продуцируется и высвобождается большое количество Glu [15]. Таким образом, содержание Glu можно рассматривать как in vivo маркер воспаления и потенциально возможный маркер поражения нейронов у пациентов с РС. Даже на ранних стадиях РРРС в СВГМ наблюдается уменьшение концентрации Cho, NAA и Glu + Gln, Glх без существенного уменьшения mIns, сопровождающего поражение глиальных клеток. Поскольку уменьшение содержания Glх является признаком метаболической дисфункции и гибели нейрональных и глиальных клеток, то одновременное убывание Glх без существенного сокращения содержания mIns свидетельствует о том, что эти показатели могут быть использованы в качестве дифференциально-диагностических маркеров РС.
Разнообразие наблюдаемых при РС метаболических изменений является подтверждением гетерогенности гистопатологических характеристик очагов РС, причиной возникновения которых является множество патологических процессов: воспаление, демиелинизация, ремиелинизация, поражение аксонов и инфильтрация макрофагов.
Как видно из приведенного на рис. 3 спектра, полученного в очаге активной демиелинизации, наблюдается возрастание интенсивности сигнала Cho и присутствие сигнала Lac. Такая картина соответствует нарушению вследствие демиелинизации целостности клеточных мембран и инфильтрации макрофагов (за счет воспаления или митохондриальной дисфункции) [7]. Поскольку Cr в основном содержится в глиальных клетках, в спектрах, полученных в очагах активной демиелинизации, также наблюдается уменьшение сигнала Cr, что связано с нарушением нормального метаболизма олигодендроцитов [7]. Из рис. 3 видно также, что в спектре, полученном в очаге активной демиелинизации, наблюдается увеличение интенсивности сигналов Lip и mIns, что, согласно [15], является прямым следствием нарушения целостности миелиновой оболочки. Кроме того, как видно из рис. 3, в спектрах, полученных в очаге активной демиелинизации, наблюдается также уменьшение сигнала NAA, что, в свою очередь, является признаком вторичной аксональной дисфункции.
Из анализа спектров, полученных по завершении фазы обострения РС, длящейся обычно от нескольких дней до нескольких недель, интенсивность сигналов Cr и Lac в спектрах, полученных в очагах демиелинизации, возвращается к значениям, наблюдаемым в интактной ткани, в отличие от сигналов Cho и Lip, интенсивность которых достигает нормальных значений лишь спустя несколько месяцев. В то же время интенсивность сигнала NAA в этих спектрах может увеличиваться и достигать значений в норме или же оставаться заниженной по сравнению с наблюдаемой в спектрах, локализованных в нормальной ткани. Обратимое уменьшение NAA прежде всего связано с аксональным дефицитом, вызванным валлеровской дегенерацией, поскольку в настоящее время доказана ее связь с обратимой аксональной дисфункцией и с поражением аксонов. Более того, в [16, 17] показано, что выраженность обратимого поражения аксонов коррелирует с тяжестью функциональных нарушений ЦНС. Первоначальное уменьшение концентрации NAA в пораженном участке ткани можно объяснить тем, что в митохондриях нейронов, расположенных в зоне отека, временно нарушается продуцирование NAA. Затем, по мере рассасывания отека, в эти участки мигрируют созревшие, локально активно пролиферирующие олигодендроциты II типа, которые являются клетками-предшественниками астроцитов, также содержащими NAA. В [17] на основе сравнительного анализа данных МРС и иммунологических исследований пациентов с РС обнаружена корреляция между снижением интенсивности сигнала NAA и аксональным дефицитом, а также между увеличением интенсивности сигнала Cho и количеством очагов активной демиелинизации, или участков глиоза.
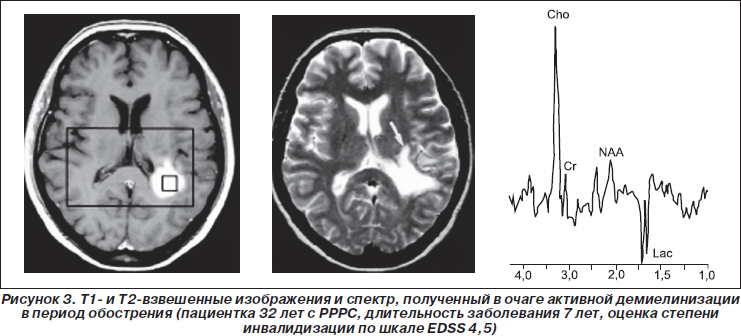
Следует отметить, что подобие спектров, получаемых во внутримозговых опухолях высокой степени анаплазии (высокоинтенсивный сигнал Cho, малоинтенсивный сигнал NAA, наличие сигнала Lac) и в очагах активной демиелинизации, может быть причиной диагностической ошибки [18]. На рис. 4 приведены МР-изображения и спектр, полученные в опухолеподобном очаге демиелинизации, из которых видно нетипичное для спектров опухолей увеличение интенсивности сигнала Cho, наличие пика Laс и Lip, уменьшение интенсивности сигнала NAA и существенное увеличение интенсивности сигналов Glu и Gln, которые обычно не наблюдаются в спектрах злокачественных опухолей. Таким образом, наличие в спектрах сигналов Glu и Gln является одним из дифференциально-диагностических признаков РС.
В данной работе мы использовали метод МРС также для изучения особенностей метаболизма интактной ткани БВГМ. Было обнаружено, что содержание NAA уменьшается как в участках ткани, смежной с очагом РС, так и в участках ткани, удаленных от очага РС. Уменьшение концентрации NAA может быть связано с дисфункцией аксонов, проникающих в крупные очаги РС или в микроскопические очаги демиелинизации, которые зачастую не обнаруживаются. В период ремиссии наблюдается обратимое восстановление значений NAA в участках ткани контралатерального полушария, которые выполняют функции ЦНС, аналогичные таковым в участках с очагами РС. К особенностям спектральных характеристик в очагах РС следует отнести также наблюдаемое увеличение интенсивности сигнала Cr. Такая картина соответствует глиозу, возникающему при реактивных воспалительных процессах [19]. Более того, изменения, наблюдаемые в спектрах БВГМ (увеличение интенсивности сигнала Cho и подвижных Lip, а также уменьшение интенсивности сигнала NAA), могут на несколько месяцев опережать появление очагов РС, которые обнаруживаются на МР-изображениях.
Несмотря на то что в данном исследовании принимали участие пациенты с РРРС, отметим некоторые особенности метаболизма пациентов с иными формами РС, которые не были включены в данное исследование, но также были исследованы нами. Обнаружено, что по спектрам, локализованным в СВГМ, можно in vivo классифицировать различные формы РС. Полученные данные согласуются с результатами [20], в котором была изучена корреляция между МРС-характеристиками и клиническими формами РС и обнаружено, что у пациентов с вторично-прогрессирующей формой РС наблюдается более существенное по сравнению с другими формами РС уменьшение концентрации NAA. Более того, по временной зависимости уменьшения концентрации NAA в БВГМ можно прогнозировать развитие РС как следствие накапливающихся микроскопических патологических изменений в БВГМ. Как следует из [20], концентрация NAA в БВГМ варьирует от значений, наблюдаемых в БВГМ в норме, для пациентов с клинически изолированным синдромом и до существенно более низких значений — для пациентов с прогрессивно-рецидивирующей формой РС. Скорость уменьшения времени концентрации NAA коррелирует с ухудшением клинического статуса пациентов: чем более выражена степень инвалидизации пациента, тем быстрее уменьшается содержание NAA в БВГМ [20].
При РС патологический процесс является более диффузным по сравнению с иными поражениями ЦНС, с вовлечением СВГМ, чем объясняется когнитивный дефицит, зачастую наблюдаемый при РС [21]. В [21] было обнаружено, что степень инвалидизации коррелирует с уменьшением интенсивности сигнала NAA. При этом оказалось, что инвалидизация в большей степени коррелирует с уменьшением интенсивности NAA в БВГМ, чем с увеличением количества и размеров очагов демиелинизации, обнаруживаемых на МР-изображениях. На ранней стадии рецидивирующе-ремиттирующего РС между концентрацией Glх в СВГМ и mIns в БВГМ существует более четкая корреляция со степенью инвалидизации, чем между уменьшением содержания NAA и степенью инвалидизации, что подтверждает предположение о том, что пролиферативная активность глии в большей степени влияет на нарушение функций ЦНС [21].
Как известно, у пациентов с РС первыми поражаются миелиновая оболочка нервов и олигодендроциты [6]. Поскольку при РС наряду с этими структурами — основными мишенями иммунологической атаки — наблюдается поражение аксонов, например проходящих через очаги демиелинизации, нарушение нейропроводящих путей связывают также с вторичной валлеровской дегенерацией, возникающей вне очагов РС. В связи с этим невозможно говорить об абсолютной корреляции между концентрацией NAA и степенью инвалидизации, без учета следующих трех факторов. Во-первых, аксональный дефицит, о котором можно судить по убыванию концентрации NAA, следует корректировать на величину, характеризующую атрофию головного мозга. Во-вторых, при построении корреляций необходимо учитывать область локализации патологического очага. Например, при поражении спинного мозга невозможно установить строгую корреляцию степени инвалидизации с содержанием NAA в головном мозге. И наконец, пластичность мозга может длительное время маскировать накопление признаков аксонального дефицита и поражения ткани головного мозга, что также не позволяет говорить о строгой корреляции между концентрацией NAA и степенью инвалидизации. Наблюдаемое при РС прогрессивное поражение аксонов является диффузным и сопровождает даже начальные стадии воспалительных процессов в ткани головного мозга. Однако на начальном этапе развития РС за счет таких адаптивных механизмов, как кортикальная реорганизация и перераспределение ионных каналов, может достигаться почти полное восстановление нормальных функций ЦНС. Благодаря этому дегенерация нейронов будет на уровне субклинических проявлений. Прогрессивная инвалидизация наступает на этапе, когда пластичность мозга не в состоянии компенсировать дальнейшую гибель нейронов и поражение аксонов. На этом этапе наблюдается настолько активная гибель нейронов, при которой возврат к восстановлению нормальных функций ЦНС уже невозможен. На данном этапе по МР-изображениям отчетливо определяется атрофия головного мозга.
Заключение
В данной работе показано, что значение соотношения интенсивностей сигналов NAA и Cr (NAA/Cr) может быть использовано в качестве биомаркера для оценки эффективности терапии. Из анализа карты распределения основных церебральных метаболитов пациентов обеих групп обнаружено, что применение ГА для лечения пациентов с РРРС, которые ранее не получали специфической для РС терапии, приводит к нормализации церебрального метаболизма, что подтверждается увеличением значений NAA/Cr в участках как пораженной, так и интактной ткани головного мозга. Увеличение NAA/Cr отмечается преимущественно на протяжении первых 12 месяцев лечения, а затем у большинства участвовавших в данном исследовании пациентов наблюдается устойчивая тенденция к возрастанию NAA/Cr, что, по-видимому, является отражением нейропротекторных свойств ГА, уменьшающих характерное для РС сублетальное повреждение нейронов и аксонов. Последний факт является исключительно важным при оценке эффективности терапии, поскольку нарушение аксональных связей является известным проявлением активности процесса демиелинизации, обнаруживаемым на необратимой стадии РС [22, 23]. Несмотря на наличие нескольких возможных механизмов действия ГА, наиболее вероятным объяснением увеличения и стабилизации содержания NAA в ткани головного мозга пациентов, получавших ГА, можно считать миграцию ГА-специфичных лимфоцитов с фенотипом Th2, генерируемых на периферии и проникающих через гематоэнцефалический барьер в ЦНС [10, 11].
Из анализа полученных в этой работе данных следует, что увеличение значений NAA/Cr объясняется повышением содержания NAA, а не уменьшением Cr (табл. 1). Как известно, NAA содержится в основном в нейронах и аксонах, следовательно, концентрация NAA исключительно чувствительна к демиелинизирующим поражениям нейронов и аксонов, а содержание Cr в ткани головного мозга исключительно стабильно, кроме случаев, когда in vivo спектры были получены во внутримозговых опухолях [7].
Кроме того, как следует из полученных нами данных, отсутствие достоверных отличий значений Cho/Cr в ГАГ и РГ также подтверждает вывод о том, что NAA/Cr связано с увеличением NAA. Достоверное увеличение NAA/Cr в белом веществе интактной ткани головного мозга объясняет отсутствие корреляции между возрастанием NAA/Cr и количеством и площадью очагов демиелинизации, обнаруживаемых на Т2-взвешенных изображениях, а также очагов активной демиелинизации, которые выглядят как гиперинтенсивные участки на Т1-взвешенных изображениях, получаемых после введения контрастного вещества. При этом исключается потенциально посторонний эффект влияния стероидной терапии на результаты наших исследований, поскольку, согласно принятому нами протоколу, мы откладывали МРТ- и МРС-исследования на 6 недель после окончания гормональной терапии при обострениях РС.
Реализованная в данной работе сравнительная in vivo оценка эффективности двух иммуномодулирующих препаратов является одним из возможных путей решения задачи подбора индивидуальной для каждого пациента схемы лечения.
Основной результат нашей работы состоит в том, что применение метода in vivo 1Н МРС позволяет на принципиально новом уровне (на уровне клетки) количественно оценивать эффективность лечения пациентов с РРРС как в обнаруживаемых участках демиелинизации, так и в потенциально интактных, не выявляемых на МР-изображениях.
1. Charkot J.M. Histology of «sclerose in plaque» [in French] // Gazette Hosp. (Paris). — 1868. — 41. — 554-566.
2. Charkot J.M. Seminar of March 14 [in French] // Comptes Rendus Seances Memoires Soc. Biol. — 1868. — 20. — 13-14.
3. Lublin F.D., Reingold S.C. Defining the clinical course of multiple sclerosis: results of an international survey. National Multiple Sclerosis Society (USA) Advisory Committee on Clinical Trials of New Agents in Multiple Sclerosis // Neurology. — 1996. — 46. — 907-911.
4. McDonald I. Diagnostic method and investigations in multiple sclerosis // McAlpine’s Multiple Sclerosis / Ed. by W.B. Matthews, A. Compston, I.V. Allen, C.N. Martyn. — London: Churchill Livingstone, 1998. — 251-279.
5. McDonald I. Pathophysiology of multiple sclerosis // McAlpine’s Multiple Sclerosis / Ed. by W.B. Matthews, A. Compston, I.V. Allen, C.N. Martyn. — London: Churchill Livingstone, 1998. — 359-378.
6. Tedeshi G., Binavita S. Magnetoresonance spectroscopy in demyelination and inflammation // Clinical MR Neuroimaging: Physiological and Functional Techniques / Ed. by J.H. Gilard, A.D. Waldman, P.B. Barker. — New York: Cambridge University Press, 2010. — 475-488.
7. Рожкова З.З. 1Н ЯМР in vivo для встановлення зв’язку між локальним станом головного мозку людини і магнітнорезонансними характеристиками церебральних метаболітів: Автореф. дис… канд. фіз.-мат. наук. — Харків, 2005.
8. Kapeller P., McLean M.A., Griffin C.M. et al. Preliminary evidence for neuronal damage in cortical grey matter and normal appearing white matter in short duration relapsing-remitting multiple sclerosis: a quantitative MR spectroscopic imaging study // J. Neurol. — 2001. — 248. — 131-138.
9. De Stefano N., Filippi M., Miller D. et al. Guidelines for using proton MR spectroscopy in multicenter clinical MS studies // Neurology. —2007. — 69. — 1942-1952.
10. Khan O., Shen Y., Caon C. et al. Axonal metabolic recovery and potential neuroprotective effect of glatiramer acetate in relapsing-remitting multiple sclerosis // Multiple sclerosis. — 2005. — 11. — 646-651.
11. Perumal J., Filippi M., Ford C. et al. Glatiramer acetate therapy for multiple sclerosis: a review // Expert Opin. Drug Metab. Toxicol. — 2006. — 2(6). — 1019-1029.
12. Kurztke J.F. Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS) // Neurology. — 1983. — 33. — 1444-1452.
13. Srinivasan R., Sailasuta N., Hurd R. et al. Evidence of elevated glutamate in multiple sclerosis using magnetic resonance spectroscopy at 3T // Brain. — 2005. — 128. — 1016-1025.
14. Cianfoni A., Niku S., Imbesi S.G. Metabolite findings in tumefactive demyelinating lesions utilizing short echo time proton magnetic resonance spectroscopy // AJNR. — 2007. — 28. — 272-277.
15. Hurd R., Napapon S., Srinivasan R. et al. Measurement of brain glutamate using TE-averaged PRESS at 3T // Magn. Reson. Med. — 2004. — 51. — 435-446.
16. Narayana P.A., Doyle T.J., Lai D. et al. Serial proton magnetic resonance spectroscopic imaging, contrast-enhanced magnetic resonance imaging, and quantitative lesion volumetry in multiple sclerosis // Ann.Neurol. — 1998. — 43. — 56-71.
17. De Stefano N., Matthews P.M., Antel J.P. et al. Chemical pathology of acute demyelinating lesions and its correlation with disability // Ann. Neurology. — 1995. — 38. — 901-909.
18. Nath K., Agarwal M., Ramola M. et al. Role of diffusion tensor imaging metrics and in vivo proton magnetic resonance spectroscopy in the differential diagnosis of intracranial mass lesions // Magn. Reson. Imaging. — 2008. — 27. — 198-206.
19. Tadeschi G., Bonavita S., McFarland H.F. et al. Proton MR spectroscopic imaging in multiple sclerosis // Neuroradiology. — 2002. — 44. — 37-42.
20. Tourbah A., Stievenart J.L., Gout O. et al. Localized proton magnetic resonance spectroscopy in relapsing-remitting versus secondary progressive multiple sclerosis // Neurology. — 1999. — 53. — 1091-1097.
21. Tartaglia M.C., Narayanan S., De Stefano N. et al. Choline is increased in pre-lesional normal appearing white matter in multiple sclerosis // J. Neurol. — 2002. — 249. — 1382-1390.
22. Gran B., Tranquill L.R., Chen M. et al. Mechanisms of immunomodulation by glatiramer acetate // Neurology. — 2000. — 55. — 1704-1714.
23. Dhib-Jalbut S. Glatiramer-acetate (Copaxone) therapy for multiple sclerosis // Pharmacol. Toxicol. — 2003. — 98. — 245-255.