Международный неврологический журнал 3 (41) 2011
Вернуться к номеру
Стрес-реакція імунонейроендокринної системи в умовах гострої церебральної ішемії
Авторы: Малахов В.О., Монастирський В.О., Харківська медична академія післядипломної освіти, Сумська міська клінічна лікарня № 4
Рубрики: Неврология
Версия для печати
Досліджено гострофазову відповідь стрес-реалізуючої імунонейроендокринної системи при ішемічному інсульті. Методом імуноферментного аналізу визначено рівні тригерних цитокінів — інтерлейкіну-1β та фактора некрозу пухлини α, стресорних гормонів — адренокортикотропного гормону (АКТГ) та кортизолу, нейропептиду зі стрес-лімітуючою дією — β-ендорфіну в плазмі крові. Виявлено високі рівні інтерлейкіну-1β, фактора некрозу пухлини α, АКТГ, кортизолу та β-ендорфіну в гострий період ішемічного інсульту, що свідчить про активацію стрес-системи у відповідь на гостру церебральну ішемію. Відмічено зв’язок цих показників із тяжкістю стану хворих та ступенем неврологічного дефіциту.
Iмунонейроендокринна система, ішемічний інсульт, цитокіни, гормони.
Гостра цереброваскулярна патологія залишається однією з головних причин захворюваності, інвалідизації та смертності у всьому світі [1]. Останніми роками в Україні зберігається тенденція до зростання захворюваності на гострі порушення мозкового кровообігу. У структурі гострої цереброваскулярної патології провідні позиції займає церебральний ішемічний інсульт (ЦІІ) [3].
Ушкодження речовини головного мозку під час його фокальної ішемії викликає ряд послідовних гематологічних, неврологічних та вегетативних реакцій, що називають гострофазовою відповіддю, вони є основою адаптивних змін [4, 12]. Компонентом відповіді гострої фази є стрес-реалізуюча реакція імунонейроендокринної системи, що викликана генною експресією, синтезом «стрес-білків» та імунних медіаторів, перш за все — інтерлейкіну-1b (ІЛ-1b) та фактора некрозу пухлини a (ФНП-a), які відіграють роль тригерів стрес-відповіді [11]. Тригерні цитокіни діють безпосередньо на нейросекреторні клітини гіпоталамусу, стимулюючи синтез та вивільнення кортиколіберину, а потім — адренокортикотропного гормону (АКТГ) і тим самим спричиняють активацію гіпоталамо-гіпофізарно-наднирникової осі [7]. Результатом активації цієї осі є підвищення рівня кортикостероїдів, насамперед кортизолу. Кортикостероїди спричиняють пригнічення протиапоптозного фактора bcl-2 [8], а катехоламіни викликають у клітинних мембранах стан «гіпервідновленості» та сприяють генерації великої кількості вільних радикалів [10], що призводить до додаткових клітинних втрат у вогнищі церебральної ішемії.
В умовах гострої церебральної ішемії активуються стрес-лімітуючі системи організму, основними з яких є система гамма-аміномасляної кислоти (ГАМК) та система ендогенних опіоїдних пептидів [10]. Найбільш активним представником системи ендогенних опіоїдних пептидів є b-ендорфін. Цей нейропептид здатен обмежувати стрес-реалізуючі впливи гіпоталамо-гіпофізарної ділянки, він справляє гальмівний вплив на нейросекреторні клітини гіпоталамусу, що призводить до пригнічення вивільнення з них кортиколіберину [7].
Стрес-відповідь імунонейроендокринної системи, що первинно є адаптаційною, незабаром починає брати участь у механізмах патологічного процесу; надмірні гормональні зміни викликають комплекс циркуляторних та метаболічних порушень, що замикають патофізіологічні кола гострої судинної мозкової недостатності. Отже, первинно компенсаторний акт стає «хворобою адаптації» [9, 10]. Дані досліджень, що викладені у світовій літературі, є досить фрагментарними та суперечливими, вони не дозволяють створити цілісну картину нейроендокринної відповіді при гострій церебральній ішемії, оцінити співвідношення стрес-реалізуючих та стрес-лімітуючих медіаторів та їх вплив на перебіг захворювання.
Мета роботи — вивчення гострофазової відповіді стрес-реалізуючої імунонейроендокринної системи при ішемічному інсульті шляхом визначення рівнів тригерних цитокінів — ІЛ-1b та ФНП-a, стресорних гормонів — АКТГ та кортизолу, нейропептиду зі стрес-лімітуючою дією — b-ендорфіну.
Матеріали і методи
Під клінічним спостереженням перебувало 128 хворих на каротидний ішемічний інсульт віком 40–70 років (середній вік 59,80 ± 0,68 року), які лікувались у неврологічному відділенні № 2 Сумської міської клінічної лікарні № 4. До обстеження включались лише хворі, які надходили до стаціонару в перші 24 години від початку захворювання. У дослідження не включались хворі з повторними інсультами, порушенням свідомості глибше сопору та патологією ендокринної системи. Тяжкість стану хворих та ступінь неврологічного дефіциту були оцінені за шкалою NIHSS на 1-шу та 10-ту добу інсульту. На підставі сумарного клінічного бала за шкалою NIHSS усіх хворих було розподілено на 4 клінічні групи:
— A (n = 14) — хворі на ЦІІ у відносно задовільному стані (середній бал за шкалою NIHSS 8,22 ± 0,63);
— B (n = 60) — хворі на ЦІІ у стані середнього ступеня тяжкості (середній бал за шкалою NIHSS 12,88 ± 0,49);
— C (n = 40) хворі на ЦІІ у тяжкому стані (середній бал за шкалою NIHSS 15,21 ± 0,59);
— D (n = 14) хворі на ЦІІ у вкрай тяжкому стані (середній бал за шкалою NIHSS 18,23 ± 0,75).
Пацієнти отримували стандартну базисну та диференційовану терапію ішемічного інсульту. Контрольну групу становили 20 практично здорових осіб, які відповідали за статтю та віком пацієнтам основної групи. Вміст ІЛ-1b та ФНП-a визначали у плазмі крові на 1-шу та 10-ту добу ішемічного інсульту методом імуноферментного аналізу за допомогою стандартних наборів виробництва ООО «Укрмедсервіс» (Україна). Визначення вмісту АКТГ у плазмі крові на 1-шу та 10-ту добу інсульту проводили методом імуноферментного аналізу з використанням наборів виробництва Biomerica (США). Рівень кортизолу визначали у плазмі крові також на 1-шу та 10-ту добу ішемічного інсульту методом імуноферментного аналізу за допомогою стандартних наборів виробництва DRG (США). Вміст b-ендорфіну в плазмі крові на 1-шу та 10-ту добу інсульту визначали методом імуноферментного аналізу з використанням наборів виробництва Peninsula Laboratories, Inc. (США).
Статистичну обробку отриманих результатів було виконано за допомогою пакету статистичного аналізу Statistica 8. Були визначені середнє значення (M), стандартна помилка (m), проведено кореляційний аналіз. Порівняння вибірок здійснене із застосуванням критерію Стьюдента (t) та коефіцієнта кореляції (r).
Результати та їх обговорення
Оцінюючи сумарний клінічний бал за шкалою NIHSS, можна відмітити вірогідне його зниження (p < 0,05) у пацієнтів на 10-ту добу інсульту (9,89 ± 0,62) порівняно з першим днем (14,86 ± 0,72).
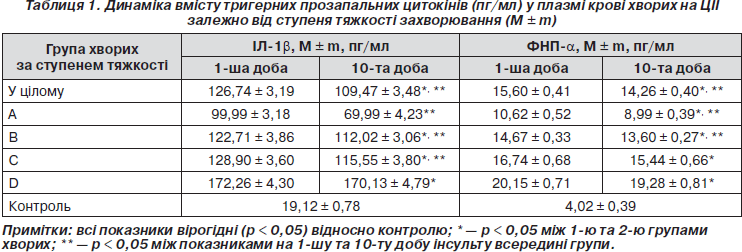
Було виявлено вірогідне підвищення (p < 0,05) рівнів ІЛ-1b на 1-шу (126,74 ± 3,19 пг/мл) та 10-ту добу (109,47 ± 3,48 пг/мл) інсульту порівняно з контролем (19,13 ± 3,49 пг/мл), що узгоджується з даними літератури про гострофазову відповідь на гостру церебральну ішемію [2, 5, 6]. Під час оцінки динаміки цього цитокіну протягом перших 10 діб захворювання (табл. 1) було відмічено вірогідне зниження рівнів ІЛ-1b на 10-ту добу порівняно з першим днем (p < 0,05). Рівні ФНП-a також виявились вірогідно підвищеними (p < 0,05) як на 1-шу (15,60 ± 0,41 пг/мл), так і на 10-ту добу (14,26 ± 0,40 пг/мл) захворювання порівняно з контролем (4,02 ± 0,39 пг/мл). Вивчення динаміки цього цитокіну виявило вірогідне його зниження на 10-ту добу захворювання порівняно з першим днем інсульту (p < 0,05).
У всіх підгрупах хворих на ЦІІ за ступенем тяжкості виявлено вірогідно підвищені (p < 0,05) рівні ІЛ-1b та ФНП-a відносно контролю (табл. 1). Максимальні значення ІЛ-1b та ФНП-a відмічено у вкрай тяжких хворих (172,26 ± 4,30 пг/мл та 20,15 ± 0,71 пг/мл відповідно), що вказує на максимальну напругу стрес-реалізуючої імунонейроендокринної системи при тяжких ішемічних ураженнях головного мозку.
У всіх підгрупах за ступенем тяжкості виявлене вірогідне зниження (p < 0,05) рівнів ІЛ-1b після лікування відносно початкових показників на 1-шу добу. Винятком є підгрупа вкрай тяжких хворих, де зниження рівнів ІЛ-1b на 10-ту добу не досягало ступеня вірогідності (p > 0,05). У підгрупах хворих із легкою та середньою тяжкістю виявлено вірогідне зниження рівнів ФНП-a на 10-ту добу ЦІІ відносно початкових показників на 1-шу добу (табл. 1). У підгрупах тяжких та дуже тяжких хворих зниження рівнів ФНП-a на 10-ту добу не досягало ступеня вірогідності (p > 0,05), що є відображенням тяжкого імунного дистресу у хворих із тяжкими ішемічними ураженнями головного мозку.
Вивчення динаміки АКТГ показало вірогідне (p < 0,05) підвищення рівнів цього гормону в 1-й день інсульту (131,86 ± 4,17 пг/мл) відносно контролю (41,90 ± 1,68 пг/мл). Рівні АКТГ на 10-й день захворювання (47,83 ± 3,52) вірогідно знижувались порівняно з показниками першої доби та наближались до контролю, вірогідно не відрізняючись від нього (p > 0,05). Пікові концентрації АКТГ в дебюті інсульту та нормалізація рівнів на 10-ту добу свідчать про його проміжну, посередницьку роль у стрес-відповіді.
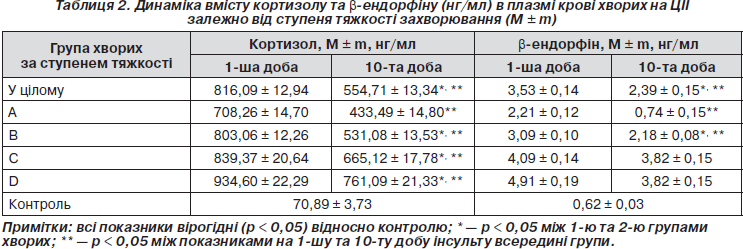
При дослідженні вмісту кортизолу було виявлено вірогідне (p < 0,05) підвищення його рівнів у пацієнтів у дебюті інсульту (816,09 ± 12,94 нг/мл) та на 10-й день захворювання (554,71 ± 13,34 нг/мл) порівняно з контролем (70,89 ± 3,73 нг/мл), що узгоджується з літературними даними про гіперкортизолізм при мозковому інфаркті [9, 12, 13]. Оцінюючи динаміку кортизолу протягом перших 10 днів інсульту, можна відмітити вірогідне (p < 0,05) зниження його вмісту у плазмі крові на 10-ту добу порівняно з початковими рівнями (табл. 2).
У всіх підгрупах хворих на ЦІІ за ступенем тяжкості виявлено вірогідне підвищення рівнів кортизолу відносно контролю (табл. 2). Максимальні значення кортизолу в дебюті захворювання відмічено у дуже тяжких хворих (934,60 ± 22,29 нг/мл), що відображає тяжкий дистрес із проявами гіперкортизолізму. У всіх підгрупах за ступенем тяжкості виявлено вірогідне зниження (p < 0,05) рівнів кортизолу після лікування відносно початкових показників на 1-шу добу.
Дослідження вмісту b-ендорфіну в плазмі крові хворих на ішемічний інсульт (табл. 2) показало вірогідне (p < 0,05) підвищення його рівнів на 1-шу добу інсульту (3,53 ± 0,14 нг/мл) та на 10-й день захворювання (2,39 ± ± 0,15 нг/мл) порівняно з контролем (0,62 ± 0,03 нг/мл). Це свідчить про активацію стрес-лімітуючої системи ендогенних опіоїдних пептидів в умовах гострої церебральної ішемії, яка на початковому етапі носить адаптивний характер та направлена на обмеження стресорних ушкоджень. На 10-ту добу інсульту спостерігалось вірогідне (p < 0,05) зниження концентрацій b-ендорфіну (2,39 ± 0,15 нг/мл), але вони залишались значно вищими за контроль.
У всіх підгрупах хворих на ЦІІ за ступенем тяжкості виявлено вірогідне підвищення (p < 0,05) рівнів b-ендорфіну відносно контролю (табл. 2). Максимальні значення b-ендорфіну в дебюті захворювання відмічено у дуже тяжких хворих (4,91 ± 0,19 нг/мл). У всіх підгрупах за ступенем тяжкості виявлено вірогідне зниження цього нейропептиду після лікування відносно початкових показників на 1-шу добу. Виняток становили групи тяжких та дуже тяжких хворих, у яких спостерігалась лише тенденція до зниження рівнів b-ендорфіну на 10-ту добу інсульту, яка не досягала ступеня вірогідності (p > 0,05).
Таким чином, початок ЦІІ супроводжується підвищенням продукції нейропептиду b-ендорфіну внаслідок активації стрес-лімітуючої системи ендогенних опіоїдних пептидів у відповідь на ушкодження головного мозку. Зі зростанням тяжкості інсульту підвищуються рівні цього пептиду у хворих. Активація стрес-реалізуючої системи призводить до стану напруги з активацією опіоїдергічних структур організму. Оскільки рівень пептиду у плазмі крові відображає ступінь його використовування організмом, можна вважати, що високі рівні b-ендорфіну свідчать про відсутність його адекватного застосування. Ймовірно, опіоїдні пептиди за умов дистресу, досягнувши «критичної» концентрації, викликають стан «ендогенної опіоїдної депресії» та починають справляти нейротоксичну дію.
Кореляційний аналіз взаємозв’язків в імунонейроендокринній системі при ЦІІ виявив певні особливості (рис. 1). Було констатовано прямий вірогідний кореляційний зв’язок значень ІЛ-1b та рівня неврологічного дефіциту за шкалою NIHSS у хворих на ЦІІ в дебюті захворювання (r = +0,51; p < 0,05). У динаміці спостереження між цими показниками зберігався вірогідний кореляційний зв’язок, що не втрачав своєї сили та напрямку (r = +0,65; p < 0,05). Таким чином, виявлені зміни в системі інтерлейкіну-1b у хворих на ЦІІ мали динаміку, залежну від періоду захворювання та ступеня тяжкості мозкового інсульту. Це підтверджує пряме відношення цього цитокіну до ініціації стрес-відповіді на ішемічне ушкодження головного мозку та подальшу участь його у патогенетичних механізмах ЦІІ.
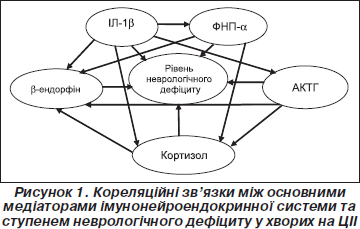
Виявлено прямий вірогідний кореляційний зв’язок значень ФНП-a та рівня неврологічного дефіциту за шкалою NIHSS у хворих на ЦІІ в дебюті захворювання (r = +0,58; p < 0,05). У динаміці спостереження між цими показниками зберігався вірогідний кореляційний зв’язок, що не втрачав своєї сили та напрямку (r = +0,67; p < 0,05). Виявлено вірогідний позитивний кореляційний зв’язок між рівнями ІЛ-1b та ФНП-a на 1-шу добу інсульту (r = +0,52; p < 0,05), що підтверджує однонаправленість їх дії в індукції гострофазової відповіді. Виявлені кореляційні зв’язки між рівнями ФНП-a та ступенем неврологічного дефіциту, а також між рівнями ФНП-a та ІЛ-1b дозволяють думати про вплив цих цитокінів на перебіг ЦІІ.
Констатовано прямий вірогідний кореляційний зв’язок концентрацій АКТГ та рівня неврологічного дефіциту за шкалою NIHSS у хворих на ЦІІ в дебюті захворювання (r = +0,23; p < 0,05). У динаміці спостереження зберігався напрямок зв’язку між цими показниками, але він не досягав статистично вірогідних значень (r = +0,07; p > 0,05). Виявлено вірогідний прямий кореляційний зв’язок між рівнями АКТГ та ІЛ-1b на 1-шу добу захворювання (r = +0,52; p < 0,05), що підтверджує цитокіново-гормональну індукцію стрес-відповіді на ішемічне ушкодження головного мозку. У динаміці спостереження прямий кореляційний зв’язок між цими показниками не досягав статистично вірогідних значень (r = +0,09; p > 0,05). Кореляційний аналіз відношень АКТГ та ФНП-a в дебюті інсульту виявив прямий зв’язок (r = +0,15; p > 0,05), що не досягав статистично вірогідних значень. У динаміці захворювання характер зв’язку зберігався (r = +0,13; p > 0,05).
Констатовано прямий вірогідний кореляційний зв’язок концентрацій кортизолу та рівня неврологічного дефіциту за шкалою NIHSS у хворих на ЦІІ в дебюті захворювання (r = +0,48; p < 0,05). У динаміці спостереження між цими показниками зберігався вірогідний кореляційний зв’язок, що не втрачав своєї сили та напрямку (r = +0,51; p < 0,05). Виявлено вірогідний прямий кореляційний зв’язок між рівнями кортизолу та ІЛ-1b на 1-шу добу інсульту (r = +0,39; p < 0,05). У динаміці спостереження прямий кореляційний зв’язок між цими показниками зберігався (r = +0,28; p < 0,05). Виявлено прямий вірогідний кореляційний зв’язок між рівнями кортизолу та ФНП-a на початку захворювання (r = +0,48; p < 0,05) та в динаміці захворювання (r = +0,34; p < 0,05). Кореляційний аналіз відношень кортизолу та АКТГ в дебюті інсульту виявив вірогідний прямий зв’язок (r = +0,19; p < 0,05). У динаміці захворювання напрямок зв’язку зберігався, але він не досягав ступеня вірогідності (r = +0,11; p > 0,05). Знайдений зв’язок рівнів кортизолу зі ступенем неврологічного дефіциту свідчить про вплив кортизолу на перебіг ЦІІ. Констатовано прямий вірогідний кореляційний зв’язок значень b-ендорфіну та рівня неврологічного дефіциту за шкалою NIHSS у хворих на ЦІІ в дебюті захворювання (r = +0,61; p < 0,05). У динаміці спостереження між цими показниками зберігався вірогідний кореляційний зв’язок, що не втрачав своєї сили та напрямку (r = +0,59; p < 0,05). Виявлено вірогідний прямий кореляційний зв’язок між рівнями b-ендорфіну та ІЛ-1b показниками на 1-шу добу захворювання (r = +0,54; p < 0,05). Це свідчить про те, що після пускової дії тригерних цитокінів та запуску стрес-реалізуючої реакції «вмикаються» стрес-лімітуючі опіоїдергічні механізми. У динаміці спостереження прямий кореляційний зв’язок між цими показниками зберігався (r = +0,48; p < 0,05). Виявлено прямий вірогідний кореляційний зв’язок між рівнями b-ендорфіну та ФНП-a на початку інсульту (r = +0,61; p < 0,05) та в динаміці захворювання (r = +0,32; p < 0,05). Кореляційний аналіз відношень b-ендорфіну та АКТГ в дебюті ЦІІ виявив вірогідний прямий зв’язок (r = +0,23; p < 0,05). У динаміці захворювання напрямок зв’язку зберігався, але він не досягав ступеня вірогідності (r = +0,12; p>0,05). Кореляційний аналіз відношень b-ендорфіну та кортизолу показав вірогідний прямий зв’язок у дебюті інсульту (r = +0,46; p < 0,05) та в динаміці захворювання (r = +0,37; p < 0,05). Зв’язок рівнів b-ендорфіну зі ступенем неврологічного дефіциту свідчить про вплив цього пептиду на перебіг ЦІІ. Можна припустити, що у легких та середньотяжких хворих нейроендокринна відповідь ще не носить характер дистресу та b-ендорфін справляє стрес-лімітуючу та нейропротективну дію. Виявлені зв’язки b-ендорфіну з ІЛ-1b, ФНП-a, АКТГ та кортизолом підтверджують однонаправленість дії імунопептидів, нейропептидів та гормонів в організації стрес-відповіді імунонейроендокринної системи на ішемічне ушкодження головного мозку.
Висновки
Проведене клініко-імунологічне дослідження показало, що церебральний ішемічний інсульт супроводжується гострофазовою відповіддю стрес-реалізуючої імунонейроендокринної системи у вигляді активації гіпоталамо-гіпофізарно-наднирникової осі та системи ендогенних опіоїдних пептидів. Інтенсивність нейроендокринної відповіді залежить від початкових рівнів тригерних цитокінів — ІЛ-1b та ФНП-a. Виявлене підвищення рівнів ІЛ-1b, ФНП-a, АКТГ та кортизолу свідчить про напруженість стрес-реалізуючих механізмів у відповідь на ішемічне ушкодження головного мозку. Показано активацію системи b-ендорфіну при ішемічному інсульті, який у високих концентраціях, ймовірно, справляє нейротоксичну дію. Можна думати про вплив ІЛ-1b, ФНП-a, АКТГ, кортизолу та b-ендорфіну на перебіг гострого ішемічного інсульту. Це підтверджує ушкоджуючий вплив надмірної стрес-реакції, яка під час гострої церебральної ішемії являє собою тяжкий дистрес із цитотоксичною та проапоптозною дією цитокінів та стресорних гормонів, що знаходить своє відображення на сумарному клінічному балі та ступені неврологічного дефіциту. Зв’язок медіаторів стрес-системи зі ступенем неврологічного дефіциту дозволяє розглядати ці показники як діагностичні критерії тяжкості перебігу інсульту та використовувати їх для розробки нових терапевтичних стратегій.
1. Дзяк Л.А., Цуркаленко Е.С. Инсульт у молодых пациентов // Здоров’я України. — 2009. — № 5 (1). — С. 12-15.
2. Жданов Г.Н., Герасимова М.М. Изучение содержания провоспалительных цитокинов в сыворотке крови больных в остром периоде ишемического инсульта // Цитокины и воспаление. — 2006. — Т. 5, № 1. — С. 27-30.
3. Мищенко Т.С. Анализ состояния распространенности, заболеваемости и смертности от цереброваскулярных заболеваний в Украине / Т.С. Мищенко // Судинні захворювання головного мозку. — 2007. — № 3. — С. 24.
4. Трошин В.Д. Стресс и стрессогенные расстройства. Диагностика, лечение и профилактика / В.Д. Трошин. — М.: Медицинское информационное агентство, 2007. — 704 с.
5. Chamorro H., Hallenbeck J. The harms and benefits of inflammatory and immune responses in vascular disease // Stroke. — 2006. — № 37. — Р. 291-292.
6. Emsley H.C.A., Smith C.J., Georgiou R.F. A randomised phase II study of interleukin-1 receptor antagonist in acute stroke patients // Journal of Neurology, Neurosurgery and Psychiatry. — 2005. — № 76. — Р. 1366-1372.
7. Fink G. Encyclopedia of Stress: Four-Volume Set, Volume 1–4. — New York: Academic Press, 2007.
8. Herbert J., Goodyer I.M., Grossman A.B. et al. Do corticosteroids damage the brain? // Journal of Neuroendocrinology. — 2006, Vol. 18. — P. 393-411.
9. Marklund N., Peltonen M., Nilsson T.K. Low and high circulating cortisol levels predict mortality and cognitive dysfunction early after stroke // Journal of Internal Medicine. — 2004. — № 256. — Р. 15-21.
10. Pajovic S.B., Radojcic M.B., Kanazir D.T. Neuroendocrine and oxidoreductive mechanisms of stress induced cardiovascular diseases // Physiological Research. — 2008. — Vol. 57, № 3. — Р. 2-15.
11. Smith C.J., Emsley H.S., Vail A. Variability of the systemic acute phase response after ischemic stroke // Journal of the Neurological Sciences. — 2006. — Vol. 251, № 1. — P. 77-81.
12. Schwarz S., Schwab S., Klinga K. Neuroendocrine changes in patients with acute space occupying ischaemic stroke // Journal of Neurology, Neurosurgery and Psychiatry. — 2003. — № 74. — Р. 725-727.
13. Smith C.J., Emsley H.S., Vail A. et al.Variability of the systemic acute phase response after ischemic stroke // Journal of the Neurological Sciences. — 2006. — Vol. 251, № 1. — P. 77-81.