Международный неврологический журнал 3 (41) 2011
Вернуться к номеру
К вопросу профилактики постпункционной головной боли
Авторы: Бойко В.В., Павлов А.А., ГУ «Институт общей и неотложной хирургии НАМН Украины», Кафедра анестезиологии, интенсивной терапии, трансфузиологии и гематологии, ХМАПО, г. Харьков
Рубрики: Неврология
Версия для печати
Причины возникновения постпункционной головной боли разнообразны. Отсюда и различная эффективность стандартных методов ее лечения. Выявлено, что комбинированное применение Актовегина и цитиколина позволяет улучшить микроциркуляцию, оксигенацию тканей и формирует мембраностабилизирующий потенциал клеток, результатом которого является нейропротективный эффект.
Субдуральная анестезия, постпункционная головная боль.
Механизмы головной боли не однозначны. Известно, что сам мозг не чувствителен к боли. Поэтому обычно головная боль обусловлена раздражением рецепторов мозговых оболочек и/или сосудов краниального региона — прецеребральных, менингеальных и, возможно, внутримозговых.
Ренессанс регионарной анестезии, который наблюдался в конце 90-х годов прошлого столетия, в значительной степени тормозился одним из грозных осложнений — постпункционной головной болью (ППГБ). В настоящее время частота ее существенно снизилась и в среднем составляет, по данным А.М. Овечкина, около 3 % [1], по данным M. Villaregio — от 1 до 10 % [9], а согласно данным I. Bettina — не превышает 13 % [4].
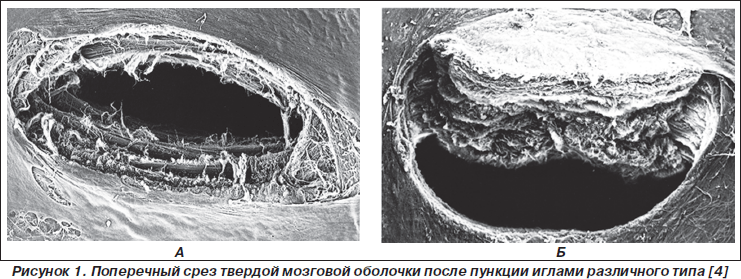
Частота ее развития значительно варьирует в зависимости от нескольких причин. Ряд авторов убедительно доказывают, что среди причин возникновения ППГБ ведущую позицию занимает уровень прогестерона. Вероятность возникновения ППГБ выше у молодых женщин и особенно возрастает при беременности, а также у пациентов мужского пола старше 50 лет. В то же время развитие технологии производства медицинского оборудования привело к совершенствованию игл для проведения регионарной анестезии. Значимым фактором риска ППГБ является диаметр спинальной иглы и ее тип. Причем тип иглы (предпочтительны иглы с кончиком в виде заточенного карандаша типа pencil-point) имеет большее значение, чем диаметр. Проходя через твердую мозговую оболочку, такие иглы в большей степени раздвигают ее волокна, чем пересекают, что способствует быстрому закрытию дефекта (рис. 1А). Форма отверстия в твердой мозговой оболочке при применении игл Квинке напоминает вскрытую консервную банку и совершенно не зависит от положения среза иглы относительно оси позвоночника. Спинальные иглы типа pencil-point и диаметром 25–27 G являются оптимальными для спиральной анестезии, так как при прокалывании твердой мозговой оболочки меньше ее травмируют и раздвигают волокна (рис. 1Б).
Обычно ППГБ развивается в течение 12–48 часов после пункции и в 50 % случаев разрешается спонтанно в течение 5 дней. К 10-м суткам остаточные головные боли сохраняются не более чем у 10 % пациентов, ощущавших их в первые сутки после операции. ППГБ является достаточно интенсивной, имеет симметричный характер (чаще лоб и затылок). Часто ППГБ сопровождается тошнотой и рвотой. Иногда отмечаются снижение слуха, диплопия, болезненные ощущения в мышцах шеи. Боль усиливается при нахождении пациента в вертикальном положении и ослабевает в горизонтальном.
Механизмы возникновения ППГБ. Представления о механизмах ППГБ достаточно противоречивы. Чаще всего ее возникновение объясняют снижением субарахноидального давления за счет подтекания спинномозговой жидкости через пункционный дефект твердой мозговой оболочки. Если истечение ликвора происходит со скоростью, превышающей его продукцию (0,3 мл/мин), возникает вероятность смещения («провисания») интракраниальных структур с натяжением мозговых оболочек и богатых ноцицепторами кровеносных сосудов, особенно значимого при переходе пациента в вертикальное положение. Возникающие при этом болевые импульсы проводятся по тройничному нерву в область лба, по языкоглоточному нерву, ветвям блуждающего нерва и шейным нервам в область затылка и шеи. В некоторых исследованиях подтверждена корреляция (R = 0,739; p < 0,05) между снижением субарахноидального давления и возникновением головной боли [5].
В ряде случаев пациенты с ППГБ отмечают некоторое снижение слуха. Данный эффект считают следствием изменений внутричерепного эндолимфатического давления и натяжения VIII пары черепно-мозговых нервов за счет смещения интракраниальных структур. Интенсивность снижения слуха коррелирует с объемом потерь спинномозговой жидкости (R = 0,816; p < 0,05). Но при этом установлено, что общий объем потери спинномозговой жидкости не коррелирует с интенсивностью ППГБ (R = 0,194; p < 0,05). Показано, что у различных пациентов с одинаковой интенсивностью ППГБ количество теряемой жидкости может варьировать от 10 до 110 мл [6].
Таким образом, возможно предположение, что острое изменение объема спинномозговой жидкости является лишь первичным, инициирующим механизмом ППГБ [8]. Потеря спинномозговой жидкости и изменение градиента давления на протяжении интракраниальных венозных сосудов приводят к их дилатации. Этот факт подтверждается тем, что компрессия яремной вены усиливает интенсивность боли (компрессия яремной вены вызывает венозную дилатацию). В эксперименте на обезьянах было выявлено, что постепенное удаление спинномозговой жидкости приводит к снижению ее давления и увеличивает мозговой кровоток [6]. Развивающаяся при этом компенсаторная дилатация интракраниальных вен, очевидно, является основным механизмом ППГБ. Низкое давление спинномозговой жидкости способствует возникновению ППГБ, но не является основной ее причиной.
Следовательно, в основе ППГБ лежат несколько механизмов, их комбинация с преобладанием тех или иных факторов может быть вариабельна и присуща индивидуально тому или иному пациенту. Отсюда и различная эффективность стандартных методов лечения ППГБ.
Лечение ППГБ основывается на клинико-физиологических представлениях этого осложнения, включает в себя: во-первых, увеличение продукции ликвора; во-вторых, уменьшение истечения ликвора через оставшийся дефект в твердой мозговой оболочке и, в-третьих, улучшение кровотока в краниальных сосудах. Как правило, консервативное лечение ППГБ включает постельный режим (2–3 суток), пероральное или внутривенное введение анальгина (500–1000 мг), кофеина (300–500 мг каждые 4 часа), суматриптана. Эффективность кофеина в этом случае объясняют тем, что потеря спинномозговой жидкости приводит к рефлекторной дилатации сосудов головного мозга. Инфузия 1000 мл раствора Рингера с добавлением 500 мг кофеина приводит к уменьшению симптомов ППГБ. При этом в стандартный объем терапевтических мероприятий не входит метаболическая поддержка, целью которой является структурно-функциональная поддержка мембран интракраниальных структур.
Целью данного исследования было определение целесообразности применения и минимально необходимого объема метаболической поддержки у пациентов, которые перенесли субдуральную анестезию.
Материалы и методы исследования
Исследование проведено на базе ГУ «ИОНХ АМНУ». В исследовании принимали участие 67 пациентов в возрасте 24,4 ± 1,3 года, среди них было 30 (44,7 %) мужчин и 37 (55,3 %) женщин, у которых в послеоперационном периоде в течение первых суток отмечались приступы головной боли. Все пациенты были прооперированы по поводу варикозной болезни нижних конечностей. Обезболивание проводилось по стандартной методике субдуральной анестезии, в качестве местного анестетика использовался бупивакаин. Оценку выраженности болевого синдрома осуществляли при помощи ВАШ. Все пациенты были разделены на две группы: в I группе (n = 29) проводилось лечение ППГБ согласно общепринятой методике с использованием волемической нагрузки и кофеина 500 мг каждые 4 часа; во II группе (n = 38) терапия была дополнена инфузией Актовегина 400 мг и цитиколина (Цераксона) 500 мг однократно в первые сутки послеоперационного периода в течение трех дней. Исследование проводилось в первые, третьи, пятые и седьмые сутки.
Для оценки стрессорной реакции использовали скрининг гликемии по стандартной методике. Оценивали уровень доставки (DO2) и утилизации кислорода (VO2) расчетным способом согласно формулам: DO2 = Qt∙CaO2 и VO2 = CB∙(CaO2∙CvO2), где CaO2 — содержание кислорода в артериальной крови, определяемое как CO2 = Hb∙1,39∙SO2 + 0,0031∙PO2, соответственно Hb — концентрация гемоглобина, SO2 — насыщение гемоглобина кислородом, PO2 — напряжение кислорода; CvO2 — содержание кислорода в венозной крови.
Определяли уровень фосфолипидов (ФСЛП) по методике Илька. Обработка данных была проведена на основе t-критерия Стьюдента и непараметрического U-критерия Манна — Уитни.
Обсуждение полученных результатов
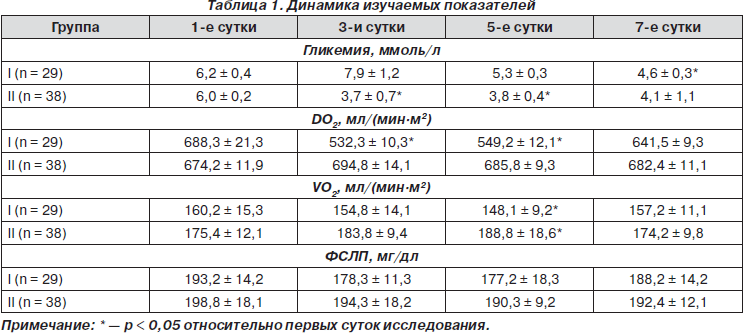
В результате проведенного исследования отмечалась тенденция к гипергликемии у пациентов I группы (табл. 1), что соответствовало превышению (p < 0,05) на 19,6 % относительно нормального значения на третьи сутки после оперативного вмешательства. В то время как во II группе наблюдается противоположная тенденция к повышенному метаболизму глюкозы, что соответствовало снижению (p = 0,05) на третьи сутки до уровня 3,7 ± 0,7 ммоль/л. Как видно, уровень гликемии в группах сравнения имел тенденцию к колебаниям в пределах нормы, однако в I группе колебания происходили у верхней границы нормы, во II группе, напротив, у нижней. По всей видимости, возможно предположение о том, что происходила повышенная утилизация глюкозы.
Это способствовало стимуляции образования аденозинтрифосфорной кислоты и нормализации энергетического метаболизма, улучшению обмена веществ и функционирования клетки. Вследствие этого значительно ослаблялось превращение глюкозы через пируват в ацетил-коэнзим А (ацетил-КоА). В свою очередь, ацетил-КоА является важным субстратом аэробного обмена и энергообеспечения клетки. Кроме того, он необходим для образования ацетилхолина — важнейшего нейромедиатора центральной нервной системы. Таким образом, при использовании Актовегина проявлялось его инсулиноподобное действие. Полученные данные соответствуют результатам исследования Е.А. Ушкалова [3], который выявил ангиопротективный эффект у пациентов с диабетической ангиопатией. Модуляция активности внутриклеточного транспорта глюкозы способствует интенсификации процессов липолиза.
Во II группе исследования отмечено существенное повышение адаптационно-компенсаторного потенциала нейронов, что является важнейшей целью нейрометаболической фармакотерапии. Под влиянием Актовегина значительно повышаются транспорт и утилизация кислорода не только нейронами мозга, но и клетками разных органов и систем. Так, на протяжении раннего послеоперационного периода превышение (p < 0,05) величины DO2 отмечается на 3,0 % в течение трех суток относительно начального этапа исследования, что соответствует синхронному превышению исходных данных величиной VO2 на 4,7 % соответственно. В то же время в I группе упомянутые показатели имеют недостоверные (p > 0,05) колебания в пределах нормы. По всей видимости, возможно предположение о том, что Актовегин способствует улучшению оксигенации микроциркуляторного кровотока. В результате улучшается энергообмен в эндотелии сосудов, что приводит к улучшению перфузии органов и тканей и снижению периферического сосудистого сопротивления [2].
Результатом использования цитиколина явилась стабильность уровня ФСЛП во II группе. В I группе данный показатель имел достоверную тенденцию (p < 0,05) к снижению на 8,2 % в течение пяти суток после выполнения субдуральной анестезии относительно исходных данных. Очевидно, что липидергическое действие позволяет сохранять композиционные, каркасные и матричные свойства мембран клеточных кластеров (нейрональных, миокардиальных, гепатоцитарных). Такой эффект цитиколина (Цераксона) формирует поливалентность его действия. По данным de la Morena [7], суть его заключается в образовании фосфатидилхолина (и других фосфолипидов), за счет чего мембраны продолжают функционировать в условиях гипоксемии. Если каркас мембраны сохранен, то в нем удерживается ее содержимое, то есть рецепторы, холестерин, посредники пострецепторных сигналов и т.д. обеспечивают эффективное функционирование клеточных структур.
Следовательно, комбинированное применение Актовегина и цитиколина (Цераксона) позволяет улучшить микроциркуляцию, оксигенацию тканей и формирует мембраностабилизирующий потенциал клеток, результатом которого является нейропротективный эффект. Подтверждением эффективности предложенной терапии была динамика ППГБ (рис. 2).
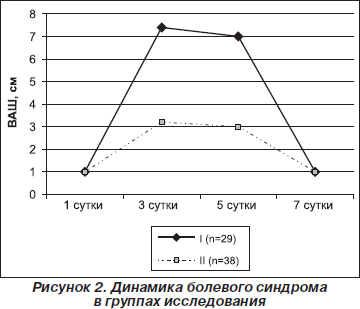
Нетрудно увидеть, что в I группе исследования интенсивность болевого синдрома имела устойчивую тенденцию к усилению (p < 0,05) в течение трех суток после выполнения субдуральной анестезии. Интенсивность ППГБ соответствовала критерию «сильной» головной боли (7,4 ± 0,9 см) и сохранялась вплоть до пятых суток. Одновременно с этим во II группе в указанные временные интервалы интенсивность ППГБ соответствовала «слабой» головной боли. Обращает на себя внимание, что к пятым суткам количество пациентов, не имеющих признаков ППГБ, составляло 11 (28,9 %), а в I группе — 4 (13,7 %) человека.
Таким образом, проведенное исследование показало, что использование Актовегина и цитиколина (Цераксона) в комплексной терапии ППГБ путем многофакторного влияния на микроциркуляторный кровоток и трансмембранный массоперенос способствует регрессированию клинических проявлений осложнений субдуральной анестезии.
1. Овечкин А.М. Осложнения спиральной анестезии / А.М. Овечкин, С.А. Осипов // Журнал интенсивной терапии. — 2005. — № 3. — С. 58-64.
2. Павлов О.О. Вплив динаміки показників мікроциркуляторної ланки на динаміку маркерів ендотеліальної дисфункції при експериментальному стрес-ураженні // Вісник Вінницького національного медичного університету. — 2008. — № 12(1). — С. 132-134.
3. Ушкалова Е.А. Антиоксидантные и антигипоксические свойства Актовегина // Трудный пациент. — 2005. — № 3. — С. 1-5.
4. Bettina I. Effect of intrathecal ketamine added to bupivacaine for spinal anaesthesia / I. Bettina, S. Каthrivеl // Anaesthesia. — 2000. — Vol. 55. — P. 899-904.
5. Benzon H., Nemickas R., Molloy R. Lumbar and thoracic epidural blood injections for the treatment of spontaneous intracranial hypotension // Anesthesiology. — 1996. — Vol. 85. — P. 920-922.
6. Hattingh J. The effect of hypoxia on haemoglobins and ATP levels in three freshwater fish species / J. Hattingh, G.L. Smit // Comparative Biochemistry and Physiology. — 1978. — Vol. 3. — P. 519-521.
7. De la Morena Ligouri G. Transient neurological symptoms after spinal anesthesia with mepivacaine and lidocaine / De la Morena Ligouri G., Zayas V., Chisholm M. // Anesthesiology. — 1991. — Vol. 88. — P. 619-623.
8. Raskin F. Орtiмаl dose of intrathecal clonidine added to sufentanil plus bupivacaine for labour analgesia / F. Raskin, A.T. Sia // Anaesthesiology. — 2000. — Vol. 47. — P. 875-80.
9. Villaregio M. Safety and efficacy of postoperative epidural analgesia / Villaregio M., Schug S., Watson D. // British Anaesthesiology. — 2001. — Vol. 87. — P. 47-61.