Международный неврологический журнал 3 (41) 2011
Вернуться к номеру
Біль: від молекулярних механізмів до клінічних аспектів
Авторы: Яворська Н.П., Львівський національний медичний університет імені Данила Галицького
Рубрики: Неврология
Версия для печати
У статті розглянуто основні механізми формування больових відчуттів. Описано різні види ноцицепторів та їх роль у сприйнятті больових подразників. Звернено увагу на різноманітні зміни при розвитку периферичної та центральної сенситизації.
Біль, ноцицептори, сенситизація.
Незважаючи на те, що біль є важливим фізіологічним механізмом, часто вона переходить у патологічну форму, спричиняючи страждання. Біль є однією з основних скарг пацієнтів, які звертаються до лікарів, особливо до неврологів. Проблемам болю приділяють значну увагу, оскільки збільшується кількість хворих із різними больовими синдромами, а ефективність лікування їх часто є незадовільною [1].
За визначенням Міжнародної асоціації з вивчення болю (International Association for the Study of Pain (IASP), біль — це неприємне сенсорне й емоційне переживання, пов’язане з наявними чи можливими пошкодженнями тканин, або таке, що описується в термінах такого пошкодження.
Больові відчуття потрібні у нашому житті, оскільки сигналізують організму про небезпеку. Важливість болю як відчуття можна показати на прикладі людей, у яких спостерігаються вроджені порушення сприйняття больових подразників. У них часто виникають різноманітні травми, такі як опіки, переломи тощо, оскільки порушені захисні рефлекси на різні чинники зовнішнього середовища. В той же час існує низка захворювань, при яких біль втрачає своє захисне значення внаслідок змін у периферичній та центральній нервовій системі. При цьому біль стає хронічним, а подразники, що не мають загрози для організму, сприймаються як біль.
Отже, за останній час зросла кількість досліджень, присвячених механізмам болю, що, в свою чергу, тісно пов’язане з активним пошуком нових препаратів, які могли б полегшити стан хворих із болем.
Ноцицепція — це процес сприйняття субпопуляцією периферичних нервових закінчень (ноцицепторами) інтенсивних теплових, механічних чи хімічних стимулів [2]. Ноцицептори збуджуються лише від подразників, які можуть загрожувати організму. Таким чином, нервові закінчення больових рецепторів сприймають різноманітні стимули (термічні, механічні та хімічні).
Виділяють два основних класи ноцицепторів [3]. І клас включає в себе середнього діаметра мієлінізовані (Аd) волокна, що пов’язані зі швидким, локалізованим, первинним болем. Цей клас, у свою чергу, поділяють згідно з електрофізіологічними характеристиками на два типи:
— тип І включає в себе високопорогові механічні ноцицептори, або НТМ (higt-threshold mechanical) ноцицептори, які сприймають механічні та хімічні подразнення, але мають високий поріг до температурних стимулів (більше 50 °С);
— тип ІІ Аd-ноцицепторів має високий поріг до механічних подразників, але низький до температурних.
ІІ клас ноцицепторів — це малого діаметра немієлінізовані С-волокна, що сприймають погано локалізований, так званий вторинний біль. Вони є досить гетерогенними. Пептидергічні С-волокна виділяють нейропептиди, субстанцію Р та пептид, генетично пов’язаний з кальцитоніном (calcitonin-gene related peptide, CGRP). На їх поверхні відбувається експресія рецептора TrkA нейротрофіну, що чутливий до фактора росту нервів (nerve growth factor, NGF). Непептидергічна популяція С-ноцицепторів містить рецептор нейротрофіну c-Ret, що чутливий до ней-ротрофічного фактора, який отриманий з гліальних клітин (glial-derived neurotrophic factor, GDNF), а також до нейротурину та артеміну [4].
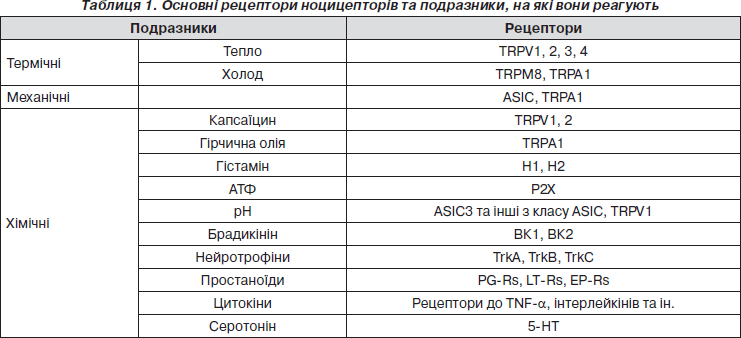
Окрему групу становлять чутливі до механічних та температурних подразників нервові закінчення (mechano-heat-sensitive fibers, CMHs) [5], а також так звані «німі» рецептори, які чутливі до механічних та нечутливі до температурних стимулів, більше реагують на хімічні речовини (капсаїцин, гістамін) і активуються лише при пошкодженнях [6]. Ноцицептори можуть відрізнятися наявністю на їх поверхні різноманітних каналів, що є чутливими до тепла (TRPV1), холоду (TRPM8), кислого середовища (ASICs), хімічних речовин (TRPA1) тощо [7].
Отже, гострий біль пов’язаний зі сприйняттям температурних, механічних та хімічних стимулів.
Вважається, що поріг больової чутливості при дії тепла знаходиться близько 43 °С [8, 9], коли активується ванілоїдний рецептор TRPV1, стимуляцію якого викликає також капсаїцин, що зумовлює появу пекучого болю. Іншими кандидатами на сприйняття больових температурних подразників є рецептори TRPV2, TRPV3 та TRPV4, що, ймовірно, активуються при різних температурах [10]. Зокрема, для рецептора TRPV2 поріг активації становить близько 52 °С, для TRPV3 та TRPV4 — між 25 та 35 °С.
Для дослідження болю при дії холоду переважно використовується ментол та евкаліпт, а його сприйняття пов’язують в першу чергу з рецептором TRPM8, поріг активації якого знаходиться близько 25 °С [11]. Робота TRPM8 тісно пов’язана з потенціалзалежними калієвими та кальцієвими каналами, що справляють на нього модулюючий вплив [12, 13]. Сприйняття низьких температур (менше 15 °С) може відбуватися за рахунок активації рецептора TRPA1 [14].
Больові механічні стимули, як було зазначено вище, сприймаються як Аd-волокнами ІІ типу та С-волокнами з високими порогами до механічних подразнень, так і низькопороговими Аd-волокнами І типу. Крім того, у відчутті вібрації та легкого тиску беруть участь Аb-закінчення, що іннервують клітини Меркеля, тільця Пачіні та волосяні фолікули. У сприйнятті механічних подразників надавали особливе значення рецепторам, чутливим до кислот (acid-sensitive ion channel, ASIC), однак їх роль на сьогодні поки що не підтверджена [15]. Іншими кандидатами на участь у сприйнятті механічних больових подразників є TRPV-, TRPА1- та KCNK-рецептори, дослідження яких триває [16–18].
Рецептори, чутливі до хімічних чинників, сприймають подразники зовнішнього та внутрішнього середовища. У даному процесі провідна роль належить TRP-каналам. Доведено, що вони реагують на великий спектр речовин, включаючи капсаїцин (TRPV1), ментол (TRPM8), їдкі компоненти гірчиці та часнику (TRPA1) [19].
Основні рецептори, що розміщені на больових рецепторах, та їх чутливість подано в табл. 1.
Ноцицептори передають інформацію у центральні відділи нервової системи за допомогою генерації потенціалу дії, що викликається активацією потенціал-залежних калієвих та натрієвих каналів. У С-волокнах значно поширеними є декілька видів потенціалзалежних натрієвих каналів, зокрема Nav1.7 та Nav1.8. Зміни у каналі Nav1.7 можуть спричиняти еритромелалгію, пароксизмальні виражені больові розлади (paroxysmal extreme pain disorder) та бути причиною гіперчутливості після запальних процесів [20–22]. Іншим важливим натрієвим каналом є Nav1.8, що має особливе значення у сприйнятті низькотемпературних подразників [12]. Потенціалзалежні натрієві канали є точками прикладання для місцевих анестетиків та деяких антидепресантів [23], а також можливими мішенями для майбутніх медикаментів (зокрема, для лікування холодової алодинії та больових синдромів при запаленні) [24].
Важливим у сприйнятті больових відчуттів є потенціалзалежні кальцієві канали, що переважно розміщені на С-волокнах. Серед цих каналів найбільшу уваги привертають N-, P/Q- та T-типи. P/Q-тип знаходиться на синаптичних закінчення в II–IV пластинах заднього рогу. Порушення роботи каналу цього типу може проявлятися геміплегічною мігренню [25]. З кальцієвими рецепторами пов’язують болі при діабетичній полінейропатії, гіперчутливість при ушкодженні нервів, виникнення нейрогенного запалення [4, 26]. Одна з субодиниць цих каналів (a2d) є мішенню дії габапентинів при лікуванні больових синдромів [27].
Тіла нейронів, що сприймають больові відчуття, знаходяться в спинномозкових або тригемінальних гангліях та мають периферичний відросток (дендрит), що йде до органів, та центральний (аксон), який закінчується у спинному мозку. Ці нейрони є псевдоуніполярними, а речовини, що в них синтезуються, розподіляються однаково між дендритом та аксоном, а отже їх периферичний та центральний відросток біохімічно мало відрізняються. Це дає їм можливість сприймати та передавати інформацію у двох напрямках. Хоча тільки периферичний відросток здатний відповідати на подразнення зовнішнього середовища (температура, холод, механічні стимули), велика кількість ендогенних молекул (іони водню, ліпіди, нейротрансмітери) можуть регулювати чутливість як периферичного, так і центрального відростка [4].
Центральні відростки прямують до спинного мозку, де закінчуються на клітинах заднього рогу. Ноцицептори Аd-типу закінчуються на І та V пластинах сірої речовини спинного мозку, а С-ноцицептори — на І та ІІ пластинах [2]. У той же час на відміну від больової чутливості волокна, що сприймають легкий дотик, проводяться по мієлінізованим Аb-волокнам та закінчуються на ІІІ, IV та V пластинах, що має значення в диференціації різних подразників. Отже, волокна, що сприймають як больові (Аd- та С-волокна), так і небольові (Аb-аференти) подразники, закінчуються на нейронах V пластини (так звані нейрони широкого динамічного діапазону — wide dynamic range (WDR) neurons), які також сприймають аференти від вісцеральних рецепторів. Таким чином, ці ней-рони пов’язані з рефлекторними болями у ділянках Захар’їна — Геда [4].
Виражена стратифікація виявляється також і для різних типів волокон [28]. Наприклад, більшість пептидергічних волокон закінчується у І пластині та задній частині ІІ пластини, а непептидергічних — в середніх відділах ІІ пластини (рис. 1).
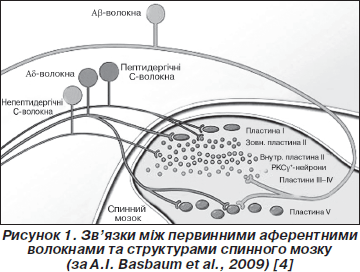
Нейрони І та V пластин формують спіноталамічні та спіноретикулярні тракти, що прямують відповідно до таламуса та стовбура мозку, а потім до кори головного мозку. Спинномозково-ретикулярні тракти погано проводять локалізоване больове відчуття. Поки що не визначено конкретної ділянки в корі головного мозку, що відповідає за біль [29]. З емоційним компонентом больових відчуттів пов’язують передню поясну закрутку та острівець, а з локалізацією — ділянки сомато-сенсорної кори [4].
Отже, спочатку больовий імпульс опрацьовується у задніх рогах спинного мозку, потім — на стовбуровому рівні, після чого в таламусі він набуває характеру первинного відчуття. Аналіз імпульсу закінчується в корі, де він усвідомлюється, локалізується та здійснюється його психологічна оцінка. У больовій інтеграції суттєве місце займає лімбічна система, яка також відповідає за емоційне забарвлення больових відчуттів.
У сприйнятті больових подразників важливою є робота ендогенної опіоїдної системи. До основних опіоїдних пептидів належать ендорфіни, енкефаліни та динорфіни, які походять з білків попередників — проопіомеланокортину, проенкефаліну та продинорфіну. Ефект цих пептидів виникає при дії їх на опіоїдні рецептори: μ (мю), d (дельта) та k (каппа), які, в свою чергу, поділяються на підгрупи. Крім цих загальновідомих рецепторів, виділяють так звані опіоїдні рецептори-сироти (ORL1), які хоч і дуже подібні до опіоїдних, однак не зв’язують налоксон. Рецепторів до ендогенних опіатів найбільше в желатинозній субстанції, сірій речовині навколо сільвієвого водопроводу, у таламусі, гіпоталамусі, лімбічній системі. Ендорфіни зв’язуються з μ- та d-рецепторами, динорфіни — з k-рецепторами, а енкефаліни виявляють свою дію через d-рецептори [30]. Рецептори типу μ переважають в пептидергічній популяції нейронів, а d-рецептори переважно розміщені на непептидергічних нейронах [31].
Найбільша кількість ендорфінів спостерігається в nucleus arcuatus гіпоталамуса, що тісно пов’язане з сірою речовиною навколо водопроводу середнього мозку [32]. Клітини nucleus tractus solitarius, які знаходяться у стовбурі мозку, також містять ендорфіни і впливають на нейрони спинного мозку. Крім цього, у задньому розі спинного мозку знаходиться невелика кількість нейронів, нейромедіатором яких є b-ендорфін [33].
Нейрони, які містять енкефаліни, знаходяться переважно в лімбічних структурах (гіпокамп, перегородка, stria terminalis) і тісно пов’язані з емоційною складовою болю. Динорфіни розміщені у лімбічній системі, в спинному мозку (переважно в інтернейронах), а також знайдені в шкірних нервах [30].
Окрім опіатної, існують також інші антиноцицептивні системи, зокрема серотонінергічна, ГАМКергічна та норадренергічна [34]. Серотонінергічна система в першу чергу пов’язана з ядром шва стовбура мозку, норадренергічна — з деякими структурами ретикулярної формації [1]. Участю норадренергічної та серотонінергічної систем може бути пояснене послаблення больового синдрому при дії антидепресантів.
У механізмах хронізації болю можуть бути задіяні як периферичні, так і центральні механізми.
Периферичні механізми пов’язані зі змінами периферичних нервів: ушкодженням нервових закінчень, зміною здатності до проведення та порушенням ней- ромедіаторних систем. Вже через декілька годин після ушкодження нервів виявляють надмірну збудливість та спонтанну активність С-волокон, які також проявляють надмірну чутливість до різних молекул, оскільки знижується їх поріг [35]. Крім цього, зростає активність сусідніх, непошкоджених С-волокон. Збільшення активності волокон пов’язане в першу чергу зі змінами регуляції натрієвих та калієвих каналів [36–38].
Периферична сенситизація часто є результатом запальних змін навколо нервових закінчень [39]. Пошкодження тканин супроводжується виділенням із закінчень нейроцитів та інших клітин (макрофагів, нейтрофілів, базофілів, тромбоцитів, ендотеліальних клітин, фібробластів, кератиноцитів та ін.) різноманітних молекул, зокрема гістаміну, серотоніну, аденозину, АТФ, субстанції Р, CGRP, брадикініну, простагландинів, тромбоксанів, лейкотрієнів, фактора росту нервів, фактора некрозу пухлин a (TNF-a), інтерлейкіну-1b, інтерлейкіну-6, протеаз та протонів тощо. Ці речовини складають так званий «запальний суп» (inflammatory soup). Перелічені фактори можуть підвищувати чутливість больових рецепторів, зв’язуючись з рецепторами на їх поверхні, включаючи рецептори, пов’язані з G-протеїном (G-protein-coupled receptors, GPCR), TRP (у першу чергу TRPV1 та TRPA1 ), ASIC, K2P, рецептори до тирозинкінази (RTK) та ін. [3].
Наприклад, вплив на чутливість ноцицепторів однієї з найбільш вивчених молекул — фактора росту нервів (NGF) може здійснюватися двома шляхами: безпосередньо через рецептор TRPV1 [40] та шляхом активації синтезу проноцицептивних протеїнів (субстанція Р, TRPV1, субодиниць каналів Nav1.8) у ядрі [41].
Сучасні терапевтичні стратегії при болю, зумовленому запальними процесами, пов’язані або з інгібуванням синтезу прозапальних речовин (основна дія нестероїдних протизапальних препаратів), або з блокуванням впливу молекул «запального супу» на ноцицептори. Якщо антитіла до TNF-a вже ефективно використовуються при лікуванні багатьох запальних захворюваннь, то ефективність антитіл до NGF тільки вивчається у клінічних дослідженнях [42].
Центральна сенситизація пов’язана з надмірною обробкою імпульсів від ноцицепторів у центральній нервовій системі. Одним з механізмів центральної сенситизації є сенситизація, опосередкована глутаматними NMDA-рецепторами. При гострому болю аксон чутливого нейрона виділяє глутамат, що генерує на мембрані нейрона заднього рогу спинного мозку збуджуючі підпорогові постсинаптичні потенціали. Їх сумація викликає потенціал дії, що прямує до вищих відділів центральної нервової системи. У цих умовах підтип NMDA глутаматних каналів не активується, оскільки за сприйняття гострого болю відповідають рецептори AMPA (alpha-amino-3-hydroxy-5-methyl-isoxazole-4-propionic-acid) [1]. Однак при травмах, коли виникає надлишок глутамату, збудження NMDA-рецепторів призводить до збільшення току кальцію, а це, в свою чергу, сприяє зміцненню синаптичних контактів між ноцицептором і нейроном заднього рогу, а отже, посиленню відповіді на різні подразники [4]. Виникає так званий феномен заведення (wind-up phenomen), при якому спостерігається часова та просторова сумація збудження з передачею больового сигналу при значно меншій кількості глутамату [1]. Також активація NMDA-рецепторів викликає зниження чутливості до опіатів та стимулює процеси апоптозу [30, 35].
Крім цього, Аb-волокна, що в нормі не пов’язані з ноцицепцією, можуть створювати нові зв’язки на нейронах, які до ушкодження контактували з С-волокнами, що зумовлює появу болю при небольових подразниках [35].
Після ушкодження нервових волокон зростає спонтанна активність у таламусі [43], а також відбуваються структурні та функціональні нейропластичні зміни на кортикальному та субкортикальному рівні [44].
Іншим механізмом центральної сенситизації вважається порушення антиноцицептивних механізмів. Згідно з теорією вхідних воріт R. Melzack і P.D. Wall, у поверхневих відділах заднього рогу спинного мозку (у першу чергу — желатинозній субстанції) ГАМКергічні та гліцинергічні інтернейрони можуть зменшувати потік нервових імпульсів, що йдуть від ноцицепторів [45]. Порушення цього механізму призводить до виникнення персистуючих болей та надмірної відповіді навіть на небольові подразники [46]. Поява персистуючого болю може бути пов’язана з втратою інгібуючого контролю стовбурових центрів (зокрема, сірої речовини навколо водопроводу та locus coeruleus) [35]. Крім цього, у спинному мозку спостерігається зниження ефективності опіоїдної системи [47].
Вважається, що мікроглія та астроцити є також причетними до виникнення центральної сенситизації при травмах нервової системи. Ймовірно, при фізичному ушкодженні периферичних відростків вивільняються специфічні сигнальні молекули, які сприймаються клітинами мікроглії. Протягом кількох годин після травми нерва мікрогліальні клітини збираються в термінальній зоні заднього рогу та біля мотонейронів переднього рогу, відростки яких зазнали пошкодження. Активовані мікрогліоцити виділяють велику кількість молекул, включаючи цитокіни (TNF-a, інтерлейкін-1b, інтерлейкін-6), що сприяють виникненню центральної сенситизації та персистуванню болю [48]. Мікроглія при травмі активується також у стовбурі мозку, де вона сприяє полегшенню передачі больових імпульсів у спинному мозку (так зване низхідне полегшення, центр якого знаходиться у вентромедіальних відділах довгастого мозку) [49]. У цей час досліджуються препарати, що впливають на мікроглію і, таким чином, можуть зменшувати вираженість больових синдромів.
Астроцити також активуються при травмі нервової системи, однак, на відміну від мікроглії, це відбувається з певною затримкою і триває довше (до 7 місяців) [50].
Отже, у виникнення болю залучена велика кількість структур та механізмів. Незважаючи на значні успіхи в розумінні фізіологічних та патологічних аспектів болю, багато ще залишається невивченим, тому дослідження, присвячені больовим синдромам, тривають, даючи нам нові теми для роздумів.
1. Павленко С.С. Патофизиология хронической боли // Справочник врача общей практики: ежемесячный научно-практический журнал. — 2007. — № 11. — С. 12-20
2. Basbaum A.I. The perception or pain / A.I. Basbaum, T. Jessel // Principles of Neuroscience. — New York: Appleton and Lange, 2000. — P. 472-491.
3. Meyer R.A., Ringcamp M., Campbell J.N., Raja S.N. Periphe-ral mechanisms of cutaneous nociception // Wall and Melzack’s Textbook of Pain. — Philadelphia: Elsevier, 2008. — P. 3-34.
4. Basbaum A.I., Bautista D.M., Scherrer G., Julius D. Cellular and Molecular Mechanisms of Pain // Cell. — 2009. — Vol. 139. — P. 267-284.
5. Perl E.R. Ideas about pain, a historical view // Nat. Rev. Neurosci. — 2007. — Vol. 8. — P. 71-80.
6. Schmidt R., Schmelz M., Forster C. et al. Novel classes of responsive and unresponsive C nociceptors in human skin // J. Neurosci. — 1995. — Vol. 15. — P. 333-341.
7. Julius D. Molecular mechanisms of nociception / D. Julius, A.I. Basbaum // Nature. — 2001. — Vol. 413. — P. 203-210.
8. Leffer A., Linte R.M., Nau C. et al. A high-threshold heat-activated channel in cultured rat dorsal root ganglion neurons resembles TRPV2 and is blocked by gadolinium // Eur. J. Neurosci. — 2007. — Vol. 26. — P. 12-22.
9. Nagy I. Noxious heat activates all capsaicin-sensitive and also a sub-population of capsaicin-insensitive dorsal root ganglion neurons / I. Nagy, H. Rang // Neuroscience. — 1999. — Vol. 88. — P. 995-997.
10. Lumpkin E.A. Mechanisms of sensory transduction in the skin / E.A. Lumpkin, M.J. Caterina // Nature. — 2007. — Vol. 445. — P. 858-865.
11. Reid G. Physiology. Cold current in thermoreceptive neurons / G. Reid, M.L. Flonta // Nature. — 2001. — Vol. 413. — P. 480.
12. Zimmermann K., Leffer A., Babes A. et al. Sensory neuron sodium channel Nav1.8 is essential for pain at low temperatures // Nature. — 2007. — Vol. 447. — P. 855-858.
13. Noel J., Zimmermann K., Busserolles J. et al. The mechanoactivated K+ channels TRAAK and TREK-1 control both warm and cold perception // EMBO J. — 2009. — Vol. 28. — P. 1308-1318.
14. Bandell M., Story G.M., Hwang S.W. et al. // Noxious cold ion channel TRPA1 is activated by pungent compounds and bradykinin // Neuron. — 2004. — Vol. 41. — P. 849-857.
15. Page A.J., Brierley S.M., Martin C.M. et al. The ion channel ASIC1 contributes to visceral but not cutaneous mechanoreceptor function // Gastroenterology. — 2004. — Vol. 127. — P. 1739-1747.
16. Muraki K., Iwata Y., Katanosaka Y. et al. TRPV2 is a component of osmotically sensitive cation channels in murine aortic myocytes // Circ. Res. — 2003. — Vol. 93. — P. 829-838.
17. Hill K. TRPA1 is differentially modulated by theamphipathic molecules trinitrophenol and chlorpromazine / K. Hill, M. Schaefer // J. Biol. Chem. — 2007. — Vol. 282. — P. 7145-7153.
18. Bautista D.M., Sigal Y.M., Milstein A.D. et al. Pungent agents from Szechuan peppers excite sensory neurons by inhibiting two-pore potassium channels // Nat. Neurosci. — 2008. — Vol. 11. — P. 772-779.
19. McKemy D.D. Identification of a cold receptor reveals a ge- neral role for TRP channels in thermosensation / D.D. McKemy, W.M. Neuhausser, D. Julius // Nature. — 2002. — Vol. 416. — P. 52-58.
20. Estacion M., Dib-Hajj S.D., Benke P.J. et al. NaV1.7 gain-of-function mutations as a continuum: A1632E displays physiological changes associated with erythromelalgia and paroxysmal extreme pain disorder mutations and produces symptoms of both disorders // J. Neurosci. — 2008. — Vol. 28. — P. 11079-11088.
21. Fertleman C.R., Baker M.D., Parker K.A. et al. SCN9A mutations in paroxysmal extreme pain disorder: allelic variants underlie distinct channel defects and phenotypes // Neuron. — 2006. — Vol. 52. — P. 767-774.
22. Nassar M.A., Stirling L.C., Forlani G. et al. Nociceptor-specifc gene deletion reveals a major role for Nav1.7 (PN1) in acute and inflammatory pain // Proc. Natl. Acad. Sci. USA. — 2004. — Vol. 101. — P. 12706-12711.
23. Dick I.E., Brochu R.M., Purohit Y. et al. Sodium channel blockade may contribute to the analgesic efficacy of antidepressants // J. Pain. — 2007. — Vol. 8. — P. 315-324.
24. Attal N., Bouhassira D., Gautron M. et al. Thermal hyperalgesia as a marker of oxaliplatin neurotoxicity: a prospective quantified sensory assessment study // Pain. — 2009. — Vol. 144. — P. 245-252.
25. De Vries B., Frants R.R., Ferrari M.D. and van den Maagdenberg A.M. Molecular genetics of migraine // Hum. Genet. — 2009. — Vol. 126. — P. 115-132.
26. Luo Z.D., Chaplan S.R., Higuera E.S. et al. Upregulation of dorsal root ganglion (alpha)2(delta) calcium channel subunit and its correlation with allodynia in spinal nerve-injured rats // J. Neurosci. — 2001. — Vol. 21. — P. 1868-1875.
27. Davies A., Hendrich J., van Minh A.T. et al. Functional biology of the alpha(2)delta subunits of voltage-gated calcium channels // Trends Pharmacol. Sci. — 2007. — Vol. 28. — P. 220-228.
28. Braz J.M., Nassar M.A., Wood J.N. and Basbaum A.I. Pa-rallel «pain» pathways arise from subpopulations of primary afferent nociceptor // Neuron. — 2005. — Vol. 47. — P. 787-793.
29. Apkarian A.V., Bushnell M.C., Treede R.D., Zubieta J.K. Human brain mechanisms of pain perception and regulation in health and disease // Eur. J. Pain. — 2005. — № 9. — Р. 463-484.
30. Przewlocki R. Opioids in Neuropathic Pain / R. Przewlocki, B. Przewlocka // Current Pharmaceutical Design. — 2005. — Vol. 11. — P. 3013-3025.
31. Scherrer G., Imamachi N., Cao Y.Q. et al. Dissociation of the opioid receptor mechanisms that control mechanical and heat pain // Cell. — 2009. — Vol. 137. — P. 1148-1159.
32. Khachaturian H., Lewis M.E., Schafer M.K., Watson S.J. Anatomy of CNS opioid systems // Trends Neurosci. — 1985. — Vol. 8. — P. 111-119.
33. Malley B.E. Immunohistochemical localization of neuropeptides and neurotransmitters of the nucleus solitatius // Chem. Senses. — 1996. — Vol. 21. — P. 367-376.
34. Кукушкин М.Л. Механизмы возникновения острой боли и хронических болевых синдромов / М.Л. Кукушкин, В.К. Решетняк // Materia Medica. — 1997. — № 3. — С. 5-21.
35. Zimmermann M. Pathobiology of neuropathic pain // European Journal of Pharmacology. — 2001. — Vol. 429. — Р. 23-37.
36. Devor M. Pathophysiology of damaged nerves in relation to chronic pain / M. Devor, Z. Seltzer // Textbook of Pain / Ed. by P.D. Wall, R. Melzack. — Edinburgh: Churchill Livingstone, 1999. — P. 129-144.
37. Woolf C.J. Dissecting out mechanisms responsible for periphe-ral neuropathic pain: implications for diagnosis and therapy // Life Sci. — 2004. — Vol. 74. — P. 2605-2610.
38. Woolf C.J. Neuropathic pain: etiology, symptoms, mechanisms and management / C.J. Woolf, R.J. Mannion // Lancet. — 1999. — Vol. 353. — P. 1959-1964.
39. McMahon S.B. Infammatory mediators and modulators of pain / S.B. McMahon, D.L.H. Bennett, S. Bevan // Wall and Melzack’s Textbook of Pain / Ed. by S.B. McMahon and M. Koltzenburg. — Philadelphia: Elsevier, 2008. — P. 49-72.
40. Chuang H.H., Prescott E.D., Kong H. et al. Bradykinin and nerve growth factor release the capsaicin receptor from PtdIns(4,5)P2-mediated inhibition // Nature. — 2001. — Vol. 411. — P. 957-962.
41. Chao M.V. Neurotrophins and their receptors: a convergence point for many signalling pathways // Nat. Rev. Neurosci. — 2003. — Vol. 4. — P. 299-309.
42. Hefti F.F., Rosenthal A., Walicke P.A. et al. Novel class of pain drugs based on antagonism of NGF // Trends Pharmacol. Sci. — 2006. — Vol. 27. — P. 85-91.
43. Nandi D., Aziz T., Carter H., Stein J. Thalamic field potentials in chronic central pain treated by periventricular gray stimulation: a series of eight cases // Pain. — 2003. — Vol. 101. — P. 97-107.
44. Flor H. Remapping somatosensory cortex after injury // Adv. Neurol. — 2003. — Vol. 93. — P. 195-204.
45. Melzack R. Pain mechanisms: a new theory / R. Melzack, P.D. Wall // Science. — 1965. — Vol. 150. — P. 971-979.
46. Keller A.F., Beggs S., Salter M.W. and De Koninck Y. Transformation of the output of spinal lamina I neurons after nerve injury and microglia stimulation underlying neuropathic pain // Mol. Pain. — 2007. — Vol. 3. — P. 27.
47. Mao J. Experimental mononeuropathy reduces the antinociceptive effects of morphine: implications for common intracellular mechanisms involved in morphine tolerance and neuropathic pain / J. Mao, C.D. Price, D.J. Mayer // Pain. — 1995. — Vol. 61. — P. 353-364.
48. DeLeo J.A. Immune and Glial Regulation of Pain / J.A. DeLeo, L.S. Sorkin and L.R. Watkins. — Seattle: IASP Press, 2007.
49. Porreca F. Chronic pain and medullary descending facilitation / F. Porreca, M.H. Ossipov and G.F. Gebhart // Trends Neurosci. — 2002. — Vol. 25. — P. 319-325.
50. Lu Y., Zheng J., Xiong L. et al. Spinal cord injury-induced attenuation of GABAergic inhibition in spinal dorsal horn circuits is associated with down-regulation of the chloride transporter KCC2 in rat // J. Physiol. — 2008. — Vol. 586. — P. 5701-5715.