Международный неврологический журнал 4 (42) 2011
Вернуться к номеру
Особенности патогенеза и клинического течения цереброваскулярных заболеваний у ВИЧ-позитивных пациентов
Авторы: Корсунская Л.Л., Крымский государственный медицинский университет им. С.И. Георгиевского Шиян С.В., Крымское республиканское учреждение «Противотуберкулезный диспансер № 1»
Рубрики: Неврология
Версия для печати
В статье представлены некоторые аспекты патогенеза и особенностей клинического течения инсультов у ВИЧ-позитивных лиц, а также результаты применения Актовегина при острых нарушениях мозгового кровообращения в данной группе пациентов.
ВИЧ-инфекция, инсульт, Актовегин.
Нервная система — один из органов-мишеней при ВИЧ-инфекции: только 1/10 000 доля лимфоцитов периферической крови больных СПИДом инфицирована вирусом, в то время как в ткани мозга вирус иммунодефицита поражает каждую сотую клетку [2, 13]. Нервная система поражается вирусом иммунодефицита человека в 80–90 % случаев, нередко при отсутствии характерных изменений в периферической крови и других органах [5, 7, 16]. По данным R.M. Levy, D.E. Bredesen (1988), в 10–20 % случаев неврологические осложнения бывают первыми клиническими проявлениями заболевания, однако ряд авторов называет более высокий процент больных с неврологической манифестацией болезни — до 40–50 %, что коррелирует с нашими собственными наблюдениями [13, 20]. В Украине первые случаи инсульта как первичного проявления нейроСПИДа были описаны С.К. Евтушенко и сотрудниками кафедры Донецкого государственного медицинского университета им. М. Горького, в частности наблюдавшими клинический пример церебрального васкулита, завершившегося стволово-полушарным ишемическим инсультом с альтернирующим синдромом Мийяра — Гублера и смертью пациентки [4, 5].
Неврологические осложнения ВИЧ-инфекции могут быть как вызваны самим ретровирусом, так и обусловлены оппортунистическими инфекциями, опухолями, цереброваскулярной патологией, метаболическими расстройствами, токсическим воздействием антиретровирусных препаратов [4, 5]. В головном мозге ВИЧ-позитивных пациентов обнаруживаются преимущественно штаммы вируса, тропные к клеткам, имеющим на своей поверхности рецепторы CD4; это могут быть астроциты, олигодендроциты, микроглия, моноциты, фибробластоподобные клетки мозга, клетки эндотелия кровеносных сосудов и нейроны [4]. Вирус попадает в головной мозг с зараженными клетками, которые мигрируют благодаря наличию молекул адгезии на эндотелии сосудов мозга и клетках микроглии. Зараженные и активированные макрофаги стимулируют экспрессию молекул адгезии Е-селектина и VCAM-1 на эндотелии сосудов мозга, а вирусный гликопротеид gp120 — молекул адгезии ICAM-1 на клетках микроглии, способствуя образованию синцития. Галактозилцерамид, находящийся на поверхности нервных клеток, связывает вирусный гликопротеид gp120 и служит, таким образом, рецептором вируса иммунодефицита. Инфекция, обусловленная ВИЧ, приводит к повреждению белого вещества и гибели нервных клеток в результате цитопатического действия гликопротеида gp120 и нейротоксических веществ, продуцируемых клетками микроглии, астроцитами и мигрирующими из крови моноцитами. Гибель нервных клеток под действием нейротоксинов, производимых активированными или зараженными вирусом моноцитами, опосредована активацией глутаматных NMDA-рецепторов. Кроме того, зараженные моноциты служат источником вирусного гликопротеида gp120, который повышает внутриклеточную концентрацию кальция и снижает продукцию фактора роста нервов в коре головного мозга. Секретируемые моноцитами цитокины (фактор некроза опухоли a, интерлейкин-1, -6, трансформирующий фактор роста b, фактор активации тромбоцитов) и эндотелин также обладают прямым или опосредованным нейротоксическим действием. При активации и заражении моноцитов и макрофагов повышается их способность к продукции эйкозаноидов, окиси азота и хинолиновой кислоты, которые также оказывают нейротоксическое действие [2, 6, 7, 17]. Непосредственное поражение ЦНС может осуществляться также за счет периневрального проникновения вируса в глиальные клетки [19].
Информация о цереброваскулярных нарушениях у ВИЧ-инфицированных пациентов приводится в ряде наблюдений в различных научных центрах, однако необходимо отметить, что данная проблема не настольно детально изучена, как неврологические нарушения, вызванные непосредственно вирусом иммунодефицита и оппортунистическими инфекциями. Nevrology MedLink в июне 2004 г. приводит результаты исследования Koppel et McArthur (1988), основанного на динамическом наблюдении за 1600 ВИЧ-позитивными пациентами в возрасте 35–45 лет в течение 2 лет. Была отмечена в 30 раз большая распространенность инсультов у ВИЧ-позитивных пациентов, чем в общей популяции среди молодых людей того же возраста. Инсульт наблюдался в 25 % случаев. В 44 % инсульт был первой манифестацией ВИЧ-инфекции, следовательно, ВИЧ-позитивные пациенты находятся в группе высокого риска инсульта. Основные формы нарушений, которые наблюдаются у ВИЧ-инфицированных лиц, — это большой ишемический инфаркт, распространенный на белое и серое вещество головного мозга и соответствующий бассейн кровоснабжения, чаще средней мозговой артерии; множественные мелкие перивентрикулярные лакунарные инфаркты либо мелкие кортикальные зоны ишемии, протекающей по типу малого ишемического инсульта и регрессирующей в течение 2–3 недель [5, 18].
Большинство специалистов, занимающихся проблемой, называют основной патогенетической причиной цереброваскулярной патологии, и в частности инсультов, у ВИЧ-инфицированных лиц васкулиты сосудов головного мозга, развитие которых обусловлено целым рядом причин. Рецепторы CD4 расположены не только в клетках нейроглии, но и в эндотелиальных клетках сосудистых сплетений оболочек мозга и эпендиме желудочков, что может приводить к ВИЧ-ассоциированным сосудистым поражениям спинного и головного мозга [4]. Поскольку процесс локализуется эндоваскулярно, возможно возникновение первичных васкулита и васкулопатии. Первичный ВИЧ-ассоциированный васкулит головного и спинного мозга, в свою очередь, способствует вторичному поражению нервной ткани. Описаны васкулиты головного мозга, вызванные героином и другими опиатами, которые сопровождались лейкоцитарной инфильтрацией стенок венул и серого вещества головного мозга и очаговым скоплением нейтрофилов в адвентициальных (периваскулярных) пространствах, окружающих кровеносные сосуды головного и спинного мозга (пространствах Вирхова — Робена) [10]. У пациентов с инъекционным употреблением наркотических средств в анамнезе поражение сосудистого русла чаще всего обусловлено аллергией или микроэмболиями инородными телами. На поздних стадиях ВИЧ-инфекции встречаются вторичные церебральные васкулиты как реакция на оппортунистическую инфекцию, обусловленную Mycobacterium tuberculosis, Aspergillus spp., Candida spp., герпес-вирусами, токсоплазмой и другими патогенными и условно-патогенными микроорганизмами. Бактериальные васкулиты сопровождают менингиты, абсцессы головного мозга или бывают вызваны септическим эмболом. Васкулит может быть осложнением туберкуломы мозга [10, 11]. Как правило, при ВИЧ-ассоциированном васкулите развиваются мультифокальные поражения [5].
При проведении гистологических исследований у ВИЧ-инфицированных пациентов были выявлены инфильтрация стенки сосуда лейкоцитами, отек и пролиферативные изменения интимы. Все это приводит к сужению просвета сосуда и его тромбозу с дальнейшим возможным инфарктом, разрывом сосуда и кровоизлиянием [10].
Ю.И. Пиголкин (2004) особо обращает внимание на такую группу риска развития цереброваскулярных осложнений, как лица, употреблявшие наркотики. У пациентов с длительной наркотической зависимостью в анамнезе гистологически в стволе головного мозга выявляются нарушения микроциркуляции в виде венозного полнокровия, пареза резистентного звена микроциркуляции, сладжа эритроцитов, стаза в капиллярах, иногда образования фибриново-эритроцитарных тромбов, а также множественные мелкие диапедезные кровоизлияния. Мелкие вены и венулы коры поясной извилины резко расширены, их стенка часто склерозирована, нередко с гипертрофией мышечного слоя. Во всех отделах мозга имеются полнокровие, разволокнение стенки мелких сосудов, особенно венул, стаз, тромбозы и мелкие кровоизлияния. Изредка кровоизлияния вовлекают мягкую мозговую оболочку [11]. Повреждения магистральных сосудов у наркоманов часто сопровождаются гнойно-септическими осложнениями в связи с использованием нестерильных шприцев, применением кустарно изготовленных наркотических веществ для внутриартериального и внутривенного введения. Осложнения со стороны сосудов порой представляют собой ангиогенный сепсис с флеботромбозами и тромбофлебитами, поскольку первичный очаг связан непосредственно с кровеносным руслом и элиминацией возбудителя в кровоток. Клиническая картина сопровождается крайне тяжелым общим состоянием больных, сердечно-легочной и печеночно-почечной недостаточностью, декомпенсацией гемопоэза, подавленным иммунитетом. Иногда наблюдается тотальная флегмона верхней конечности, повздошно-бедренный тромбоз [11].
Тромботические инсульты встречаются также у больных с ангиитами. Развитие гранулематозного ангиита может быть связано с герпетическим поражением лица, но встречается и у ВИЧ-инфицированных пациентов, не болевших герпетической инфекцией [5]. У части пациентов причину тромботических инсультов установить не удается. Возможно, некоторые из них имели «антикоагулянтную волчанку», антикардиолипиновые антитела. Наличие «антикоагулянтной волчанки» обычно обосновывают высоким парциальным тромбопластиновым временем, ложноположительным VDRL-тестом и тромбоцитопенией. О тромбоэмболическом инсульте сообщалось у больных с инфекционным эндокардитом или небактериальным эндокардитом с тромбоэмболическим синдромом, который может ассоциироваться с саркомой Капоши (A.N. Pinto, 1996).
У ВИЧ-инфицированных пациентов довольно часто наблюдается трансформация ишемического инсульта в геморрагический, в то время как первичные геморрагические инсульты описываются достаточно редко. В наших наблюдениях были отмечены случаи спонтанного спинального кровоизлияния. Кровоизлияния в ткань мозга могут быть связаны с острым общим венозным полнокровием гипоксического генеза и с нарушениями реологических свойств крови. Не исключен прямой ангиотоксический эффект некоторых наркотических средств и примесей к ним. Тромбоцитопения сопровождает течение ВИЧ-инфекции и повышает риск развития интрацеребральных геморрагий. Геморрагический инсульт чаще встречается у больных с тяжелой тромбоцитопенией и при метастазах саркомы Капоши в головной мозг [6].
Абсолютно новые данные, определяющие дополнительные факторы риска инсульта у ВИЧ-позитивных лиц, были опубликованы в 2010 году специалистами из университета Сан-Диего B. Ovbiagele и A. Nath [9]. Исследование, проведенное B. Ovbiagele и A. Nath, включало анализ данных по госпитализации людей с диагнозом «инсульт» в период 1997–2006 гг. В результате исследования установлено, что число инсультов в исследуемой выборке сократилось на 7 %, при этом число инсультов у ВИЧ-позитивных людей увеличилось на 67 %. Приведенная статистика, по данным авторов, была полностью обусловлена увеличением частоты возникновения ишемических инсультов. По словам B. Ovbiagele, проанализированный период времени совпадает с тем, когда для лечения пациентов с ВИЧ стала применяться высокоактивная антиретровирусная терапия (ВААРТ). ВААРТ в значительной степени продлевает жизнь пациентов с ВИЧ. Однако лекарственные препараты ВААРТ оказывают влияние на уровень содержания липидов и глюкозы — биомаркеров возможного возникновения инсульта. «Почти 3/4 инсультов случаются у людей старше 65 лет, после 55 лет риск возникновения инсульта удваивается каждые 10 лет, — говорит B. Ovbiagele. — Однако у пациентов с ВИЧ средний возраст, в котором возникал инсульт, был равен 50 годам».
Нами было проведено динамическое наблюдение за ВИЧ-инфицированными пациентами (921 чел.), находившимися на стационарном лечении в различных лечебных учреждениях г. Симферополя в период 2005–2010 гг. В 38,0 % случаев (281 пациент) были выявлены нарушения со стороны центральной нервной системы в виде: цереброваскулярной патологии (12,1 % случаев, 34 человека), оппортунистических инфекций (65,5 % случаев, 184 человека), ВИЧ-ассоциированной энцефалопатии (22,4 % случаев, 63 человека) (рис. 1).
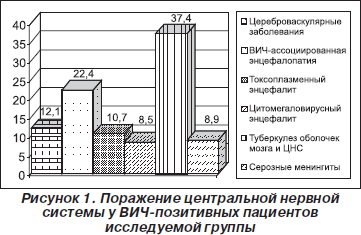
Средний возраст 34 ВИЧ-позитивных пациентов с диагностированными инсультами — 32,1 года. У 11 из них (32,6 %) инсульт был первой манифестацией ВИЧ-инфекции. В 25 случаях (73,5 %) диагностирован ишемический инсульт, в 9 (26,5 %) — геморрагический инсульт. В 30 случаях (88,2 %) инсульт локализовался в каротидном бассейне (все — средняя мозговая артерия), в 4 (11,8 %) случаях обнаружено субарахноидальное кровоизлияние в бассейне передней спинальной артерии. В 18 случаях (72,0 %) поражались крупные артерии с образованием кортикальных инфарктов, в 7 (29,0 %) — мелкие артерии с образованием субкортикальных инфарктов (рис. 2).

У всех пациентов была выражена иммуносупрессия: 66,7 % пациентов имели уровень CD4 ниже 200/мкл, 33,3 % — 200–500/мкл.
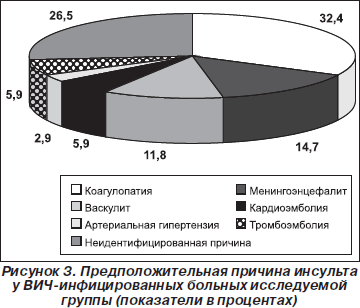
У пациентов исследуемой группы были обнаружены различные оппортунистические инфекции: у 3 (9,1 %) — туберкулезный менингоэнцефалит на фоне активного легочного туберкулеза, у 8 (24,2 %) — ВИЧ-ассоциированный энцефалит (токсоплазменный, цитомегаловирусный), у 14 (42,2 %) — кандидоз ротовой полости, у 2 (6,1 %) — системный кандидоз, у 1 (3 %) — пневмоцистная пневмония, у 4 (12,1 %) — рецидивирующая герпетическая инфекция. У 12 (36,4 %) пациентов отмечалась тромбоцитопения, у 14 (42,2 %) — наркотическая зависимость в анамнезе. Только 3 пациента (9,1 %) имели артериальную гипертензию, 2 (6,1 %) — кардиомиопатию. Предположительная причина инсульта у ВИЧ-инфицированных больных исследуемой группы в 32,4 % случаев — коагулопатия; в 14,7 % — менингоэнцефалит, обусловивший развитие вторичного васкулита; в 11,8 % — первичные васкулиты; в 5,9 % случаев — тромбоэмболия из экстракраниальных сосудов; в 5,9 % случаев — кардиоэмболия, подтвержденная на аутопсии; в 2,9 % — артериальная гипертензия. В 26,5 % случаев причина инсульта осталась неидентифицированной (рис. 3).
За период наблюдения летальность среди осмотренных пациентов составила 53,7 %, однако непосредственно инсульт стал причиной смерти 4 больных с субарахноидальным кровоизлиянием.
Актовегин (депротеинизированный гемодериват из крови молодых телят) — высокоэффективный стимулятор синтеза и утилизации кислорода и глюкозы, увеличивающий синтез АТФ в 19 раз, а транспорт глюкозы из крови в головной мозг — на одну треть. В составе: неорганические электролиты, микроэлементы, около 30 % органических веществ (пептиды, аминокислоты, нуклеозиды, промежуточные продукты углеводного и животного обмена, липиды и олигосахариды). Оказывает центральное и периферическое действие, стимулируя микроциркуляторный периферический кровоток, улучшая трофику тканей, имеет выраженный антигипоксический эффект за счет активации ферментов окислительного фосфорилирования, активирует аэробное и анаэробное окисление, стабилизируя энергетический потенциал клетки. Улучшает энергообмен в эндотелии сосудов, высвобождая простациклин и оксид азота. Улучшается перфузия тканей, снижается периферическое сосудистое сопротивление. Актовегин пациентам исследуемой группы назначался с первых дней курсом 10 дней внутривенно по 250 мл 10% раствора, затем по 2 таблетки 3 раза в день в течение 50 дней. Спустя два месяца от начала лечения был проведен контрольный осмотр пациентов (анализ субъективных ощущений пациента, неврологический осмотр, компьютерная томография головного мозга, оценка статуса когнитивных нарушений по шкале MMSE).
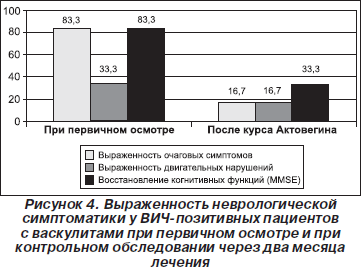
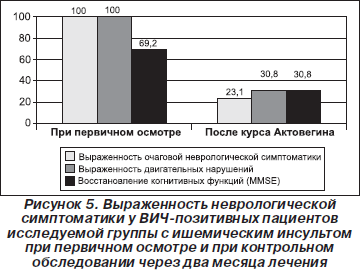
При васкулитах отмечен значительный регресс очаговой (на 66,6 %) и двигательной (на 16,7 %) неврологической симптоматики при объективном обследовании, уменьшение когнитивных нарушений на 50 % (по шкале MMSE) (рис. 4). В целом при ишемическом инсульте наблюдалось восстановление двигательной функции в 70 % случаев при объективном обследовании; улучшение когнитивных функций на 39 % (по шкале MMSE) в сравнении с первичным осмотром (рис. 5). При лечении больных со спинальными геморрагическими инсультами мы не смогли оценить эффективность проводимой терапии, так как во всех наблюдаемых случаях больные находились в терминальной стадии болезни, со значительным иммунодефицитом, манифестирующими оппортунистическими заболеваниями, и у них достаточно быстро наступал летальный исход.
Таким образом, в результате проведенного исследования установлено, что течение инсультов у ВИЧ-позитивных пациентов имеет ряд особенностей, обусловленных в первую очередь преморбидными изменениями сосудов головного и спинного мозга. Благодаря наличию рецепторов CD4 на клетках нейроглии и эндотелиальных клетках сосудистых сплетений оболочек мозга и эпендимы желудочков возникают первичные васкулиты и васкулопатии, обусловленные вирусом иммунодефицита человека. Васкулиты и перенесенные оппортунистические заболевания, обусловленные Mycobacterium tuberculosis, Aspergillus spp., Candida spp., герпес-вирусами, токсоплазмой и другими патогенными и условно-патогенными микроорганизмами, являются основными причинами инсультов у ВИЧ-позитивных лиц. У пациентов с инъекционным употреблением наркотических средств в анамнезе поражение сосудистого русла чаще всего обусловлено аллергической природой или микроэмболиями инородными телами. Также нельзя исключать влияние препаратов высокоактивной антиретровирусной терапии, которые значительно продлевают жизнь ВИЧ-позитивных лиц, однако повышают уровень содержания липидов и глюкозы — биологических маркеров возможного возникновения инсульта. Данные, полученные нами в результате исследования, могут послужить началом полномасштабного всестороннего изучения применения Актовегина у ВИЧ-позитивных лиц, что приведет к снижению процента инвалидизации в данной группе пациентов.
1. AIDS and the nervous system / Еds. by M.D. Rosenblum, R.M. Levy, D.E. Bredesen. — N.Y.: Raven Press, 1988. — 410 p.
2. Бобкова М.Р. Иммунитет и ВИЧ-инфекция. — М.: Олимпия, 2006. — 236 с.
3. ВИЧ-инфекция: клиника, диагностика и лечение / В.В. Покровский, Т.Н. Ермак, В.В. Беляева, О.Г. Юрин — М.: ГЭОТАР, 2000. — 496 с.
4. Евтушенко С.К. Диагностика и лечение поражений нервной системы у ВИЧ-инфицированных при первичном и вторичном нейроСПИДе: Метод. рекоменд. / С.К. Евтушенко, И.Н. Деревянко. — Донецк: ДонГМИ, 2001. — 23 с.
5. Евтушенко С.К. НейроСПИД как одна из актуальнейших проблем современной практической неврологии / С.К. Евтушенко, И.Н. Деревянко // Международный неврологический журнал. — 2006. — № 5 (9). — С. 147-157.
6. Зайцев И.А., Мирошниченко В.А. Поражение нервной системы при ВИЧ-инфекции и СПИДе // Новости медицины и фармации. — 2010. — № 330. — С. 6-14.
7. Запорожан В.М. ВИЧ-инфекция и СПИД / В.М. Запорожан, Н.Л. Аряев — К.: Здоровье, 2004. — 636 с.
8. Неврологические синдромы при ВИЧ-инфекции / Макаров А.Ю., Чикова Р.С., Улюкин И.М. и др. // Неврологический журнал. — 2004. — № 5. — С. 45-53.
9. Ovbiagele B., Nath A. Increasing incidence of ischemic stroke in patients with HIV infection // Neurology. — 2011. — № 76 (5). — Р. 444-450.
10. Пиголкин Ю.И. Морфологическая диагностика наркотических интоксикаций в судебной медицине. — М., 2004. — 78 с.
11. Судебная медицина: Учебное пособие / Ю.И. Пиголкин, Е.Х. Баринов, Д.В. Богомолов и др. — М.: ГЭОТАР-МЕД, 2002. — 360 с.
12. Факторы, определяющие эффективность высокоактивной антиретровирусной терапии у больных ВИЧ-инфекцией / А.В. Кравченко, В.В. Беляева, Ю.Р. Ситдыкова и др. // Эпидемиология и инфекционные болезни. — 2005. — № 5. — С. 53-58.
13. Фаучи Э. ВИЧ-инфекция и СПИД / Э. Фаучи, К. Лейн: Пер. с англ. Н.Н. Алипова. — М.: Практика, 1998. — 80 с. (Внутренние болезни / Под ред. Т.Р. Харрисона, гл. 308).
14. Хоффман К. Лечение ВИЧ-инфекции / К. Хоффман, Ю.К. Рокстро, Б.С. Кампс: Пер. с англ. — М., 2006. — 573 с.
15. Чернушенко Е.Ф. Апоптоз клеток иммунной системы и его значение в клинике // Мистецтво лікування. — 2006. — № 9-10. — С. 60-63.
16. Яковлев Н.А. НейроСПИД. Неврологические расстройства при ВИЧ-инфекции/СПИДе: Учебное пособие / Н.А. Яковлев, Н.М. Жулев, Т.А. Слюсарь — М.: МИА, 2005. — 278 с.
17. An exploratory study of long-term neurocognitive outcomes following recovery from opportunistic brain infections in HIV + adults / Levine A.J., Hinkin C.H., Ando K. et al. // Journal of Clinical and Experimental Neuropsychology. — 2008. — Vol. 30, № 7 — Р. 836-843.
18. Bartlett J.G. Medical Management of HIV Infection / J.G. Bartlett, J.E. Gallant. — Baltimore, Maryland, USA.: John Hopkins University School of Medicine, 2007. — 618 р.
19. Marra Ch.M. HIV and Neurology opportunistic infections // Международный неврологический журнал. — 2006. — № 5. — С. 195-196.
20. NeuroAIDS: Characteristics and Diagnosis of the Neurological Complications of AIDS / Commins M.A., Steven J., Romy H. et al. // Molecular Diagnosis & Therapy — 2008. — Vol. 12, № 1. — Р. 25-43.
