Международный неврологический журнал 4 (42) 2011
Вернуться к номеру
Показники мозкової гемодинаміки у хворих з різними патогенетичними підтипами транзиторних ішемічних атак
Авторы: Черенько Т.М., Фартушна О.Є., Національний медичний університет імені О.О. Богомольця, м. Київ
Рубрики: Неврология
Версия для печати
Серед механізмів розвитку транзиторних ішемічних атак (ТІА) важливу роль відіграють гемодинамічні розлади, що є проявом порушення їх регуляції. Мета роботи — дослідити показники церебральної гемодинаміки в пацієнтів із різними патогенетичними підтипами ТІА залежно від наявності вогнища інфаркту та розвитку повторного гострого порушення мозкового кровообігу. Обстежено 178 пацієнтів з установленим діагнозом ТІА. За механізмом розвитку виділені атеротромботичний, кардіоемболічний, лакунарний та остаточно не визначений патогенетичні підтипи захворювання. Описані показники мозкової гемодинаміки при різних підтипах ТІА, визначений взаємозв’язок між особливостями мозкової гемодинаміки в пацієнтів із різними патогенетичними підтипами ТІА.
Транзиторні ішемічні атаки, патогенетичний підтип, мозкова гемодинаміка.
Важливу роль у патогенезі ТІА відіграють розлади церебральної гемодинаміки, що в умовах комбінованого ураження екстра- та інтракраніальних церебральних судин і недостатності колатерального кровообігу можуть призвести до розвитку стійкої або транзиторної ішемії мозку [6, 14, 21]. Серцево-судинна недостатність відіграє важливу роль у розвитку ТІА, особливо в осіб похилого віку [4]. За останніми даними інших авторів, гемодинамічні порушення при ТІА мають досить помірний м’який характер та менш виражені, ніж при інсульті [1, 12]. Разом із тим близько 22 % хворих із ТІА мають в анамнезі ішемічну хворобу серця, а в 26 % випадків причиною ТІА є захворювання серця [3, 17, 18]. У 95 % випадків ТІА зумовлені макроангіопатіями, ураженням внутрішньочерепних судин малого калібру (мікроангіопатіями) або кардіальною емболією [27]. K. Holzer та співавтори повідомляють про високий ризик розвитку інсульту та інших серцево-судинних подій у пацієнтів із ТІА та змінами параметрів гемодинаміки за даними транскраніальної допплерографії [22].
Багато авторів вказують на особливе значення патології магістральних судин голови в розвитку ТІА [5, 31], що, зокрема, визначає характер клінічного перебігу ТІА [10, 26]. Інші дослідники зазначають, що ТІА можуть бути зумовлені не лише ураженням відповідної артерії, а й неадекватними зрушеннями компенсаторного характеру, тобто феноменом обкрадання (Robin Hood syndrome) [11]. У ряді випадків ТІА розвиваються в результаті зриву авторегуляції мозкового кровообігу на тлі різких коливань артеріального тиску (АТ), що призводить до ураження дрібних інтрацеребральних артерій [2]. Нерідко ТІА є результатом порушення перфузії внаслідок різкого падіння системного АТ при симптоматичних стенозах великих екстра- та інтрацеребральних артерій більше ніж 50 % просвіту, що призводить до розвитку мозкової гіпоперфузії [15]. Інші автори описують стеноз проксимального відділу підключичної артерії як одну з частих причин ТІА та транзиторних розладів мозкового кровотоку при ТІА [25, 30].
Упровадження в клінічну практику сучасних методів оцінки мозкового кровообігу розширили наші уявлення щодо патофізіологічних механізмів розвитку ішемії, етапів формування інфаркту мозку. Проте дотепер немає повної ясності в питанні впливу величини мозкового кровотоку та стенозу каротидних артерій на ризик повторних ГПМК. Деякі автори повідомляють, що пацієнти з симптоматичною оклюзією сонної артерії та низьким мозковим кровотоком по основних артеріях мозку мають високий ризик виникнення повторного ішемічного інсульту [16, 24]. Також зниження вазореактивності в пацієнтів із вираженим стенозом сонної артерії є предиктором наступних цереброваскулярних подій [19, 29] і може збільшувати ризик церебральної ішемії [23]. В інших дослідженнях відзначається зв’язок між відносним збільшенням мозкового кровотоку по контралатеральній внутрішній сонній артерії (ВСА) у хворих з оклюзією сонної артерії та повторним ішемічним інсультом [13, 28].
Таким чином, дані літератури недостатньо висвітлюють особливості порушень мозкової гемодинаміки при ТІА та їх значимість у розвитку повторних ГПМК. Не проводилися дослідження щодо вивчення цих особливостей у хворих із різними патогенетичними підтипами ТІА.
Мета роботи — дослідити показники церебральної гемодинаміки в пацієнтів із різними патогенетичними підтипами ТІА залежно від наявності вогнища інфаркту та розвитку повторного ГПМК.
Матеріали і методи
У дослідження включені 178 хворих із ТІА. Вік хворих коливався від 25 до 83 років (середній вік — 57,5 ± 0,9 року). Чоловіків було 72 (40,4 %), жінок — 106 (59,6 %).
Хворі були госпіталізовані в перші 3–6 год після виникнення неврологічного дефіциту. Середній час між виникненням симптоматики та оглядом невролога — 2,7 ± 0,3 (mediana — 2 год, mode — 1 год). Діагноз ТІА виставляли згідно із стандартами ВООЗ, за умови якщо у хворого виникали осередкові рухові, мовні або зорові порушення тривалістю менше 24 годин, що можна було б пояснити судинними розладами [32]. Симптоми ТІА визначали згідно з рекомендаціями спеціального комітету консультативної ради Національного інституту неврологічних, комунікативних захворювань та інсульту США [8].
Об’єм неврологічного дефіциту визначали при надходженні та на другу добу через 24 год за шкалою NIHSS; оцінювали тривалість та оборотність неврологічної симптоматики. Відновлення життєдіяльності визначали за модифікованою шкалою Ренкіна (мШР). Наявність чи відсутність нових осередків ішемії в паренхімі головного мозку візуалізували за допомогою магнітно-резонансної томографія (МРТ) і дифузійно-зваженої (ДЗ) МРТ упродовж перших 24 год після розвитку симптомів.
Усім хворим особливості церебральної гемодинаміки та стану мозкових артерій оцінювали допплерографічними методами. Функціональний стан магістральних артерій голови в екстракраніальному відділі та інтракраніальних артерій досліджували за допомогою ультразвукового дуплексного (апарат Multigon 500M, США) і триплексного (апарат Аloka SSD-4000, Японія) сканування за стандартними методиками.
При підозрі на кардіоемболічну природу ТІА проводили ЕхоКГ серця (GE Medical Systems VIVID 3, Японія) за загальноприйнятою методикою з оцінкою стану камер, клапанів серця, загальної та локальної скоротливості шлуночків [7], фракції серцевого викиду, кінцево-діастолічного та кінцево-систолічного об’ємів. Під час дослідження ЕхоКГ була виконана всім пацієнтам з кардіоемболічним та остаточно не визначенним патогенетичними підтипами ТІА, 40 (81,6 %) пацієнтам з атеротромботичним та 23 (53,5 %) особам із лакунарним підтипом захворювання.
Усі пацієнти підлягали особливо уважному проспективному спостереженню з метою оцінки ризику розвитку повторної ТІА/інсульту. Інформацію про стан пацієнта отримували при особистих зустрічах у клініці під час амбулаторного обстеження або інтерв’ю по телефону і документували. Контрольні огляди або опитування відбувались протягом гострого періоду при надходженні, у першу добу, на 2, 7, 30, 90-ту добу та через кожні 3 місяці протягом 2 років.
На підставі даних неврологічної клініки, результатів МР-томографічного, ультразвукового допплерографічного дослідження головного мозку, з урахуванням етіопатогенетичних механізмів розвитку ТІА та відповідно до критеріїв TOAST (Trial of ORG 10172 in Acute Stroke Treatment) [9, 20] виділені чотири патогенетичні підтипи ТІА: атеротромботичний (АТ), кардіоемболічний (КЕ), лакунарний (ЛАК), остаточно нез’ясованого ґенезу (НВ). Згідно з виділеними підтипами всі хворі були розподілені на відповідні чотири групи, які порівнювалися між собою під час дослідження.
Стенотичне ураження ВСА пацієнтів з атеротромботичним підтипом ТІА > 60 % зустрічалось у 44 (89,8 %) пацієнтів, > 70 % — у 3 (6,1 %) осіб, а у 2 (4,1 %) діагностована оклюзія ВСА. У пацієнтів цієї групи були також виявлені інтракраніальні стенози різного ступеня, що впливали на показники мозкового кровотоку. У 7 (16,3 %) пацієнтів із лакунарним та в 11 (28,2 %) осіб з остаточно невизначеним підтипом ТІА діагностовано стенотичні ураження ВСА < 50 % по площі судини.
Середні показники товщини комплексу інтима-медіа внутрішніх сонних артерій (ТКІМ ВСА) значно перевищували показники норми та відрізнялися по групах (р < 0,01). У пацієнтів з атеротромботичним та кардіоемболічним підтипами захворювання ТКІМ ВСА була вищою від норми з середніми показниками в групах 1,3 ± 0,05 та 1,0 ± 0,04 відповідно. Також пацієнти в групах відрізнялися за структурою КІМ ВСА (р < 0,01). Лише у 2 (4,1 %) осіб з атеротромботичним підтипом ТІА КІМ був структурованим, у 14 (28,6 %) — ущільненим, а у 33 (67,3 %) — дезінтегрованим. В інших групах КІМ був структурованим та/або ущільненим. Дезінтегрований КІМ був виявлений також у 4 (10,3 %) пацієнтів з остаточно невизначеним підтипом ТІА.
Статистична обробка матеріалу включала використання стандартних методик оцінки відмінностей в обстежуваних групах за допомогою непараметричних тестів на ПЕОМ ІВМ/РС за допомогою програми електронних таблиць Microsoft Excel 2003, пакету програм Statistica 8.0 (StatSoft, США), програмного забезпечення SPSS (Statistical Package for the Social Sciences). З метою перевірки гіпотези про різницю виборок (груп хворих) використовували Mann — Whitney U-тест, t-тест. Статистично вірогідною різницю вважали при р < 0,05.
Результати дослідження та їх обговорення
Дослідження інтрацеребрального кровотоку виявило певні особливості в пацієнтів із різними патогенетичними підтипами ТІА.
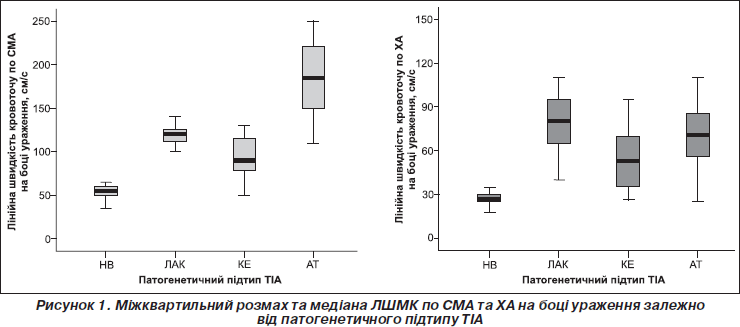
Відзначено суттєве зниження максимальної систолічної лінійної швидкості кровотоку (ЛШМК) в басейні середньої мозкової артерії (СМА) на боці ураження в пацієнтів із провідним кардіоемболічним механізмом ТІА (119,3 ± 3,2) та в разі ТІА на тлі мікроангіопатії (106,6 ± 2,8). Найнижчими виявилися показники мозкового кровотоку у разі чітко не визначеного провідного механізму ТІА — 57,4 ± 1,3; серед цих хворих певну частину (87,2 %) становили пацієнти з аномаліями розвитку судин, їх патологічними звивистостями. У хворих з атеротромботичним підтипом ТІА спостерігалося деяке підвищення середніх значень ЛШМК на боці ураження (р < 0,05), що пояснювалося наявністю інтракраніальних стенозів у таких хворих. Середні показники швидкості мозкового кровотоку в каротидному басейні вірогідно (р < 0,01) відрізнялися залежно від патогенетичного підтипу ТІА. Міжквартильний розмах та медіана швидкості мозкового кровотоку по СМА та хребтовим артеріях (ХА) залежно від патогенетичного підтипу на боці ураження подані на рис. 1.
Згідно з результатами нейровізуалізації, у 66 (37,0 %) хворих із ТІА (24 (36,4 %) чоловіки та 42 (63,6 %) жінки) за даними МРТ та ДЗ-МРТ головного мозку був виявлений новий осередок ішемії. У 112 (63,0 %) пацієнтів із ТІА не відзначено інфарцирування тканини мозку.
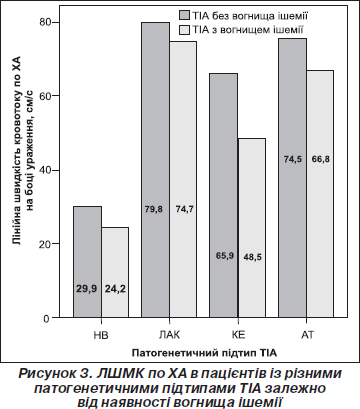
Нами проведений порівняльний аналіз змін ЛШМК на боці судинної катастрофи у хворих з класичною ТІА та в пацієнтів з осередком інфаркту. Виявлено дещо більше зниження швидкості кровотоку по СМА у хворих із ТІА і вогнищем ішемії порівняно з пацієнтами з ТІА без вогнища, проте відмінності не досягали рівня статистичної значимості (р = 0,17). Водночас середні показники ЛШМК по ХА були вірогідно нижчими у хворих із вогнищем інфаркту порівняно з такими без нового осередка ішемії за даними нейровізуалізації (р = 0,013). Хворі цих груп за середньою величиною ЛШМК по СМА вірогідно відрізнялися між собою залежно від патогенетичного підтипу захворювання (р < 0,01) (рис. 2).
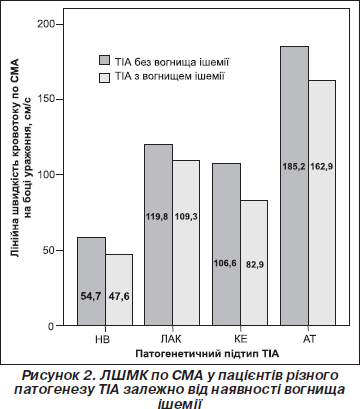
Привертає увагу той факт, що вірогідно за показниками ЛШМК по ХА розрізнялися лише хворі з КЕ-варіантом та в разі НВ-підтипу ТІА (р < 0,01); у пацієнтів із лакунарним та атеротромботичним генезом минущих порушень мозкового кровообігу цього не спостерігалось (р = 0,082).
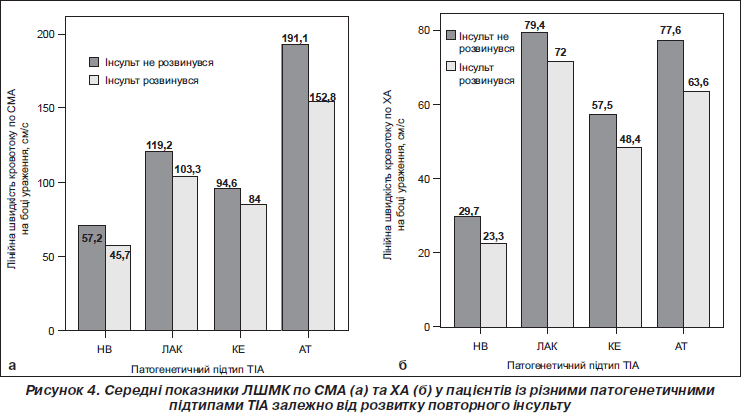
Проспективне спостереження протягом 2 років за пацієнтами, які перенесли ТІА, виявило, що в тих із них, у яких розвинувся інсульт, ЛШМК по відповідних СМА та ХА була вірогідно нижчою порівняно з пацієнтами, які уникли цієї гострої судинної події, та становила 85,4 ± 2,4 мл/хв та 126,5 ± 1,2 мл/хв відповідно (р < 0,05). Також показники ЛШМК статистично вірогідно відрізнялися залежно від патогенетичного підтипу захворювання з високим рівнем значимості (р < 0,001). Ця різниця була вірогідною за умови АТ-підтипу ТІА (р < 0,001) (рис. 4).
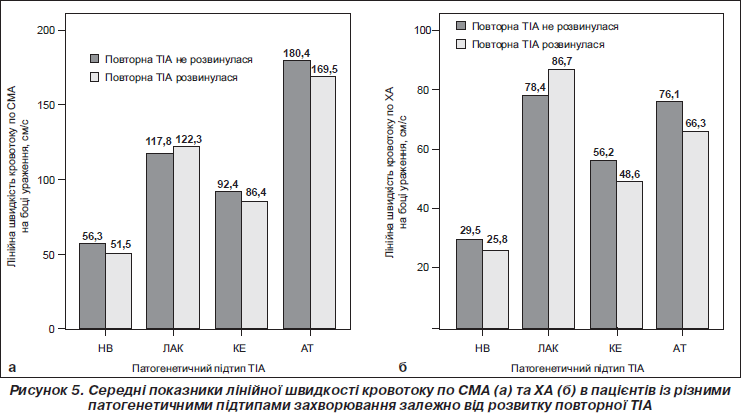
Не було вірогідної різниці між показниками лінійної швидкості мозкового кровотоку по СМА в осіб, у яких у подальшому розвинулися повторні ТІА, порівняно з пацієнтами, у яких повторні ГПМК не виникли (рис. 5а).
Якщо повторною судинною подією у хворих із ТІА був не ішемічний інсульт, а повторна ТІА, то вихідні показники ЛШМК були нижчими лише в разі КЕ-підтипу першої ТІА, і це стосувалося лише ХА. Відмічалося вірогідне зниження лінійної швидкості кровотоку по ХА на боці ураження в пацієнтів із повторною ТІА порівняно з тими, у яких ТІА не розвинулися (р < 0,05). Не зрозумілий той факт, що в разі лакунарного варіанта транзиторної атаки ЛШМК по ХА на боці ураження були вірогідно вищими в пацієнтів, у яких повторилася ТІА, порівняно з пацієнтами без повторних ТІА надалі (р < 0,05).
Незалежно від провідного патогенетичного механізму першої ТІА ЛШМК у пацієнтів із повторними ТІА та без таких по ХА була вірогідно нижчою, ніж по СМА (р < 0,01).
Таким чином, проведені дослідження показали, що ТІА — результат виражених патофізіологічних змін, складовою та наслідком яких є значні порушення мозкової гемодинаміки. Ступінь та особливості цих порушень різні в пацієнтів із різними патогенетичними підтипами захворювання.
Висновки
1. Зміни показників мозкового кровотоку у хворих із ТІА відрізняються залежно від їх патогенетичного підтипу.
2. Наявність вогнища ішемії у хворих із ТІА асоціюється зі зниженням ЛШМК переважно в ХА в разі КЕ-підтипу ТІА.
3. Розвиток повторних інсультів асоціюється із значнішими (порівняно з хворими без рецидиву) розладами ЛШМК на боці ураження, що відрізняються залежно від патогенетичного варіанта ТІА.
1. Бедрій І.І. Стан мозкової та центральної гемодинаміки у хворих з минущими порушеннями мозкового кровообігу: Автореф. дис… канд. мед. наук. — К., 1996. — 24 с.
2. Віничук С.М., Прокопів М.М. Гострий ішемічний інсульт. — Київ: Наукова думка, 2006. — 286 с.
3. Дядык А.И., Багрий А.Э., Онищенко А.В., Самойлова О.В., Зборовский С.Р., Гришин Д.В. Оценка степени тяжести хронической митральной недостаточности с помощью эхокардиографического метода проксимальной конвергенции потока на митральном клапане // Арх. клін. експ. мед. — 2004. — Т. 13, № 1–2. — С. 37-43.
4. Евтушенко С.К. Взаимоотношение кардионеврологии и нейрокардиологии на клинической модели кардиоэмболического инсульта // Международный неврологический журнал. — 2010. — Т. 6, № 36. — С. 7-16.
5. Лелюк В.Г., Лелюк С.Э. Ультразвуковая ангиология. — М.: Реальное время, 2003. — 322 с.
6. Мироненко Т.В., Перетятько С.Г., Склярова Л.А., Борзенко А.В. Транзиторные ишемические атаки: диагностические подходы // Международный неврологический журнал. — 2008. — Т. 6, № 22. — С. 123-130.
7. Шиллер Н., Осипов М.А. Клиническая эхокардиография. — М., 1993. — 347 с.
8. Ad Hoc Committee on Cerebrovascular Disease of the Advisory Council of the National Institute on Neurological Disease and Blindness: a classification of and outline of cerebrovascular diseases // Neurologу. — 1958. — 8. — 395-434.
9. Adams H.P. Jr, Bendixen B.H., Kappelle L.J., Biller J., Love B.B., Gordon D.L., Marsh E.E. Classification of subtype of acute ischemic stroke: definitions for use in a multicenter clinical trial. TOAST: Trial of Org 10172 in acute stroke treatment // Stroke. — 1993. — 24. — 35-41.
10. Albers G.W., Caplan L.R., Easton J.D. еt al. Transient ischemic attack — Proposal for a new definition // N. Engl. J. Med. — 2002. — Vol. 347, № 21. — P. 1713-1716.
11. Alexandrov A.V., Nguyen H.T., Rubiera M., Alexandrov A.W., Zhao L., Heliopoulos I., Robinson A., Dewolfe J., Tsivgoulis G. Prevalence and risk factors associated with reversed Robin Hood syndrome in acute ischemic stroke // Stroke. — 2009. — 40(8). — 2738-42.
12. Atkins E.R., Brodie F.G., Rafelt S.E., Panerai R.B., Robinson T.G. Dynamic cerebral autoregulation is compromised acutely following mild ischaemic stroke but not transient ischaemic attack // Cerebrovasc. Dis. — 2010 Feb. — 29(3). — 228-35.
13. Cerebral hemodynamics in relation to patterns of collateral flow / M. Kluytmans, J. van der Grond, K.J. van Everdingen et al. // Stroke. — 1999. — Vol. 30. — P. 1432-1439.
14. Coutts S.B., Simon J.E., Eliasziw M., Sohn C.H., Hill M.D., Barber P.A., Palumbo V., Kennedy J., Roy J., Gagnon A., Scott J.N., Buchan A.M., Demchuk A.M. Triaging transient ischemic attack and minor stroke patients using acute magnetic resonance imaging // Ann. Neurol. — 2005. — 57. — 848-54.
15. Dharmasaroja P. Prevalence of extracranial carotid stenosis in Thе ischemic stroke/TIA patients // J. Neurol. Sci. — 2008. — 269(1–2). — 92-95.
16. Effect of collateral blood flow and cerebral vasomotor reactivity on the outcome of carotid artery occlusion / F. Vernieri, P. Pasqualetti, M. Matteis et al. // Stroke. — 2001. — Vol. 32. — P. 1552-1558.
17. European Stroke Organisation (ESO) Executive Committee and the ESO Writing Committee. (2008) Guidelines for Management of Ischaemic Stroke and Transient Ischaemic Attack // http://www.eso-stroke.org/pdf/ESO08_ Guidelines_Original_english.pdf
18. Ferguson G.G., Eliasziw M., Barr H.W., Clagett G.P., Barnes R.W., Wallace M.C., Taylor D.W., Haynes R.B., Finan J.W., Hachinski V.C., Barnett H.J. The North American Symptomatic Carotid Endarterectomy Trial: surgical results in 1415 patients // Stroke. — 1999 Sep. — 30(9). — 1751-8.
19. Franklin D.L., Baker D.W., Ellis R.W. A pulsed ultrasonic flowmeter // IRE Trans. Med. Electron. — 1959. — 6. — 204.
20. Goldstein L.B., Jones M.R., Matchar D.B., Edwards L.J., Hoff J., Chilukuri V., Armstrong S.B., Horner R.D. Improving the reliability of stroke subgroup classification using the Trial of Org 10172 in Acute Stroke Treatment (TOAST) criteria // Stroke. — 2001. — 32. — 1091-1097.
21. Han S.W., Kim S.H., Kim J.K., Park C.H., Yun M.J., Heo J.H. Hemodynamic changes in limb shaking TIA associated with anterior cerebral artery stenosis // Neurology. — 2004 Oct 26. — 63(8). — 1519-21.
22. Holzer K., Sadikovic S., Esposito L., Bockelbrink A., Sander D., Hemmer B., Poppert H. Transcranial Doppler ultrasonography predicts cardiovascular events after TIA // BMC Med. Imaging. — 2009. — 9. — 13.
23. Magnetic resonance techniques for the identification of patients with symptomatic carotid artery occlusion at high risk of cerebral ischemic events / C.J.M. Klijn, L.J. Kappelle, J. van der Grond et al. // Stroke. — 2000. — Vol. 31. — P. 3001-3007.
24. Markus H. Severely impaired cerebrovascular reactivity predicts stroke and TIA risk in patients with carotid artery stenosis and occlusion / H. Markus, M. Cullinane // Brain. — 2001. — Vol. 124, Pt 3. — P. 457-467.
25. Matsuda N., Matsuura Y., Soeta T., Shibano K., Endo K., Sato Y., Takahashi K., Yokoyama H., Yamamoto T. Evaluation of neurosonography for a case of brainstem transient ischemic attack (TIA) due to proximal subclavian artery stenosis, with favorable outcome after axillo-axillary bypass grafting // Rinsho Shinkeigaku. — 2005. — 45(5). — 372-5. Japanese.
26. Ovbiagele B., Liebeskind D.S., Kim D., Ali L.K., Pineda S., Saver J.L. Optimizing screening and management of asymptomatic coronary artery disease in patients with stroke and patients with transient ischemic attack // Stroke. — 2009. — 40(10). — 3407-9.
27. Ovbiagele B., Cruz-Flores S., Lynn M.J., Chimowitz M.I. Warfarin-Aspirin Symptomatic Intracranial Disease (WASID) Study Group (2008) Early stroke risk after transient ischemic attack among individuals with symptomatic intracranial artery stenosis // Arch. Neurol. — 65(6). — 733-737.
28. Powers W.J. Cerebral hemodynamics in ischemic cerebrovascular disease / W.J. Powers // Ann. Neurol. — 1991. — Vol. 29. — P. 231-240.
29. Recurrent stroke in patients with symptomatic carotid artery occlusion is associated with high-volume flow to the brain and increased collateral circulation / D.R. Rutgers, C.J. Klijn, L.J. Kappelle, J. van der Grond // Stroke. — 2004. — Vol. 35, № 6. – P. 1345–1349.
30. Satomura S., Tamura A., Kido Y. Study of blood flow in vessels by ultrasonics // Abstr. Meeting Acoust Soc. Jpn. — 1958. — 81-82 (in Japanese).
31. Sharma V.K. Transient ischemic attack associated with stenosis of accessory middle cerebral artery // Clin. Neurol. Neurosurg. — 2010. — 112(1). — 88.
32. World Health Organization MONICA Project Principal Investigators. The World Health Organization MONICA Project (monitoring trends and determinants in cardiovascular disease) // J. Clin. Epidemiol. — 1988. — 48. — 105-114.