Журнал «» 3(17) 2011
Вернуться к номеру
Досвід використання Бісопрололу у пацієнтів молодого віку з нейроциркуляторною дистонією
Авторы: Осовська Н.Ю., д.м.н., кафедра внутрішньої медицини № 1 Вінницького національного медичного університету ім. М.І. Пирогова
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
Практикуючі лікарі добре знають, що існує певна категорія пацієнтів, які висловлюють численні скарги, пов’язані з діяльністю серцево-судинної системи, але при проспективному спостереженні за цими пацієнтами практично не виявляється формування будь-яких серйозних захворювань, таких як: ішемічна або гіпертонічна хвороба; небезпечні для життя порушення ритму; застійна серцева недостатність. Кількість таких пацієнтів досить велика, а саме вони становлять 32–50 % від осіб, які взагалі мають скарги з боку серцево-судинної системи. Це досить великий контингент хворих, тому лікар не може ігнорувати таких пацієнтів та їх скарги [1, 2]. Ці особи довго страждають з періодичним загостренням та вщуханням симптоматики, вкрай нестійкі до різних стресових ситуацій, мають знижену працездатність і взагалі можуть бути соціально неповноцінними. Страждання цих людей має особливе емоційне забарвлення, тому якість їх життя буває гіршою, навіть як у пацієнтів із тяжкими соматичними захворюваннями.
Хоча нейроциркуляторна дистонія (НЦД) є досить поширеною патологією, що зустрічається в будь-якому віці, немає чітких статистичних даних як в Україні, так і за кордоном. Причина полягає в значній варіабельності симптомів, і зовсім не обов’язково тільки з боку серцево-судинної системи. Пацієнту з НЦД виставляється багато діагнозів і проводиться багато курсів лікування, як правило, малоуспішного. Це стає причиною переконання пацієнта у складності його хвороби, тяжкості стану та безнадійності лікування, що замикає патологічне коло у свідомості пацієнта та загострює симптоматику.
У вітчизняній літературі прийнято вважати, що термін «нейроциркуляторна дистонія» був введений Г.Ф. Лангом у 1953 році. За визначенням автора, НЦД — поліетіологічне захворювання, в основі якого лежать порушення нейроендокринної регуляції з численими та різноманітними клінічними симптомами, що виникають та поглиблюються на фоні стресових впливів та відзначаються доброякісним прогнозом. Іншими словами, НЦД — це група симптомів, в основі яких лежить порушення судинного тонусу, макро- та мікроциркуляції. Виходячи з цього, була запропонована і відповідна класифікація з виділенням гіпер-, гіпотонічного та змішаного типів, що впродовж уже половини століття використовується нашими лікарями. Дана класифікація визначила належність НЦД саме до захворювань серцево-судинної системи. Це підтверджується і тим, що на сьогодні виявлено можливість активації місцевих гормонів, які пошкоджують міокард в умовах порушеної нейрогуморальної регуляції серцево-судинної системи та викликають появу змін за типом дистрофії міокарда. За визначенням Г.Ф. Ланга, «дистрофія міокарда — це фукціональна патологія, яка характеризується наявністю біохімічних та фізико-хімічних змін у серцевому м’язі, при яких морфологічний субстрат остаточно не з’ясований, імовірно, є непостійним, а часто і зовсім відсутній…».
Така невизначеність щодо морфологічного субстрату захворювання і стала основою критики визначення НЦД як самостійної нозологічної одиниці. Однак ще в 1936 році Д.Д. Плетньов, описуючи «невроз серця», зауважив, що це захворювання «скоріше з невиявленими змінами (щодо субстрату), ніж зовсім без змін…». Далі він виводить молекулярні основи цього захворювання з акцентом на «зміни кількості та співвідношення електролітів та певних гормонів… що суттєво впливає на стан клітинної мембрани».
На сьогодні виявлено порушення ряду регуляторних систем у пацієнтів із НЦД: у першу чергу симпатоадреналової, меншою мірою — серотонінергічної, гістамін-гістаміназної, калікреїн-кінінової [3, 4]. Відмічено навіть динамічне зниження скоротливої здатності міокарда лівого шлуночка при проведенні проби з фізичним навантаженням у пацієнтів із НЦД з тяжким перебігом [5]. У молодих пацієнтів із вираженими кардіалгіями та вегетативними розладами визначені зміни метаболізму міокарда, аналогічні таким при ішемічній хворобі серця [6].
Ще одним фактом, який визначає НЦД як структурно-функціональний стан, є зв’язок вегетативної дисфункції зі сполучнотканинною дисплазією та малими структурними серцевими аномаліями як її проявами: пролапсом мітрального клапана, аномальними хордами тощо. Більше ніж у половини пацієнтів із синдромом сполучнотканинної дисплазії і малими структурними серцевими аномаліями реєструється вегетосудинна дистонія з ознаками гіперсимпатикотонії та підвищенням артеріального тиску (АТ). Гіперсимпатикотонія та артеріальна гіпертензія у цих молодих людей, на думку більшості дослідників, є проявом одного патологічного процесу порушення на рівні побудови біологічних мембран, який реалізується в особливостях як центральних і периферичних нервових рецепторів, так і сполучнотканинних структур [7, 8].
Зважаючи на значну нестійкість АТ у пацієнтів із НЦД, було проведено ряд досліджень із використаннями добового моніторування артеріального тиску (ДМАТ), які виявили зміни переважно систолічного АТ (САТ), а саме значну його варіабельність, підвищення АТ в нічний час, підвищення частоти серцевих скорочень (ЧСС). Ці зміни добового профілю АТ супроводжувалися збільшенням добової екскреції катехоламінів та їх метаболітів [5]. Різноманітність, частота та вираженість вегетативних порушень саме у молодих пацієнтів із підйомами АТ визначають актуальність вивчення особливостей перебігу та зумовлюють вибір корекції цих патологічних станів вже на перших етапах виявлення хвороби.
Викликає особливий інтерес та стурбованість зв’язок НЦД з панічними розладами. У зарубіжній літературі терміни «вегетативний криз» та «панічна атака» є тотожними. Картина панічного розладу досить чітка: це напад гострої тривоги (паніки), який виникає раптово, без суттєвої зовнішньої причини, і супроводжується значними вегетативними проявами: серцебиттям («серце колотиться, вискакує з грудей»), утрудненням дихання та відчуттям нестачі повітря, тремтінням кінцівок або всього тіла, можуть бути пітливість, запаморочення, нудота, млявість, гострий страх смерті або втрати контролю над собою. Поширеність панічних розладів серед дорослого населення становить 1,5–2 % [9]. Характерний вік початку — 20–30 років. Підвищений або нестабільний АТ спостерігається у таких пацієнтів у 80–100 % випадків.
Тахікардичний синдром — один із характерних проявів НЦД, для якого властиве підвищення автоматизму синоатріального вузла із збільшенням ЧСС до 90 і більше ударів за хвилину. Цей синдром зустрічається у 85–92 % пацієнтів із НЦД. Частіше в його основі лежить підвищення тонусу симпатичної нервової системи, рідше зниження тонусу блукаючого нерва. Синусова тахікардія істотно лімітує фізичну працездатність хворих, у чому переконують результати проведення проб із дозованим фізичним навантаженням. ЧСС досягає субмаксимальних для даного віку величин вже при виконанні робіт малої потужності — 50–75 Вт.
У хворих із НЦД у межах аритмічного синдрому найчастіше зустрічається екстрасистолія, рідше надшлуночкові форми пароксизмальної тахікардії, вкрай рідко пароксизми фібриляції або тріпотіння передсердь. Порушення ритму при НЦД доводиться диференціювати з такими при міокардитах, дисметаболічних кардіоміопатіях, рефлекторних впливах (остеохондроз, патологія жовчного міхура), гіперфункцією щитоподібної залози.
Гіперкінетичний кардіальний синдром є самостійним клінічним різновидом НЦД. Як і інші кардіальні синдроми, він відноситься до центрогенно обумовлених вегетативних розладів. Кінцевою ланкою його патогенезу є підвищення активності бета-адренорецепторів міокарда на фоні і внаслідок симпатоадреналової гіперактивації. У результаті формується гіперкінетичний тип кровообігу з характерною гемодинамічною тріадою: збільшення ударного і хвилинного об’ємів серця, що набагато перевершують метаболічні потреби тканин; збільшення швидкості вигнання крові з серця; компенсаторне падіння загального периферичного судинного опору.
Мета. Зважаючи на провідну роль активації симпатоадреналової системи у виникненні більшості симптомів НЦД, метою нашої роботи стало вивчення впливу монотерапії b-адреноблокатором препаратом Бісопрол® на клінічні прояви, показники добового профілю АТ, холтерівського моніторування ЕКГ (ХМЕКГ) та варіабельності ритму серця (ВРС) у пацієнтів з НЦД.
Матеріали і методи
У дослідження було включено 30 пацієнтів із клінічними проявами НЦД, гіперсимпатикотонії та підвищенням АТ. Середній вік хворих становив 21,8 ± 3,6 року; жінок було 20 (66,7 %), чоловіків — 10 (33,3 %). У дослідження не включали пацієнтів із доведеною гіпертонічною хворобою, будь-якими вродженими та набутими вадами серця, значною супутньою патологією.
ХМЕКГ проводили в амбулаторних та стаціонарних умовах. Запис ЕКГ під час моніторування був безперервний у 3 відведеннях, що відповідали стандартним відведенням ІІ, V2 та V5. Під час моніторування хворі дотримувалися рухового режиму, який відповідав повсякденному рівню фізичного навантаження. Аналіз порушень ритму та відхилень сегмента ST щодо ізолінії проводився автоматично, відповідно до загальноприйнятих критеріїв. Визначали такі показники: середню добову частоту серцевих скорочень, загальну кількість шлуночкових екстрасистол (ШЕ) за добу (клас ШЕ за класифікацією Лауна) загальну кількість надшлуночкових екстрасистол (НШЕ) за добу, наявність епізодів шлуночкових (ШТ) та надшлуночкових тахікардій (НШТ).
Інтервали між вимірюваннями становили 15 хвилин з 7.00 до 22.00 та 30 хвилин в нічний період — з 22.00 до 7.00. Оцінювали такі показники: середній добовий систолічний АТ, середній добовий діастолічний АТ (ДАТ), індекс часу підвищення систолічного та діастолічного АТ (відповідно ІЧ САТ, ІЧ ДАТ) — навантаження тиском, відсоток вимірювань від загальної кількості, при яких значення АТ перевищують нормальні величини (вдень — 140/90 мм рт.ст., вночі — 120/80 мм рт.ст.), добові індекси АТ (ДІ САТ, ДІ ДАТ відповідно), варіабельність систолічного та діастолічного АТ за добу (ВАР САТ, ВАР ДАТ відповідно), швидкість ранкового підйому (ШРП САТ, ШРП ДАТ) з 5-ї до 10-ї години, яку розраховували як різницю між максимальним та мінімальним значеннями. Аналіз показників ДМАТ з визначенням ступеня АГ проводився згідно з рекомендаціями Європейського товариства кардіологів [11].
Оцінка показників добової ВРС проводилася за допомогою ХМЕКГ. Відповідно до рекомендацій вивчали часові й частотні показники ВРС: стандартне відхилення NN-інтервалу (SDNN), відсоток сусідніх NN-інтервалів, різниця між якими перевищує 50 мс (pNN50 %), квадратний корінь суми квадратів різниць тривалості сусідніх інтервалів NN (RMSSD), потужність у діапазоні низьких частот (0,04–0,15 Гц) (LF), потужність спектра високочастотного компонента (0,15–0,4 Гц) (HF) HF, відношення LF до HF (LF/HF) [12].
Оцінку вегетативного статусу проводили в балах за допомогою анкети-питальника з використанням критеріїв синдрому вегетативних порушень, запропонованої А.М. Вейном [10]. Якщо загальна сума балів перевищувала 15, констатували синдром вегетативної дистонії, від 16 до 25 балів — легкого ступеня, від 25 до 35 — середнього ступеня, більше 35 — тяжкого ступеня.
Відповідно до дизайну дослідження як монотерапію використовували селективний b-адреноблокатор препарат Бісопрол®, добова доза якого становила 2,5–5 мг на добу в 1 прийом. Термін лікування — 3 місяці.
Статистична обробка отриманих результатів проводилась методами параметричної та непараметричної статистики. У вибірках із нормальним розподіленням даних результати наведені у вигляді М ± m, де М — середня величина і m — математична похибка середньої, порівняння результатів проведено за параметричним методом лінійних контрастів із використанням критерію Шеффе. Порівняння відносних величин проведено за допомогою критерію c2.
Результати і їх обговорення
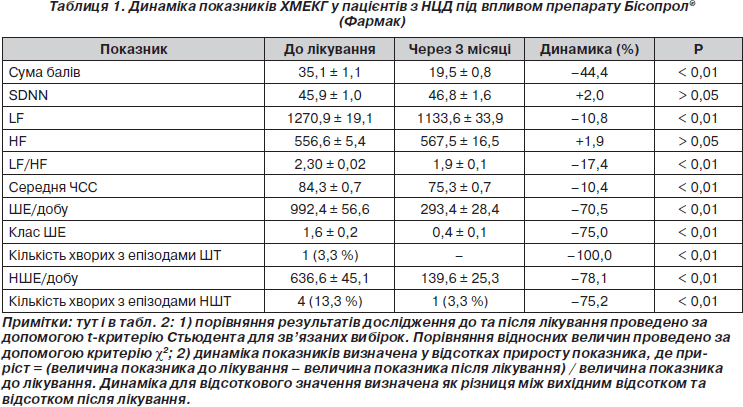
Лікування препаратом Бісопрол® сприяло покращенню загального стану хворих: за результатами оцінки вегетативного стану за шкалою питальника Вейна сума балів після лікування достовірно (р < 0,01) зменшилася майже вдвічі (35 та 19 балів відповідно). Слід відзначити, що зменшення втомлюваності відмітили 76 % пацієнтів, кардіалгій — 59 %, головного болю — 55 %, задишки — 38 %, серцебиття — 80 %, зменшення кількості та ступеня вираженості вегетативних кризів — 77 % пацієнтів. Суттєве покращення загального стану хворих та зменшення скарг було відмічено на фоні достовірного (р < 0,01) зменшення ЧСС (табл. 1).
Початкова оцінка вегетативного балансу за анкетою-питальником дозволила виявити підвищення симпатоадреналової активності в обстежених нами хворих порівняно з віковими нормативами [11]. При вивченні показників ВРС до лікування відмічено помірне зменшення SDNN порівняно з нормою (р < 0,01), що свідчило про зниження загальної ВРС, збільшення показника низьких частот LF і співвідношення LF/HF, що характерне для гіперсимпатикотонії (табл. 1). Проте в частини хворих спостерігалось помірне збільшення показника HF, що відобразило підвищення тонусу парасимпатичної нервової системи, ймовірно, компенсаторного характеру. Зниження загальної варіабельності ритму серця з переважанням адренергічної активності можливо розглядати як предиктор прогресування як АГ, так і аритмій.
Аналіз порушень серцевого ритму (табл. 1) до початку лікування виявив значну кількість як надшлуночкових, так і шлуночкових екстрасистол, причому як ШЕ, так і НШЕ спостерігалися частіше в активний період доби, що зумовлене фізичним та психічним навантаженням і знову-таки гіперсимпатикотонією, яка вважається одним з пускових механізмів порушень ритму серця в пацієнтів із НЦД. Як видно з даних табл. 1, у 13,3 % пацієнтів мали місце епізоди НШТ та у 3,3 % — ШТ, які відмічалися також удень, що ще раз підтверджує гіпотезу про гіперсимпатикотонію як провідний механізм аритмій у пацієнтів без очевидного ураження серця.
Під впливом препарату Бісопрол® значно зменшилась кількість ШЕ — на 70,5 %, причому достовірно зменшилась градація ШЕ за класифікацією Лауна, та НШЕ — на 78,1 % (р < 0,01). Після 3-місячної терапії, за даними ХМЕКГ, хворих з епізодами тахікардій, як ШТ, так і НШТ, не було (табл. 1). Слід відзначити, що Бісопрол® зменшив кількість майже всіх видів аритмій в активний, а також у пасивний періоди доби.
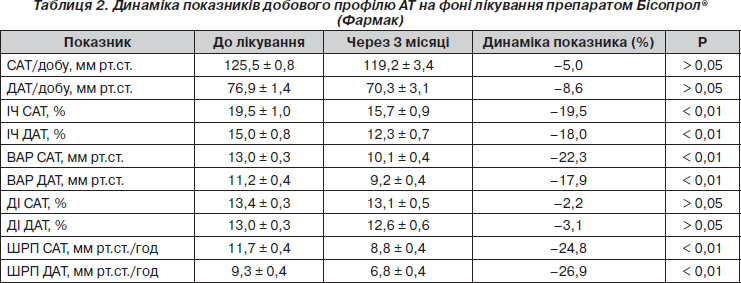
Середні показники ДМАТ, отримані в амбулаторних умовах, та їх підвищення позитивно корелюють з наявністю та ступенем органних змін [12, 13].Хоча в наших пацієнтів середні цифри АТ не перевищували рекомендованої норми [14] (табл. 2), індекс часу систолічного та діастолічного АТ по групі був на верхній межі, а у 33 % перевищив рекомендовані показники. Під впливом 3-місячного лікування препаратом Бісопрол® намітилася тенденція до зменшення середніх показників систолічного та діастолічного АТ, а також достовірно (р < 0,01) зменшилися показники ІЧ САТ та ІЧ ДАТ — на 19,5 та 18 % відповідно. Перевищення рекомендованих норм після лікування не спостерігалося в жодного пацієнта. Індекс часу більш точно, ніж середні значення АТ, характеризує гіпербаричне навантаження на органи-мішені. У числених дослідженнях довели, що тривалість підвищення АТ є важливим фактором ризику серцево-судинних ускладнень: W.B. White із співавт. [15] встановили більш тісний кореляційний зв’язок між індексом маси міокарда лівого шлуночка, максимальною швидкістю наповнення лівого шлуночка та індексом лівого передсердя з навантаженням часом, ніж з середніми та абсолютними показниками АТ. Тому зменшення та нормалізація індексів часу є суттєвим позитивним результатом, отриманим у результаті лікування.
Дослідження ролі варіабельності АТ показали, що підвищення ВАР АТ має тісні кореляційні залежності з тяжкістю АТ, раннім розвитком гіпертрофії лівого шлуночка та його діастолічної дисфункції, а також ретинопатії [16, 17]. Лікування препаратом Бісопрол ® призвело до достовірного (р < 0,01) зменшення варіабельності систолічного та діастолічного АТ на 22 та 18 % відповідно.
Фремінгемське дослідження, яке вважається еталоном епідеміологічних досліджень, висвітлило значення ранкового підйому АТ у виникненні таких ускладнень артеріальної гіпертензії, як інсульти, інфаркти та раптова смерть, ризик яких на 70 % був вищий у ранкові часи порівняно з іншими періодами доби. У наших пацієнтів швидкість ранішнього підйому систолічного АТ сягнула рекомендованої норми, діастолічного — знаходилася на її межі. У результаті лікування було досягнуто достовірного (р < 0,01) зменшення ШРП САТ та ШРП ДАТ майже на 25 та 27 % відповідно (табл. 2).
Не зазнали ніякого впливу на тлі лікування показники добового індексу АТ. Це, ймовірно, пов’язане з тим, що ці показники були нормальними й до лікування: у дослідження ввійшли пацієнти-дипери без значних стійких порушень добового профілю АТ.
Висновки
1. Монотерапія b-адреноблокатором Бісопрол® у дозі 2,5–5 мг на добу в 1 прийом позитивно впливає на якість життя, зменшує ступінь вегетативного дисбалансу як за даними шкали вегетативного тонусу, так і за даними варіабельності серцевого ритму в пацієнтів із НЦД та домінуючими в клініці тахікардією, екстрасистолією і підвищенням АТ. А також сприяє зменьшенню всіх видів аритмій як в активний, так і в пасивний період доби.
2. Призначення препарату Бісопрол® протягом 3 місяців у молодих пацієнтів із НЦД сприяло нормалізації добового профілю артеріального тиску, що характеризувалося зменшенням індексів часу, швидкості ранкового підйому й варіабельності як систолічного, так і діастолічного АТ (зменшення показників ІЧ САТ та ІЧ ДАТ на 19,5 та 18 %, та достовірне зменшення ШРП САТ та ШРП ДАТ на 25 та 27 %).
3. Суттєве зниження під впливом лікування препаратом Бісопрол® частоти та ступеня порушень серцевого ритму є підставою для рекомендації використання препарату Бісопрол® в осіб молодого віку з НЦД та ознаками гіперсимпатикотонії у дозі 2,5–5 мг на добу.
1. Йонеску В. Сердечно-сосудистые расстройства невротического типа: Пер. с рум. — Бухарест: Изд-во Акад. Соц. респ. Румыния, 1973. — 203 с.
2. Михайлов Б.М. Соматоморфные расстройства // Здоровье Украины. — 2007. — № 6/1. — С. 27.
3. Зимин В.И. Клинические аспекты изучения калликреин-кининовой системы у больных нейроциркуляторной дистонией: Автореф. дис... канд. мед. наук. — М., 1983.
4. Меньшиков В.В., Маколкин В.И., Большакова Т.Д. Нейроэндокринная регуляция у больных с нейроциркуляторной дистонией // Кардиология. — 1980. — № 11. — С. 23-28.
5. Маколкин В.И., Подзолков В.И., Большакова Т.Д. Особенности обмена катехоламинов у больных гипертонической болезнью в начальной стадии // Тер. арх. — 1997. — № 9. — С. 23-27.
6. Rusdal A.E., Teelsen O., Pedersen A. Regulatory disturbances in neurotic patients: psychophysiological and neurophysiological correlates // Int. J. Neuroregul. Dis. — 2002. — V. 11. — P. 45-56.
7. Калмыкова А.С., Ткачева А.С., Зарытовская Н.В. Малые сердечные аномалии и синдром вегетативной дисфункции у детей // Педиатрия. — 2003. — № 3. — С. 9-11.
8. Богослав Т.В., Медведева В.И., Медведев В.В. Вариабельность ритма сердца у больных первичным пролапсом митрального клапана // Вестник аритмологии. — 2002. — № 26. — С. 67-70.
9. Евсегнеев Р.А. Психиатрия для всех. — Мн.: Беларусь, 2006. — 478 с.
10. Вегетативные расстройства: клиника, диагностика, лечение / Под ред. А.М. Вейна. — М.: Мед. информ. агентство, 2000.
11. Рабочая группа Европейского Кардиологического Общества и Северо-Американского общества стимуляции и электрофизиологии. Вариабельность сердечного ритма. Стандарты измерения, физиологической интерпретации и клинического использования // Вестник аритмологии. — 1999. — № 11. — С. 53-78.
12. Den Hond E., Staessen J.A. Relation between left ventricular mass and sistolic blood pressure at baseline in the APTH and THOP trials // Blood Pressure Monitoring. — 2003. — V. 8. — P. 173-175.
13. Staessen J.A., Bieniaszewsky L., O’Brien E.T. et al. An epidemiologic approach to ambulatory blood pressure monitoring: the Belgian population study // Blood Pressure Monitoring. — 1996. — V. 1. — P. 13-26.
14. O’Brien E., Asmar R., Beilin L. et al. European Society of Hypertension Working Group on Blood Pressure Monitoring. Practice guidelines of the European Society of Hypertension for clinic, ambulatory and self blood pressure measurement // J. Hypertens. — 2005. — V. 23. — P. 697-701.
15. White W.B., Lund-Johansen P., Omvik P. Assisment of four ambulatory monitors and measurements by clinicians versus intraarterial blood pressure at rest and during exercise // Amer. J. Cardiol. — 1990. — Vol. 65. — P. 60-66.
16. Дзяк Г.В., Коваль Е.А., Колесник Т.В. и др. Ренин-ангиотензиновая система (РАС) и гипертрофия левого желудочка: возможности предотвращения и обратного развития с помощью ингибиторов АПФ // Укр. кардіологічний журнал. — 2003. — № 6. — С. 67-78.
17. Miao C.Y., Su D.F. The importance of blood pressure variability in rat aortic and left ventricular hypertrophy prodused by sinoaortic denervatson // J. Hypertens. — 2002. — V. 20 (9). — Р. 1725-9.