Журнал «Боль. Суставы. Позвоночник» 2 (02) 2011
Вернуться к номеру
Роль навантаження у формуванні кісткової тканини та попередженні її втрати. Огляд літератури
Авторы: BERGMANN P., Department of Nuclear Medicine, Laboratory of Clinical Chemistry and Experimental Medicine, CHU Brugmann, Universite Libre de Bruxelles, Belgium;
BODY J.J., Department of Medicine, CHU Brugmann, Universite Libre de Bruxelles, Brussels, Belgium;
BOONEN S., Division of Gerontology and Geriatrics, Center for Musculoskeletal Research, Department of Experimental Medicine, Catholic Leuven University, Belgium;
BOUTSEN Y., Department of Rheumatology, Mont-Godinne University Hospital, Universite Catholique de Louvain, Belgium;
DEVOGELAER J.P., Rheumatology Unit, Saint-Luc University Hospital, Universite Catholique de Louvain, Brussels, Belgium;
GOEMAERE S., KAUFMAN J., Unit for Osteoporosis and Metabolic Bone Diseases, Ghent University Hospital, Ghent, Belgium;
REGINSTER J.Y., Department of Public Health Sciences, University of Liege, Liege, Belgium;
ROZENBERG S., Department of Gynaecology-Obstetrics, Free University of Brussels, Brussels, Belgium
Рубрики: Семейная медицина/Терапия, Ревматология, Травматология и ортопедия, Неврология
Версия для печати
1. Вступ
Перші дані про зв’язок між механічним навантаженням та метаболізмом кісткової тканини були отримані понад сторіччя тому, коли у 1892 році Wolff описав, як моделювання кістки під час росту залежить від локального натягу та еволюціонує в напрямку найбільш пристосованої структури, яка чинить опір механічному тиску [1]. Низька гравітація або іммобілізація викликає втрату маси кісткової тканини (BMC). Збільшення місцевого навантаження веде до приросту кісткової тканини. Frost, узявши ці спостереження за основу, запропонував теорію механостату, згідно з якою маса кістки та її геометрія регулюються механічними навантаженнями [2, 3]. Відповідно до цієї концепції, однією з умов розвитку та підтримки здорової кістки є механічний натяг, сприйняття якого безпосередньо передається на ефекторні клітини, остеокласти та остеобласти. Механічне навантаження та його сприйняття є важливим у будь-якому віці, зокрема, для формування міцної кістки протягом дитинства та юності, для підтримки піку кісткової маси протягом молодого віку, для мінімізації втрат кісткової тканини в клімактеричному періоді та при старінні. У даній статті підсумовано сучасні дані про тригери та ефектори, що беруть участь у механічній регуляції моделювання та ремоделювання кістки. Автори статті розглядають, як механічне регулювання взаємодіє з іншими регуляторами кісткового метаболізму: харчовим, гормональним та медикаментозним. Окрім цього, автори досліджують, яка механічна сила може допомогти покращити кісткову масу в різні періоди життя.
Дана стаття базується на літературних джерелах, отриманих через систему Pubmed та Medline, використовуючи ключові слова: механічне навантаження, остеопороз, формування та резорбція кісткової тканини, фізична активність, спорт. Також були використані декілька нещодавно опублікованих оглядів літератури.
2. Експериментальні моделі, які демонструють вплив навантаження на ремоделювання кістки
Використовували різні експериментальні моделі, щоб вивчити in vivo, як впливає на ремоделювання кістки механічне навантаження при різних видах механічної деформації (< 50–4000 μstrains). Механічне навантаження поділеної на частини ліктьової кістки птаха запобігає збільшенню пористості кортикального шару, резорбції ендосту та індукує формування нового шару періосту, що сягає максимуму на поверхні натягу [4]. Ефект механічного навантаження на формування окістя залежить від сили навантаження [5] та периферичного градієнту натягу [6], який визначається частотою (коли натяг є низьким, то для отримання істотного ефекту частота повинна бути високою) [7, 8]. Навантаження іммобілізованої великогомілкової кістки силою в чотири бали попереджує втрату кісткової маси внаслідок іммобілізації та збільшує формування періосту [9]. Осьове навантаження ліктьової кістки щура перетворює поверхню резорбції на зону формування нового шару періосту [10]. Зростання темпів формування періосту також спостерігалося в моделі навантаження великогомілкових кісток мишей та залежало від його частоти (у межах 10–400 Гц) [11]. Осьова компресія індукує збільшення об’єму губчастої кістки, який є максимальним у проксимальному метафізі великогомілкових кісток мишей [12] і в дистальному метафізі стегнової кістки кролика [13]. Аксіальна компресія також збільшує формування кістки у випадку моделі навантаження хвостових хребців щура [14]. Низьке навантаження (< 50 μstrain) при дуже високій частоті (90 Гц), подібній до сигналів, які генерують м’язи при динаміці зміни положення тіла [15], може збільшити швидкість формування трабекулярної кісткової тканини в щурів за рахунок навантаження масою власного тіла, відновити формування трабекулярної кістки до нормального рівня в підвішених за хвіст щурів та у випадку моделі невагомості [16]. Подібно до гормональної передачі сигналів, існує десенсибілізація до тривалого механічного стимулювання; чутливість відновлюється при переривчастому навантаженні [17, 18], короткі періоди навантаження є достатніми для посиленого формування кістки [19].
3. Сприйняття навантаження та передача сигналу
Багато експериментальних досліджень in vitro та in vivo вказують на те, що сітка остеоцитів є головним сенсором, який виявляє навантаження на кісткову тканину [20]. Остеоцити знаходяться в лакунарно-канальцевій системі та широко представлені в кістковій тканині, взаємопов’язані своїми відростками та сполучаються з клітинами періосту та з кістковим мозком [21], ідеально розташовані для сприйняття навантаження на кістку та змінюють інтенсивність ремоделювання залежно від його сили. Остеоцити чутливі до біомеханічного тиску [22], особливо до рідкого потоку, що індукується при занурюванні в лакунарно-канальцеву систему [23, 24]. Чутливість остеоцитів до навантаження є вищою, ніж у остеобластів [25]. Остеоцити вмирають шляхом апоптозу внаслідок відсутності навантаження [26], їх смерть запускає місцеву резорбцію внаслідок зменшення їх інгібуючого впливу [27]. З іншого боку, коли остеоцити зазнають навантаження, пригнічується їх апоптоз [28], з’являються сигнали, які пригнічують активність остеокластів [29, 30] та активують диференціацію остеобластів [31]. Математичне моделювання з використанням аналізу кінцевих елементів може описати ремоделювання в кортикальній та трабекулярній кістці з дослідженням орієнтації остеонів, спираючись на контроль остеоцитів [32].
Різні кальцієві канали [33] викликають внутрішньоклітинну передачу сигналу через збільшення рівня внутрішньоклітинного кальцію та протеїнкінази C. Реакція на навантаження передається від клітини до клітини через клітинні відростки, кількість яких збільшується при навантаженні [20, 34], залежить від структури мембрани та взаємодії елементів цитоскелета. Сигнали, які генеруються під впливом дотичного навантаження, посилюють секрецію ATФ, впливають на G-білкові пуриноцептори [35]. Внутрішньоклітинна трансдукція включає декілька кіназ, зокрема, позаклітинного сигнального регулятора – ERK-кіназу, пригнічення якої погіршує механічну передачу сигналів [36]. Вплив навантаження, подібно до дії паратгормону та інших стимуляторів формування кісткової тканини, збільшує остеобласт-c-fos-транскрипцію, взаємодіючи з декількома ділянками промотора [37].
Сприйняття навантаження також можливе через взаємодію з паратгормоном. Наприклад, Miyauchi та співавтори описали об’єм-залежний потік Ca2+ в остеоцити, особливо в ті, які активуються паратгормоном через аденілатциклазу [38]. Взаємодія сприйняття навантаження та c-fos-транскрипції, можливо, сприяє синергічному впливу механічного навантаження та паратгормону на метаболізм кісткової тканини [39–42].
Інша ключова молекула для сприйняття механічного навантаження у кістці — рецептор до естрогенів a (ERa). Понад 90 % остеоцитів кортикальної кістки щурів містять ERa. При навантаженні на великогомілкову кістку щура виникає фосфорилювання ERa [43], ймовірно, через МАР-кіназу [44], та відбувається зміщення ERa у бік ядра та мембрани [45]. Зменшення ERa знижує потенціал остеобластів для відповіді на механічне навантаження [46]. Вплив останнього на експлантовану ліктьову кістку щура підвищується естрогенами [47–49] та подібне до відповіді на навантаження остеобластів у постменопаузальних жінок [50].
Зважаючи на те, що вміст ERa регулюється естрогенами, то Lanyon вважає, що зменшення чутливості до навантаження зумовлене зменшенням кількості рецепторів, що може бути ключовим чинником у втраті кісткової маси в постменопаузальному періоді [51]. Доведено, що дефіцит естрогенів та відсутність механічного навантаження індукують апоптоз остеоцитів та втрату кісткової маси [26, 52, 53].
З іншого боку, надмірне навантаження та пошкодження кістки збільшують апоптоз остеоцитів [54]. In vivo експерименти на вівцях показали істотний взаємозв’язок між рівнем естрадіолу і навантаженням на поперечний зріз середнього сегмента кісток задньої кінцівки: приріст кортикальної кістки становив від 6 до 27 % у тварин, які мали фізичне навантаження та підвищений рівень естрадіолу порівняно з групою з низьким рівнем естрадіолу, та тваринами, які майже не рухалися [55]. Навпаки, лікування самців щурів естрогенами може зменшити товщину періосту, що індукується механічним навантаженням [56]. Це може бути зумовлено тим, що естрогени безпосередньо індукують збільшений механічний опір кістки, зменшуючи натяг, викликаний механічною дією [57]. Поліморфізм ERa також посилює вплив фізичної активності на формування кісткової тканини у дівчат [58].
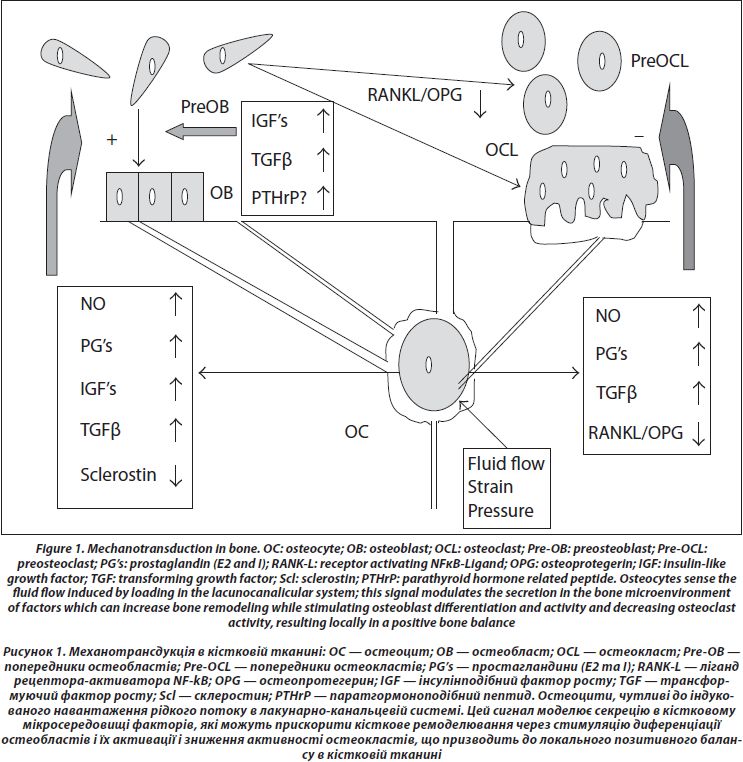
4. Передача сигналу до ефекторних клітин (рис. 1)
Остеоцити можуть впливати на проліферацію і диференціацію остеобластів [59]. На сьогодні ідентифіковано декілька хімічних медіаторів, які можуть циркулювати в лакунарно-канальцевій системі та досягати ефекторних клітин. До цих посередників зараховують оксид азоту (NO), простагландини Е та І, склеростин, IGF’s, TGFb, RANKL і OPG.
По-перше, дотичне навантаження на кістку індукує продукцію оксиду азоту (NO) [60, 61]; експресія синтази NO зростає in vivo в остеоцитах після навантаження попередньо підвішених за хвіст щурів [62]. NO пригнічує активність остеокластів [63] та підвищує активність остеобластів [64]. Пригнічення синтезу NO через L-NAME запобігає формуванню періосту, що індукується механічним навантаженням [65], таким чином припускають, що саме NO належить центральна роль у механізмі трансдукції. Ця ідея підтримується тим, що ремоделювання кістки неможливе при навантаженні у мишей, які раніше були підвішені за хвіст та які не здатні індукувати синтез NO [66].
По-друге, навантаження викликає синтез простагландинів [67] за рахунок збільшення активності індукованих циклооксигеназ (COX2), зростання яких залежить від фосфорилювання позаклітинної регульованої кінази (ERK) [68, 69]. Простагландини стимулюють активність остеобластів через збільшення синтезу IGF’s [70], тому їх рівень збільшується одразу після механічної стимуляції [71–73]. РGE і PGI безпосередньо гальмують діяльність остеокластів [74] та одночасно активують кісткове ремоделювання через клітини остеобластичної лінії [75].
По-третє, концентрація склеростину (SOST) — білка, що синтезується остеоцитами та належить до сім’ї TGF/BMP, який гальмує Wnt-сигнал, знижується у відповідь на механічну стимуляцію [76]; оскільки Wnt відіграє істотну роль у проліферації і диференціюванні остеобластів, зниження SOST могло б стати важливим сигналом до збільшення кісткової маси у відповідь на навантаження [77, 78].
Оскільки при навантаженні відбуваються зміни в інтенсивності процесів резорбції, то, крім можливої прямої дії простагландинів E та І на пригнічення активності остеокластів, також здійснюється вплив на співвідношення RANKL і OPG в остеоцитах та стовбурових клітинах, зменшуючи їх залежно від сили навантаження [30, 79]. При механічній стимуляції остеоцити синтезують TGF, який може бути посередником у пригніченні процесів остеокластогенезу [80].
Крім контролю за діяльністю остеоцитів, остеобластів та остеокластів, відзначено вплив на кістковий матрикс та стан кістки (трабекулярного шару, ендоосту та періосту), деформації — скорочення або подовження цих клітин. В експерименті іn vitro доведено, що механічні деформації можуть привести до генерації сигналів, які збільшують проліферацію остеобластів на певних стадіях диференціювання [81]. Циклічні навантаження також регулюють експресію RANKL та OPG остеобластоподібними клітинами [82]. Також відзначено, що при механічному навантаженні пригнічуються проліферація та диференціювання остеокластів у кістковому мозку [83].
Локальна секреція паратгормоноподібних пептидів (PTHrP) клітинами остеобластичної лінії також може бути важливим місцевим медіатором навантаження. Миші, у яких видалено гени, що відповідають за синтез PTHrP у остеобластах, мають остеопенію та сповільнене формування кісткової тканини [84]. Кількість PTHrP індукована натягом в остеобластах [85]. PTHrP знаходиться в періості, особливо в місцях кріплення сухожилля [86]. Автори помітили, що через три дні після фіксації щура за хвіст рівень PTHrP був зниженим в періості стегнової та великогомілкової кісток [87]. Через те, що PTHrP має аналогічну дію з паратгормоном на остеобласти та попередники остеобластів, циклічний локальний синтез PTHrP з періодичними механічними навантаженнями може бути одним зі стимуляторів формування кісткової тканини на рівні періосту у відповідь на навантаження. Зважаючи на взаємодію навантаження та активації клітинних рецепторів до паратгормону періодичне підвищення секреції PTHrP може посилювати відповідь на навантаження.
5. Нерухомість (іммобілізація)
Зменшення впливу маси тіла на кісткову тканину в умовах мікрогравітації викликає втрату кісткової маси [88]. Vikо і співавт. [89] повідомили результати дослідження стану мінеральної щільності кісткової тканини (BMD), отримані за допомогою pQCT дистального відділу променевої кістки та великогомілкової кістки в 11 космонавтів, які провели 6-місячний космічний політ. Не спостерігалося вірогідних змін на рівні дистального відділу променевої кістки, проте відбувалося суттєве зменшення мінеральної щільності у великогомілковій кістці як у кортикальному (з –0,4 до –4,3 %), так і трабекулярному (з –0,4 до –24,0 %) шарах. Після 6 місяців реабілітації відновлення було неповним. Втрата кісткової маси під час польоту виникла в результаті порушеного кісткового ремоделювання, як показали дослідження біомаркерів [90, 91]. Проведений експеримент на зрілих щурах обох статей, яких помістили в умови штучної невагомості (підвішені за задні кінцівки), також засвідчив знижене формування періосту та трабекулярної кістки, а також підвищення кісткової резорбції [92]. Зниження формування кістки в умовах мікрогравітації може виникнути в результаті зміщення диференціації мультипотентних мезенхімальних стовбурових клітин із остеобластогенезу в бік ліпогенезу [93].
Тривалий ліжковий режим призводить до втрати кісткової маси та наближається до показників, які спостерігалися в умовах мікрогравітації, наприклад, 1,2 % в тазових кістках та 0,4 % на місяць у нижніх кінцівках (Leblanc і співавт.) [94], і 1,2 % на місяць на рівні трохантера (Zerwekh і співавт.) [95]. Zerwekh спостерігав зростання поверхні резорбції та зниження формування кістки при гістоморфометрії, а також вірогідне зростання біомаркерів резорбції. Цікаво, що було вірогідне зростання BMD у кістках черепа. Цей градієнт змін у BMD, імовірно, є результатом змін потоку рідини в лежачому положенні або в умовах мікрогравітації [96]. Після шести місяців ремобілізації відновлення було лише частковим [94].
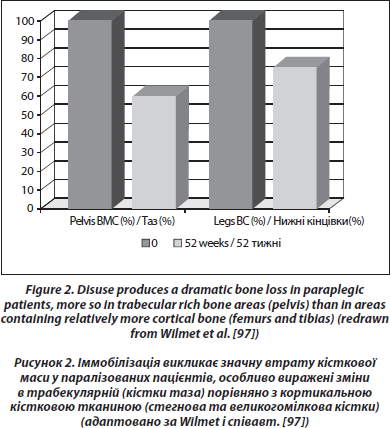
У пацієнтів, які перенесли травму спинного мозку, спостерігається суттєва та постійна втрата кісткової маси в нижній частині тіла (0,5–1,0 % трабекулярної тканини на тиждень нижче рівня пошкодження [97, 98]) (рис. 2). Ця втрата є більш значною, ніж та, що спостерігається при простій іммобілізації, та, можливо, частково викликана зміною нервової регуляції кісткової тканини, яка накладається на нерухомість [99]. Втрата кісткової маси є швидко прогресуючою та має тенденцію до стабілізування після першого року для трабекулярної кістки та через 2–3 роки для кортикальної кістки [100]. Пасивне механічне навантаження може частково зберігати кісткову масу в паралізованих ділянках, особливо в ділянці ніжки ендопротезу стегнової кістки [101]. В одному дослідженні, проведеному у пацієнтів з хребтово-спинномозковою травмою тривалістю від 0,1 до 29,5 року, призначення алендронової кислоти в дозі 10 мг щодня стабілізувало BMD у метафізі великогомілкової кістки [102]. Не спостерігалося збільшення BMD у паралізованих ділянках, хоча відзначалося зростання BMD у хребті. У сліпому плацебо-контрольованому дослідженні при гострій хребтово-спинномозковій травмі призначення алендронової кислоти в дозі 70 мг/тиждень сповільнювало втрату кісткової маси в паралізованих ділянках, але зниження втрати кісткової маси було частковим [103]. Автори спостерігали лише часткову відповідь на щотижневий прийом алендронової кислоти в обсерваційному дослідженні при гострому паралічі нижніх кінцівок [104].
Втрата кісткової маси пов’язана з геміплегією, є суттєвою у верхніх кінцівках. У лонгітудинальному спостереженні за 32 пацієнтами, що тривало в середньому 3 місяці, зниження BMD становило 12 % у паретичній верхній кінцівці та 5 % у паретичній нижній кінцівці [105]. Втрата BMD у непаретичній верхній кінцівці становила 3,5 % та у непаретичній нижній кінцівці — 2 %. Про аналогічні результати повідомили Sаtо та співавт. [106]. Ці пацієнти мають підвищений ризик переломів шийки стегнової кістки [107] у зв’язку із втратою кісткової маси, захворюваннями опорно-рухового апарату та вітамін D-недостатністю.
Частіше зустрічається втрата кісткової маси у випадку призначення терапевтом ліжкового режиму [108, 109]. У ретроспективному аналізі клінічних досліджень, проведених Heaney щодо ефективності ризендронової кислоти, встановлено, що у пацієнтів, госпіталізованих через тяжкі клінічні випадки, річна втрата BMD була максимальною на рівні трохантера стегнової кістки та становила –2,7 % на рік порівняно з –0,7 % на рік у негоспіталізованих пацієнтів групи плацебо-контролю [109]. Втрата кісткової маси в літніх пацієнтів з остеопенією, які перебували на ліжковому режимі, ймовірно, сприяє зменшенню міцності їх скелета. Результати дослідження Heaney показали ефективність ризендронової кислоти у нівелюванні втрати кісткової маси в лежачих пацієнтів.
6. Фізичні вправи і здоров’я кісткової тканини
Таким чином, шкідливий вплив нерухомості (іммобілізації) на кісткову тканину доведено. Дані експериментальних робіт демонструють, що навантаження запускає процеси формування кістки і викликає її потовщення, проте фізичні вправи мають менш виражений позитивний ефект, особливо у дорослих. Довготривалі вправи підвищують кісткову масу в молодих [110] і в літніх людей [111]. Однак, як підкреслює Forwood, «фізичні вправи не є синонімом механічного навантаження» [112]. «Вправи» охоплюють широкий спектр різноманітних заходів, починаючи з прогулянки до спорту великих досягнень. Окрім того, рівень або вид фізичного навантаження, який найкращим чином імітує навантаження в лабораторії безпосередньо на кістку, досі невідомий, тому ефект змінюватиметься залежно від типу вправи, що виконується. Наприклад, серед атлетів у бігунів BMD є вищою у ділянці «все тіло» та нижні кінцівки порівняно з середньопопуляційними показниками; а в чоловіків-велосипедистів, які брали участь у змаганнях протягом 1 року, щільність кісткової тканини на рівні хребта [113, 114] та шийки стегнової кістки зменшується [115]; очікуваний ефект є специфічним для конкретної ділянки. Є певні системні чинники, що накладаються на дію навантаження: зміна кальцієвого обміну, яка супроводжується підвищеною секрецією паратгормону і підвищенням рівня сироваткового фосфору [116, 117]; енергетичний баланс [118]; ендокринні порушення (у професійних спортсменів спостерігається зниження гіпофізарної функції) [119]. З іншого боку, під час виконання фізичної вправи виникають сигнали, що спрямовані на кістку та стимулюють формування кісткової тканини (достатнє навантаження, прикладене з достатньою швидкістю і частотою). Звичайно, дуже важко прослідкувати за більшістю людей, і особливо за особами літнього віку, та пацієнтами, які мають остеопороз і переломи. Більшість досліджень про взаємозв’язок між переломами та фізичними вправами мають епідеміологічний характер, є аналізом конкретних випадків та не мають рандомізованого характеру, водночас вони є упередженими. На сьогодні маємо декілька проспективних рандомізованих лонгітудинальних досліджень, проте за своєю суттю вони не є сліпими, тривалими й частіше за все не мають достатніх даних для вивчення впливу фізичних вправ на переломи. Знайдено лише дві оглядові статті за авторством Karlsson, в яких узагальнюються дані про ефективність вправ у попередженні переломів [120, 121].
6.1. Вправи в період росту
Декілька досліджень показали, що BMD є вищою в атлетів порівняно з середньопопуляційними показниками. У чоловіків-штангістів мінеральна щільність кісткової тканини вища на рівні верхніх та нижніх кінцівок, проте знижена в кістках черепа [122]. У жінок-гімнасток відмічається підвищення щільності кісткової тканини в кінцівках та хребті, показник корелює з тривалістю тренування [123]. У футболістів виявлено вищу мінеральну щільність на рівні стегнової кістки [124].
Оскільки ці популяційні дослідження можуть бути необ’єктивними, найбільш переконливі докази ефективності фізичних вправ для стану кісткової тканини можна почерпнути з досліджень, що вивчали вплив фізичних навантажень на різні ділянки тіла. У тенісистів протягом усього життя відзначається потовщення кортикального шару в домінуючій руці порівняно з контралатеральною [125, 126]. Зростання BMC пов’язано з розширенням кістки, а не зі збільшенням її мінеральної щільності в об’ємі. Відмінності в мінеральній щільності кісткової тканини більші, якщо людина почала займатися спортом до початку статевого дозрівання [127], а також досліджено, що товщина окістя є ширшою у чоловіків, ніж у жінок [128], дані цього спостереження збігаються з результатами експериментального дослідження про гальмівний вплив естрогенів на формування окістя [55, 56]. Збільшення кісткової маси супроводжується збільшенням м’язової маси [129]. Такі ж висновки були зроблені Ducher і співавт., але в їх дослідженні ще доведено, що тенісисти мають більшу щільність кісткової тканини у дистальному відділі променевої кістки домінуючої руки [130].
Декілька одномоментних досліджень та лонгітудинальних спостережень встановили зв’язок між рівнем фізичної активності, мінеральною щільністю та геометрією кістки. Так, в одномоментному дослідженні хлопчиків і дівчаток віком від 5 до 11 років показано зв’язок між ступенем фізичного навантаження (реєстрували за допомогою акселерометра), площею поперечного січення (DXA) і показником Z, індексом міцності при вигинанні кістки (розраховувався за допомогою вимірювань, проведених DXA), навіть із урахуванням знежиреної маси [131]. Tobias довів зв’язок між геометрією кістки та фізичною активністю в одномоментному дослідженні 4457 11-річних дітей [132]. У лонгітудинальному спостереженні, здійсненому вченими Саскачеванського університету, що охоплювало 154 підлітків (від 8 до 15 років на момент початку дослідження), отримано позитивний зв’язок між рівнем фізичної активності в підлітковому віці та показниками BMC усього тіла, поперекового відділу хребта, стегнової кістки, яке вимірювали наприкінці пубертатного періоду. Приріст (від 8 до 10 %) підтримувався і в молодому віці, можливо, тому що рівень фізичного навантаження залишався незмінним у всій групі [133]. У період припинення росту дослідження GOOD показало, що у молодих чоловіків (18,9 року) спостерігається позитивний зв’язок між рівнем фізичної активності, товщиною кортикального шару кістки, BMD усього тіла, хребта, шийки стегна, передпліччям, а також із трабекулярною vBMD [134]. Мінімальний обсяг фізичної активності становив 4 години на тиждень, і ефект був кращим у дітей, які розпочинали заняття у віці до 13 років.
Лонгітудинальні контрольовані дослідження демонструють нижчі результати. Нещодавнє дослідження 53 дівчаток-добровольців віком 7–9 років, які протягом року займалися фізичними вправами 200 хвилин на тиждень, не відзначило підвищення BMD та покращення геометричних параметрів стегнової кістки порівняно з групою контролю [135]. Отримані результати суперечать попереднім даним тієї ж групи дослідників щодо поперекового відділу хребта [136] та іншим дослідникам [137–139]. 16-місячна рандомізована контрольована програма з вивчення фізичної активності в школярів також виявила збільшення сили дистальних кісток гомілки в хлопчиків препубертатного віку та не виявила таких змін у дівчаток [140]. Найкращий вплив фізичних вправ на кісткову тканину спостерігається у дітей препубертатного віку та у тих, які виконували вправи (такі як стрибки), навіть упродовж декількох місяців [141]. Наприкінці програми показники були вищими на 3,5 % порівняно з контрольною групою. За цими дітьми потім спостерігали щорічно. Незважаючи на швидку втрату отриманих показників протягом 3 місяців після закінчення програми, невеликий приріст зберігався у досліджуваній групі після 7 років [142] (рис. 3).
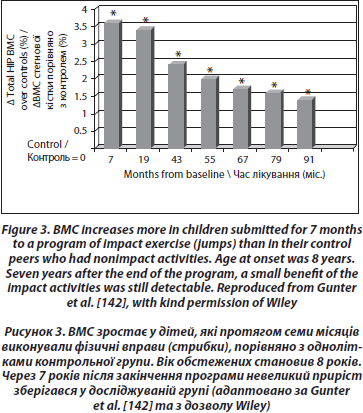
Неоднорідність результатів може бути пов’язана з впливом багатьох інших чинників, таких як дотримання умов дослідження, типу фізичних вправ, віку та ступеня статевого дозрівання до початку програми, тривалості вправ, вихідного рівня фізичної активності, жирової та знежиреної маси тіла.
Деякі харчові фактори також можуть взаємодіяти з фізичною активністю та змінювати приріст кісткової маси. Одним із таких чинників є рівень кальцію в харчуванні [143, 144]. Однак рандомізоване контрольоване дослідження не виявило змін з боку BMD в 10-річних гімнасток при призначенні кальцію в кількості 500 мг на день протягом року [145]. Іншим важливим фактором є кількість білка в харчуванні. Останні епідеміологічні дослідження Chevalley і співавт. [146] показали тісний зв’язок між рівнем вживання білка та фізичною активністю в дітей препубертатного віку: хлопчики, в яких рівень фізичної активності та показники вживання білка були вище середнього, мали найвищі показники BMD у декількох ділянках скелета. У цьому дослідженні не було виявлено зв’язку між рівнем кальцію та BMD, мабуть, через те, що вони вживали кальцій вище рекомендованого рівня.
6.2. Доросле життя
6.2.1. Підтримання кісткової маси, набутої під час росту, та її вплив на ризик переломів протягом усього життя
Теоретично, досягнення більш високого піку кісткової маси може захистити від розвитку остеопорозу та переломів у подальшому житті. Ця гіпотеза спрацьовує тільки в тому випадку, коли позитивний ефект високого рівня фізичної активності в дитячому віці зберігається протягом дорослого життя. Дослідження на тваринах свідчать, що данне положення дійсне тільки у випадку продовження «помірної» фізичної активності [147–149], неоднорідності можуть виникнути через відмінності у тренувальній програмі [150]. П’ятирічне спостереження за тенісистами показало, що деякий позитивний вплив на кісткову масу може зберігатися [151]. Колишні гімнастки зберігають особливості BMD до 12 років після виходу на пенсію [152, 153]. Колишні атлети мають вищі показники BMD протягом 4 років після припинення їх кар’єри порівняно з контрольною групою [154]. Інші результати є менш оптимістичними. Ультразвукові параметри, виміряні в п’ятковій кістці, значно знижуються в бігунів через рік після припинення тренувань [155]. Тривалі спостереження за футболістами виявили, що «надвисокі» показники BMD, отримані в процесі росту, втрачаються після припинення тренувань, і ризик переломів вірогідно не відрізняється у людей, старших 50 років, порівняно з контрольною групою, тобто людьми, які не займалися спортом [156].
Проблема того, як щоденні вправи в жінок впливають на BMD, вивчена у дослідженні пар «мати — дочка» [157]. Ретроспективно оцінювали щоденну активність шляхом опитування 25 пар «мати — дочка», після чого будували модель множинної регресії, де відповіді виступали як можливі детермінанти загальної, аксіальної і периферичної BMD. Вправи з обтяженням тісно корелювали з загальною і периферичною BMD лише в дочок. Припускають, що з віком інші фактори стають домінуючими як BMD-детермінанта, такі як маса тіла, кількість кальцію в харчуванні або рівень естрогенів. Однак в іншому одномоментному дослідженні (Uusi-Rasi і співавт.) за допомогою периферичної QCT виявлено, що в жінок у постменопаузі (середній вік 67 років) із більш високим рівнем фізичної активності вищі показники vBMD і механічної міцності великогомілкової кістки [158].
6.2.2. Вплив фізичної активності на кісткову масу в молодому віці
Bakker і співавт. [159] у своєму 10-річному дослідженні показали, що зміни BMD у поперековому відділі хребта були пов’язані з реакцією на силові фізичні вправи у молодих чоловіків, але не в жінок. Ефект був невеликий. У контрольованому рандомізованому дослідженні жінок у пременопаузальному періоді середнього віку (35–40 років) високоінтенсивні вправи (біг, ходьба, стрибки) тривалістю близько 60 хвилин три рази на тиждень протягом 1 року вірогідно корелювали з BMD стегнової кістки та трохантера. Приріст BMD був вищим у випадку швидкого бігу та стрибків [160]. Дана група мала більші розміри окружності середньої частини стегнової кістки. Зміни в тренованій групі були мінімальними, але вірогідно залежали від кількості вправ [161].
6.2.3. Використання фізичної активності та вправ для профілактики втрати кісткової тканини, зумовленої менопаузою та старінням
Чи можуть фізичні вправи запобігти втраті кісткової маси внаслідок менопаузи та старіння? Підказкою може стати той факт, що в атлеток із аменореєю та втратою кісткової маси, зумовленою гіпогонадизмом, навантаження викликає зростання BMD у тих ділянках скелета, на які воно припадає, та зменшення в ділянках, які не навантажуються.
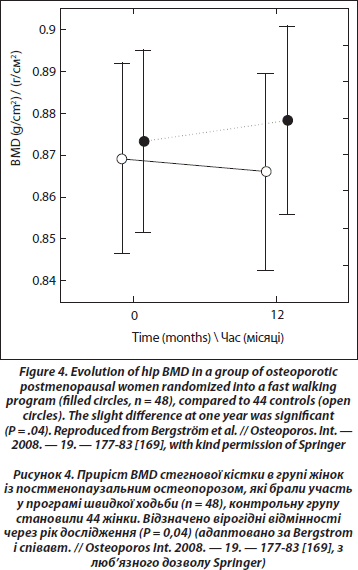
У дівчаток з нервовою анорексією зниження BMD є вірогідним у всіх ділянках скелета [162]. Крім того, фізичні вправи можуть запобігти втраті кісткової маси в оваріоектомованих щурів [163]. Проте порівняння впливу стандартизованих вправ зі стрибками в жінок у пре- і постменопаузальному періоді дозволило зробити висновок, який узгоджується з фізіологічними особливостями: вплив фізичних вправ на BMD є повільнішим у жінок постменопаузального віку [164]. Несподіваним результатом цього дослідження стало те, що естрогензамісна терапія щонайменше 12 місяців не змінила відповіді жінок у постменопаузі. Таким чином, вік, а не дефіцит естрогенів може бути причиною сповільненої реакції, проте середній вік обстежених жінок у постменопаузі в даному дослідженні становив лише 55 років. Результати метааналізу, проведеного в 2000 році, який складався із 21 контрольованого рандомізованого дослідження жінок у постменопаузі (медіана середнього віку — 59 років) показав, що фізичні вправи, дещо знизили втрату кісткової маси на рівні хребта та шийки стегнової кістки в жінок у пре- і постменопаузальному періоді без гормонозамісної терапії порівняно з контролем. Пізніше проведений метааналіз Martyn-St and Carroll [166], який ґрунтувався на 15 рандомізованих конт- рольованих дослідженнях жінок в постменопаузі, показав вірогідний, проте невеликий позитивний ефект (0,006 г/см2) на рівні хребта, відсутність вірогідних змін на рівні кульшових суглобів та шийки стегна. У нещодавньому проспективному дослідженні [167] жінки з ранньою менопаузою (52 роки) були рандомізовані в дві групи: перша — виконувала вправи із навантаженнями (важка атлетика), друга — контрольна. У кожній групі були дві підгрупи залежно від прийому гормонозамісної терапії. Наприкінці дослідження, яке тривало один рік, зміни BMD на рівні хребта були вірогідно нижчими (–3,6 %) у контрольній групі без гормонозамісної терапії. У групах, які виконували вправи, спостерігався невеликий приріст кісткової маси на рівні хребта (+0,7 %). У контрольній групі із гормонозамісною терапією спостерігали невелику втрату BMD (–0,7 %). Дослідження в літніх жінок не виявили позитивного впливу фізичного навантаження та гормонозамісної терапії [168]. Нещодавно, у рандомізованому дослідженні, в якому брали участь жінки у постменопаузальному періоді з остеопенією та остеопорозом віком від 45 до 65 років, доведено невеликий, але вірогідний позитивний ефект від швидкої ходьби (3 ґ 30 хв/тиждень) та виконання фізичних вправ два рази на тиждень протягом 1 року на рівні стегнової кістки [169] (рис. 4). Ще одне недавнє одномоментне дослідження взаємозв’язку між фізичною активністю та параметрами кісткової тканини (такими як щільність та міцність) показало лише позитивний зв’язок між показниками резистентності стегнової кістки в ділянці діафіза та тривалістю фізичної активності та відсутність такого зв’язку з BMD різних ділянок скелета [170].
6.2.4. Чи корисні фізичні вправи при лікуванні постменопаузального або сенільного остеопорозу?
Доведено на тваринах, що адаптація кістки до механічного навантаження зменшується з віком [171]. Таке зниження чутливості до навантаження може бути однією з фізіологічних основ сенільного остеопорозу. Таким чином, стимули, які необхідні для підвищення кісткової міцності, повинні бути сильнішими в старших людей, ніж у молодих. З іншого боку, інтенсивні вправи в людей літнього віку можуть привести до їх травматизації [172]. Результати 12-місячного рандомізованого контрольованого дослідження показали, що виконання вправ із стрибками у жінок 70–79 років без остеопорозу не виявили вірогідного позитивного впливу на BMD і геометрію шийки стегнової кістки та діафіза великогомілкової кістки [173]. Однак покращення фізичного стану в тренованій групі могло сприяти профілактиці переломів.
Фізичні вправи ніколи не стануть методом лікування встановленого остеопорозу, проте важливо уточнити взаємозв’язок між навантаженнями та дією фармакологічних посередників при цій патології. Останні експериментальні дослідження в оваріектомованих щурів показали, що тварини, які отримували алендронову кислоту та займалися на біговій доріжці протягом 14 тижнів, мали істотно вищі показники BMC, які досягали нормальних величин у четвертому поперековому хребці, проксимальному та середньому відділі стегнової кістки порівняно з тваринами, які отримували лише алендронову кислоту. Треновані щури також мали більшу площу та товщину кортикального шару в стегновій кістці за одночасного звуження кістково-мозкового каналу (група, яка приймала алендронову кислоту) та розширення періостального периметра (група, яка виконувала фізичні вправи) [174]. В однорічному рандомізованому дослідженні 164 жінок постменопаузального віку, яким поступово збільшували частоту стрибків та фоні прийому алендронової кислоти та без неї, показано, що застосування тільки фізичних вправ не мало вірогідного впливу на мінеральну щільність кісткової тканини.
Терапія алендроновою кислотою на фоні виконання фізичних вправ не збільшила BMC в жодному відділі скелета, але покращила міцність кісток дистального відділу гомілки [175]. Супутній ефект був ще помітніший у пацієнтів із ризиком розвитку глюкокортикоїд-індукованого остеопорозу. Призначення тільки алендронової кислоти призупиняло втрату кісткової маси після трансплантації в пацієнтів, які мали високий ризик розвитку глюкокортикоїд-індукованого остеопорозу. Призначення фізичних вправ на витривалість підвищувала показники мінеральної щільності кісткової тканини всього скелета, поперекового відділу хребта та шийки стегнової кістки [176, 177].
Проте на сьогодні залишається актуальним питання — чи зменшиться позитивний ефект терапії бісфосфонатами в пацієнтів із низьким рівнем фізичної активності. Експериментальні роботи на собаках із 12-місячною іммобілізацією передніх кінцівок показали, що втрата кісткової маси, пов’язана з іммобілізацію, повністю не відновлюється ризедроновою кислотою [178]. Клінічні дослідження з використанням бісфосфонатів у пацієнтів зі спинномозковою травмою показали не повне відновлення кісткової маси у випадку нещодавньої травми [103], а в пацієнтів зі старою травмою бісфосфонати призупиняли втрату кісткової маси, однак не збільшували її в паралізованій ділянці [102].
З огляду на наявність взаємозв’язку між механічним навантаженням на остеоцити та синтезом паратгормону [36–38, 179–181], ймовірно, існує зв’язок між фізичною активністю та лікуванням остеопорозу за допомогою препарату рекомбінантного паратгормону, проте таких клінічних досліджень ще не проведено. Експериментальні дослідження на щурах мають позитивні результати [182, 183]. Так, Turner та ін., використовуючи модель підвішування щурів за задні кінцівки, показали, що терапія паратгормоном запобігає втраті трабекулярної кісткової тканини [41], а навантаження масою власного тіла разом із застосуванням паратгормону збільшує формування кортикальної кісткової тканини [42].
6.3. Моделювання механічних сил
Багато спроб було зроблено, щоб обмежити втрату кісткової тканини в пацієнтів-інвалідів з іммобілізацією та в космонавтів, які страждають від тривалого перебування в невагомості. Часто спроби були невдалими. Дослідники відзначають втрату кісткової маси в космонавтів навіть тоді, коли вони проходили інтенсивну програму фізичних вправ до та під час польоту [184]. Використання вправ з опорою під час ліжкового режиму лише частково зменшило втрату кісткової маси в діафізі й епіфізі великогомілкової кістки у добровольців, які 90 днів перебували на ліжковому режимі [185]. Циклічне призначення функціональної електричної стимуляції в пацієнтів із пошкодженням спинного мозку може частково відновити втрату кісткової маси в дистальному відділі стегнової кістки [186].
За останні роки особливу увагу приділяють вібрації. Основна ідея методу полягає в тому, щоб збільшити кісткову масу та покращити архітектоніку трабекулярної кістки не шляхом надмірних навантажень, а використовуючи невеликі навантаження, які виникають при постійній активності м’язів, зокрема тих, які беруть участь у підтриманні постави [187]. Дійсно, можна попередити розвиток іммобілізаційного остеопорозу в щурів, підвішених за хвіст, шляхом короткочасного впливу вкрай низьких механічних подразників [16]. Профілактичний ефект вібрації спостерігався також у попередженні розвитку підвищеної резорбції ендосту та зниженні міцності стегнової і великогомілкової кісток, пов’язаних із оваріектомією в дорослих щурів [188]. Rubin і співавт. у 2002 році вивчали роль вібрації на задніх кінцівках овець протягом 20 хв на день упродовж 5 днів на тиждень, кульмінаційне прискорення становило 0,3 г, частота — 30 Гц. Напруження, яке генерувалося в гомілці, було в 500 разів нижче, ніж те, яке виникає при ходінні. DXA проводилася тваринам у певні часові відрізки, а через рік проводили in vivo DXA та pQCT стегнової кістки із подальшою гістоморфометрією. Обидва методи дослідження, pQCT та статична гістоморфометрія, показали вірогідне збільшення об’єму трабекулярної кістки на 30 %. Формування кісткової тканини та мінералізація її поверхні вірогідно збільшилися [189]. Програма також мала позитивний вплив на кісткову міцність [190]. Аналогічна програма була проведена 70 молодим жінкам у постменопаузі за методикою, яку описано вище. Жінки тренувалися на вібруючій платформі. У пацієнток із високим рівнем відповідності вимогам дослідження приріст BMD становив 0,04 % на рівні стегнової кістки та 0,1 % у поперековому відділі хребта; в контрольній групі відзначалася втрата BMD до 2,1 та 1,6 % відповідно. Кращі результати отримано в жінок із низьким індексом маси тіла [191]. Verschueren і співавт. продемонстрували результати призначення вібруючої платформи (максимальне прискорення від 2,3 до 5,1 г) у здорових жінок 60–70 років; отримано вірогідний приріст BMD стегнової кістки в досліджуваній групі при порівнянні з групою, яка займалася лише фізичними вправами, та контрольною групою (0,93 проти 0,14 % у групі з фізичними вправами та –0,62 % у контрольній групі) [192]. Ці результати відрізняються від попередніх досліджень у групі молодих людей, у яких не зареєстровано вірогідного впливу на BMD; тривалість вібрації у них була коротшою (4 хв порівняно з 20) [193].
Експериментальні дослідження в мишей показали позитивний вплив на скелет, який росте, короткотривалих (15 хв на день) високочастотних та низькоінтенсивних коливань: через 3 тижні резорбція кістки знизилася, а через 6 тижнів мінералізація поверхні проксимального метафізу великогомілкової кістки була значно вищою, так само, як і об’єм трабекулярної, кортикальної кістки та окістя, а також показники інерції [194, 195]. Позитивний ефект спостерігався також на м’язову масу. Результати контрольованого клінічного дослідження 48 молодих жінок (середній вік становив 17 років) із низькою BMD показали істотний вплив на м’язову масу, об’єм губчастої BMD хребта, виміряної при КТ, і кортикального шару стегнової кістки [196]. На сьогодні немає жодного дослідження, яке б вивчало вплив вібрації на частоту переломів.
7. Висновки
Механічне навантаження є основним регулятором кісткової маси та геометрії кістки. Сприйняття та трансдукція навантаження є істотними чинниками в підтриманні здоров’я кістки. Основним завданням навантаження є зниження резорбції та підвищення формування кісткової тканини в тих місцях, де необхідно найбільше сили, щоб протистояти навантаженню. Таким чином, застосування механічної сили може стати найбільш фізіологічним способом збільшення міцності кісток та профілактики або лікування остеопорозу.
Головним сенсором, що виявляє навантаження на кісткову тканину, є сітка остеоцитів, які переносять «накази» до ефекторних клітин, остеокластів та остеобластів, шляхом секреції декількох цитокінів, які модулюють мікрооточення з OPG, RANK-L та IGF’s навколо кістки. Основними молекулами сприйняття та трансдукції є кальцієві канальці, MAP-кінази, зокрема ERK-1/2 та рецептори до естрогенів a. Реакція кістки на механічне навантаження залежатиме від якості навантаження як з точки зору інтенсивності, так і частоти. Через десенсибілізацію системи безперервним навантаженням інтермітуюча активність, як очікується і як було показано, є більш ефективною. Відповідь буде залежати також від чутливості сенсора, яка знижується з віком і корегується гормональним фоном, особливо естрогенами. Максимальна здатність клітин остеобластичної лінії реагувати на сигнали також є вагомим чинником, який може обмежити ефективність механічних навантажень у дорослих і літніх людей [184]. Таким чином, шкідливий вплив іммобілізації спостерігається в усіх вікових групах, а ефективність фізичного навантаження шляхом виконання вправ важко оцінити. Чіткий висновок, який можна зробити з дослідження дії фізичних вправ на кісткову тканину, — це їх позитивний вплив на досягнення піку кісткової маси протягом росту дитини. Інтенсивні фізичні вправи в процесі росту сприяють збільшенню кісткової маси та зміцненню геометрії кістки, особливо під час препубертатного періоду. Поки залишається невирішеним питання, чи зберігається користь від інтенсивного фізичного навантаження (професійний спорт) у дитинстві і після виходу на пенсію та на який термін? Доведено, що певний рівень вправ у дорослому віці необхідний для підтримки кісткової маси і її геометрії, але цей рівень цього мінімуму залишається поки невідомим. Таким чином, виконання фізичних вправ у школі є цінним з точки зору профілактики остеопорозу, а також стимулює дорослих підтримувати достатній рівень фізичної активності протягом усього життя. Що таке «достатній рівень», на сьогодні не дуже добре визначено, але прогулянки протягом 30–60 хвилин на день, імовірно, будуть корисними. Дослідження ефективності фізичних програм у дорослих показали невелике і не завжди вірогідне покращення BMD та іноді й геометрії кістки. Ці програми досить важко впроваджувати, прихильність до їх виконання, як правило, низька, тому вважаємо нереальним забезпечити їх виконання систематично як частину лікування остеопорозу. Антирезорбтивна терапія та препарати, що стимулюють формування кісткової тканини, будуть більш ефективними за умови механічного навантаження, а пацієнтам, які лікуються від остеопорозу, слід рекомендувати достатню фізичну активність. Клінічні дослідження з додаванням вібрації до класичного фармакологічного лікування остеопорозу були б цікавими.
Фізична активність впливає не тільки на кісткову тканину, але й діє на м’язову масу та її силу, останні чинники відіграють важливу роль у профілактиці падінь та переломів.
Механізми сприйняття та трансдукції вже достатньо детально вивчені, що дозволяє рекомендувати фармакологічні посередники, які б могли імітувати навантаження [197]. Проте ці механізми є загальними для багатьох клітин, тому фармацевтичні заходи повинні бути чітко орієнтованими на клітини кісткової тканини та не впливати на інші основні фізіологічні процеси.
Післяслово
Дана стаття є науковим доробком консенсусу Бельгійського клубу Bone. Стаття люб’язно надана проф. Я. Реджинстером для друку в журналі «Біль. Суглоби. Хребет», а також подана до друку в Journal of Osteoporosis.
Переклад здійснено Н.І. Балацькою та Р.В. Поворознюк
1. Wolff J. Das Gesetz der Transformation der Knochen / A. Hirshwald. — Berlin, Germany, 1892.
2. Frost H.M. Bone «mass» and the «mechanostat»: a proposal // Anatomical Record. — 1987. — Vol. 219, № 1. — P. 1-9.
3. Frost H.M. From Wolff’s law to the Utah paradigm: insights about bone physiology and its clinical applications // Anatomical Record. — 2001. — Vol. 262, № 4. — P. 398-419.
4. Rubin C.T., and Lanyon L.E. Regulation of bone formation by applied dynamic loads // Journal of Bone and Joint. — Surgery A. — 1984. — Vol. 66, № 3. — P. 397-402.
5. Mosley J.R., March B.M., Lynch J., and Lanyon L.E. Strain magnitude related changes in whole bone architecture in growing rats // Bone. — 1997. — Vol. 20, № 3. — P. 191-198.
6. Gross T.S., Edwards J.L., McLeod K.J., and Rubin C.T. Strain gradients correlate with sites of periosteal bone formation // Journal of Bone and Mineral Research. — 1997. — Vol. 12, № 6. — P. 982-988.
7. Qin Y.X., Rubin C.T., and McLeod K.J. Nonlinear dependence of loading intensity and cycle number in the maintenance of bone mass and morphology // Journal of Orthopaedic Research. — 1998. — Vol. 16, № 4. — P. 482-489.
8. Rubin C., Turner A.S., Bain S., Mallinckrodt C., and McLeod K. Low mechanical signals strengthen long bones // Nature. — 2001. — Vol. 412, № 6847. — P. 603-604.
9. Inman C.L., Warren G.L., Hogan H.A., and Bloomfield S.A. Mechanical loading attenuates bone loss due to immobilization and calcium deficiency // Journal of Applied Physiology. — 1999. — Vol. 87, № 1. — P. 189-195.
10. Hillam R.A. and Skerry T.M. Inhibition of bone resorption and stimulation of formation by mechanical loading of the modeling rat ulna in vivo // Journal of Bone and Mineral Research. — 1995. — Vol. 10, № 5. — P. 683-689.
11. LaMothe J.M., Hamilton N.H., and Zernicke R.F. Strain rate influences periosteal adaptation in mature bone // Medical Engineering and Physics. — 2005. — Vol. 27, № 4. — P. 277-284.
12. Fritton J.C., Myers E.R., Wright T.M., and van der Meulen M.C.H. Loading induces site-specific increases in mineral content assessed by microcomputed tomography of the mouse tibia // Bone. — 2005. — Vol. 36, № 6. — P. 1030-1038.
13. Van der Meulen M.C.H., Morgan T.G., Yang X. et al. Cancellous bone adaptation to in vivo loading in a rabbit model // Bone. — 2006. — Vol. 38, № 6. — P. 871-877.
14. Chambers T.J., Evans M., Gardner T.N., Turner-Smith, A. and Chow J.W.M. Induction of bone formation in rat tail vertebrae by mechanical loading // Bone and Mineral. — 1993. — Vol. 20, № 2. — P. 167-178.
15. Huang R.P., Rubin C.T., and McLeod K.J. Changes in postural muscle dynamics as a function of age // Journals of Gerontology. — Series A. — 1999. — Vol. 54, № 8. — P. B352-B357.
16. Rubin C., Xu G., and Judex S. The anabolic activity of bone tissue, suppressed by disuse, is normalized by brief exposure to extremely low-magnitude mechanical stimuli // FASEB Journal. — 2001. — Vol. 15, № 12. — P. 2225-2229.
17. Saxon L.K., Robling A.G., Alam I., and Turner C.H. Mechanosensitivity of the rat skeleton decreases after a long period of loading, but is improved with time off // Bone. — 2005. — Vol. 36, № 3. — P. 454-464.
18. Robling A.G., Hinant F.M., Burr D.B., and Turner C.H. Improved bone structure and strength after long-term mechanical loading is greatest if loading is separated into short bouts // Journal of Bone and Mineral Research. — 2002. — Vol. 17, № 8. — P. 1545-1554.
19. Pead M.J., Skerry T.M., and Lanyon L.E. Direct transformation from quiescence to bone formation in the adult periosteum following a single brief period of bone loading // Journal of Bone and Mineral Research. — 1988. — Vol. 3, № 6. — P. 647-656.
20. Bonewald L. Mechanosensation and transduction in osteocytes // Bone Key-Osteovision. — 2006. — Vol. 3. — P. 7-15.
21. Kamioka H., Honjo T., and Takano-Yamamoto T. A threedimensional distribution of osteocyte processes revealed by the combination of confocal laser scanning microscopy and differential interference contrast microscopy // Bone. — 2001. — Vol. 28, № 2. — P. 145-149.
22. Klein-Nulend J., Van der Plas A., Semeins C.M. et al. Sensitivity of osteocytes to biomechanical stress in vitro // FASEB Journal. — 1995. — Vol. 9, № 5. — P. 441-445.
23. Weinbaum S., Cowina S.C., and Zenga Y. A model for the excitation of osteocytes by mechanical loading-induced bone fluid shear stresses // Journal of Biomechanics. — 1994. — Vol. 27, № 3. — P. 339-360.
24. Knothe T.M.L., Steck R., Forwood M.R., and Niederer P. In vivo demonstration of load-induced fluid flow in the rat tibia and its potential implications for processes associated with functional adaptation // Journal of Experimental Biology. — 2000. — Vol. 203, № 18. — P. 2737-2745.
25. Mikuni-Takagaki Y., Suzuki Y., Kawase T., and Saito S. Distinct responses of different populations of bone cells to mechanical stress // Endocrinology. — 1996. — Vol. 137, № 5. — P. 2028-2035.
26. Aguirre J.I., Plotkin L.I., Stewart S.A. et al. Osteocyte apoptosis is induced by weightlessness in mice and precedesosteoclast recruitment and bone loss // Journal of Bone and Mineral Research. — 2006. — Vol. 21, № 4. — P. 605-615.
27. Gu G., Mulari M., Peng Z., Hentunen T.A., and Vaananen H.K. Death of osteocytes turns off the inhibition of osteoclasts and triggers local bone resorption. — Biochemical and Biophysical Research Communications. — 2005. — Vol. 335, № 4. — P. 1095-1101.
28. Tan S.D., Bakker A.D., Semeins C.M., Kuijpers-Jagtman A.M., and Klein-Nulend J. Inhibition of osteocyte apoptosis by fluid flow is mediated by nitric oxide Biochemical and Biophysical Research // Communications. — 2008. — Vol. 369, № 4. — P. 1150-1154.
29. Tan S.D., de Vries T.J., Kuijpers-Jagtman A.M., Semeins C.M., Everts V., and Klein-Nulend J. Osteocytes subjected to fluid flow inhibit osteoclast formation and bone resorption // Bone. — 2007. — Vol. 41, № 5. — P. 745-751.
30. You L., Temiyasathit S., Lee P. et al. Osteocytes as mechanosensors in the inhibition of bone resorption due to mechanical loading // Bone. — 2008. — Vol. 42, № 1. — P. 172-179.
31. Vezeridis P.S., Semeins C.M., Chen Q., and Klein-Nulend J. Osteocytes subjected to pulsating fluid flow regulate osteoblast proliferation and differentiation // Biochemical and Biophysical Research Communications. — 2006. — Vol. 348, № 3. — P. 1082-1088.
32. Van Oers R.F.M., Ruimerman R., Tanck E., Hilbers P.A.J. and Huiskes R. A unified theory for osteonal and hemiosteonal remodeling // Bone. — 2008. — Vol. 42, № 2. — P. 250-259.
33. Rawlinson S.C.F., Pitsillides A.A., and Lanyon L.E. Involvement of different ion channels in osteoblasts and osteocytes early responses to mechanical strain // Bone. — 1996. — Vol. 19, № 6. — P. 609-614.
34. Rubin J., Rubin C., and Jacobs C.R. Molecular pathways mediating mechanical signaling in bone // Gene. — 2006. — Vol. 367, № 1–2. — P. 1-16.
35. Liu D., Genetos D.C., Shao Y. et al. Activation of extracellular-signal regulated kinase (ERK1/2) by fluid shear is Ca2+- and ATP-dependent in MC3T3-E1 osteoblasts // Bone. — 2008. — Vol. 42, № 4. — P. 644-652.
36. Kapur S., Baylink D.J., and Lau K.H.W. Fluid flow shear stress stimulates human osteoblast proliferation and differentiation through multiple interacting and competing signal transduction pathways // Bone. — 2003. — Vol. 32, № 3. — P. 241-251.
37. Peake M.A. and El Haj A.J. Preliminary characterisation of mechanoresponsive regions of the c-fos promoter in bone cells FEBS // Letters. — 2003. — Vol. 537, № 1–3. — P. 117-120.
38. Miyauchi A., Notoya K., Mikuni-Takagaki Y. et al. Parathyroid hormone-activated volume-sensitive calcium influx pathways in mechanically loaded osteocytes // The Journal of Biological Chemistry. — 2000. — Vol. 275, № 5. — P. 3335-3342.
39. Ma Y., Jee W.S.S., Yuan Z. et al. Parathyroid hormone and mechanical usage have a synergistic effect in rat tibial diaphyseal cortical bone // Journal of Bone and Mineral Research. — 1999. — Vol. 14, № 3. — P. 439-448.
40. Tanaka S., Sakai A., Tanaka M. et al. Skeletal unloading alleviates the anabolic action of intermittent PTH(1–34) in mouse tibia in association with inhibition of PTH-induced increase in c-fos mRNA in bone marrow cells // Journal of Bone and Mineral Research. — 2004. — Vol. 19, № 11. — P. 1813-1820.
41. Turner R.T., Evans G.L., Cavolina J.M., Halloran B., and Morey-Holton E. Programmed administration of parathyroid hormone increases bone formation and reduces bone loss in hindlimb-unloaded ovariectomized rats // Endocrinology. — 1998. — Vol. 139, № 10. — P. 4086-4091.
42. Turner R.T., Lotinun S., Hefferan T.E., and Morey-Holton E. Disuse in adult male rats attenuates the bone anabolic response to a therapeutic dose of parathyroid hormone // Journal of Applied Physiology. — 2006. — Vol. 101, № 3. — P. 881-886.
43. Zaman G., Jessop H.L., Muzylak M. et al. Osteocytes use estrogen receptor a to respond to strain but their Erα content is regulated by estrogen // Journal of Bone and Mineral Research. — 2006. — Vol. 21, № 8. — P. 1297-1306.
44. Kato S., Endoh H., Masuhiro Y. et al. Activation of the estrogen receptor through phosphorylation by mitogenactivated protein kinase Science. — 1995. — Vol. 270, № 5241. — P. 1491-1494.
45. Jessop H.L., Sjцberg M., Cheng M.Z., Zaman G., Wheeler- Jones C.P.D., and Lanyon L.E. Mechanical strain and estrogen activate estrogen receptor α in bone cells // Journal of Bone and Mineral Research. — 2001. — Vol. 16, № 6. — P. 1045-1055.
46. Jessop H.L., Suswillo R.F.L., Rawlinson S.C.F. et al.Osteoblast-like cells from estrogen receptor α knockout mice have deficient responses to mechanical strain // Journal of Bone and Mineral Research. — 2004. — Vol. 19, № 6. — P. 938-946.
47. Cheng M.Z., Zaman G., Rawlinson S.C.F., Suswillo R.F.L., and Lanyon L.E. Mechanical loading and sex hormone interactions in organ cultures of rat ulna // Journal of Bone and Mineral Research. — 1996. — Vol. 11, № 4. — P. 502-511.
48. Damien E., Price J.S., and Lanyon L.E. The estrogen receptor’s involvement in osteoblasts’ adaptive response to mechanical strain // Journal of Bone andMineral Research. — 1998. — Vol. 13, № 8. — P. 1275-1282.
49. Cheng M.Z., Zaman G., Rawlinson S.C.F., Pitsillides A.A., Suswil- lo R.F.L., and Lanyon L.E. Enhancement by sex hormones of the osteoregulatory effects of mechanical loading and prostaglandins in explants of rat ulnae // Journal of Bone and Mineral Research. — 1997. — Vol. 12, № 9. — P. 1424-1430.
50. Joldersma M., Klein-Nulend J., Oleksik A.M., Heyligers I.C., and Burger E.H. Estrogen enhances mechanical stressinduced prostaglandin production by bone cells from elderly women // American Journal of Physiology. — 2001. — Vol. 280, № 3. — P. E436-E442.
51. Lanyon L., Armstrong V., Ong D., Zaman G., and Price J. Is estrogen receptor α key to controlling bones’ resistance to fracture? // Journal of Endocrinology. — 2004. — Vol. 182, № 2. — P. 183-191.
52. Tomkinson A., Reeve J., Shaw R.W., and Noble B.S. The death of osteocytes via apoptosis accompanies estrogen withdrawal in human bone // Journal of Clinical Endocrinology and Metabolism. — 1997. — Vol. 82, № 9. — P. 3128-3135.
53. Tomkinson A., Gevers E.F., Wit J.M., Reeve J., and Noble B.S. The role of estrogen in the control of rat osteocyte apoptosis // Journal of Bone and Mineral Research. — 1998. — Vol. 13, № 8. — P. 1243-1250.
54. Noble B.S., Peet N., Stevens H.Y. et al. Mechanical loading: biphasic osteocyte survival and targeting of osteoclasts for bone destruction in rat cortical bone // American Journal of Physiology. — 2003. — Vol. 284, № 4. — P. C934-C943.
55. Devlin M.J. and Lieberman D.E. Variation in estradiol level affects cortical bone growth in response to mechanical loading in sheep // Journal of Experimental Biology. — 2007. — Vol. 210, № 4. — P. 602-613.
56. Saxon L.K. and Turner C.H. Low-dose estrogen treatment suppresses periosteal bone formation in response tomechanical loading // Bone. — 2006. — Vol. 39, № 6. — P. 1261-1267.
57. Jдrvinen T.L.N., Kannus P., Pajamдki I. et al. Estrogen deposits extra mineral into bones of female rats in puberty, but simultaneously seems to suppress the responsiveness of female skeleton to mechanical loading // Bone. — 2003. — Vol. 32, № 6. — P. 642-651.
58. Suuriniemi M., Suominen H., Mahonen A., Alйn M., and Cheng S. Estrogen receptor α polymorphism modifies the association between childhood exercise and bone mass: follow-up study // Pediatric Exercise Science. — 2007. — Vol. 19, № 4. — P. 444-458.
59. Heino T.J., Hentunen T.A., and Vддnдnen H.K. Conditioned medium from osteocytes stimulates the proliferation of bone marrow mesenchymal stem cells and their differentiation into osteoblasts // Experimental Cell Research. — 2004. — Vol. 294, № 2. — P. 458-468.
60. Zaman G., Pitsillides A.A., Rawlinson S.C.F. et al. Mechanical strain stimulates nitric oxide production by rapid activation of endothelial nitric oxide synthase in osteocytes // Journal of Bone and Mineral Research. — 1999. — Vol. 14, № 7. — P. 1123-1131.
61. Vatsa A., Smit T.H., and Klein-Nulend J. Extracellular NO signalling from a mechanically stimulated osteocyte // Journal of Biomechanics. — 2007. — Vol. 40, supplement 1. — P. S89-S95.
62. Basso N. and Heersche J.N.M. Effects of hind limb unloading and reloading on nitric oxide synthase expression and apoptosis of osteocytes and chondrocytes // Bone. — 2006. — Vol. 39, № 4. — P. 807-814.
63. Van ’T Hof R.J. and Ralston S.H. Cytokine-induced nitric oxide inhibits bone resorption by inducing apoptosis of osteoclast progenitors and suppressing osteoclast activity // Journal of Bone and Mineral Research. — 1997. — Vol. 12, № 11. — P. 1797-1804.
64. Otsuka E., Hirano K., Matsushita S. et al. Effects of nitric oxide from exogenous nitric oxide donors on osteoblastic metabolism // European Journal of Pharmacology. — 1998. — Vol. 349, № 2–3. — P. 345-350.
65. Turner C.H., Takano Y., Owan I., and Murrell G.A.C. Nitric oxide inhibitor L-NAME suppresses mechanically induced bone formation in rats // American Journal of Physiology. — 1996. — Vol. 270, № 4. — P. E634-E639.
66. Watanuki M., Sakai A., Sakata T. et al. Role of inducible nitric oxide synthase in skeletal adaptation to acute increases in mechanical loading // Journal of Bone and Mineral Research. — 2002. — Vol. 17, № 6. — P. 1015-1025.
67. Ajubi N.E., Klein-Nulend J., Nijweide P.J., Vrijheid-Lammers T., Alblas M.J., and Burger E.H. Pulsating fluid flow increases prostaglandin production by cultured chicken osteocytes-A cytoskeleton-dependent process // Biochemical and Biophysical Research Communications. — 1996. — Vol. 225, № 1. — P. 62-68.
68. Klein-Nulend J., Burger E.H., Semeins C.M., Raisz L.G., and Pilbeam C.C. Pulsating fluid flow stimulates prostaglandin release and inducible prostaglandin G/H synthase mRNA expression in primary mouse bone cells // Journal of Bone and Mineral Research. — 1997. — Vol. 12, № 1. — P. 45-51.
69. Wadhwa S., Godwin S.L., Peterson D.R., Epstein M.A., Raisz L.G., and Pilbeam C.C. Fluid flow induction of cyclooxygenase 2 gene expression in osteoblasts is dependent on an extracellular signal-regulated kinase signaling pathway // Journal of Bone and Mineral Research. — 2002. — Vol. 17, № 2. — P. 266-274.
70. Raisz L.G., Fall P.M., Gabbitas B.Y., McCarthy T.L., Kream B.E., and Canalis E. Effects of prostaglandin E2 on bone formation in cultured fetal rat calvariae: role of insulin-like growth factor-I // Endocrinology. — 1993. — Vol. 133, № 4. — P. 1504-1510.
71. Lean J.M., Jagger C.J., Chambers T.J., and Chow J.W.M. Increased insulin-like growth factor I mRNA expression in rat osteocytes in response to mechanical stimulation // American Journal of Physiology. — 1995. — Vol. 268, № 2. — P. E318-E327.
72. Cheng M.Z., Zaman G., Rawlinson S.C.F., Mohan S., Baylink D.J., and Lanyon L.E. Mechanical strain stimulates ROS cell proliferation through IGF-II and estrogen through IGF-I Journal of Bone and Mineral Research. — 1999. — Vol. 14, № 10. — P. 1742-1750.
73. Cheng M.Z., Rawlinson S.C.F., Pitsillides A.A. et al. Human osteoblasts’ proliferative responses to strain and 17β-estradiol are mediated by the estrogen receptor and the receptor for insulin-like growth factor I // Journal of Bone and Mineral Research. — 2002. — Vol. 17, № 4. — P. 593-602.
74. Fuller K. and Chambers T.J. Effect of arachidonic acid metabolites on bone resorption by isolated rat osteoclasts // Journal of Bone and Mineral Research. — 1989. — Vol. 4, № 2. — P. 209-215.
75. Raisz L.G. Pathogenesis of osteoporosis: concepts, conflicts, and prospects // Journal of Clinical Investigation. — 2005. — Vol. 115, № 12. — P. 3318-3325.
76. Robling A.G., Niziolek P.J., Baldridge L.A. et al. Mechanical stimulation of bone in vivo reduces osteocyte expression of Sost/sclerostin // The Journal of Biological Chemistry. — 2008. — Vol. 283, № 9. — P. 5866-5875.
77. Sawakami K., Robling A.G., Ai M. et al. The Wnt coreceptor LRP5 is essential for skeletal mechanotransduction but not for the anabolic bone response to parathyroid hormone treatment // The Journal of Biological Chemistry. — 2006. — Vol. 281, № 33. — P. 23698-23711.
78. Bonewald L.F. and Johnson M.L. Osteocytes, mechanosensing andWnt signaling // Bone. — 2008. — Vol. 42, № 4. — P. 606-615.
79. Kim C.H., You L., Yellowley C.E., and Jacobs C.R. Oscillatory fluid flow-induced shear stress decreases osteoclastogenesis through RANKL and OPG signaling // Bone. — 2006. — Vol. 39, № 5. — P. 1043-1047.
80. Heino T.J., Hentunen T.A., and Kalervo Vnnen H. Osteocytes inhibit osteoclastic bone resorption through transforming growth factor-β: enhancement by estrogen // Journal of Cellular Biochemistry. — 2002. — Vol. 85, № 1. — P. 185-197.
81. Weyts F.A.A., Bosmans B., Niesing R., Van Leeuwen J.P.T.M., and Weinans H. Mechanical control of human osteoblast apoptosis and proliferation in relation to differentiation // Calcified Tissue International. — 2003. — Vol. 72, № 4. — P. 505-512.
82. Tang L., Lin Z., and Li Y.M. Effects of different magnitudes of mechanical strain on Osteoblasts in vitro // Biochemical and Biophysical Research Communications. — 2006. — Vol. 344, № 1. — P. 122-128.
83. Rubin J., Biskobing D., Fan X., Rubin C., McLeod K., and Taylor W.R. Pressure regulates osteoclast formation and MCSF expression in marrow culture // Journal of Cellular Physiology. — 1997. — Vol. 170, № 1. — P. 81-87.
84. Miao D., He B., Jiang Y. et al. Osteoblast-derived PTHrP is a potent endogenous bone anabolic agent that modifiesthe therapeutic efficacy of administered PTH 1-34 // Journal of Clinical Investigation. — 2005. — Vol. 115, № 9. — P. 2402-2411.
85. Chen X., Macica C.M., Ng K.W., and Broadus A.E. Stretch-induced PTH-related protein gene expression in osteoblasts // Journal of Bone and Mineral Research. — 2005. — Vol. 20, № 8. — P. 1454-1461.
86. Chen X., Macica C., Nasiri A., Judex S., and Broadus A.E. Mecha- nical regulation of PTHrP expression in entheses // Bone. — 2007. — Vol. 41, № 5. — P. 752-759.
87. Nijs-De Wolf N., Holy X., Bйgot L. et al. Decreased PTHrP mRNA expression in the periosteum of hind limb long bones in tail suspended rats // Bone. — 2007. — Vol. 40, supplement 2. — P. S211.
88. Turner R.T. Physiology of a microgravity environment invited review: what do we know about the effects of spaceflight on bone? // Journal of Applied Physiology. — 2000. — Vol. 89, № 2. — P. 840-847.
89. Vico L., Collet P., Guignandon A. et al. Effects of long-term microgravity exposure on cancellous and cortical weightbearing bones of cosmonauts // The Lancet. — 2000. — Vol. 355, № 9215. — P. 1607-1611.
90. Caillot-Augusseau A., Lafage-Proust M.H., Soler C., Pernod J., Dubois F., and Alexandre C. Bone formation and resorption biological markers in cosmonauts during and after a 180-day space flight (Euromir 95) // Clinical Chemistry. — 1998. — Vol. 44, № 3. — P. 578-585.
91. Smith S.M., Nillen J.L., Leblanc A. et al. Collagen crosslink excretion during space flight and bed rest // Journal of Clinical Endocrinology and Metabolism. — 1998. — Vol. 83, № 10. — P. 3584-3591.
92. Hefferan T.E., Evans G.L., Lotinun S., Zhang M., Morey-Holton E., and Turner R.T. Effect of gender on bone turnover in adult rats during simulated weightlessness // Journal of Applied Physiology. — 2003. — Vol. 95, № 5. — P. 1775-1780.
93. Zayzafoon M., Gathings W.E., and McDonald J.M. Modeled microgravity inhibits osteogenic differentiation of human mesenchymal stem cells and increases adipogenesis // Endocrinology. — 2004. — Vol. 145, № 5. — P. 2421-2432.
94. Leblanc A.D., Schneider V.S., Evans H.J., Engelbretson D.A., and Krebs J.M. Bone mineral loss and recovery after 17 weeks of bed rest // Journal of Bone and Mineral Research. — 1990. — Vol. 5, № 8. — P. 843-850.
95. Zerwekh J.E., Ruml L.A., Gottschalk F., and Pak C.Y.C. The effects of twelve weeks of bed rest on bone histology, biochemical markers of bone turnover, and calcium homeostasis in eleven normal subjects // Journal of Bone and Mineral Research. — 1998. — Vol. 13, № 10. — P. 1594-1601.
96. McCarthy I.D. Fluid shifts due to microgravity and their effects on bone: a review of current knowledge // Annals of Biomedical Engineering. — 2005. — Vol. 33, № 1. — P. 95-103.
97. Wilmet E., Ismail A.A., Heilporn A., Welraeds D., and Bergmann P. Longitudinal study of the bone mineral content and of soft tissue composition after spinal cord section // Paraplegia. — 1995. — Vol. 33, № 11. — P. 674-677.
98. Biering-Sorensen F., Bohr H.H., and Schaadt O.P. Longitudinal study of bone mineral content in the lumbar spine, the forearm and the lower extremities after spinal cord injury // European Journal of Clinical Investigation. — 1990. — Vol. 20, № 3. — P. 330-335.
99. Jiang S.D., Jiang L.S., and Dai L.Y. Mechanisms of osteoporosis in spinal cord injury Clinical // Endocrinology. — 2006. — Vol. 65, № 5. — P. 555-565.
100. Zehnder Y., Lьthi M., Michel D. et al. Long-term changes in bone metabolism, bone mineral density, quantitative ultrasound parameters, and fracture incidence after spinal cord injury: a cross-sectional observational study in 100 paraplegic men // Osteoporosis International. — 2004. — Vol. 15, № 3. — P. 180-189.
101. Goemaere S., Van Laere M., De Neve P., and Kaufman J.M. Bone mineral status in paraplegic patients who do or do not perform standing // Osteoporosis International. — 1994. — Vol. 4, № 3. — P. 138-143.
102. Zehnder Y., Risi S., Michel D. et al. Prevention of bone lossin paraplegics over 2 years with alendronate // Journal of Bone and Mineral Research. — 2004. — Vol. 19, № 7. — P. 1067-1074.
103. Gilchrist N.L., Frampton C.M., Acland R.H. et al. Alendronate prevents bone loss in patients with acute spinal cord injury: a randomized, double-blind, placebo-controlled study // Journal of Clinical Endocrinology and Metabolism. — 2007. — Vol. 92, № 4. — P. 1385-1390.
104. Hizem R., Delaunoy I., Ventura M., and Bergmann P. Prevention of bone loss in patients with spinal cord section with weekly alendronate: a pilot study // Osteoporosis International. — 2007. — Vol. 18, supplement 1. — P. S121.
105. Yavuzer G., Ataman S., Sьldьr N., and Atay M. Bone mineral density in patients with stroke International // Journal of Rehabilitation Research. — 2002. — Vol. 25, № 3. — P. 235-239.
106. Sato Y., Fujimatsu Y., Kikuyama M., Kaji M., and Oizumic K. Influence of immobilization on bone mass and bone metabolism in hemiplegic elderly patients with a longstanding stroke // Journal of the Neurological Sciences. — 1998. — Vol. 156, № 2. — P. 205-210.
107. Ramnemark A., Nyberg L., Borssйn B., Olsson T., and Gustafson Y. Fractures after stroke // Osteoporosis International. — 1998. — Vol. 8, № 1. — P. 92-95.
108. Krolner B. and Toft B. Vertebral bone loss: an unheeded side effect of therapeutic bed rest // Clinical Science. — 1983. — Vol. 64, № 5. — P. 537-540.
109. Heaney R.P., Valent D.J., and Barton I.P. Hospitalization-related bone loss and the protective effect of risedronate // Osteoporosis International. — 2006. — Vol. 17, № 2. — P. 212-216.
110. Snow-Harter C., Bouxsein M.L., Lewis B.T., Carter D.R., and Marcus R. Effects of resistance and endurance exercise on bone mineral status of young women: a randomized exercise intervention trial // Journal of Bone and Mineral Research. — 1992. — Vol. 7, № 7. — P. 761-769.
111. Hoshino H., Kushida K., Yamazaki K. et al. Effect of physical activity as a caddie on ultrasound measurements of the os calcis: a cross-sectional comparison // Journal of Bone and Mineral Research. — 1996. — Vol. 11, № 3. — P. 412-418.
112. Forwood M.R. Mechanical effects on the skeleton: are there clinical implications? // Osteoporosis International. — 2001. — Vol. 12, № 1. — P. 77-83.
113. Stewart A.D. and Hannan J. Total and regional bone density in male runners, cyclists, and controls // Medicine and Science in Sports and Exercise. — 2000. — Vol. 32, № 8. — P. 1373-1377.
114. Rector R.S., Rogers R., Ruebel M., and Hinton P.S. Participation in road cycling vs running is associated with lower bone mineral density in men // Metabolism. — 2008. — Vol. 57, № 2. — P. 226-232.
115. Barry D.W. and Kohrt W.M. BMD decreases over the course of a year in competitive male cyclists // Journal of Bone and Mineral Research. — 2008. — Vol. 23, № 4. — P. 484-491.
116. Ljunghall S., Joborn H., Rastad J., and Akerstrom G. Plasma potassium and phosphate concentrations — influence by adrenaline infusion, β-blockade and physical exercise // Acta Medica Scandinavica. — 1987. — Vol. 221, № 1. — P. 83-93.
117. Zerath E., Holy X., Douce P., Guezennec C.Y., and Chatard J.C. Effect of endurance training on postexercise parathyroid hormone levels in elderly men // Medicine and Science in Sports and Exercise. — 1997. — Vol. 29, № 9. — P. 1139-1145.
118. Zanker C.L. and Cooke C.B. Energy balance, bone turnover, and skeletal health in physically active individuals // Medicine and Science in Sports and Exercise. — 2004. — Vol. 36, № 8. — P. 1372-1381.
119. Nichols J.F., Rauh M.J., Barrack M.T., and Barkai H.S. Bone mineral density in female high school athletes: interactions of menstrual function and type of mechanical loading // Bone. — 2007. — Vol. 41, № 3. — P. 371-377.
120. Karlsson M. Is exercise of value in the prevention of fragility fractures in men? // Scandinavian Journal of Medicine and Science in Sports. — 2002. — Vol. 12, № 4. — P. 197-210.
121. Karlsson M. Has exercise an antifracture efficacy in women? // Scandinavian Journal of Medicine and Science in Sports. — 2004. — Vol. 14, № 1. — P. 2-15.
122. Karlsson M.K., Johnell O., and Obrant K.J. Bone mineral density in weight lifters // Calcified Tissue International. — 1993. — Vol. 52, № 3. — P. 212-215.
123. Dowthwaite J.N., DiStefano J.G., Ploutz-Snyder R.J., Kanaley J.A., and Scerpella T.A. Maturity and activity-related differences in bone mineral density: tanner I vs. II and gymnasts vs. non-gymnasts // Bone. — 2006. — Vol. 39, № 4. — P. 895-900.
124. Vicente-Rodriguez G., Ara I., Perez-Gomez J., Serrano-Sanchez J.A., Dorado C., and Calbet J.A.L. High femoral bone mineral density accretion in prepubertal soccer players // Medicine and Science in Sports and Exercise. — 2004. — Vol. 36, № 10. — P. 1789-1795.
125. Haapasalo H., Kannus P., Sievдnen H. et al. Development of mass, density, and estimated mechanical characteristics of bones in caucasian females // Journal of Bone and Mineral Research. — 1996. — Vol. 11, № 11. — P. 1751-1760.
126. Haapasalo H., Kontulainen S., Sievдnen H., Kannus P., Jдrvinen M., and Vuori I. Exercise-induced bone gain is due to enlargement in bone size without a change in volumetric bone density: a peripheral quantitative computed tomography study of the upper arms of male tennis players // Bone. — 2000. — Vol. 27, № 3. — P. 351-357.
127. Kannus P., Haapasalo H., Sankelo M. et al. Effect of starting age of physical activity on bone mass in the dominant arm of tennis and squash players // Annals of Internal Medicine. — 1995. — Vol. 123, № 1. — P. 27-31.
128. Haapasalo H., Sievдnen H., Kannus P., Heinonen A., Oja P., and Vuori I. Dimensions and estimated mechanical characteristics of the humerus after long-term tennis loading // Journal of Bone and Mineral Research. — 1996. — Vol. 11, № 6. — P. 864-872.
129. Heinonen A., Mckay H.A., Whittall K.P., Forster B.B., and Khan K.M. Muscle cross-sectional area is associated with specific site of bone in prepubertal girls: a quantitative magnetic resonance imaging study // Bone. — 2001. — Vol. 29, № 4. — P. 388-392.
130. Ducher G., Tournaire N., Meddahi-Pellй A., Benhamou C.L., and Courteix D. Short-term and long-term site-specific effects of tennis playing on trabecular and cortical bone at the distal radius // Journal of Bone and Mineral Metabolism. — 2006. — Vol. 24, № 6. — P. 484-490.
131. Janz K.F., Gilmore J.M.E., S.M. Levy, Letuchy E.M., Burns T.L., and Beck T.J. Physical activity and femoral neck bone strength during childhood: the Iowa Bone Development // Study Bone. — 2007. — Vol. 41, № 2. — P. 216-222.
132. Tobias J.H., Steer C.D., Mattocks C.G., Riddoch C., and Ness A.R. Habitual levels of physical activity influence bone mass in 11-year-old children from theUnited Kingdom: findings from a large population-based cohort // Journal of Bone and Mineral Research. — 2007. — Vol. 22, № 1. — P. 101-109.
133. Baxter-Jones A.D.G., Kontulainen S.A., Faulkner R.A., and Bailey D.A. A longitudinal study of the relationship of physical activity to bone mineral accrual from adolescence to young adulthood // Bone. — 2008. — Vol. 43, № 6. — P. 1101-1107.
134. Lorentzon M., Mellstrцm D., and Ohlsson C. Association of amount of physical activity with cortical bone size and trabecular volumetric BMD in young adult men: the GOOD study // Journal of Bone and Mineral Research. — 2005. — Vol. 20, № 11. — P. 1936-1943.
135. Alwis G., Linden C., Stenevi-Lundgren S. et al. A one-year exercise intervention program in pre-pubertal girls does not influence hip structure BMC // Musculoskeletal Disorders. — 2008. — Vol. 9, article 9.
136. Linden C., Ahlborg H.G., Besjakov J., Gardsell P., and Karlsson M.K. A school curriculum-based exercise program increases bone mineral accrual and bone size in prepubertal girls: two-year data from the pediatric osteoporosis prevention (POP) study // Journal of Bone and Mineral Research.— 2006. — Vol. 21, № 6. — P. 829-835.
137. Heinonen A., Sievдnen H., Kannus P., Oja P., Pasanen M., and Vuori I. High-impact exercise and bones of growing girls: a 9-month controlled trial // Osteoporosis International. — 2000. — Vol. 11, № 12. — P. 1010-1017.
138. MacKelvie K.J., Petit M.A., Khan K.M., Beck T.J., and McKay H.A. Bone mass and structure are enhanced following a 2-year randomized controlled trial of exercise in prepubertal boys // Bone. — 2004. — Vol. 34, № 4. — P. 755-764.
139. Petit M.A., McKay H.A., MacKelvie K.J., Heinonen A., Khan K.M., and Beck T.J. A randomized school-based jumping intervention confers site and maturity-specific benefits on bone structural properties in girls: a hip structural analysis study // Journal of Bone and Mineral Research. — 2002. — Vol. 17, № 3. — P. 363-372.
140. H. M. Macdonald, S. A. Kontulainen, K. M. Khan, and McKay H.A. Is a school-based physical activity intervention effective for increasing tibial bone strength in boys and girls? // Journal of Bone and Mineral Research. — 2007. — Vol. 22, № 3. — P. 434-446.
141. Fuchs R.K., Bauer J.J., and Snow C.M. Jumping improves hip and lumbar spine bone mass in prepubescent children: a randomized controlled trial // Journal of Bone and Mineral Research. — 2001. — Vol. 16, № 1. — P. 148-156.
142. Gunter K., Baxter-Jones A.D.G., Mirwald R.L. et al. Impact exercise increases BMC during growth: an 8-year longitudinal study // Journal of Bone and Mineral Research. — 2008.— Vol. 23, № 7. — P. 986-993.
143. Specker B.L. Evidence for an interaction between calcium intake and physical activity on changes in bone mineral density // Journal of Bone and Mineral Research. — 1996. — Vol. 11, № 10. — P. 1539-1544.
144. Bass S.L., Eser P., and Daly R. The effect of exercise and nutrition on the mechanostat Journal of Musculoskeletal // Neuronal Interactions. — 2005. — Vol. 5, № 3. — P. 239-254.
145. Ward K.A., Roberts S.A., Adams J.E., Lanham-New S., and Mughal M.Z. Calcium supplementation and weight bearing physical activity — do they have a combined effect on the bone density of pre-pubertal children? // Bone. — 2007. — Vol. 41, № 4. — P. 496-504.
146. Chevalley T., Bonjour J.P., Ferrari S., and Rizzoli R. High-protein intake enhances the positive impact of physical activity on BMC in prepubertal boys // Journal of Bone and Mineral Research. — 2008. — Vol. 23, № 1. — P. 131-142.
147. Silbermann M., Schapira D., Leichter I., and Steinberg K. Moderate physical activity through out adulthood increases peak bone mass at middle age and maintains higher trabecular bone density in vertebrae of senescent female rats // Cells Materials. — 1991. — Vol. S1. — P. 151-158.
148. Wu J., Wang X.X., Higuchi M., Yamada K., and Ishimi Y. High bone mass gained by exercise in growing male mice is increased by subsequent reduced exercise // Journal of Applied Physiology. — 2004. — Vol. 97, № 3. — P. 806-810.
149. Iwamoto J., Yeh J.K., and Aloia J.F. Effect of deconditioning on cortical and cancellous bone growth in the exercise trained young rats Journal of // Bone and Mineral Research. — 2000. — Vol. 15, № 9. — P. 1842-1849.
150. Modlesky C.M. and Lewis R.D. Does exercise during growth have a long-termeffect on bone health? // Exercise and Sport Sciences Reviews. — 2002. — Vol. 30, № 4. — P. 171-176.
151. Kontulainen S., Kannus P., Haapasalo H. et al. Good maintenance of exercise-induced bone gain with decreased training of female tennis and squash players: a prospective 5-year follow-up study of young and old starters and controls // Journal of Bone and Mineral Research. — 2001. — Vol. 16, № 2. — P. 195-201.
152. Bass S., Pearce G., Bradney M. et al. Exercise before puberty may confer residual benefits in bone density in adulthood: studies in active prepubertal and retired female gymnasts // Journal of Bone and Mineral Research. — 1998. — Vol. 13, № 3. — P. 500-507.
153. Zanker C.L., Osborne C., Cooke C.B., Oldroyd B., and Truscott J.G. Bone density, body composition and menstrual history of sedentary female former gymnasts, aged 20–32 years // Osteoporosis International. — 2004. — Vol. 15, № 2. — P. 145-154.
154. Nordstrцm A., Karlsson C., Nyquist F., Olsson T., Nordstrцm P. and Karlsson M. // Bone loss and fracture risk after reduced physical activity // Journal of Bone and Mineral Research. — 2005. — Vol. 20, № 2. — P. 202-207.
155. Lehtonen-Veromaa M., Mцttцnen T., Kautiainen H., Heinonen O.J., and Viikari J. Influence of physical activity and cessation of training on calcaneal quantitative ultrasound measurements in peripubertal girls: a 1-year prospective study // Calcified Tissue International. — 2001. — Vol. 68, № 3. — P. 146-150.
156. Karlsson M.K., Linden C., Karlsson C., Johnell O., Obrant K., and Seeman E. Exercise during growth and bone mineral density and fractures in old age // The Lancet. — 2000. — Vol. 355, № 9202. — P. 469-470.
157. Ulrich C.M., Georgiou C.C., Snow-Harter C.M., and Gillis D.E. Bone mineral density in mother-daughter pairs: relations to lifetime exercise, lifetime milk consumption, and calcium supplements // American Journal of Clinical Nutrition. — 1996. — Vol. 63, № 1. — P. 72-79.
158. Uusi-Rasi K., Sievдnen H., Pasanen M., Oja P., and Vuori I. Associations of calcium intake and physical activity with bone density and size in premenopausal and postmenopausal women: a peripheral quantitative computed tomography study // Journal of Bone and Mineral Research. — 2002. — Vol. 17, № 3. — P. 544-552.
159. Bakker I., Twisk J.W.R., Van Mechelen W., Roos J.C., and Kemper H.C.G. Ten-year longitudinal relationship between physical activity and lumbar bone mass in (young) adults // Journal of Bone and Mineral Research. — 2003. — Vol. 18, № 2. — P. 325-332.
160. Vainionpдд A., Korpelainen R., Vihriдlд E., Rinta-Paavola A., Leppдluoto J., and Jдmsд T. Intensity of exercise as associated with bone density change in premenopausal women Osteoporosis International. — 2006. — Vol. 17, № 3. — P. 455-463.
161. Vainionpдд A., Korpelainen R., Sievдnen H., Vihriдlд E., Leppдluoto J., and Jдmsд T. Effect of impact exercise and its intensity on bone geometry at weight-bearing tibia and femur Bone. — 2007. — Vol. 40, № 3. — P. 604-611.
162. Young N., Formica C., Szmukler G., and Seeman E. Bone density at weight-bearing and nonweight-bearing sites in ballet dancers: the effects of exercise, hypogonadism, and body weight // Journal of Clinical Endocrinology and Metabolism. — 1994. — Vol. 78, № 2. — P. 449-454.
163. Tromp A.M., Bravenboer N., Tanck E. et al. Additional weight bearing during exercise and estrogen in the rat: the effect on bonemass, turnover, and structure // Calcified Tissue International. — 2006. — Vol. 79, № 6. — P. 404-415.
164. Bassey E.J., Rothwell M.C., Littlewood J.J., and Pye D.W. Pre- and postmenopausal women have different bone mineral density responses to the same high-impact exercise // Journal of Bone and Mineral Research. — 1998. — Vol. 13, № 12. — P. 1805-1813.
165. Wallace B.A. and Cumming R.G. Systematic review of randomized trials of the effect of exercise on bone mass in pre- and postmenopausal women // Calcified Tissue International. — 2000. — Vol. 67, № 1. — P. 10-18.
166. Martyn-St J.M. and Carroll S. High-intensity resistance training and postmenopausal bone loss: a meta-analysis // Osteoporosis International. — 2006. — Vol. 17, № 8. — P. 1225-1240.
167. Maddalozzo G.F., Widrick J.J., Cardinal B.J., Winters-Stone K.M., Hoffman M.A., and Snow C.M. The effects of hormone replacement therapy and resistance training on spine bone mineral density in early postmenopausal women // Bone. — 2007. — Vol. 40, № 5. — P. 1244-1251.
168. Going S., Lohman T., Houtkooper L. et al. Effects of exercise on bone mineral density in calcium-replete postmenopausal women with and without hormone replacement therapy // Osteoporosis International. — Vol. 14, № 8. — 2003. — P. 637-643.
169. Bergstrцm I., Landgren B.M., Brinck J., and Freyschuss B. Physical training preserves bone mineral density in postmenopausal women with forearm fractures and low bone mineral density // Osteoporosis International. — 2008. — Vol. 19, № 2. — P. 177-183.
170. Shedd K.M., Hanson K.B., Alekel D.L., Schiferl D.J., Hanson L.N., and Van Loan M.D. Quantifying leisure physical activity and its relation to bone density and strength // Medicine and Science in Sports and Exercise. — 2007. — Vol. 39, № 12. — P. 2189-2198.
171. Turner C.H., Takano Y., and Owan I. Aging changes mechanical loading thresholds for bone formation in rats // Journal of Bone and Mineral Research. — 1995. — Vol. 10, № 10. — P. 1544-1549.
172. Kallinen M. and Markku A. Aging, physical activity and sports injuries. An overview of common sports injuries in the elderly // Sports Medicine. — 1995. — Vol. 20, № 1. — P. 41-52.
173. Karinkanta S., Heinonen A., Sievдnen H. et al. A multicomponent exercise regimen to prevent functional decline and bone fragility in home-dwelling elderly women: randomized, controlled trial // Osteoporosis International. — 2007. — Vol. 18, № 4. — P. 453-462.
174. Fuchs R.K., Shea M., Durski S.L., Winters-Stone K.M., Widrick J., and Snow C.M. Individual and combined effects of exercise and alendronate on bone mass and strength in ovariectomized rats // Bone. — 2007. — Vol. 41, № 2. — P. 290-296.
175. Uusi-Rasi K., Kannus P., Cheng S. et al. Effect of alendronate and exercise on bone and physical performance of postmenopausal women: a randomized controlled trial // Bone. — 2003. — Vol. 33, № 1. — P. 132-143.
176. Braith R.W., Magyari P.M., Fulton M.N., Aranda J., Walker T., and Hill J.A. Resistance exercise training and alendronate reverse glucocorticoid-induced osteoporosis in heart transplant recipients // Journal of Heart and Lung Transplantation. — 2003. — Vol. 22, № 10. — P. 1082-1090.
177. Braith R.W., Conner J.A., Fulton M.N. et al. Comparison of alendronate vs alendronate plus mechanical loading as prophylaxis for osteoporosis in lung transplant recipients: a pilot study // Journal of Heart and Lung Transplantation. — 2007. — Vol. 26, № 2. — P. 132-137.
178. Li C.Y., Price C., Delisser K. et al. Long-term disuse osteoporosis seems less sensitive to bisphosphonate treatment than other osteoporosis // Journal of Bone and Mineral Research. — 2005. — Vol. 20, № 1. — P. 117-124.
179. Kim C.H., Takai E., Zhou H. et al. Trabecular bone response to mechanical and parathyroid hormone stimulation: the role of the mechanical microenvironment // Journal of Bone and Mineral Research. — 2003. — Vol. 18, № 12. — P. 2116-2125.
180. Bakker A.D., Joldersma M., Klein-Nulend J., and Burger E.H. Interactive effects of PTH and mechanical stress on nitric oxide and PGE production by primary mouse osteoblastic cells // American Journal of Physiology. — 2003. — Vol. 285, № 3. — P. E608-E613.
181. Ryder K.D. and Duncan R.L. Parathyroid hormone enhances fluid shear-induced Ca2+. signaling in osteoblastic cells through activation of mechanosensitive and voltagesensitive Ca channels // Journal of Bone and Mineral Research. — 2001. — Vol. 16, № 2. — P. 240-248.
182. Chow J.W.M., Fox S., Jagger C.J., and Chambers T.J. Role for parathyroid hormone inmechanical responsiveness of rat bone American // Journal of Physiology. — 1998. — Vol. 274, № 1. — P. E146-E154.
183. Li J., Duncan R.L., Burr D.B., Gattone V.H., and Turner C.H. Parathyroid hormone enhances mechanically induced bone formation, possibly involving L-type voltagesensitive calcium channels // Endocrinology. — 2003. — Vol. 144, № 4. — P. 1226-1233.
184. Grigoriev A.I., Morukov B.V., Oganov V.S., Rakhmanov A.S., and Buravkova L.B. Effect of exercise and bisphosphonate on mineral balance and bone density during 360 day antiorthostatic hypokinesia // Journal of Bone and Mineral Research. — 1992. — Vol. 7, supplement 2. — P. S449-S455.
185. Rittweger J., Frost H.M., Schiessl H. et al. Muscle atrophy and bone loss after 90 days’ bed rest and the effects of flywheel resistive exercise and pamidronate: results from the LTBR study // Bone. — 2005. — Vol. 36, № 6. — P. 1019-1029.
186. Frotzler A., Coupaud S., Perret C. et al. High-volume FEScycling partially reverses bone loss in people with chronic spinal cord injury // Bone. — 2008. — Vol. 43, № 1. — P. 169-176.
187. Rubin C., Turner A.S., Bain S., Mallinckrodt C., and McLeod K. Low mechanical signals strengthen long bones // Nature. — 2001. — Vol. 412, № 6847. — P. 603-604.
188. Oxlund B.S., Ortoft G., Andreassen T.T., and Oxlund H. Low-intensity, high-frequency vibration appears to prevent the decrease in strength of the femur and tibia associated with ovariectomy of adult rats // Bone. — 2003. — Vol. 32, № 1. — P. 69-77.
189. Rubin C., Turner A.S., Mallinckrodt C., Jerome C., McLeod K., and Bain S. Mechanical strain, induced noninvasively in the high-frequency domain, is anabolic to cancellous bone, but not cortical bone // Bone. — 2002. — Vol. 30, № 3. — P. 445-452.
190. Rubin C., Turner A.S., Mьller R. et al. Quantity and quality of trabecular bone in the femur are enhanced by a strongly anabolic, noninvasive mechanical intervention // Journal of Bone and Mineral Research. — 2002. — Vol. 17, № 2 — P. 349-357.
191. Rubin C.T., Recker R., Cullen D., Ryaby J., McCabe J., and McLeod K. Prevention of postmenopausal bone loss by a lowmagnitude, high-frequency mechanical stimuli: a clinical trial assessing compliance, efficacy, and safety // Journal of Bone and Mineral Research. — 2004. — Vol. 19, № 3. — P. 343-351.
192. Verschueren S.M.P., Roelants M., Delecluse C., Swinnen S., Vanderschueren D., and Boonen S. Effect of 6-month whole body vibration training on hip density, muscle strength, and postural control in postmenopausal women: a randomized controlled pilot study // Journal of Bone and Mineral Research. — 2004. — Vol. 19, № 3. — P. 352-359.
193. Torvinen S., Kannus P., Sievдnen H. et al. Effect of 8-month vertical whole body vibration on bone, muscle performance and body balance. A randomized controled study // Journal of Bone and Mineral Research. — 2003. — Vol. 18, № 5. — P. 876-884.
194. Xie L., Jacobson J.M., Choi E.S. et al. Low-level mechanical vibrations can influence bone resorption and bone formation in the growing skeleton // Bone. — 2006. — Vol. 39, № 5. — P. 1059-1066.
195. Xie L., Rubin C., and Judex S. Enhancement of the adolescent murine musculoskeletal system using low-level mechanical vibrations // Journal of Applied Physiology. — 2008. — Vol. 104, № 4. — P. 1056-1062.
196. Gilsanz V., Wren T.A.L., Sanchez M., Dorey F., Judex S., and Rubin C. Low-level, high-frequency mechanical signals enhance musculoskeletal development of young women with low BMD // Journal of Bone and Mineral Research. — 2006.— Vol. 21, № 9. — P. 1464-1474.
197. Narkar V.A., Downes M., Yu R.T. et al. AMPK and PPARδ agonists are exercise mimetics // Cell. — 2008. — Vol. 134, № 3. — P. 405-415.