Журнал «Боль. Суставы. Позвоночник» 2 (02) 2011
Вернуться к номеру
Влияние стронция ранелата на вертебральный болевой синдром и качество жизни у женщин в постменопаузальном периоде: результаты многоцентрового украинского исследования
Авторы: Поворознюк В.В., Дзерович Н.И., Бондаренко Л.И., Вайда В.М., Верич В.Ф., Гнилорыбов А.М., Гриценко Г.Н., Костерин С.Б., Кухтей О.А., Рекалов Д.Г., Синенький О.В., Трубина С.Ю., Чижикова И.В., Шпилевая Н.И., Яшина Е.Г., Украинский научно-медицинский центр проблем остеопороза, г. Киев
Рубрики: Семейная медицина/Терапия, Ревматология, Травматология и ортопедия, Неврология
Версия для печати
Остеопороз — наиболее распространенное системное заболевание скелета, характеризующееся снижением прочности костной ткани c последующим увеличением риска и количества остеопоротических переломов. В Европе, США и Японии остеопорозом страдают 75 миллионов человек. При этом число больных с каждым годом увеличивается, что связано с постарением населения и увеличением числа постменопаузальных женщин. Ускоренное ремоделирование костной ткани в постменопаузальном периоде вызывает дисбаланс между формированием и резорбцией кости, приводящий к ее потере, возникновению остеопоротических переломов [1, 2]. Почти у каждой третьей женщины в возрасте 65 лет и старше наблюдается как минимум один остеопоротический перелом. Только в США остеопороз приводит к возникновению 250 000 переломов бедренной кости, 250 000 переломов костей предплечья и 700 000–750 000 вертебральных переломов в год.
Многие годы основными фармакологическими средствами терапии постменопаузального остеопороза были антирезорбенты — бисфосфонаты, заместительная гормональная терапия, селективные модуляторы эстрогенных рецепторов (ралоксифен), кальцитонин. Однако выбор антиостеопоротических средств увеличился за счет препаратов с анаболической активностью. Среди последних — стронция ранелат, двухвалентная стронциевая соль ранеловой кислоты, обладающая уникальным двойным механизмом действия [12–14]. В декабре 2006 года стронция ранелат, зарегистрированный под коммерческим названием Бивалос, появился на фармакологическом рынке Украины. В отличие от антирезорбентов стронция ранелат одновременно не только снижает резорбцию костной ткани, но и увеличивает формирование последней, способствуя восстановлению нарушенной при остеопорозе микроархитектоники костной ткани [9].
Среди проведенных клинических исследований стронция ранелата всем требованиям доказательной медицины соответствуют 4 исследования: PREVOS, STRATOS, SOTI и TROPOS [17, 23, 25, 27–30]. Цель исследований PREVOS (профилактика ранней постменопаузальной потери костной массы стронция ранелатом) и STRATOS (назначение стронция ранелата для лечения остеопороза) состояла в том, чтобы определить минимальную дозу, при которой стронция ранелат будет эффективным в профилактике потери костной массы у женщин в раннем постменопаузальном периоде без остео- пороза и в лечении постменопаузального остеопороза позвоночника. Оба исследования были рандомизированными двойными слепыми плацебо-контролируемыми по определению эффективной дозы в параллельных группах и продолжались 2 года. В исследовании PREVOS 160 женщин в раннем постменопаузальном периоде были рандомизированы в группу плацебо и три основные группы (прием стронция ранелата в дозе 125 мг/день, 500 мг/день или 1 г/день). В исследовании STRATOS 353 женщины с постменопаузальным остеопорозом, по крайней мере с одним вертебральным переломом и Т-показателем для минеральной плотности костной ткани (МПКТ) поясничного отдела позвоночника < –2,4 SD были рандомизированы в группу плацебо и три основные группы (прием стронция ранелата в дозе 500 мг/день, 1 г/день или 2 г/день). В обоих исследованиях первичным критерием эффективности была МПКТ поясничного отдела позвоночника, определенная методом двухэнергетической рентгеновской денситометрии. Вторичные критерии эффективности включали инцидентность новых деформаций позвонков (только в исследовании STRATOS) и динамику биохимических маркеров метаболизма костной ткани [21, 22, 24, 27].
В исследовании PREVOS увеличение МПКТ поясничного отдела по сравнению с исходными данными в группе пациентов, принимавших 1 г/день стронция ранелата, через два года составило 5,53 % и было выше по сравнению с отрицательной динамикой (–0,75 %) в группе плацебо (p < 0,001); на уровне всей бедренной кости: стронция ранелат — +3,21 % и –0,88 % в группе плацебо (p < 0,001); на уровне шейки бедренной кости: стронция ранелат — +2,46 % и –0,87 % в группе плацебо (p < 0,001). В исследовании STRATOS ежегодное увеличение МПКТ поясничного отдела позвоночника в группе больных с постменопаузальным остеопорозом, принимавших стронция ранелат в дозе 2 г/день, составило 7,3 % и было достоверно выше по сравнению с динамикой (+0,5 %) в группе плацебо (p < 0,001); на уровне шейки бедренной кости: стронция ранелат — +3,1 % и –0,6 % в группе плацебо (p < 0,001). Отмечалось достоверное снижение количества пациентов с новыми позвоночными деформациями на втором году лечения в группе больных, принимавших 2 г/день (относительный риск: 0,56; 95%-й довери- тельный интервал: 0,35–0,89). В обоих исследованиях наблюдали достоверное увеличение маркера формирования костной ткани (костный изомер щелочной фосфатазы) в группе более высокой дозы. Экскреция с мочой маркера резорбции костной ткани (N-телопептид) была ниже в группе больных, принимавших стронция ранелат, по сравнению с таковой в группе плацебо в исследовании STRATOS. Стронция ранелат хорошо переносился пациентами в этих исследованиях. Минимальная доза, при которой стронция ранелат является эффективным в предотвращении потери костной массы у женщин в раннем постменопаузальном периоде без остеопороза, составила 1 и 2 г/день соответственно [21, 22, 27].
Исследование SOTI продемонстрировало быстрое и эффективное снижение количества новых вертебральных переломов у постменопаузальных женщин с остеопорозом. В исследование было включено 1649 женщин в постменопаузальном периоде с установленным остеопорозом (по показателям МПКТ) и как минимум одним вертебральным переломом. Пациентки были распределены на 2 группы, одна из которых получала перорально стронция ранелат (2 г/день), другая — плацебо в течение 3 лет на фоне препаратов кальция и витамина D. В конце 1-го года терапии было установлено уменьшение риска вертебральных переломов на 49 % в группе, получавшей стронция ранелат, по сравнению с таковым в группе плацебо и на 52 % — уменьшение риска симптоматических переломов. В течение 3-летнего периода лечения в группе, получающей стронция ранелат, установлено снижение риска новых вертебральных переломов на 41 % по сравнению с таковым в группе плацебо.
Проведенное международное двойное плацебо-контролируемое исследование TROPOS позволило оценить эффективность стронция ранелата в снижении риска невертебральных переломов. Исследование проведено с участием 5091 пациента из 12 стран Европы и Австралии в возрасте старше 70 лет с низкой минеральной плотностью костной ткани шейки бедренной кости (показатель Т < –2,5 SD), получавших либо стронция ранелат 2 г/день ежедневно per os (n = 2554) либо плацебо (n = 2537) более 3 лет на фоне приема препаратов кальция и витамина D в обеих группах. Достоверное снижение (16 %) относительного риска невертебральных остеопоротических переломов было выявлено в группе женщин, принимавших стронция ранелат (р = 0,04), также выявлено достоверное снижение на 19 % (р = 0,031) относительного риска новых остеопоротических переломов предплечья, таза, грудины, ребер, ключицы, проксимального отдела бедренной кости. Установлено, что стронция ранелат хорошо переносится пациентами и не вызывает побочных эффектов [1, 2, 4, 5].
Представлены результаты пяти- [Reginster J.Y. et al., 2008] и десятилетних [Reginster J.Y. et al., 2011] наблюдений за пациентами из исследований SOTI и TROPOS [26]. С докладом о результатах 10-летнего наблюдения за больными, принимавшими стронция ранелат, на конгрессе ECCEO11-IOF (Валенсия, 23–26 марта 2011 года) выступил президент ECCEO, вице-президент IOF профессор J.Y. Reginster. Докладчик отметил, что минеральная плотность костной ткани на уровне позвоночника у больных, принимавших стронция ранелат, достоверно увеличивалась с каждым годом и достигла значения 34,5 % по сравнению с исходными данными; на уровне шейки и всей бедренной кости МПКТ увеличивалась в период до 7 лет, достигая значений 10,7 и 11,7 % соответственно по сравнению с исходными показателями, и затем оставалась стабильной до 10 лет. Для оценки 10-летней эффективности стронция ранелата в защите от переломов использовалась методика сравнения риска развития переломов в группе активной терапии в первые 5 лет (от 0 до 5 лет) лечения по сравнению с последующими 5 годами терапии (от 5 до 10 лет). Несмотря на постарение участников наблюдаемой группы, не было отмечено повышения случаев новых переломов, как вертебральных, так и невертебральных, за период с 5-го по 10-й год терапии в сравнении с первыми 5 годами. Это свидетельствует о сохраняющейся эффективности стронция ранелата в защите от переломов любой локализации на протяжении 10 лет терапии. При этом стронция ранелат остается безопасным и хорошо переносимым лекарственным средством [24, 25].
26 мая 2011 года согласно программе конгресса EULAR состоялся симпозиум компании Servier, посвященный эффективности и безопасности стронция ранелата [30]. С докладами выступили известные ученые — C. Cooper (Великобритания), D. Felsenberg (Германия), H.P. Dimai (Австрия), M.L. Brandi (Италия), J.Y. Reginster (Бельгия). Их заключение: «…стронция ранелат имеет прекрасную доказательную базу, поддерживающую его использование в качестве терапии первой линии, которая эффективно уменьшает риск вертебральных, невертебральных переломов, переломов бедренной кости, улучшает архитектуру костной ткани» [30].
Стронция ранелат рекомендован как препарат первой линии лечения постменопаузального остеопороза в клинических рекомендациях многих стран: Австралии, Австрии, Бельгии, Болгарии, Венгрии, Германии, Гонконга, Италии, Испании, Латвии, Сингапура, Словении, Украины, Франции и др.
В 2008 году в Украине проводилось мультицентровое исследование «Баланс». Применение стронция ранелата в лечении нарушений структурно-функционального состояния костной ткани у женщин в постменопаузальном периоде приводило к снижению выраженности вертебрального болевого синдрома, улучшению качества жизни, расширению двигательного режима и физической активности, повышению МПКТ на уровне поясничного отдела позвоночника (7,7 %) и бедренной кости (4,1–5,9 %) в течение одного года. Полученные результаты были неоднократно представлены на международных форумах (Афины, 2008; Лондон, 2009; Манчестер, 2009; Таиланд, 2009; Москва, 2009) [21, 22].
С апреля 2009 по октябрь 2010 года в Украине проводилось новое мультицентровое исследование «Один год жизни с Бивалосом».
Целью исследования было изучить влияние стронция ранелата на динамику вертебрального болевого синдрома и ежедневную функциональную активность у женщин в постменопаузальном периоде с нарушениями структурно-функционального состояния костной ткани.
Объект и методы исследования
Под руководством проф. В.В. Поворознюка была создана научно-исследовательская группа, в состав которой вошли врачи и научные сотрудники из различных регионов Украины (Днепропетровск, Донецк, Запорожье, Киев, Львов, Харьков). В исследовании принимало участие 894 женщины в постменопаузальном периоде. В течение 4 месяцев препарат принимала 541 пациентка, 8 месяцев — 245, 11 месяцев — 72 женщины. Средний возраст обследованных составил 60,0 ± ± 10,6 года, средняя масса тела — 71,3 ± 13,4 кг, средний рост — 161,8 ± 7,1 см. В исследование включались женщины со структурно-функциональными нарушениями костной ткани (остеопения, остеопороз) и вертебральным болевым синдромом. 255 пациенток (28,5 %) отметили низкоэнергетические переломы различной локализации в анамнезе. Основными факторами риска остеопороза среди обследуемых женщин были наличие низкоэнергетических переломов у пациентки в анамнезе (28 %), переломов бедренной кости у матери обследуемой (17 %), прием глюкокортикоидов в анамнезе длительностью более 3 месяцев (27 %), курение (12 %) и др. В исследование не включали пациенток, которые с лечебной целью в течение последних 3 месяцев принимали лекарственные средства, влияющие на метаболизм костной ткани, а также пациенток с сопутствующей патологией в стадии суб- или декомпенсации.
Пациентки получали стронция ранелат (Бивалос, Servier) по 1 саше 1 раз в день и комбинированный препарат кальция и витамина D (кальцемин адванс по 1 табл. 2 раза в день) постоянно в течение 4–11 месяцев.
Обследование пациенток проводилось до начала терапии (М0), через 4 (М4), 8 (М8) и 11 месяцев (М11) лечения стронция ранелатом.
Для оценки эффективности лечения использовали 5-бальную шкалу оценки выраженности боли, согласно которой 0 баллов — отсутствие боли, 1 балл — незначительная боль, 2 балла — умеренная боль, 3 балла — сильная боль, 4 балла — резко выраженная боль. В каждой точке наблюдения пациентке предлагалось оценить, насколько сильно ее беспокоит боль в спине или области тазобедренного сустава.
Относительное изменение выраженности боли по отношению к исходному показателю на основании средних значений было оценено по формуле:
где Мi = М4, М8 и М11.
В каждой точке наблюдения пациенткам предлагалось оценить ежедневную активность согласно 4-балльной шкале оценки ежедневной функциональной активности: 1 балл — плохая, 2 балла — удовлетворительная, 3 балла — хорошая, 4 балла — отличная.
Относительное изменение выраженности боли по отношению к исходному показателю было оценено по формуле:
где Мi = М4, М8 и М11.
С целью дальнейшего анализа удовлетворенности пациенток лечением стронция ранелатом им предлагалось ответить на следующие вопросы:
— удовлетворена ли пациентка терапией;
— удовлетворена ли пациентка приемом препарата 1 раз в день.
Так как отметки ставились только в случае утвердительного ответа относительно удовлетворенности лечением, то в случае отсутствия отметки при анализе считалось, что данная пациентка не удовлетворена лечением.
Также в каждой точке наблюдения оценивали побочные явления. Во время визитов М4, М8 и М11 принималось решение относительно продолжения терапии стронция ранелатом. Если же решение было отрицательным, то указывалась причина прекращения терапии.
Статистический анализ полученных результатов проводился с помощью пакетов программ Microsoft Excel и SPSS 13.0. При анализе применялись методы описательной статистики (для количественных переменных вычислялись показатели — среднее арифметическое, медиана, стандартное отклонение, минимум и максимум, а для категориальных — частота и доля в процентах), графические методы, методы интервального оценивания (выполнялось построение доверительных интервалов для средних арифметических или медиан в зависимости от согласования данных с нормальным законом распределения). Для анализа согласованности распределения данных с нормальным законом распределения применялся критерий Шапиро — Уилка при уровне значимости 0,01. Анализ значимости изменения выраженности боли был выполнен при помощи двухфакторного дисперсионного анализа по смешанной модели: зависимая переменная — выраженность боли в баллах, фактор «время» — фиксированный (уровни М0, М4, М8 и М11), фактор «пациентки» — случайный.
Результаты исследования
Отмечена положительная динамика выраженности болевого синдрома и нарушений ежедневной функциональной активности у обследованных женщин на всех этапах исследования (М4, М8 и М11).
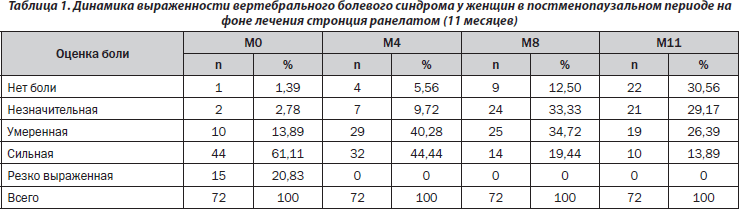
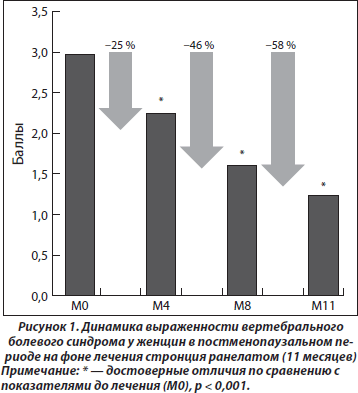
Оценка эффективности лечения пациенток, принимавших стронция ранелат в течение 11 месяцев. Пациентки отмечали достоверное уменьшение выраженности болевого синдрома уже через 4 месяца терапии. Динамика данного показателя через 4 месяца составила 25 %, через 8 — 46 % и через 11 месяцев — 58 % (рис. 1).
Согласно проведенному анализу (табл. 1) от боли различной выраженности в начале исследования (М0) страдала 71 пациентка (98,61 %) из 72. Во время визита М4 боль не беспокоила 3 пациенток (4,17 %), визита М8 — 8 (11,1 %), а во время визита М11 — 21 пациентку (29,16 %). Соответственно болевые ощущения во время визита М11 отмечала 51 женщина (70,84 %).
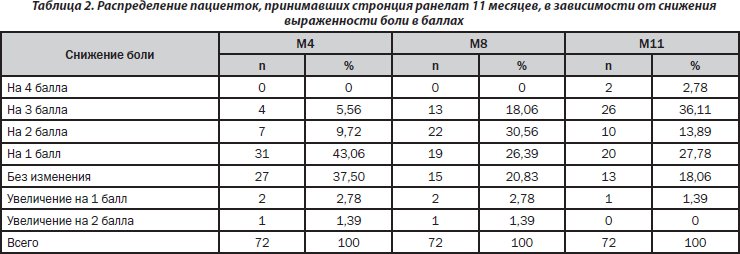
Определяли степень снижения боли в баллах. Полученные результаты для пациенток, принимавших стронция ранелат в течение 11 месяцев, приведены в табл. 2. Только у 13 пациенток (18,06 %) не отмечалось динамики выраженности болевого синдрома, а у 1 пациентки (1,39 %) наблюдалась отрицательная динамика.
Согласно результатам дисперсионного анализа эффект фактора «время» статистически значим (р < 0,001), что свидетельствует о влиянии длительной терапии стронция ранелатом на уменьшение выраженности боли. Проверка нормальности распределения остатков дисперсионного анализа — основной предпосылки дисперсионного анализа — была выполнена при помощи критерия Шапиро — Уилка. Так как остатки были распределены нормально, то выполненный дисперсионный анализ правомерен.
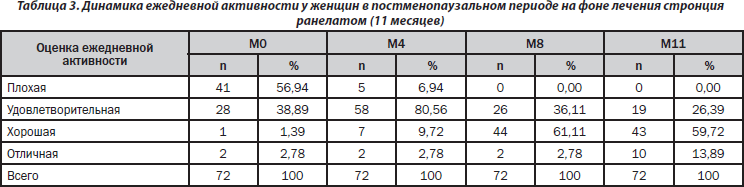
На фоне проводимой терапии пациентки отметили увеличение физической активности и расширение двигательного режима. Так, через 11 месяцев ежедневная функциональная активность у женщин, принимавших стронция ранелат, улучшилась на 92 % (рис. 2).
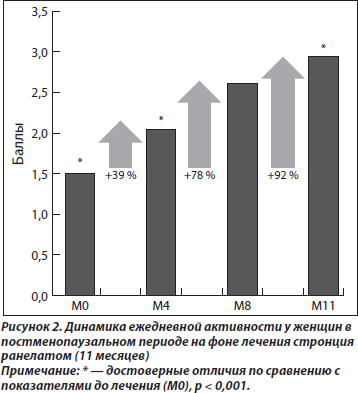
По мере увеличения длительности приема препарата отмечена тенденция к увеличению ежедневной активности пациенток. Через 8 месяцев терапии 61 % пациенток оценили ежедневную активность как «хорошую». На «отлично» через 11 месяцев оценили ежедневную активность уже 14 % женщин (табл. 3).
Согласно результатам дисперсионного анализа эффект фактора «время» статистически значим (р < 0,001), что свидетельствует о влиянии длительной терапии стронция ранелатом на увеличение оценок ежедневной активности.
Таким образом, эффект длительности терапии стронция ранелатом статистически значимо (р < 0,001) влияет на уменьшение выраженности болевого синдрома и увеличение оценок ежедневной активности. Согласно результатам контрастного анализа можно констатировать, что уменьшение выраженности боли и увеличение оценок ежедневной активности статистически значимо (р < 0,001) уже после 4 месяцев терапии стронция ранелатом (точка времени М4), а также в других точках наблюдения (М8 и М11).
В течение исследования проводилась оценка пациенткой удовлетворенности лечением. Во время визита М4 пациентки были удовлетворены проводимым лечением в 98,61 % случаев, визита М8 удовлетворенность лечением наблюдалась у 100 % женщин, визита М11 — у 98,61 %. Удовлетворенность режимом лечения (прием препарата один раз в день) через 4 месяца составила 97,22 %, через 8 месяцев — 94,44 % и через 12 месяцев — 87,50 %.
Во время визита М11 были выявлены 2 побочные реакции:
— диспептические явления (диарея), n = 1 (1,4 %);
— головная боль, n = 1 (1,4 %).
Указанные явления не требовали отмены препарата. Одна пациентка прекратила прием стронция ранелата через 10 месяцев лечения в связи с улучшением самочувствия (1,4 %).
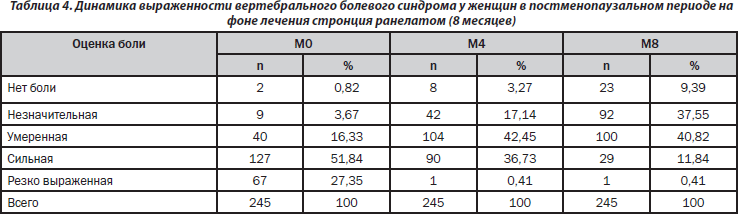
Оценка эффективности лечения пациенток, принимавших стронция ранелат в течение 8 месяцев. Согласно проведенному анализу (табл. 4) от боли разной выраженности в момент времени М0 страдали 243 пациентки из 245. Во время визита М4 8 пациенток отметили отсутствие болевого синдрома (3,27 %), визита М8 — 23 пациентки (9,39 %). Соответственно, болевые ощущения во время визита М8 остались у 222 пациенток (90,61 %).
Выраженность боли к концу 8-го месяца наблюдения (М8) уменьшилась на 48,1 % по сравнению с исходным состоянием.
Определена степень снижения боли в баллах. Полученные результаты для пациенток, принимавших стронция ранелат в течение 8 месяцев, представлены в табл. 5.
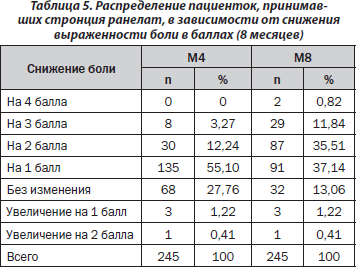
Согласно результатам дисперсионного анализа эффект фактора «время» статистически значим (р < 0,001), что свидетельствует о влиянии 8-месячной терапии стронция ранелатом на уменьшение выраженности боли.
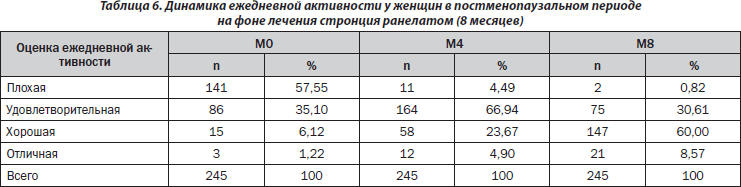
В начале исследования ежедневную функциональную активность пациентки оценили как плохую в 57,55 % случаев, а уже через 8 месяцев лечения данный показатель уменьшился до 0,82 %. Хорошей посчитали ежедневную активность 60 % пациенток, удовлетворительной — 30,61 % женщин во время визита М8. Результаты распределения пациенток в зависимости от оценки их ежедневной активности в каждой точке графика наблюдения приведены в табл. 6.
Таким образом, увеличивалась доля пациенток с хорошими и отличными оценками, что свидетельствовало о повышении их ежедневной активности.
Относительное изменение средних оценок ежедневной активности по отношению к исходному показателю во время визита М4 составило 51,62 %, визита М8 — 82,97 %.
Согласно результатам дисперсионного анализа эффект фактора «время» статистически значим (р < 0,001), что свидетельствует о влиянии длительной терапии стронция ранелатом на увеличение оценок ежедневной активности.
Таким образом, эффект длительности терапии стронция ранелатом (8 месяцев) статистически значимо (р < 0,001) влияет на уменьшение выраженности болевого синдрома и увеличение оценок ежедневной активности. Согласно результатам контрастного анализа можно констатировать, что уменьшение выраженности болевого синдрома и увеличение оценок ежедневной активности статистически значимо (р < 0,001) после 4 и 8 месяцев терапии стронция ранелатом.
Среди принимавших стронция ранелат на протяжении 8 месяцев на вопрос об удовлетворенности терапией утвердительно ответили 95,92 % пациенток в точке М4 и 91,84 % в точке М8 из включенных в анализ (245 человек). Во время визита М4 93,88 % пациенток были удовлетворены приемом препарата 1 раз, визита М8 — 89,8 %.
Во время визита М8 было выявлено 13 побочных реакций:
— диспептические явления (диарея, тошнота), n = 10 (4 %);
— головная боль, n = 2 (0,8 %);
— повышение артериального давления, n = 1 (0,4 %).
В данной выборке пациентов побочные явления не требовали отмены препарата. Причинами прекращения приема стронция ранелата во время визита М8 были улучшение самочувствия (n = 3 (1,2 %)), финансовые сложности (n = 2 (0,8 %)) и изменение места жительства (n = 1 (0,4 %)).
Оценка эффективности лечения пациенток, принимавших стронция ранелат в течение 4 месяцев. Во время визита М0 от боли разной выраженности страдали 536 пациенток из 541 (табл. 7). Через 4 месяца отсутствие болевого синдрома отмечено у 18 пациенток (3,33 %). Соответственно, болевые ощущения во время визита М4 выявлены у 523 пациенток (96,67 %).
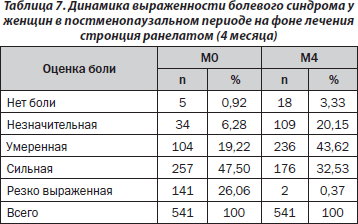
Средний балл выраженности боли к концу 4-го месяца наблюдения (М4) уменьшился на 29,17 % по сравнению с исходным показателем.
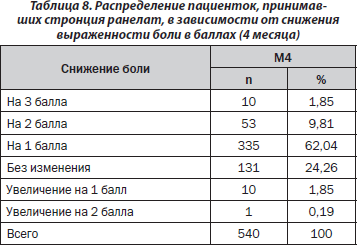
Определена степень снижения боли в баллах. Полученные результаты для пациенток, принимавших стронция ранелат в течение 4 месяцев, приведены в табл. 8.
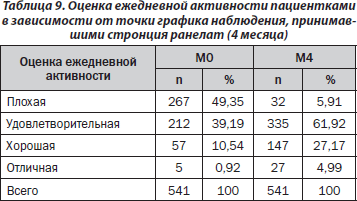
Во время визита М4 по сравнению с М0 отмечена тенденция увеличения оценок ежедневной активности у пациенток. Так, доля пациенток с плохими оценками уменьшилась, в то время как возросла доля пациенток с относительно хорошими оценками. Результаты распределения больных в зависимости от оценки их ежедневной активности в каждой точке графика наблюдения приведены в табл. 9.
Таким образом, терапия стронция ранелатом на протяжении 4 месяцев статистически значимо (р < 0,001) влияет на уменьшение выраженности боли и увеличение физической активности.
Относительное изменение средних оценок ежедневной активности по отношению к исходному показателю к концу 4-го месяца наблюдения составило 41,84 %.
На вопрос об удовлетворенности терапией утвердительно ответили 92,05 % пациенток в точке М4 из включенных в анализ (541 пациентка). Приемом препарата 1 раз в день были удовлетворены 91,87 % пациенток.
Во время визита М4 было выявлено 52 побочные реакции (табл. 10).
У основной части пациенток данные явления были кратковременны и не требовали отмены препарата. Во время визита М4 заявили о прекращении приема препарата 37 пациенток. 9 женщин (1,7 %) прекратили прием препарата из-за побочных явлений. В связи с улучшением самочувствия уже через 4 месяца приема препарата 3 пациентки прекратили прием стронция ранелата. Основной же причиной прекращения приема препарата в течение первых месяцев терапии являлись финансовые сложности (3,3 %) (табл. 11).
Обсуждение полученных результатов
В нашем исследовании показано положительное влияние стронция ранелата на вертебральный болевой синдром и качество жизни у женщин в постменопаузальном периоде. Достоверные различия относительно указанных показателей наблюдались уже через 4 месяца и увеличивались через 8 и 11 месяцев лечения стронция ранелатом.
Меньшая (в процентах) положительная динамика вертебрального болевого синдрома наблюдалась по результатам post hoс анализа объединенных с SOTI и TROPOS данных [7]. Стронция ранелат достоверно (р = 0,03) по сравнению с плацебо снижал выраженность вертебрального болевого синдрома за период лечения (41,8 и 31,3 % соответственно).
Стронция ранелат был эффективен в снижении болевого синдрома в поясничной области у женщин с постменопаузальным остеопорозом по результатам анкетного опроса QUALIOST. Анализ показал снижение на 30 % (p = 0,005) по сравнению с плацебо числа больных без боли в пояснице после 3 лет терапии (14,5 против 10,8 %) [Marguis P. et al., 2008]; при этом достоверные различия на 31 % между группами отмечены после первого года (p < 0,05) (13,2 и 10,0 %) и на 28 % — после 4 лет (14,6 против 11,2 %) [Meunier P.J. et al., 2009]. Побочные эффекты в нашем исследовании встречались реже по сравнению с исследованиями SOTI и TROPOS [24, 25, 27].
Таким образом, применение стронция ранелата в лечении нарушений структурно-функционального состояния костной ткани (остеопороза, остеопении) у женщин в постменопаузальном периоде приводит к достоверному снижению выраженности болевого синдрома, повышению ежедневной активности и улучшению качества жизни. Длительность терапии стронция ранелатом достоверно влияет на уменьшение выраженности болевого синдрома и увеличение оценок ежедневной активности. Лечение сопровождается минимальным количеством побочных эффектов, хорошо переносится пациентами.
1. Поворознюк В.В. Захворювання кістково-м’язової системи в людей різного віку (вибрані лекції, огляди, статті): У 2 т. — К., 2004. — С. 480.
2. Поворознюк В.В., Григорьева Н.В. Менопауза и костно-мышечная система. — К., 2004. — 512 с.
3. Поворознюк В.В., Дзерович Н.И., Орлик Т.В., Вайда В.М. Влияние стронция ранелата на минеральную плотность костной ткани и вертебральный болевой синдром у женщин в постменопаузальном периоде: данные литературы и результаты собственных исследований // Проблеми остеології. — 2008. — 3–4. — С. 3-15.
4. Поворознюк В.В., Дзерович Н.И., Орлик Т.В., Вайда В.М. Результаты программы БАЛАНС: опыт украинских специалистов по применению стронция ранелата у пациенток с постменопаузальным остеопорозом // Здоровье Украины. — 2008. — 18(199). — С. 38-39.
5. Alexanderson P., Karsdal M., Ovist P. et al. Strontium ranelate reduces the urinary level of cartilage degradation biomarker CTX-II in postmenopausal women // Bone. — 2007. — 40. — P. 218-222.
6. Ammann P., Rizzoli R., Deloffre P. et al. The increase in vertebral bone mass induced in intact rats by long-term administration of the strontium salt S-12911 is directly correlated with vertebral bone strength // Osteoporos. Int. — 1996. — 6 (Suppl. 1). — P. 259.
7. Bruyere O., Delferriere D., Roux C. et al. Effects of strontium ranelate on spinal osteoarthritis progression // Ann. Rheum. Dis. — 2008. — 67. — P. 335-339.
8. Cole Z., Dennison E., Cooper C. Update on the treatment of postmenopausal osteoporosis // British Medical Bulletin. — 2008. — 86. — P. 129-143.
9. Deeks E.D., Dbillon S. Strontium ranelate. A review of its use in the treatment of postmenopausal osteoporosis // Drugs — 2010. — 70 (6) — P. 733-759.
10. Henrotin Y., Labasse A., Zheng S.X. et al. Strontium ranelate increases cartilage matrix formation // J. Bone Miner. Res. — 2001. — 16. — P. 299-308.
11. Jupsin I., Collette J., Henrotin Y. et al. Strontium ranelate (Fujisawa/Servier) // Curr. Opin. Investig. Drugs. — 2005. — 6. — P. 4354-44.
12. Kanis J.A., Burlet N., Cooper C. European guidance for the diagnosis and management of osteoporosis in postmenopausal women // Osteoporos. Int. — 2008. — 19. — P. 399-428.
13. Marie P.J., Amman P., Boivin G., Rey C. Mechanisms of action and therapeutic potential of strontium in bone // Calcif. Tissue Int. — 2001. — 69. — P. 121-129.
14. Marie P.J. Strontium ranelate: a novel mode of action of optimizing bone formation and resorption // Osteoporos. Int. — 2005. — 16 (Suppl. 1). — Р. S7-10.
15. Meunier P.J., Roux C., Seeman E. et al. The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis // N. Engl. J. Med. — 2004. — 350. — P.459-468.
16. Meunier P.J., Slosman D., Delmas P.D. et al. Strontium ranelate: dose-dependent effects in established postmenopausal vertebral osteoporosis. The Stratos 2-year randomized placebo controlled trial // J. Clin. Endocrinol. Metab. — 2002. — 87. — P. 2060-2066.
17. Meunier P.J., Reginster J.Y. Design and methodology of the phase 3 trials for the clinical development of strontium ranelate in the treatment of women with postmenopausal osteoporosis // Osteoporos. Int. — 2003. — 14 (Suppl. 3). — Р. S66-76.
18. Nielsen S.P., Slosman D., Sorensen O.H. et al. Influence of strontium on bone mineral density and bone mineral content measurements by dual X-ray absorptiometry // J. Clin. Densitom. — 1999. — 2. — P. 371-379.
19. O’Donnell S., Cranney A., Wells G.A. et al. Strontium ranelate for preventing and treating postmenopausal osteoporosis // Cochrane Database Syst. Rev. — 2006. — 4. — CD005326.
20. Povoroznyuk V.V., Dzerovych N.I., Orlyk T.V. Effect of strontium ranelate on vertebral pain syndrome in postmenopausal women with systemic osteoporosis treatment // Book of abstract «7th Athens Congress on women’s health and disease, Athens, September 11–13, 2008». — 2008. — P. 145.
21. Povoroznyuk V.V., Dzerovych N.I., Orlyk T.V. Effect of strontium ranelate on vertebral pain syndrome in postmenopausal women with systemic osteoporosis treatment // Pain Practice. — 2009. — Vol. 9 (Suppl. 1). — P. 73-74.
22. Povoroznyuk V.V., Dzerovych N.I., Orlyk T.V. Effect of strontium ranelate on vertebral pain syndrome in postmenopausal women with systemic osteoporosis treatment // Abstract book (The 8th European Congress on Menopause, London, UK, 16–20 May, 2009). — 2009. — P. 155.
23. Reginster J.Y., Deroisy R., Dougados M. et al. Prevention of early postmenopausal bone loss by strontium ranelate: the randomized, two-year, double-masked, dose-ranging, placebo-controlled PREVOS trial // Osteoporos. Int. — 2002. — 13. — P. 925-931.
24. Reginster J.Y., Felsenberg D., Boonen S. et al. Effects of long-term strontium ranelate treatment on the risk of non-vertebral and vertebral fractures in post menopausal osteoporosis: results of a 5-year, randomized, placebo-controlled trial // Arthritis Rheum. — 2008. — 58(6). — P. 1687-1695.
25. Reginster J.Y., Bruyere O., Sawicki A. et al. Long-term treatment of postmenopausal osteoporosis with strontium ranelate: results at 8 years // Bone. — 2009. — 45. — P. 1059-1064.
26. Reginster J.Y., Kaufman J.M., Devogelaer J.P. et al. Long-term efficacy and safety of strontium ranelate in postmenopausal osteoporotic women: results over 10 years // Osteoporos. Int. — 2011. — 22(S1). — Р. 110-111.
27. Reginster J.Y., Seeman E., De Vernejoul M.C. et al. Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: Treatment of Peripheral Osteoporosis (TROPOS) study // J. Clin. Endocrinol. Metab. — 2005. — 90. — P. 2816-2822.
28. Roux C., Reginster J.Y., Fechtenbaum J. et al. Vertebral fracture risk reduction with strontium ranelate in women with postmenopausal osteoporosis is independent of baseline risk factors // J. Bone Miner. Res. — 2006. — 21. — P. 536-42.
29. Seeman E., Vellas B., Benhamou C. et al. Strontium ranelate reduces the risk of vertebral and non vertebral fractures in women eighty years of age and older // J. Bone Miner. Res. — 2006. — 21. — P. 1113-1120.
30. Structural insights into improved bone health // A Satellite Symposium held during the European League Against Rheumatism Congress (EULAR): Chairpersons: Cooper C., Reginster J.-Y. — 2011, May 26. — Р. 18.