Журнал «Боль. Суставы. Позвоночник» 2 (02) 2011
Вернуться к номеру
Апоптоз
Авторы: Дедух Н.В., Заведующая лабораторией морфологии соединительной ткани ДУ «Институт патологии позвоночника и суставов им. проф. М.И. Ситенко АМН Украины», доктор биологических наук, профессор; Поворознюк В.В., Руководитель отдела клинической физиологии и патологии опорно-двигательного аппарата ГУ «Институт геронтологии АМН Украины», заслуженный деятель науки и техники, доктор медицинских наук, профессор
Рубрики: Семейная медицина/Терапия, Ревматология, Травматология и ортопедия, Неврология
Версия для печати

 Апоптоз (в переводе с греческого означает «опадание листьев») — форма гибели клеток в многоклеточном организме вследствие реализации программы, приводящей к поэтапному прекращению его жизнедеятельности. Впервые этот термин был введен J.F. Kerr и соавт. (1972) [1] при проведении электронномикроскопических исследований клеток, хотя принципы апоптоза были описаны ранее C. Vogin в 1842 году, а затем анатомом W. Flemming в 1885 году [2].
Апоптоз (в переводе с греческого означает «опадание листьев») — форма гибели клеток в многоклеточном организме вследствие реализации программы, приводящей к поэтапному прекращению его жизнедеятельности. Впервые этот термин был введен J.F. Kerr и соавт. (1972) [1] при проведении электронномикроскопических исследований клеток, хотя принципы апоптоза были описаны ранее C. Vogin в 1842 году, а затем анатомом W. Flemming в 1885 году [2].
При апоптозе в клетке наблюдаются характерные молекулярные проявления, приводящие к цитологическим изменениям, которые характеризуются уменьшением ее размера, сморщиванием цитоплазматической мембраны, переходом фосфатидилсерина из внутреннего монослоя цитоплазматической мембраны в наружный монослой, конденсацией и фрагментацией ядра (кариопикноз и кариорексис), фрагментацией ДНК хромосом. Затем вследствие распада ядра и цитоплазмы формируются апоптические мембраносвязанные тельца с внутриклеточным содержимым, которые в последующем подвергаются фагоцитозу (рис. 1).
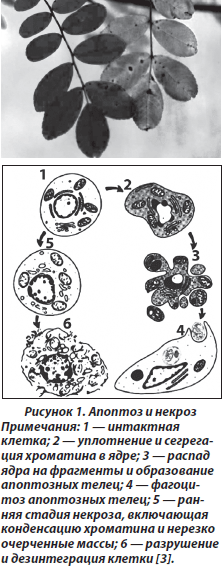
Другая форма гибели клетки — некроз возникает как патологический процесс в результате воздействия на нее внешнего повреждающего фактора. Синоним термина некроз — «гибель клетки от повреждения». Одним из основных механизмов гибели клетки вследствие некроза является повреждение ее плазматической мембраны, лизис, что приводит к нарушению ее ионного состава, набуханию мембранных органелл, разрыву лизосомальных мембран и, как следствие, деструкции цитоплазматических структур (рис. 1). Во внеклеточном пространстве продукты деструкции некротических клеток вызывают воспалительный процесс. В дальнейшем клеточный детрит поглощается фагоцитами. Обычно некроз характерен для нескольких клеток, формирующих группы, в то время как апоптоз может наблюдаться в одной клетке.
В отличие от некроза апоптоз — не обязательно проявление патологического процесса. Этот важный внутриклеточный процесс часто инициируется во время нормального жизненного цикла клетки с целью поддержания гомеостаза в организме. Апоптоз является важным механизмом изменения численности клеток в развитии организма. Существует множество физиологических процессов (наблюдающихся в основном в ходе морфогенеза или поддержания нормального состава обновляющихся клеточных популяций), когда клетки, завершившие свой жизненный цикл, удаляются путем апоптоза. Этот процесс характерен для формирования в эмбриональном онтогенезе суставных щелей, разделения пальцев верхних и нижних конечностей и др. У детей в возрасте 8–14 лет путем апоптоза погибает до 20–30 миллиардов клеток каждый день, а в организме взрослого человека — среднем от 50 миллиардов до 70 миллиардов клеток.
Факторы, приводящие к апоптозу. Апоптоз контролируется различными клеточными сигналами, которые носят экстраклеточный или интраклеточный характер [4, 5] и приводят к повреждению ДНК [6]. В процесс апоптоза клетки вовлекаются с увеличением возраста, под действием ультрафиолета, химических или физических факторов, токсинов, гормонов, факторов роста, оксида азота и др., а также при таких заболеваниях, как СПИД, болезнь Альцгеймера и Паркинсона, инфаркт миокарда, остеопороз, остеоартроз и др.
Апоптоз может иметь место, если в клетке произошла мутация, которая может привести к неконтролируемому опухолевому росту, при этом низкий уровень апоптоза способствует прогрессированию опухолевого процесса. Однако точка зрения на этот факт неоднозначна. В последние годы получены данные, что у низкодифференцированных опухолей имеет место высокая апоптозная активность, а у высокодифференцированных она значительно ниже [7].
Путем апоптоза клетки погибают при воспалительном процессе, в частности, гибель лимфоцитов отмечается на заключительных этапах инфекционного процесса, когда организм уже не нуждается в дальнейшей выработке антител. Однако высокий уровень апоптоза может приводить к выраженному снижению численности клеток, например при нейродистрофических процессах.
Таким образом, клеточные сигналы, контролирующие апоптоз, могут носить позитивный или негативный характер.
Каспазы и апоптоз. К гибели клетки путем апоптоза приводит класс протеаз, называемых каспазами, которые присутствуют в клетке в неактивной форме (в качестве проэнзимов). Каспазы — семейство эволюционно консервативных цистеиновых протеаз, которые специфически активируются в апоптозных клетках и играют ключевую роль в механизмах программируемой смерти клетки. В своих субстратах они катализируют гидролиз пептидных связей, образованных карбоксильными группами аспарагиновой кислоты, в связи с чем они и получили свое название (Cys + + Asp + протеаза = CASPAS) [8]. В настоящее время у человека идентифицировано более 10 каспаз, отдельные из которых обозначаются как «инициирующие» — это каспазы 8, 9, 10 и 12, а другие каспазы — 3, 6, 7 и 14 определены как «эффекторные» [9]. Инициирующие каспазы после активации мишенью воздействия выбирают эффекторные каспазы. Среди каспаз только каспаза 2 обладает как инициирующими, так и эффекторными функциями [10]. С активацией каспаз связан протеолиз цитоплазматических фибриллярных компонентов, субмембранных и ядерных белков.
В целом процесс апоптоза можно представить в виде трех этапов (рис. 2) [11]:
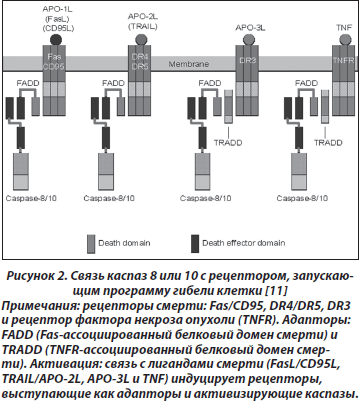
1. Активация каспаз специфическим сигналом.
2. Активация эффекторных каспаз инициирующими каспазами, первые выполняют функцию расщепления в специфических местах, например, каспаза 3 воздействует на фактор фрагментации ДНК DFF-45, PARP-полимеразу, PAK2-киназу и др.
3. Деградация важных клеточных белков каспазами.
Финальная стадия апоптоза характеризуется разрушением ДНК и формированием апоптозных телец различной формы и размера.
Сигнальные пути при апоптозе. Молекулярные процессы апоптоза запускаются в цитозоле, на мембранах, но реализуются только в ядре за счет репрессии генов и необратимого процесса межнуклеосомной фрагментации ДНК. В зависимости от стимулов, инициирующих апоптоз, можно выделить два главных внутриклеточных апоптозных сигнальных каскада: путь через рецепторы смерти и митохондриальный путь.
Механизмы активации инициирующих каспаз могут быть различными. Рецепторный путь запуска каспазного каскада начинается с активации расположенных на клеточной мембране рецепторов, воспринимающих внешний сигнал, например Fas/CD95, DR-4, DR-5, TNF и т.п. [11, 12] (рис. 2). Активация рецептора Fas одноименным лигандом либо антителами ведет к присоединению к рецептору адаптора FADD (Fas-associated protein with death domain), который, в свою очередь, связывается с прокаспазой 8, что приводит к ее активации. К рецепторам смерти относятся и рецепторы фактора некроза опухоли (TNF).
Митохондриальные механизмы апоптоза. В последние годы получены данные, касающиеся роли митохондрий в апоптозе. При митохондриальном пути запуска каспазного каскада ключевым звеном является изменение состояния митохондрий.
Выделены три фазы, включающие: 1) премитохондриальную, на которой происходит активация путей повреждения; 2) митохондриальную, связанную со снижением функции митохондрий; 3) постмитохондриальную, проявляющуюся выделением из митохондрий активных проапоптозных компонентов, приводящих к гибели клетки [13]. При нарушении целостности мембраны из митохондрий выходит ряд белков. Цитохром С в комбинации с фактором Apaf-1 (apoptotic protease-activating factor-1) и прокаспазой 9 образует каспазу 9, активирующую каспазу 3. В митохондриях существует и некаспазный путь, приводящий к апоптозу. На наружной мембране митохондрий локализована большая часть белков семейства Bcl-2, в состав которого входят промоторы (Bax, Bid и Bik) и ингибиторы (собственно Bcl-2 и Bcl-XL) апоптоза (рис. 3). От соотношения активности этих белков зависит, состоится апоптоз или нет. Особую роль играет белок Bcl-2 как фактор антиапоптического действия. В норме он закрывает митохондриальные поры, препятствуя высвобождению цитохрома С.
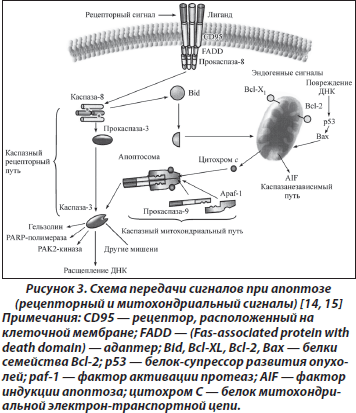
Один из белков семейства Bcl-2, промотор апоптоза Bid, может связывать рецепторный и митохондриальный пути.
Митохондрии являются ключевым звеном в передаче сигнала во время апоптоза, связанного с повреждением ДНК при действии на клетку разного рода факторов. Важную роль при этом играет также белок p53, который, перемещаясь в митохондрию, стимулирует открытие пор.
Описаны дополнительные пути апоптоза, которые могут происходить в комплексе Гольджи. В нем экспрессируется каспаза 2, основной мишенью которой является расщепление белка гольджин-160, индуцирующего апоптоз.
Многие молекулярные механизмы апоптоза на сегодняшний день расшифрованы. Выделены ключевые белки, обеспечивающие процессы апоптоза, однако механизмы их активации требуют дальнейших исследований. Остается открытым вопрос о том, сможет ли клетка выйти из апоптоза, включенного физиологическим апоптическим сигналом, особенно в случае, если каспазы уже были активированы [8].
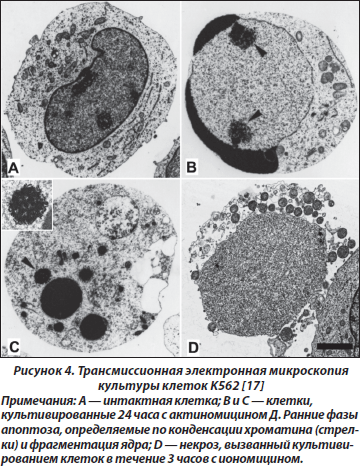
Методы исследования апоптоза подробно описаны [16]. Метод световой микроскопии позволяет выявить клетки с пикнотичными ядрами, а также вариант апоптического нарушения структуры ядра — кариорексис. Используют гистохимические методы, позволяющие выявить белки — маркеры апоптоза. Больше информации можно получить при использовании флюоресцентной микроскопии, основанной на применении для окраски флюоресцентных красителей. Клетки с апоптозом возможно верифицировать методом проточной цитофотометрии. Олигонуклеосомную деградацию ДНК изучают методом in situ. Фазы формирования нарушений в ядре и формирование апоптических телец возможно выявить методом электронной микроскопии (рис. 4).
1. Kerr J.F. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics / J.F. Kerr, A.H. Wyllie, A.R. Currie // Br. J. Cancer. — 1972. — Vol. 26, № 4. — P. 239-257.
2. Википедия // http://ru.wikipedia.org/wiki
3. Мурашко Н.К. Позитивні й негативні наслідки апоптозу в медичній практиці / Н.К. Мурашко // Лікарю-практику. — 2008. — Т. 4, № 10. http://internal.mif-ua.com/archive/issue-5470/article-5528/
4. Cotran R.S. Pathologic basis of disease / R.S. Cotran, V. Kumar, T. Collins. — Philadelphia: W.B. Saunders Company, Hardcover, 1998. — 1440 p.
5. Brьne B. Nitric oxide: NO apoptosis or turning it ON? / Brьne B. // Cell Death Differ. — 2003. — Vol. 10, № 8. — P. 864-869.
6. Ghobrial I.M. Targeting apoptosis pathways in cancer therapy / I.M. Chobrial, T.E. Witzig, A.A. Adjei / CA Cancer J. Clin. — 2005. — Vol. 55. — P. 178-194.
7. Szende B. The occurrence and significance of apoptosis in tumors / B. Szende // Magy Onkol. — 2004. — Vol. 48, № 3. — Vol. 215-219.
8. Кухта В.К. Молекулярные механизмы апоптоза / В.К. Кухта, Н.В. Морозкина, Е.В. Богатырева, И.Г. Сокольчик // http://www.bsmu.by/index.php?option=com_content&view=article&id=3380:2010-05-19-08-06-40&catid=162:12004&Itemid=52. — 2011.
9. Vermeulen K. Apoptosis: mechanisms and relevance in cancer / K. Vermeulen, D.R. Van Bockstaele, Z.N. Berneman // Ann. Hematol. — 2005. — Vol. 84. — P. 627-639.
10. Zhivotovsky B. Caspase-2 function in response to DNA damage / B. Zhivotovsky, S. Orrenius // Biochem. Biophys. Res. Commun. — 2005. — Vol. 331. — P. 359-867.
11. Apoptosis // http://www.web-books.com/MoBio/Free/Ch6G.htm
12. Kaufmann S.H. Programmed cell death: alive and well in the new millennium / Kaufmann S.H., Hengartner M. // Trends Cell Biol. — 2001. — Vol. 11. — P. 526-534.
13. Мишуніна Т.М. Основні молекулярні механізми апоптозу та їх порушення при канцерогенезі щитоподібної залози (огляд літератури) / Мишуніна Т.М., Тронько М.Д. // Журн. АМН України. — 2006. — Т. 12, № 4. — С. 611-633.
14. Hengartner M.O. The biochemistry of apoptosis / M.O. Hengartner // Nature. — 2000. — Vol. 407. — P. 770-776.
15. Широкова А.В. Апоптоз. Сигнальные пути и изменение ионного и водного баланса клетки / А.В. Широкова // Цитология. — 2007. — Т. 49, № 5. — С. 385-394.
16. Манских В.Н. Морфологические методы верификации и количественной оценки апоптоза / В.Н. Манских // Бюллетень сибирской медицины. — 2004. — № 1. — C. 63-70.
17. Kressel M., Groscurth P. Distinction of apoptotic and necrotic cell death by in situ labelling of fragmented DNA / M. Kressel, P.Groscurth // Cell Tissue Res. — 1994. — Vol. 278. — P. 549-556.
