Журнал «Боль. Суставы. Позвоночник» 2 (02) 2011
Вернуться к номеру
Псориатический артрит: гендерные и возрастные особенности, эффективность лечения
Авторы: Пушкарева Е.Е., Делятин О.В., Синяченко О.В., Ермолаева М.В., Донецкий национальный медицинский университет имени М. Горького
Рубрики: Семейная медицина/Терапия, Ревматология, Травматология и ортопедия, Неврология
Версия для печати
 Часть 1. Гендерные особенности течения
Часть 1. Гендерные особенности течения
Около 2–3 % людей земного шара страдают псориазом [5, 8], а каждый третий — пятый из них — псориатическим артритом (ПсА) [10, 13], который наносит большой медицинский, социальный и экономический ущерб [4, 9]. Псориатическое поражение опорно-двигательного аппарата бесспорно относится к актуальным проблемам современной отечественной ревматологии [1], причем численность таких больных в некоторых регионах Украины за последние 20 лет увеличилась более чем вдвое [2].
Частота развития ПсA у женщин выше, чем у мужчин (хотя различия недостоверны), а в дебюте заболевания у них поражение кожи существенно превалирует над суставным синдромом (в соотношении 9 : 1) [6, 14]. Необходимо отметить, что по частоте вовлечения в патологический процесс ногтей, периартикулярных тканей, позвоночника, крестцово-подвздошных сочленений и развития суставных узураций костей половой диморфизм ПсА отсутствует. Подчеркнем, что мужской пол относится к неблагоприятным факторам в отношении эффективности терапии ПсА [7], тогда как женский пол считается фактором риска возникновения осложнений при патогенетическом лечении больных [3]. Существуют и другие гендерные особенности течения ПсА, но эти вопросы мало изучены и в будущем требуют более детальной оценки [11, 12].
Целью и задачами данного фрагмента исследования стали анализ клинических, рентгенологических, ультразвуковых и денситометрических признаков течения ПсА у мужчин и женщин.
Под наблюдением находился 121 больной с ПсА в возрасте от 16 до 68 лет (в среднем 42,0 ± 1,1 года), среди которых было 57 (47 %) мужчин в возрасте 41,0 ± 1,7 года и 64 (53 %) женщины в возрасте 43,0 ± 1,4 года. Длительность заболевания составила от 1 до 43 лет (в среднем 11,0 ± 0,9 года), причем в группе мужчин — 9,0 ± 1,2 года, у женщин — 12,0 ± 1,2 года (p = 0,092). В 13 % случаев отмечена отягощенная наследственность псориаза. I степень активности патологического процесса констатирована в 35 % наблюдений, II — в 47 %, III — в 18 %. Вульгарная форма псориаза имела место в 66 % случаев, инфильтративно-бляшечная — в 26 %, экссудативная — в 8 %. Сопутствующая патология выявлена у 37 % мужчин и 41 % женщин. Гипертоническая болезнь (эссенциальная артериальная гипертензия) диагностирована в 12 % наблюдений, ишемическая болезнь сердца — в 10 %, желчнокаменная болезнь — в 4 %, сахарный диабет II типа, мочекаменная болезнь, хронические вирусные гепатиты В и С — соответственно в 3 %, хронический пиелонефрит с сохраненной функцией почек — в 2 %, эутиреоидный зоб и хронический бронхит — в 1 %. У мужчин в 3,3 раза чаще отмечена ишемическая болезнь сердца (р = 0,041).
У 65 % больных первым признаком псориаза было поражение кожи, у 22 % — суставов, у 14 % — сочетанный кожно-артикулярный синдром. Мужчины и женщины достоверно не отличались между собой по частоте дебюта заболевания с кожных и суставных проявлений. Коленные суставы вовлекались в патологический процесс в 79 % случаев ПсА, голеностопные — в 63 %, проксимальные межфаланговые суставы кистей — в 57 %, дистальные — в 47 %, лучезапястные — в 42 %, проксимальные межфаланговые суставы стоп — в 40 %, плечевые — в 33 %, дистальные суставы пальцев стоп — в 25 %, локтевые — в 24 %, пястнофаланговые и плюснефаланговые — соответственно в 22 %, суставы поясничного отдела позвоночника — в 19 %, тазобедренные и шейного отдела позвоночника — в 14 %, грудного отдела — в 12 %, крестцово-подвздошные сочленения — в 6 %, височно-челюстные — в 3 %, грудино-ключичные — в 1 %. При рентгенологическом исследовании сужение суставных щелей зарегистрировано в 53 % наблюдений, субхондральный склероз — в 6 %, остеофитоз — в 22 %, остеокистоз — в 32 %, эпифизарный остеопороз — в 21 %, узурации поверхностей костей — в 16 %, лигаментоз — в 7 %, суставной анкилоз — в 3 %. При сонографии суставов кальцификаты в артикулярных тканях наблюдались в 26 % наблюдений, изменения рогов менисков — в 44 %, кисты Бейкера — в 10 %, тела Пеллегрини — Штиды и Гоффа — соответственно в 3 %, хондромные тела — в 9 %. Остеодефицит (остеопороз или остеопения) установлен у 33 % больных ПсА, тендовагиниты имели место в 46 % наблюдений, энтезопатии — в 22 %.
При обследовании пациентов мы пользовались критериями Комитета Американской дерматологической академии. Больным проводили рентгенологическое (аппарат Multix-Compact-Siеmens, Германия) и ультразвуковое (аппарат Envisor-Philips, Голландия) исследование периферических суставов, позвонковых и крестцово-подвздошных сочленений, двухэнергетическую рентгеновскую остеоденситометрию проксимального отдела бедренной кости (аппарат QDR-4500-Delphi-Hologic, США). Оценивали периферический метакарпальный индекс (МКИ) Барнетта — Нордина и индекс минеральной плотности кости (МПК).
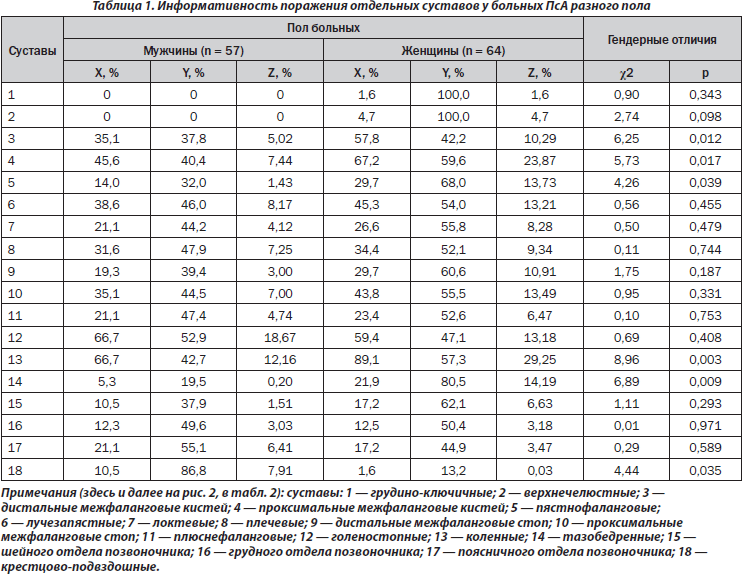
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (лицензионные программы Microsoft Excel и Statistica-StatSoft). В зависимости от пола оценивали средние значения показателей, их ошибки, критерии Стьюдента, дисперсии, Уилкоксона — Рао, хи-квадрат (χ2) и достоверность статистических показателей (р). Вычисляли для больных мужчин и женщин частоту того или иного признака (X), его специфичность (Y) и относительную значимость (Z).
Согласно нашим исследованиям, существует половой диморфизм в отношении характера псориатического процесса (р = 0,019), который проявляется более частым развитием у мужчин экссудативной формы болезни. В группе мужчин оказалась и более высокая степень активности заболевания (p = 0,048).
По данным многофакторного дисперсионного анализа, пол больных мало влияет на интегральный характер поражения суставов при псориазе. В свою очередь, как демонстрирует однофакторный анализ, пол пациентов оказывает воздействие на развитие артритов дистальных, проксимальных межфаланговых кистей, пястнофаланговых и тазобедренных сочленений (соответственно p = 0,012, p = 0,017, p = 0,039, p = 0,008). Следует подчеркнуть, что наблюдается отсутствие достоверной связи с полом распространенности суставного синдрома. Как видно из табл. 1, в женской группе достоверно чаще (на 23 %) развивается поражение дистальных суставов пальцев верхних конечностей, на 22 % — проксимальных кистей и коленных, в 2,1 раза — пястнофаланговых и в 4,1 раза — тазобедренных, тогда как у мужчин в 6,6 раза чаще диагностируется сакроилеит. Если у мужчин Z суставов конечностей составляет 79,2 %, то у женщин — 166,2 %. Отметим, что женщинам свойственно поражение суставов верхних конечностей, а Z для этого признака превышает аналогичный показатель у мужчин в 4,7 раза (соответственно 33,4 и 78,7 %).
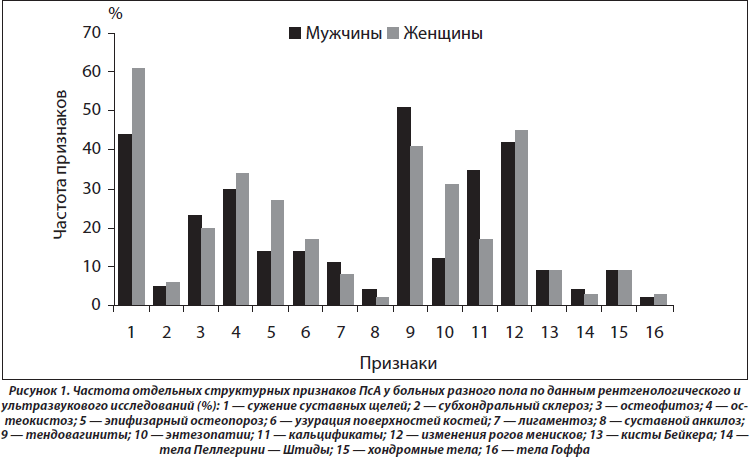
Результаты анализов ANOVA/MANOVA демонстрируют слабое влияние пола на интегральные клинико-рентгенологические признаки. Обращает на себя внимание большая частота (в 2,6 раза) у женщин энтезопатий (р = 0,012), у мужчин (в 2,0 раза) — артикулярных кальцификатов (р = 0,024) (рис. 1). Кроме того, гендерные особенности ПсА касаются частоты развития остеодефицита (остеопения, остеопороз), который в женской группе диагностирован в 3,1 раза чаще (p < 0,001). Параметры МКИ і 0,45 у.е. отмечаются в 28 % наблюдений, а индекса МПК Ј –1,0 SD — в 32 % случаев.
Продолжительность заболевания достоверно влияет на вовлечение в процесс пястнофаланговых (p = 0,032), лучезапястных (p = 0,026) и тазобедренных (p = 0,041) суставов, а также на формирование узураций костей (p = 0,020), форма псориаза — на изменения коленных сочленений (p = 0,002) и развитие лигаментоза (p = 0,002). В случаях дебюта заболевания с кожных и артикулярных проявлений отмечается связь течения ПсА с поражением проксимальных межфаланговых суставов кистей (соответственно p = 0,017 и p = 0,043) и коленных (p = 0,030 и p = 0,024), при одновременных изменениях кожи и суставов — с грудным и поясничным отделами позвоночника (соответственно p = 0,029 и p = 0,039).
По нашим данным, половой диморфизм касается и других серонегативных спондилоартритов. Так, гендерные особенности реактивного хламидийиндуцированного артрита проявляются более частым развитием у мужчин сакроилеита, а у женщин распространенным и тяжелым течением суставного синдрома. Для мужчин, страдающих анкилозирующим спондилитом (болезнью Бехтерева), специфичны вовлечение в патологический процесс пястнофаланговых, лучезапястных, тазобедренных суставов, шейного отдела позвоночника и развитие околосуставного остеопороза, а для женщин — локтевых, плечевых, голеностопных сочленений, грудного и поясничного отделов позвоночника, формирование остеокистоза, костных узур, отложений кальция в артикулярных тканях, появление энтезопатий и тендовагинитов.
Выводы
1. Существует половой диморфизм течения ПсА, который проявляется в различиях частоты нарушения минеральной плотности кости, поражения периферических суставов, крестцово-подвздошных сочленений и периартикулярных тканей.
2. Для мужчин характерны более высокая степень активности патологического процесса, большая частота сакроилеита и кальцификатов в периартикулярных тканях, а для женщин — поражение суставов кистей, формирование гонитов, кокситов, энтезопатий и остеодефицита (остеопения, остеопороз).
3. Гендерные особенности течения ПсА диктуют необходимость разработки специальной патогенетической терапии заболевания для мужчин и женщин.
Часть 2. Возрастные особенности течения
В Украине численность больных ПсА ежегодно растет [1, 2], и на распространенность заболевания в целом оказывают влияние такие факторы, как этнические группы населения и носительство в этой популяции HLA-B27 [15]. Факторами риска развития артрита при псориазе являются: возраст больных, наличие онихопатии, наследственная предрасположенность к заболеванию, избыточная масса тела, носительство HLA-Cw*0602 [3, 10].
Средний возраст всех больных с ПсА в европейских странах в среднем составляет 45–50 лет [7], при этом имеют место возрастные особенности течения артропатии [13, 14]. Более раннее начало псориатической суставной патологии ассоциируется в последующем с более частым развитием сопутствующей ишемической болезни сердца, сахарного диабета II типа и хронического обструктивного заболевания легких [8]. Течение ПсА у представителей разных возрастных групп изучено недостаточно, не определены клинические, рентгенологические, ультразвуковые и денситометрические параметры костно-суставной системы у больных молодого, зрелого и пожилого возраста [9, 18]. Изложенное стало целью и задачами данного фрагмента исследования.
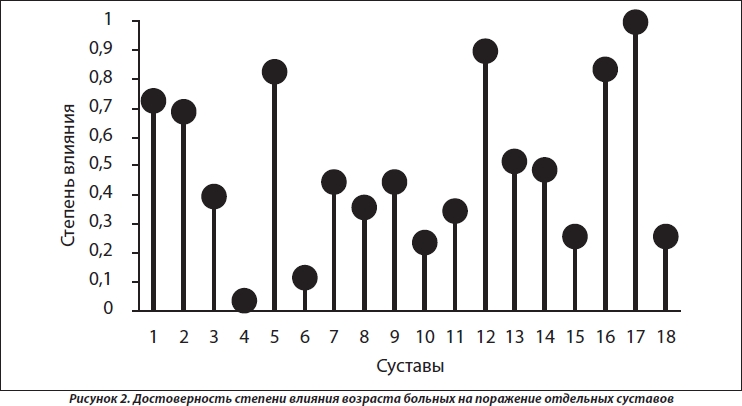
Согласно результатам многофакторного дисперсионного анализа, возраст больных не оказывает достоверного воздействия на интегральный характер суставного синдрома, тогда как по данным однофакторного дисперсионного анализа он влияет на частоту поражения проксимальных межфаланговых суставов кистей (p = 0,027), что нашло свое отражение на рис. 2. Отсутствуют достоверные связи дебюта суставного синдрома с возрастом больных.
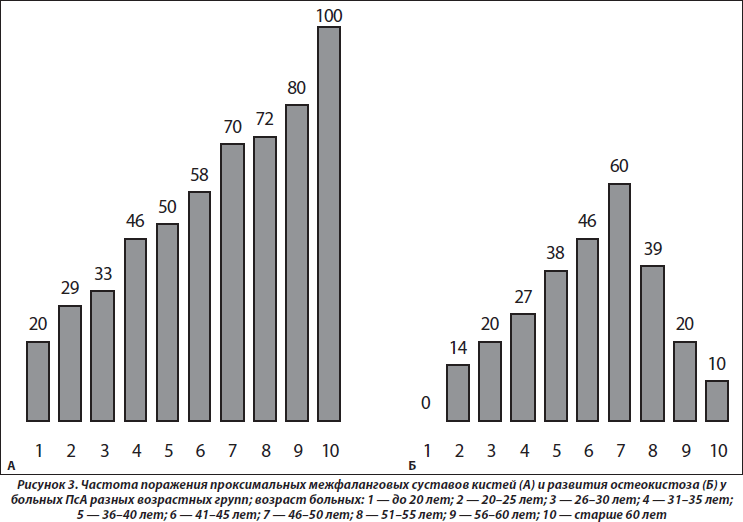
Как свидетельствует результат анализа ANOVA, возраст больных влияет на частоту сужения суставных щелей (p = 0,034), развитие остеокистоза (p = 0,049), остеоузураций (p = 0,026), артикулярных кальцификатов (p = 0,010), частоту изменений рогов менисков (p = 0,004), на появление хондромных тел (p < 0,001) и тел Гоффа (p = 0,049), а также формирование энтезопатий (p = 0,041). Как видно на рис. 3, с возрастом больных учащаются случаи изменений проксимальных суставов пальцев верхних конечностей. Любопытно, что появление суставных кист к 50 годам учащается, а затем с возрастом уменьшается. Несколько неожиданным оказалось отсутствие достоверных корреляционных связей параметров распространенности суставного синдрома, МКИ и МПК, поскольку формирование остеодефицита (остеопения, остеопороз), даже без ПсА, прямо соотносится с возрастом пациентов [6, 19].
Если без сопутствующей патологии средний возраст больных составляет 38,0 ± 1,2 года, то при наличии фоновых заболеваний — 48,0 ± 1,6 года (p < 0,001). По результатам ANOVA/MANOVA, сопутствующая патология оказывает достоверное воздействие на характер суставного синдрома (p = 0,003). Однофакторный дисперсионный анализ демонстрирует влияние сопутствующих болезней на поражение плюснефаланговых суставов (p = 0,018), развитие субхондрального склероза (p = 0,002), остеокистоза (p = 0,049) и эпифизарного остеопороза (p = 0,003).
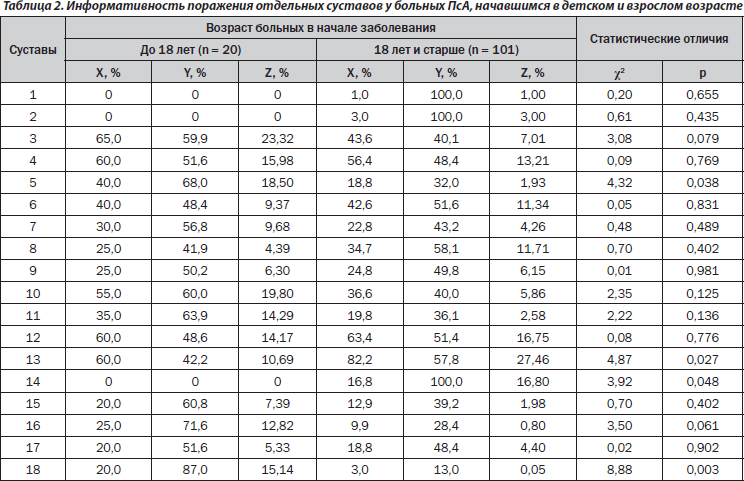
В настоящее время изучаются особенности характера течения ПсА, протекающего или начавшегося в детском возрасте [17]. Необходимо отметить, что ювенильный ПсА у азиатских больных развивается позже, чем у европейских, а частота отдельных форм кожного псориаза и вовлечения в патологический процесс ногтей у них не отличается [5]. Среди пациентов, у которых ПсА начался в детском возрасте (табл. 2), не наблюдалось поражения грудино-ключичных, верхнечелюстных и тазобедренных суставов. В случаях постювенильного ПсА в 2,1 раза чаще наблюдается поражение пястнофаланговых суставов и в 6,7 раза — крестцово-подвздошных сочленений (соответственно Z составляет в первой подгруппе 33,64 %, во второй — лишь 1,98 %), тогда как изменения коленных суставов отмечаются в 1,4 раза реже, а Z коленных и тазобедренных суставов в этих подгруппах больных составляет 10,69 и 44,26 %.
Выводы
1. Особенности течения ПсА с увеличением возраста больных проявляются учащением вовлечения в патологический процесс проксимальных межфаланговых суставов кистей, развитием энтезопатий, остеокистоза, остеоузураций, артикулярных кальцификатов, изменений рогов менисков, суставных хондромных тел и тел Гоффа, на что влияет наличие сопутствующей соматической патологии.
2. В случаях появления ПсА в детском возрасте дальнейшее течение заболевания характеризуется более частым поражением пястнофаланговых и крестцово-подвздошных сочленений, но относительно редким формированием гонитов и кокситов.
3. Возрастные особенности течения ПсА диктуют необходимость разработки специальной медицинской технологии диагностики и лечения заболевания для детей, людей зрелого возраста и пожилых лиц.
Часть 3. Эффективность лечения
Комплексное лечение больных периферическим ПсА и псориатической спондилопатией чаще всего включает в себя применение нестероидных противовоспалительных препаратов, глюкокортикоидных гормонов, лефлуномида, сульфасалазина, метотрексата, циклоспорина [2, 4, 10, 17]. Относительно редко у таких больных применяют азатиоприн, микофенолата мофетил, ацитретин, такролим и 6-тиогуанин [14].
Наиболее признанным средством иммунодепрессивной базисной терапии ПсА является метотрексат [5, 12]. Согласно данным, отчетливый положительный эффект при изолированном использовании метотрексата и лефлуномида регистрируется у 30 % больных ПсА [3]. Продемонстрирована относительная безопасность комбинированного применения метотрексата и лефлуномида у больных ПсА [18].
Необходимо отметить, что лечение ПсА вызывает большие трудности, а его результаты зачастую остаются неудовлетворительными [17]. Целью и задачами данного фрагмента работы стали оценка эффективности традиционной патогенетической терапии при разном течении ПсА и выявление факторов, ее определяющих, изучение степени влияния содержания токсичных и эссенциальных микроэлементов (МЭ) в волосах и крови, а также в зонах проживания больных (почва, грунтовые воды) на результаты лечебных мероприятий.
По данным настоящего исследования, нестероидные противовоспалительные препараты (диклофенак натрия, мелоксикам, целекоксиб, нимесулид) до обследования больных применяли у 79 % пациентов, медрол (метилпреднизолон) — у 41 %, сульфасалазин — у 12 %, метотрексат — у 43 %, циклоспорин (лайфмун) — у 16 %, лефлуномид (арава) — у 17 %, полиферментные смеси системной энзимотерапии (вобэнзим, флогэнзим) — у 31 %. Эффективность лечения больных ПсА оценивали спустя 3–38 недель от начала наблюдения (в среднем через 13,0 ± 0,7 недели). Под значительным улучшением понимали достижение уменьшения активности заболевания на две степени, исчезновение жалоб больных, тендовагинитов и энтезопатий. Обязательными условиями улучшения были: снижение лабораторной степени активности болезни, уменьшение выраженности тендовагинитов и энтезопатий, а также числа болезненных суставов.
Отсутствие эффекта от лечения констатировано у 6 % больных, незначительное улучшение — у 35 %, улучшение — у 53 %, значительное улучшение — у 7 %. Результаты терапии женщин с ПсА оказались выше (p = 0,014), а улучшение и значительное улучшение у них констатировано на 13 % чаще, чем у мужчин. В связи с этим, по данным литературы, мужской пол относится к прогнознегативным факторам в терапии ПсА [6].
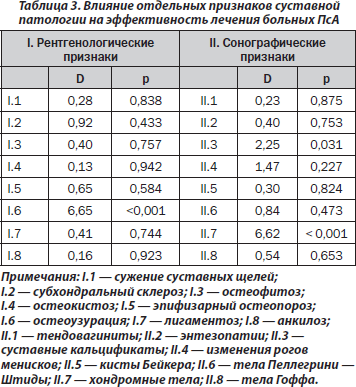
По данным однофакторного дисперсионного анализа, на эффективность лечебных мероприятий при ПсА оказывают влияние наличие гонита (p = 0,016) и поражение грудного отдела позвоночника (p = 0,013). Существует обратная корреляционная связь эффективности терапии с числом измененных суставов (p < 0,001). Результаты лечения связаны с наличием у больных артикулярных костных узур (p < 0,001), кальцификатов (p = 0,031) и хондромных тел (p < 0,001). Результаты дополнительного непараметрического статистического анализа оказались неожиданными: именно поражение коленных суставов и грудного отдела позвоночника является благоприятным фактором для последующей терапии (соответственно p < 0,001). По нашему мнению, перечисленные клинические признаки являются прогнозпозитивными в эффективности терапии у больных ПсА, а рентгенологические и ультразвуковые — прогнознегативными. Не установлено достоверного влияния на результаты терапии ПсА наличия системного остеодефицита (остеопения, остеопороз), а также исходных параметров МКИ и МПК.
Данные дисперсионного анализа демонстрируют достоверное воздействие на эффективность лечения больных ПсА лефлуномида (p = 0,023) и системной энзимотерапии (p < 0,001). При применении этих препаратов улучшение и значительное улучшение констатируется в 2,1 раза чаще (p < 0,001). Мы считаем, что использование лефлуномида с полиферментными смесями (вобэнзим, флогэнзим) является методом выбора лечения больных ПсА.
На эффективность терапии больных ПсА оказывает воздействие уровень в волосах Al (p = 0,020), Be (p = 0,016) и Cr (p = 0,022), что отражено на рис. 4. Необходимо отметить, что результаты лечения обратно коррелируют с концентрациями Al и Be (соответственно р = 0,042 и р = 0,038). Ухудшает эффективность лечебных мероприятий при ПсА высокий уровень в крови Со (p = 0,011). Таким образом, прогнознегативными критериями терапии пациентов с ПсА могут быть показатели (> M + s больных) в волосах Al > 10 мкг/г и Be > 5 нг/г, а в крови — Co > 12 мкг/л.
Следует подчеркнуть, что высокие концентрации Al в организме больных артритами способствуют остеомаляции [9], а загрязнение окружающей среды отходами алюминиевого металлургического производства вызывает учащение развития у людей остеопороза, поскольку Al оказывает токсическое действие на остеобласты, нарушает структуру и функцию кости, задерживает костеобразование [1]. Уровень Ве в организме больных ПсА обычно повышается [11], что сопровождается параллельным накоплением в крови концентраций Al и Со [7].
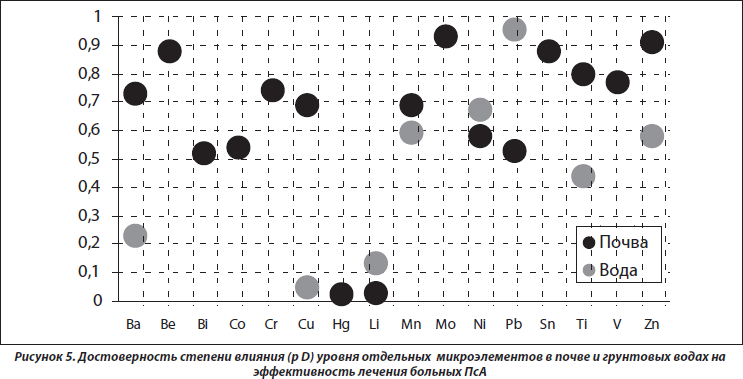
Эффективность лечения ПсА тесно связана с уровнями в почве зон проживания больных Hg (p = 0,025) и Li (p = 0,029), а в грунтовых водах — Cu (p = 0,048), что представлено на рис. 5. При этом с первыми двумя факторами существует обратная корреляционная связь (соответственно р = 0,042 и р = 0,046), а с третьим — прямая (р = 0,025). Заметим, что высокая концентрация в окружающей среде Hg неблагоприятно воздействует на Т-клеточное звено системы иммунитета, центральную и периферическую нервную систему, способствует прогрессированию ревматоидного артрита, а Li ухудшает течение ПсА у больных артритами [15]. У больных с воспалительными заболеваниями суставов содержание Cu в сыворотке крови обычно повышается и прямо коррелирует со степенью активности патологического процесса. Вместе с тем Cu не оказывает негативного влияния на артикулярный хрящ, а in vitro не влияет на хондроциты и синтез протеогликанов, но усиливает выработку коллагена типа II [8].
Для лечения больных ПсА все шире используют противоцитокиновые препараты — ингибиторы TNF-α, причем нередко на фоне применения метотрексата. У такой категории больных перспективными являются адалимумаб, голимумаб, инфликсимаб, устекинумаб, цертолизумаб, этарнецепт [13, 16]. Представляют интерес изучение влияния перечисленных биологических препаратов на динамику микроэлементоза у больных ПсА и оценка факторов, определяющих эффективность такой терапии. Но это задачи ближайшего будущего.
Выводы
1. Улучшение и значительное улучшение в процессе комплексной патогенетической терапии наблюдается у 60 % больных ПсА.
2. Наибольшее положительное влияние на результаты лечения отмечается при использовании лефлуномида и полиферментных смесей системной энзимотерапии (вобэнзим, флогэнзим).
3. Эффективность лечебных мероприятий при ПсА имеет гендерные особенности (у мужчин результаты хуже), определяется наличием гонитов и поражений грудного отдела позвоночника (позитивная связь), узураций суставных костей, артикулярных кальцификатов и хондромных тел (негативная связь).
4. Результаты терапии отрицательно зависят от исходных показателей в волосах токсичных Al и Be, а в крови Со, от уровней в почве зон проживания пациентов Hg и Li, но эффективность лечения прямо повышается с увеличением в грунтовых водах содержания эссенциального Cu.
5. Оценивая эффективность лечения ПсА, следует учитывать экологические факторы окружающей среды, а при прогнозировании дальнейших результатов терапевтических мероприятий — изучать микроэлементный состав в волосах и крови больных.
Часть 1
1. Нейко Є.М. Оцінка ефективності та безпеки зинаксину у лікуванні при псоріатичному артриті / Є.М. Нейко, Р.І. Яцишин, О.І. Олійник // Укр. ревматол. журн. — 2007. — Т. 28, № 2. — С. 39-43.
2. Якименко О.О. Аналіз структури ревматичних захворювань за 22 роки (1983–2005) в Одесі / О.О. Якименко, Л.В. Закатова, В.В. Дець // Укр. ревматол. журн. — 2007. — Т. 29, № 3. — С. 86-87.
3. Amital H. Hepatotoxicity rates do not differ in patients with rheumatoid arthritis and psoriasis treated with methotrexate / H. Amital, Y. Arnson, G. Chodick, V. Shalev // Rheumatology. — 2009. — Vol. 48, № 9. — P. 1107-1110.
4. Garg A. Recognizing psoriatic arthritis in the dermatology clinic / A. Garg, D. Gladman // J. Am. Acad. Dermatol. — 2010. — Vol. 63, № 5. — P. 733-750.
5. Gisondi P. Metabolic comorbidities and psoriasis / P. Gisondi, A. Ferrazzi, G. Girolomoni // Acta Dermatovenerol. Croat. — 2010. — Vol. 18, № 4. — P. 297-304.
6. Glintborg B. Treatment response, drug survival and predictors thereof in 764 patients with psoriatic arthritis treated with anti-tumor necrosis factor α therapy: Results from the Danish nationwide DANBIO registry / B. Glintborg, M. Ostergaard, L. Dreyer, N.S. Krogh // Arthritis Rheum. — 2010. — Vol. 27, № 10. — P. 85-88.
7. Glintborg B. Treatment response, drug survival, and predictors thereof in 764 patients with psoriatic arthritis treated with anti-tumor necrosis factor α therapy: results from the nationwide Danish DANBIO registry / B. Glintborg, M. Ostergaard, L. Dreyer, N.S. Krogh // Arthritis Rheum. — 2011. — Vol. 63, № 2. — P. 382-390.
8. Kuhn A. Use of methotrexate in patients with psoriasis / A. Kuhn, V. Ruland, N. Patsinakidis, T.A. Luger // Clin. Exp. Rheumatol. — 2010. — Vol. 28, № 5, suppl. 61. — P. 138-144.
9. Langham S. Large-scale, prospective, observational studies in patients with psoriasis and psoriatic arthritis / S. Langham, J. Langham, H.P. Goertz, M. Ratcliffe // BMC Med. Res. Methodol. — 2011. — Vol. 31, № 11. — P. 32-42.
10. Loіpez-Ferrer A. Psoriatic arthritis: what the dermatologist needs to know / A. Loіpez-Ferrer, V. Torrente-Segarra, L. Puig // Actas Dermosifiliogr. — 2010. — Vol. 101, № 7. — P. 578-584.
11. Morgan C. Five-year outcome of a primary-care-based inception cohort of patients with inflammatory polyarthritis plus psoriasis / C. Morgan, M. Lunt, D. Bunn, D.G. Scott // Rheumatology. — 2007. — Vol. 46, № 12. — P. 1819-1823.
12. Wallenius M. Work disability and health-related quality of life in males and females with psoriatic arthritis / M. Wallenius, J.F. Skomsvoll, W. Koldingsnes, E. Radevand // Ann. Rheum. Dis. — 2009. — Vol. 68, № 5. — P. 685-689.
13. Weger W. An update on the diagnosis and management of psoriatic arthritis // G. Ital. Dermatol. Venereol. — 2011. — Vol. 146, № 1. — P. 1-8.
14. Zisman D. Clinical and demographic characteristics of patients with psoriatic arthritis in northern Israel / D. Zisman, L. Eder, M. Elias, A. Laor // Rheumatol. Int. — 2010. — Vol. 12, № 1. — P. 70-76.
Часть 2
1. Нейко Є.М. Оцінка ефективності та безпеки зинаксину у лікуванні при псоріатичному артриті / Є.М. Нейко, Р.И. Яцишин, О.І. Олійник // Укр. ревматол. журн. — 2007. — Т. 28, № 2. — С. 39-43.
2. Якименко О.О. Аналіз структури ревматичних захворювань за 22 роки (1983–2005) в Одесі / О.О. Якименко, Л.В. Закатова, В.В. Дець // Укр. ревматол. журн. — 2007. — Т. 29, № 3. — С. 86-87.
3. Armesto S. Nail psoriasis in individuals with psoriasis vulgaris: A study of 661 patients / S. Armesto, A. Esteve, P. Coto-Segura, M. Drake // Actas Dermosifiliogr. — 2011. — Vol. 102, № 5. — P. 365-372.
4. Carneiro C. Fatigue in psoriasis with arthritis / C. Carneiro, M. Chaves, G. Verardino, A. Drummond // Skinmed. — 2011. — Vol. 9, № 1. — P. 34-37.
5. Chiam L.Y. Juvenile psoriasis in European and Asian children: similarities and differences / L.Y. Chiam, M.E. de Jager, Y.G. Giam, E.M. de Jong // Br. J. Dermatol. — 2011. — Vol. 164, № 5. — P. 1101-1103.
6. Faulhaber G.A. Low bone mineral density is associated with insulin resistance in bone marrow transplant subjects / G.A. Faulhaber, M.O. Premaor, H.L. Moser Filho, L.M. Silla // Bone Marrow. Transplant. — 2009. — Vol. 43, № 12. — P. 953-957.
7. Glintborg B. Treatment response, drug survival and predictors thereof in 764 patients with psoriatic arthritis treated with anti-tumor necrosis factor α therapy: Results from the Danish nationwide DANBIO registry / B. Glintborg, M. Ostergaard, L. Dreyer, N.S. Krogh // Arthritis Rheum. — 2010. — Vol. 27, № 10. — P. 85-88.
8. Khraishi M. Prevalence of patient-reported comorbidities in early and established psoriatic arthritis cohorts / M. Khraishi, D. Macdonald, E. Rampakakis, J. Vaillancourt // Clin. Rheumatol. — 2011. — Vol. 2, № 2. — P. 60-64.
9. Loіpez-Ferrer A. Psoriatic arthritis: what the dermatologist needs to know / A. Loіpez-Ferrer, V. Torrente-Segarra, L. Puig // Actas Dermosifiliogr. — 2010. — Vol. 101, № 7. — P. 578-584.
10. Maejima H. Evaluation of nail disease in psoriatic arthritis by using a modified nail psoriasis severity score index / H. Maejima, T. Taniguchi, A. Watarai, K. Katsuoka // Int. J. Dermatol. — 2010. — Vol. 49, № 8. — P. 901-906.
11. Mazlan S.A. A study of intima media thickness and their cardiovascular risk factors in patients with psoriatic arthritis / S.A. Mazlan, M.S. bin Mohamed Said, H. Hussein, K. binti Shamsuddin // Acta Medica. — 2009. — Vol. 52, № 3. — P. 107-116.
12. Mease P.J. Psoriatic arthritis: update on pathophysiology, assessment and management // Ann. Rheum. Dis. — 2011. — Vol. 70, suppl. 1. — P. 77-84.
13. Morgan C. Five-year outcome of a primary-care-based inception cohort of patients with inflammatory polyarthritis plus psoriasis / C. Morgan, M. Lunt, D. Bunn, D.G. Scott // Rheumatology. — 2007. — Vol. 46, № 12. — P. 1819-1823.
14. Queiro R. Stratification by age of onset with 30 years as age limit is an effective means of identifying PSORS1-associated psoriasis in patients with psoriatic arthritis / R. Queiro, S. Alonso, M. Alperi, M. Fernandez // Joint Bone Spine. — 2011. — Vol. 19, № 4. — P. 93-97.
15. Reveille J.D. Epidemiology of spondyloarthritis in North America // Am. J. Med. Sci. — 2011. — Vol. 341, № 4. — P. 284-286.
16. Spandonaro F. Health-related quality of life in psoriasis: an analysis of Psocare project patients / F. Spandonaro, G. Altomare, E. Berardesca, P. Calzavara-Pinton // G. Ital. Dermatol. Venereol. — 2011. — Vol. 146, № 3. — P. 169-178.
17. Stoll M.L. Clinical comparison of early-onset psoriatic and non-psoriatic oligoarticular juvenile idiopathic arthritis / M.L. Stoll, P.A. Nigrovic, A.C. Gotte, M. Punaro // Clin. Exp. Rheumatol. — 2011. — Vol. 23, № 2. — P. 50-55.
18. Weger W. An update on the diagnosis and management of psoriatic arthritis // G. Ital. Dermatol. Venereol. — 2011. — Vol. 146, № 1. — P. 1-8.
19. Yoshimura N., Muraki S., Oka H., Mabuchi A. Epidemiology of lumbar osteoporosis and osteoarthritis and their causal relationship — is osteoarthritis a predictor for osteoporosis or vice versa? / N. Yoshimura, S. Muraki, H. Oka, A. Mabuchi // Osteoporos. Int. — 2009. — Vol. 20, № 6. — P. 999-1008.
Часть 3
1. Синяченко О.В. Металлы при остеоартрозе — Донецк: Норд-Пресс, 2008. — 404 с.
2. Claudepierre P. Psoriatic arthritis / P. Claudepierre, M. Bagot // Ann. Dermatol. Venereol. — 2008. — Vol. 135, suppl. 4. — P. 263-268.
3. De Vlam K. Update in treatment options for psoriatic arthritis / K. De Vlam, R.J. Lories // Expert. Rev. Clin. Immunol. — 2009. — Vol. 5, № 6. — P. 779-788.
4. Diamanti A.P. Reversion of resistance to immunosuppressive agents in three patients with psoriatic arthritis by cyclosporine A: modulation of P-glycoprotein function / A.P. Diamanti, M. Rosado, V. Germano, M. Scarsella // Clin. Immunol. — 2011. — Vol. 138, № 1. — P. 9-13.
5. Gisondi P. Metabolic comorbidities and psoriasis / P. Gisondi, A. Ferrazzi, G. Girolomoni // Acta Dermatovenerol. Croat. — 2010. — Vol. 18, № 4. — P. 297-304.
6. Glintborg B. Treatment response, drug survival and predictors thereof in 764 patients with psoriatic arthritis treated with anti-tumor necrosis factor α therapy: Results from the Danish nationwide DANBIO registry / B. Glintborg, M. Ostergaard, L. Dreyer, N.S. Krogh // Arthritis Rheum. — 2010. — Vol. 27, № 10. — P. 85-88.
7. Grubl A. Serum aluminium and cobalt levels after ceramic-on-ceramic and metal-on-metal total hip replacement / A. Grubl, M. Weissinger, W. Brodner // J. Bone Joint Surg. Br. — 2006. — Vol. 88, № 8. — P. 1003-1005.
8. Heraud F. Copper modulation of extracellular matrix synthesis by human articular chondrocytes / F. Heraud, C. Savineau, M.F. Harmand // Scand. J. Rheumatol. — 2009. — Vol. 31, № 5. — P. 279-284.
9. Hirota K. Nutrition-related bone disease / K. Hirota, T. Hirota // Nippon Rinsho. — 2006. — Vol. 64, № 9. — P. 1707-1711.
10. Homer D. Providing patients with information about disease-modifying anti-rheumatic drugs: Individually or in groups? A pilot randomized controlled trial comparing adherence and satisfaction / D. Homer, P. Nightingale, P. Jobanputra // Musculoskeletal Care. — 2009. — Vol. 7, № 2. — P. 78-92.
11. Krachler M. Clinical laboratory parameters in osteoarthritic knee-joint effusions correlated to trace element concentrations / M. Krachler, W. Domej // Biol. Trace Elem. Res. — 2011. — Vol. 79, № 2. — P. 139-148.
12. Kuhn A. Use of methotrexate in patients with psoriasis / A. Kuhn, V. Ruland, N. Patsinakidis, T.A. Luger // Clin. Exp. Rheumatol. — 2010. — Vol. 28, № 5, suppl. 61. — P. 138-144.
13. Laws P.M. Ustekinumab for the treatment of psoriasis / P.M. Laws, R.B. Warren // Expert. Rev. Clin. Immunol. — 2011. — Vol. 7, № 2. — P. 155-164.
14. Menter A. Guidelines of care for the management and treatment of psoriasis with traditional systemic agents / A. Menter, N.J. Korman, C.A. Elmets, S.R. Feldman // J. Am. Acad. Dermatol. — 2009. — Vol. 61, № 3. — P. 451-485.
15. Mrowietz U. The importance of disease associations and concomitant therapy for the long-term management of psoriasis patients / U. Mrowietz, J.T. Elder, J. Barker // Arch. Dermatol. Res. — 2006. — Vol. 298, № 7. — P. 309-319.
16. Murdaca G. Adalimumab for the treatment of immune-mediated diseases: An update on old and recent indications / G. Murdaca, B.M. Colombo, F. Puppo // Drugs Today. — 2011. — Vol. 47, № 1. — P. 277-288.
17. Sharma A. Management of psoriatic arthritis / A. Sharma, S. Dogra // Indian J. Dermatol. Venereol. Leprol. — 2010. — Vol. 76, № 6. — P. 645-651.
18. Zhang G.L. A clinical study of leflunomide and methotrexate therapy in psoriatic arthritis / G.L. Zhang, F. Huang, J.L. Zhang, X.F. Li // Zhonghua Nei Ke Za Zhi. — 2009. — Vol. 48, № 7. — P. 570-574.