Журнал «Боль. Суставы. Позвоночник» 2 (02) 2011
Вернуться к номеру
Програмування схильності до остеопорозу у ранньому онтогенезі
Авторы: Поворознюк В.В., Вайсерман О.М., Мєхова Л.В., Поворознюк Вас.В., Дзерович Н.І., ДУ «Інститут геронтології АМН України», м. Київ
Рубрики: Семейная медицина/Терапия, Ревматология, Травматология и ортопедия, Неврология
Версия для печати

Традиційно геронтологічні дослідження зосереджені на пізніх етапах життя при практично повному ігноруванні процесів, пов’язаних із розвитком організму. Нещодавно, однак, ситуація радикально змінилася. Були запропоновані декілька нових гіпотез старіння, що припускають важливість перебігу ранніх етапів розвитку у визначенні потенціалу здоров’я та тривалості життя [11, 13, 34]. Зокрема виявлено, що організми різних видів можуть реалізовувати різні адаптаційні стратегії відповідно до особливостей оточення, в якому вони, згідно з «перинатальними очікуваннями», будуть жити. Відомий етолог Патрік Бейтсон у своїх працях наводить приклад коників, які живуть у східно-африканській савані [7]. У нормі ці коники зелені. Але якщо вони вилуплюються з кладки яєць, які залишаються живими під час пожежі, то мають чорний колір. Це дозволяє комахам уникати загибелі, тому що, якби вони залишалися зеленими, їх могли би легко побачити на чорному ґрунті птахи. А їхні нащадки, які з’являються на світ після пожежі, коли трава у савані відростає, знову мають зелений колір. Отже, генетично ідентичні особини можуть бути фенотипічно дуже відмінні залежно від того, які сигнали оточення вони отримують протягом розвитку, і ці відмінності: 1) мають адаптивне значення і 2) визначаються епігенетичними змінами, що індуковані цими сигналами. У сучасній літературі такий різновид адаптації називають прогностичним адаптивим відгуком (predictive adaptive response) [29]. Часто ці стратегії залежать від певних нейрогуморальних реплік, завдяки яким ембріон, опосередковано через материнський організм, отримує інформацію щодо актуального оточення. У випадку відповідності умов оточення після народження таким, що очікувалися «перинатально», організм отримує додаткові переваги щодо виживання. Якщо ж ці умови не відповідають таким, що очікувалися, це може йому шкодити, наприклад, спричиняти певні захворювання (зокрема, кардіоваскулярні та метаболічні розлади) на пізніх етапах життя [8].
Багато авторів припускають, що подібні ефекти залежать від подій, що відбуваються на епігенетичному рівні [17, 19, 35]. Епігенетика вивчає спадкові зміни в фенотипі або в експресії генів, що викликані іншими механізмами, ніж зміни послідовності нуклеотидів ДНК. Такі зміни можуть залишатися видимими протягом декількох клітинних поколінь чи навіть кількох поколінь живих організмів. Усе нове — це давно забуте старе. Епігенетика — це нове звучання старих ідей, які висловлювалися ще у XVIII столітті. «Якщо орган часто використовується, він розвивається. Якщо орган не використовується, він поступово відмирає» (Жан Батіст Ламарк, XVIII ст.). Наразі, в XXI сторіччі, епігенетика стверджує: якщо ген актуальний — він працює, якщо ні — він вимикається і не працює.

Якщо орган часто використовується, він розвивається. Якщо орган не використовується, він поступово відмирає.
Жан-Батіст ЛАМАРК
До епігенетичних процесів належать зміни активності (експресії) генів (спричинені метилюванням/деметилюванням ДНК, модифікацією гістонів хроматину тощо), що не супроводжуються змінами структури ДНК (рис. 1). Ці процеси відіграють ключову роль у розвитку [15]. Виявлено, що вони є вкрай чутливими до факторів оточення, особливо на «сенситивних» стадіях розвитку, коли клітини організму ще не завершили процес диференціювання та спеціалізації [24, 28].
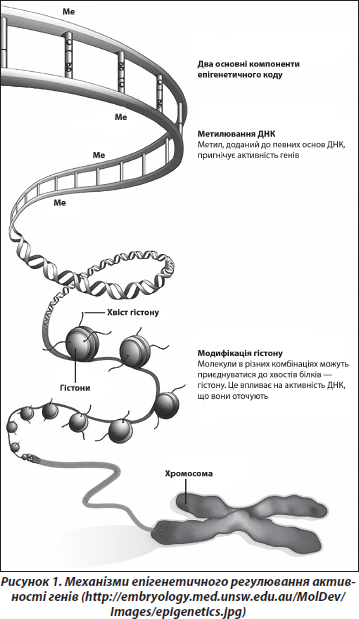
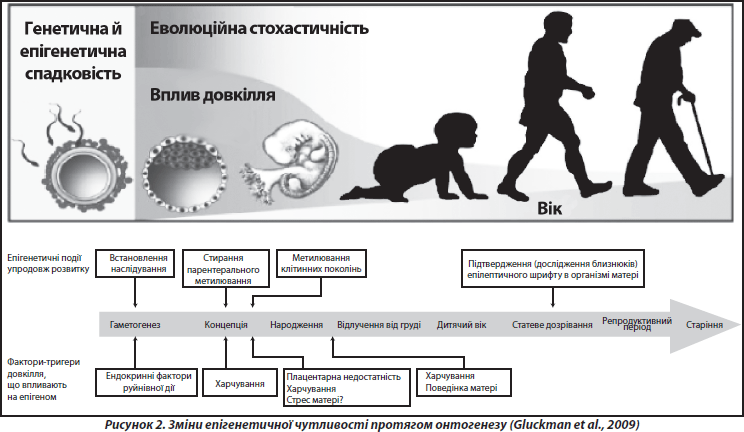
У багатьох дослідженнях показано, що основна частина всіх епігенетичних подій відбувається під час ранніх етапів індивідуального розвитку, починаючи з переконцептуального періоду і до періоду грудного вигодовування (рис. 2). Епігенетичні зміни, індуковані певними впливами (наприклад, стресами) у ранньому онтогенезі, можуть відтворюватись у ряді клітинних поколінь протягом тривалого часу, інколи навіть протягом усього життя організму [37]. Епігенетичні механізми також визначають різні аспекти старіння, зокрема етіологію та патогенез пов’язаних із віком хвороб, що є невід’ємною частиною процесу «нормального» старіння [20, 30].
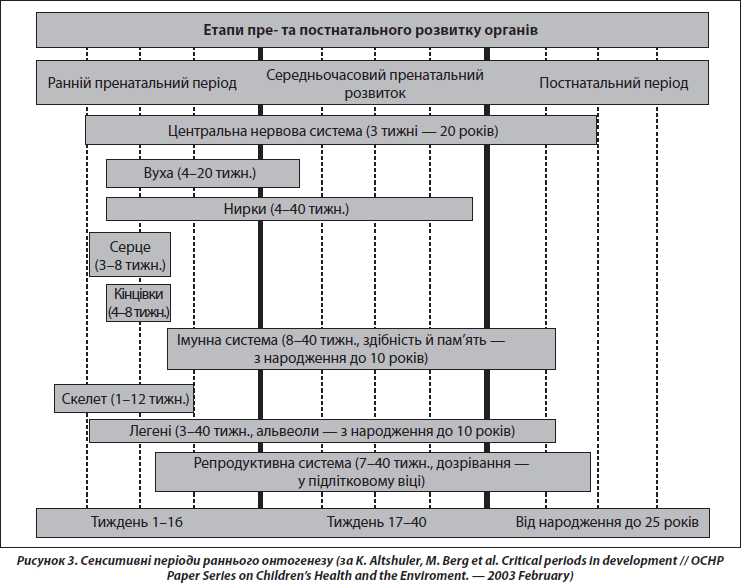
Принциповою в розумінні феномену раннього програмування є концепція сенситивних періодів розвитку — етапів онтогенезу, під час яких дія несприятливих факторів здатна стійко й необоротно впливати на структуру та особливості функціонування органів та систем. Накопичені знання щодо критичних періодів розвитку поступово сформувалися в теорію завдяки, головним чином, працям видатного радянського ембріолога П.Г. Свєтлова [2]. Згідно з цією теорією, у ссавців критичні періоди збігаються з періодами імплантації та плацентації (рис. 3). Перший критичний період у людини припадає на кінець 1-го — початок 2-го тижня вагітності. Вплив шкідливих факторів у цей час в основному призводить до загибелі зародка. Другий період охоплює 6-й тиждень, коли аналогічний вплив призводить до вроджених вад, часто несумісних із життям. Отже, під час критичних періодів розвитку під впливом факторів зовнішнього середовища морфологічні аномалії розвитку є специфічними за часом впливу й виникають незалежно від природи діючого агента. Особливості фетального періоду внутрішньоутробного розвитку характеризуються тим, що впливи факторів навколишнього середовища в цей час мають переважно модулюючий ефект, спричиняючи адаптивні зміни в організмі, що готують його до життя поза материнським організмом. Для кісткової системи періодом найбільш інтенсивного росту, а отже, сенситивним періодом є третій триместр вагітності [33].
Основним методом епідеміологічних досліджень, що присвячені вивченню процесу раннього програмування, є аналіз довгострокових наслідків впливу дії «природних експериментів» упродовж пренатального та раннього постнатального періодів розвитку. До «природних експериментів», зазвичай, зараховують періоди соціальних та природних катаклізмів, таких як війни, революції, посухи, епідемії тощо. Дуже зручним постійно діючим природним експериментом є сезонна зміна дії чинників довкілля. Для України використання сезону народження як індикатора умов раннього розвитку є виправданим, оскільки завдяки географічному положенню маємо достатньо контрастну зміну впливу сезонних факторів упродовж року. Таким чином, люди, що народжуються в різні сезони року, мають різні умови пренатального та раннього постнатального періоду. Описана сезонна різниця в наш час частково нівелюється завдяки сучасним технологіям зберігання продуктів харчування. Але період народження людей у дослідженій нами вибірці припадає на час, коли люди набагато більше залежали від сезонних впливів. У світовій літературі є праці, що свідчать про сезонність народження людей, у подальшому схильних до захворювання на остеопороз (ОП), але такі роботи поодинокі [22]. Зокрема, епідеміологічне дослідження, проведене в Кореї, засвідчило, що діти, народжені взимку, мають нижчий рівень щільності кісткової маси порівняно з народженими в літні місяці [25]. Дослідження сезонності народження хворих на ОП в Україні проведене вперше.
Матеріали і методи
У дослідженні використані дані Українського науково-медичного центру проблем остеопорозу. Для аналізу відібрано дані щодо дати народження, статі осіб, у яких був встановлений стан остеопенії (доклінічна стадія ОП) або ОП та які народилися в 1930–1959 рр. в Україні.
Дефіцит мінеральної щільності кісткової тканини визначався за допомогою двохенергетичної рентгенівської абсорбціометрії (DEXA), що дозволяє вимірювати вміст кісткового мінералу в будь-якій ділянці скелету і визначати Т-критерій. За Т-критерієм оцінювалася вираженість остеопенії або ОП за рекомендаціями ВООЗ (показник остеопенії: –2,5 Ј T Ј –1,0; остеопорозу: Т < –2,5).
Досліджувана вибірка включала 4365 осіб, з них 522 чоловіки і 3843 жінки. Як референтний стандарт використані деперсоніфіковані дані Всеукраїнського перепису населення 2001 року, надані для аналізу Держкомстатом України по 5 областях України, що представляють всі її регіони (Північний — Чернігівська, Південний — Херсонська, Східний — Харківська, Західний — Рівненська та Центральний — Вінницька). Референтна популяція включала 2 962 195 осіб, із них 1 303 725 чоловіків і 1 658 470 жінок, які народилися у відповідних областях у 1930–1959 рр. Сезонність народжуваності в порівнюваних популяціях визначали за допомогою стандартного методу конструювання псевдокогорт (обчислення кількості осіб, народжених у кожну пору року протягом усього досліджуваного періоду). Для визначення того, чи існують сезонні відхилення у народженні людей, які мають остеопороз, порівняно з контрольними групами, порівнювали емпіричні (Е) та теоретичні (Т) розподіли частот за сезонами народження.
Теоретичні частоти (Т) у кожній з груп були розраховані за допомогою формули:
Т = α х β/δ,
де α — кількість осіб, народжених протягом певного сезону року в референтній популяції;
β — загальна кількість хворих осіб;
δ — загальна кількість осіб у референтній популяції.
Відхилення (ВІДХ) емпіричних частот від відповідних теоретичних частот визначали за допомогою формули:
ВІДХ = (Е/Т – 1) х 100 %.
Для порівняння емпіричних (Е) та теоретичних (Т) розподілів частот народження в різні сезони року в групах хворих осіб та відповідних референтних групах був використаний критерій χ2.
Відношення шансів поширеності (ВШП, prevalence odds ratio) було розраховано як відношення числа пацієнтів з ОП, включених у регістр, до числа людей без ОП у когортах з різними сезонами народження:
ВШП = (a/b)/(c/d),
де a — кількість людей, що захворіли на ОП, у когорті осіб, що народилися восени (група порівняння);
b — кількість людей, які не захворіли на ОП, у когорті осіб, які народилися восени (група порівняння);
c — кількість людей, які захворіли на ОП, у когорті осіб, які народилися в будь-який інший сезон, крім осені;
d — кількість людей, які не захворіли на ОП, у когорті осіб, які народилися в будь-який інший сезон, крім осені.
Для оцінки вірогідності ВШП використаний двосторонній критерій Фішера. Всі розрахунки здійснені за допомогою статистичного пакета Statistica 6.0.
Результати та їх обговорення
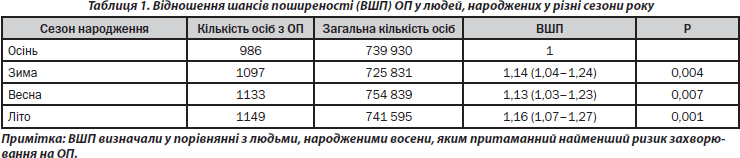
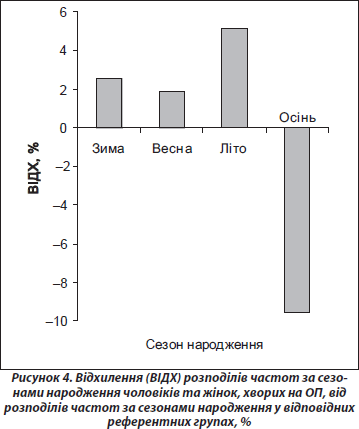
Поширеність ОП у людей, народжених узимку, навесні та влітку, у представленому дослідженні практично не відрізнялася (рис. 4). У той самий час поширеність ОП в осіб, народжених восени, виявилася вірогідно нижчою, ніж в осіб, народжених протягом інших трьох сезонів року (табл. 1). Як видно з табл. 1, люди, народжені протягом цих сезонів року, мають більш високі шанси захворювання на ОП (взимку — на 14 %, весною — на 13 % і влітку — на 16 %), ніж особи, народжені восени. Можна припустити, що така ситуація пов’язана з сезонними особливостями факторів навколишнього середовища, що мають безпосередній вплив на функціональний стан: якісний та кількісний склад продуктів харчування, наявність вітамінів, режим освітлення, температура повітря та ін. Низький рівень поширеності ОП в осіб, народжених восени, може пояснюватися тим, що критичний період розвитку кісткової системи організму (третій триместр вагітності) припадає у цих людей на літо. Цей період року є найбільш сприятливим як щодо режиму харчування (особливо споживання вітамінів), так і у зв’язку з можливістю напрацювання максимально великої кількості необхідного для нормального розвитку кісток вітаміну D, оскільки він характеризується найвищим рівнем ультрафіолетового сонячного опромінення та великою тривалістю світлового дня.
Непрямим підтвердженням наших результатів є свідчення ізраїльських дослідників, що на територіях із контрастними сезонними змінами люди з найменшою масою частіше народжуються влітку [12]. Мала маса при народженні є індикатором внутрішньоутробного неблагополуччя, а за нашими даними, саме у людей, народжених улітку, найвища схильність до остеопорозу, оскільки найбільша частина внутрішньоутробного розвитку у них проходить на тлі нестачі вітамінів та сонячного світла. Ці дані відповідають концепції раннього програмування, що стосуються аліментарного дефіциту [7]: дефіцит харчування на ранніх етапах онтогенезу має необоротні наслідки для плоду; порушення харчування залежно від періоду онтогенезу, на який він припадає, має неоднакові наслідки; організм у період інтенсивного росту є найбільш чутливим до аліментарного дефіциту; перманентні ефекти порушення харчування можуть проявлятися зниженням загальної кількості клітин, порушенням структури органів та зміною гормональних співвідношень.
Підтверджують ці положення експериментальні дані, які показують, що найбільш виражені зміни в гормональній забезпеченості плода відбуваються у відповідь на варіації стану його харчування, особливо в пізній гестації, коли функціонує вся ендокринна система плода [3]. Відомо, що при погіршенні харчування плода в його внутрішньому середовищі знижується концентрація анаболічних гормонів (інсулін, інсуліноподібний фактор росту — IПФР, соматотропний гормон росту — СТГ, тироксин) та підвищується вміст катаболічних гормонів (кортизол, катехоламіни) [16].
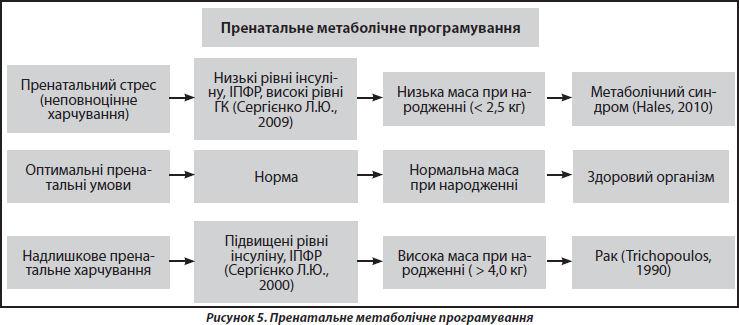
Інсулін — це типовий анаболічний гормон плода. Концентрація інсуліну позитивно співвідноситься з рівнем глюкози в крові — при підвищенні останньої рівень гормону зростає і, навпаки, знижується, коли в організм плода надходить менше глюкози. Таким чином, від рівня глюкози в крові плода, а отже, й матері, залежить подальша морфологічна та функціональна потужність (уразливість) цієї ланки ендокринної системи в постнатальний період. Отже, будь-які фактори, що можуть спричинити внутрішньоутробний дефіцит глюкози (стрес, недостатнє харчування матері або плацентарна недостатність), можуть також призводити до зменшеної кількості та функціональної здатності b-клітин у підшлунковій залозі плода, що, в свою чергу, приводить до зменшення адаптивних можливостей у функціонуванні цього органу в подальшому постнатальному житті; це стає особливо очевидним, якщо взяти до уваги, що основний пул клітин острівців Лангерганса підшлункової залози формується антенатально [26]. У свою чергу, низький рівень секреції інсуліну пригнічує синтез інсуліноподібного фактора росту. Саме система ІПФР вважається найбільш важливим ендокринним чинником регуляції росту плода. Представники цієї системи визначаються в багатьох тканинах плода, починаючи з першого триместру вагітності їх концентрація в циркуляції плода постійно зростає впродовж внутрішньоутробного розвитку [21]. ІПФР є найважливішим ендокринним посередником дії соматотропного гормону — у периферичних тканинах саме він забезпечує практично всі фізіологічні ефекти СТГ. Сьогодні вважається, що біологічна дія СТГ повною мірою проявляється після народження. Зокрема, СТГ має глибокий вплив на кістковий метаболізм. Так, показано, що у великого відсотка пацієнтів з ідіопатичним остеопорозом спостерігаються зниження вікових піків СТГ та низька концентрація ІПФР [18]. Вважають, що причиною вищезазначеного є резистентність тканин до СТГ на тлі антенатально сформованої нестачі ІПФР [18]. У той час, як інсулін, СТГ, ІПФР відіграють роль анаболіків в організмі плода і сприяють росту його клітин, глюкокортикоїди (ГК) виступають як регулятори функціонального дозрівання тканин та адаптації плода до умов існування як in utero, так і після народження. Адаптаційна роль ГК, як і інших стероїдів, пов’язана з тим, що для них притаманні пролонговані організуючі ефекти, тобто здатність викликати під час критичних періодів розвитку такі внутрішні зміни в таргетних клітинах, тканинах, органах та системах, що практично не піддаються дії подальших маніпуляцій з цими гормонами. Тому на сьогодні вважається, що серед гормонів, які контролюють розвиток плода, ГК є найбільш значущими для програмування in utero фенотипових ознак організму до та після його народження [9]. У багатьох дослідженнях показано, що підвищений пренатальний рівень ГК призводить до більш високої, ніж у нормі, базальної секреції ГК й зниженої секреції у відповідь на стрес у постнатальному періоді [3]. Вітчизняні дослідники у багаторічних експериментах, виконаних на нащадках самиць щурів, стресованих під час вагітності, отримали дані, які свідчать про те, що соціально-емоційний стрес у цей період формує підвищений рівень функціонування гіпоталамо-гіпофізарно-адреналової системи у їх нащадків, проявом чого є стійкий гіперкортицизм на тлі зниження рівня статевих гормонів, гіперінсулінемії та гіперглікемії. Було показано, що нащадки стресованих матерів мають цілий комплекс ендокринних зрушень у постнатальному житті, у них має місце відхилення в системі кальційрегулюючих гормонів, що призводить до порушень остеогенезу та ремоделювання кісткової тканини. Повторні стресування таких нащадків зумовлюють швидкі та виражені втрати щільності кісткової тканини, і, як наслідок, розвивається ОП [3]. У дослідженнях, проведених в Австралії та Великобританії, був простежений взаємозв’язок маси тіла при народженні з рівнем кортизолу в плазмі крові [27]. Було продемонстровано, що народження з низькою масою тіла пов’язане з підвищенням рівня кортизолу плазми натще в жителів усіх обраних регіонів. Статистичний аналіз продемонстрував зниження рівня кортизолу на 23,9 нмоль/л на кожний кілограм збільшення маси тіла при народженні. Вищевикладені та багато інших фактів сприяли формуванню концепції пренатального метаболічного програмування, основні сценарії якої проілюстровані на рис. 5.
У контексті результатів нашої роботи цікавим є факт, що чутливість до пренатального програмування кортикостероїдами має значні статеві відмінності: показано, що нащадки-самиці з тих самих приплодів демонструють високий базальний рівень адренокортикотропного гормону та кортизолу і значне зростання цих показників після додаткового стресування порівняно з самцями-нащадками [1]. Цікавим є той факт, що самці-нащадки стресованих матерів звикають до дії повторних стресів, а самиці-нащадки — ні. Статеві відмінності стрес-реактивності нащадків стресованих матерів можуть бути зумовлені тим, що через плаценти ембріонів-самиць проходить більше глюкокортикоїдів, ніж через плаценти ембріонів-самців [23]. Можливий біологічний сенс надлишкової обробки плодів жіночої статі материнськими ГК полягає в необхідності формування в самиці-нащадка такої моделі поведінки, що допоможе їй зберегти щурят у несприятливому навколишньому середовищі. Ці дані якоюсь мірою можуть пояснити семиразове перевищення кількості жінок у групі осіб, які мають знижені рівні мінеральної щільності кісток, оскільки підвищений рівень ГК, як було показано, є фактором ризику для розвитку остеопорозу. Цікавим є також дослідження італійських учених щодо віку настання менопаузи: продемонстровано, що у жінок, які народилися восени, на відміну від народжених навесні, менопауза настає на 2 роки пізніше. Серед імовірних причин цього автори називають сезонні зміни у рівні сонячного освітлення та температури довкілля, зміни в дієті й кількість інфекцій, сезонні коливання рівня секреції гормону мелатоніну під час внутрішньоутробного розвитку, що могло вплинути на формування резерву яйцеклітин [10]. А як відомо, одним із доведених факторів ризику остеопорозу в жінок є рання менопауза. Отже, «осінні» жінки мають менше шансів захворіти на остеопороз, що підтверджується й результатами нашого дослідження.
Як було відмічено, серед найважливіших факторів навколишнього середовища, що беруть участь у процесах раннього програмування та мають чіткі сезонні відмінності, називають інтенсивність і тривалість інсоляції. Так, показано, що від рівня вітаміну D під час ранніх етапів онтогенезу залежить схильність до розвитку ОП [36]. Вітамін D і його активні метаболіти відіграють важливу роль у регуляції кальцієвого гомеостазу [4, 5]. Однією з функцій вітаміну D є абсорбція кальцію в шлунково-кишковому тракті, інтенсивність якої під час третього триместру внутрішньоутробного розвитку збільшується вдвічі [32]. Важливість достатньої кількості вітаміну D у період вагітності для повноцінного формування мінеральної щільності кісткової маси в дитини доведена в багатьох епідеміологічних [36] та експериментальних [14] дослідженнях. Необхідною умовою для синтезу вітаміну D є наявність достатньої кількості ультрафіолетового випромінювання. Показано, що існує тісний зв’язок між рівнем ультрафіолетового випромінювання в третьому триместрі вагітності (період інтенсивного росту скелета) та станом кісткової тканини після народження [31].
Не є винятком, що розвиток ідеї раннього програмування може згодом призвести до певних практичних наслідків. Якщо епігенетична адаптація дійсно є ключовим механізмом програмування довговічності, то певні цілеспрямовані втручання протягом сенситивних стадій раннього розвитку могли б дозволити досягати оптимального балансу активації/репресії різних генів. Підбити підсумок вищесказаному можна словами відомого німецького вченого-ендокринолога Г. Дорнера: «Мільйони людей є розумово, емоційно та фізично неповноцінними і навіть інвалідами та/або передчасно вмирають від розладів здоров’я чи хвороб, які пов’язані з порушенням процесів розвитку».
1. Науменко Е.В., Дыгало Н.Н., Маслова Л.П. Длительная модификация стрессорной реактивности воздействия в пренатальном онтогенезе // Онтогенетические и генетико-эволюционные аспекты нейроэндокринной регуляции стресса. — Новосибирск: Наука, 1990. — С. 28-40.
2. Светлов П.Г. Теория критических периодов развития и ее значение для понимания принципов действия среды на онтогенез // Вопр. цитологии и общей физиологии. — М.: Изд-во АН СССР, 1966. — С. 263-274.
3. Сергієнко Л.Ю. Аберації гормональної забезпеченості плода — причина ендокринних та гормональнозалежних хвороб у дорослому віці: проблеми ендокринної патології // Медичний науково-практичний журнал. — 2009. — № 4. — С. 42-56.
4. Поворознюк В.В. Кальцій та вітамін D у профілактиці та лікуванні остеопорозу // Здоров’я України. — 2002. — С. 5-8.
5. Поворознюк В.В. Остеопороз: фактори ризику, класифікація, лікування // Нова медицина. — 2002. — № 5. — С. 38-41.
6. Поворознюк В.В., Григорьева Н.В., Григоров Ю.Г. Фактическое питание и метаболизм костной ткани // Остеопороз: Эпидемиология, клиника, діагностика, профілактика и лечение. — Харьков: Золотые страницы, 2002. — С. 410-424.
7. Bateson P. Fetal experience and good adult design // Int. J. Epidemiol. — 2001. — Vol. 30. — P. 928-934.
8. Bateson P., Barker D., Clutton-Brock T. et al. Developmental plasticity and human health // Nature. — 2004. — 430. — P. 419-421.
9. Bertram C.E., Hanson M.A. Prenatal programming of postnatal endocrine responses by glucocorticoids // Reproduction. — 2002. — Vol. 124. — P. 459-467.
10. Cagnacci Angelo. Birth date influences menopause. Medafarm.ru
11. Chen J.H., Cottrell E.C., Ozanne S.E. Early growth and ageing // Nestle Nutr. Workshop Ser Pediatr Program. — 2010. — Vol. 65. — P. 41-50.
12. Chodick G., Flash S., Deoitch Y., Shavel V. Seosanality in birth weight: review of global patterns and potential causes // Hum. Biol. — 2009. — Vol. 81. — P. 463-77.
13. Fernandez-Capetillo O. Intrauterine programming of ageing // EMBO Rep. — 2010. — 11. — P. 32-36.
14. Finch S.L., Rauch F., Weiler H.A. Postnatal vitamin D supplementation following maternal dietary vitamin D deficiency does not affect bone mass in weanling guinea pigs // J. Nutr. — 2010. — Vol. 140. — P. 1574-1581.
15. Gan Q., Yoshida T., McDonald O.G., Owens G.K. Epigenetic mechanisms contribute to pluripotency and cell lineage determination of embryonic stem cells // Stem Cells. — 2007. — Vol. 25. — P. 2-9.
16. Gicquel C., Le Bouc Y. Hormonal regulation of fetal growth // Hormone Res. — 2006. — Vol. 65 (Suppl. 3). — P. 28-33.
17. Gluckman P.D., Hanson M.A., Low F.M. The role of developmental plasticity and epigenetics in human health // Birth Defects Res. C. Embryo Today. — 2011. — Vol. 93. — P. 12-8.
18. Gуmez J.M., Gуmez N., Fiter J., Soler J. Effects of long-term treatment with GH in the bone mineral density of adults with hypopituitarism and GH deficiency and after discontinuation of GH replacement // Horm. Metabol. Res. — 2000. — Vol. 32, № 2. — P. 66-70.
19. Gravina S., Vijg J. Epigenetic factors in aging and longevity // Pflugers Arch. — 2010. — Vol. 459. — P. 247-258.
20. Hochberg Z., Feil R., Constancia M. et al. Child health, developmental plasticity, and epigenetic programming // Endocr. Rev. — 2011. — Vol. 32. — P. 159-224.
21. Kim Y.J., Felig P. Plasma chorionic somatomammotropin levels during starvation in midpregnancy // J. Clin. Endocrinol. Metabol. — 1971. — Vol. 32, № 6. — P. 864-867.
22. Lanham S.A., Roberts C., Cooper C. Intrauterine programming of bone. Part 1: alteration of the osteogenic environment // Osteoporos Int. — 2008. — Vol. 19. — P. 147-156.
23. McCormick C.M., Smythe J.W., Sharma Sh., Meaney M.J. Meaney Sex-specific effects of prenatal stress on hypothalamic-pituitary-adrenal responses to stress and brain glucocorticoid receptor density in adult rats // Develop. Brain Res. — 1995. — Vol. 84, № 1. — P. 55-61.
24. Morgan H.D., Santos F., Green K. et al. Epigenetic reprogramming in mammals // Hum. Mol. Genet. — 2005. — 14. — P. 47-58.
25. Namgung R., Tsang R.C., Lee Ch. et al. Low total body bone mineral content and high bone resorption in Korean winter-born versus summer-born newborn infants // J. Pediatr. — 1998. — Vol. 132. — P. 421-425.
26. Petrik J., Reusens B., Arany E. et al. A low protein diet alters the balance of islet cell replication and apoptosis in the fetal and neonatal rat and is associated with a reduced pancreatic expression of insulin-like growth factor-II // Endocrinology. — 1999. — Vol. 140. — P. 4861-4873.
27. Phillips D.I., Walker B.R., Reynolds R.M. et al. Low birth weight predicts elevated plasma cortisol concentrations in adults from 3 populations // Hypertension. — 2000. — Vol. 35. — P. 1301-1310.
28. Reik W., Santos F., Dean W. Mammalian epigenomics: reprogramming the genome for development and therapy // Theriogenology. — 2003. — 59. — P. 21-32.
29. Rickard I.J., Lummaa V. The Predictive Adaptive Response and metabolic syndrome: Challenges for the hypothesis // Trends Endocr. Metab. — 2007. — 18. — P. 94-99.
30. Rodrнguez-Rodero S., Fernбndez-Morera J.L., Fernandez A.F. et al. Epigenetic regulation of aging // Discov. Med. — 2010. — Vol. 10. — P. 225-233.
31. Sayers A., Tilling K., Boucher B. et al. Predicting ambient ultraviolet from routine meteorological data; its potential use as an instrumental variable for vitamin D status in pregnancy in a longitudinal birth cohort in the UK // Int. J. Epidemiol. — 2009. — Vol. 38, № 6. — P. 1681-1688.
32. Specker B. L. Vitamin D requirements during pregnancy // Am. J. Clin. Nutr. — 2004. — Vol. 80. — P. 1740-1747.
33. Steer C.D., Tobias J.H. Insights into the programming of bone development from the Avon Longitudinal Study of Parents and Children (ALSPAC) // Am. J. Clin. Nutr. — 2011 (in press).
34. Vaiserman A. Early-life origin of adult disease: evidence from natural experiments // Exp. Gerontol. — 2011. — Vol. 46. — P. 189-192.
35. Vaiserman A.M., Voitenko V.P., Mechova L.V. Epigenetic epidemiology of age-related diseases // Ontogenez. — 2011. — Vol. 42. — P. 30-50.
36. Viljakainen H. T., Saarnio E., Hytinantti T. et al. Maternal Vitamin D status determines bone variables in the newborn // J. Clin. Endocrinol. Metab. — 2010. — Vol. 95, №4. — P. 1749-1757.
37. Waterland R.A., Jirtle R.A. Early nutrition, epigenetic changes at transposons and imprinted genes, and enhanced susceptibility to adult chronic diseases // Nutrition. — 2004. — 20. — P. 63-68.