Журнал «» 4(18) 2011
Вернуться к номеру
Вплив прямого інгібітора реніну аліскірену на стан інсулінорезистентності в пацієнтів із метаболічним синдромом та артеріальною гіпертензією
Авторы: Сіренко Ю.М., Рековець О.Л., Савицький С.Ю, Павлюк Є.А., Міхеєва К.В., Доброход А.С., ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» АМН України, м. Київ
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
Метою нашого дослідження було вивчення впливу аліскірену та атенололу на вуглеводний і ліпідний обміни в пацієнтів з артеріальною гіпертензією (АГ) та метаболічним синдромом (МС). У дослідження було включено 64 пацієнти з м’якою та помірною АГ і ознаками МС згідно з критеріями АТР ІІІ. Усім пацієнтам на початку дослідження після семиденної відміни попередньо призначеної антигіпертензивної терапії та через шість місяців лікування проводили такі дослідження: вимірювання офісного артеріального тиску (АТ), вимірювання маси тіла та зросту, вимірювання окружностей талії та стегон, добове моніторування АТ, біохімічний аналіз крові з визначенням ліпідного спектра, 2-годинний пероральний тест визначення толерантності до глюкози. Залежно від лікування всі пацієнти були розподілені на дві групи: у першу групу увійшли 36 пацієнтів (23 жінки та 13 чоловіків), які отримували атенолол у дозі 50–100 мг/добу. У другу групу ввійшли 28 пацієнтів (9 жінок, 19 чоловіків), які отримували аліскірен у дозі 150–300 мг/добу. Якщо до кінця першого місяці прийому не досягався цільовий рівень АТ (< 140/90 мм рт.ст.), то до терапії додавали гідрохлортіазид у добовій дозі 12,5 мг/добу. Період спостереження становив 6 місяців.
Результати. На фоні еквівалентного ефективного контролю артеріального тиску тривале лікування атенололом достовірно погіршувало інсулінорезистентність, що проявилось у збільшенні індексу НОМА на 78,2 % (р < 0,05). На фоні лікування аліскіреном інсулінорезистентність зменшувалася, індекс НОМА знизився на 14,5 % (р > 0,05).
Висновок. Аліскірен може бути використаний як метаболічно нейтральний препарат у пацієнтів із м’якою та помірною артеріальною гіпертензією та клінічними ознаками метаболічного синдрому без цукрового діабету з проявами інсулінорезистентності. Метаболічна нейтральність зберігається навіть при призначенні гідрохлортіазиду. Призначення атенололу небажане у пацієнтів з артеріальною гіпертензією та клінічними ознаками метаболічного синдрому без цукрового діабету, незалежно від наявності чи відсутності в них проявів інсулінорезистентності, оскільки сприяє розвитку нових випадків цукрового діабету. Особливо небажане його поєднання з тіазидними діуретиками.
Серцево-судинні захворювання (ССЗ) є безпосередньою причиною смерті в 65–75 % хворих на цукровий діабет (ЦД) 2-го типу [2, 3, 5]. На сьогодні не викликає сумнівів, що метаболічний синдром (МС) є одним з основних факторів ризику розвитку ССЗ: інсульту, ішемічної хвороби серця (ІХС), інфаркту міокарда (ІМ), серцевої недостатності [21, 27, 28]. Збільшення рівня глюкози натще на 10 % у віці 50 років асоціюється зі збільшенням ризику інфаркту міокарда на 21,7 % після 60 років [29].
У дослідженні Strong Heart Study вивчалася роль інсулінорезистентності (ІР) та МС як незалежних факторів ризику розвитку ССЗ (2283 американських індіанці без ЦД 2-го типу та ІХС). Переконливо доведено, що ІР та МС виступають предикторами ССЗ, але не є незалежними від ЦД та інших факторів ризику ССЗ [13, 15].
Таким чином, ІР та гіперінсулінемія при МС самостійно та/або опосередковано через супутні метаболічні порушення прискорюють розвиток атеросклеротичних судинних захворювань. Отже, активно впливаючи на ІР та гіперінсулінемію при МС можна сповільнити розвиток атеросклеротичних уражень судин та їх наслідки.
Наявність артеріальної гіпертензії (АГ) у хворих із МС обумовлює певні особливості застосування антигіпертензивної терапії, яка забезпечує не тільки корекцію артеріального тиску (АТ), але і впливає на вуглеводний та ліпідний обмін, що сприятиме покращенню перебігу АГ і прогнозу захворювання. Доведено, що на фоні терапії різними АГ-препаратами частота розвитку ЦД може значно відрізнятися. Різні АГ-препарати можуть по-різному впливати на ризик розвитку ССЗ та ускладнень.
За даними проспективних досліджень, тривале постійне застосування антигіпертензивних препаратів, особливо деяких класів (неселективних) бета-адреноблокаторів, тіазидних діуретиків, може прискорити розвиток ЦД 2-го типу [15, 31, 32]. Особливо схильні до цього захворювання пацієнти з початковими метаболічними порушеннями. Виникає небезпека, що зниження ризику розвитку серцево-судинних ускладнень унаслідок антигіпертензивної терапії може збільшити ризик їх виникнення в результаті розвитку ЦД. З огляду на це, однією з основних вимог до препаратів для лікування АГ є їх метаболічна нейтральність.
Дослідження, проведені з препаратами, що блокують активність ренін-ангіотензинової системи (РАС), — інгібіторами ангіотензинперетворюючого ферменту (ІАПФ) і блокаторами рецепторів ангіотензину II, показали не просто їх метаболічну нейтральність, а навіть здатність запобігати або відстрочувати розвиток нових випадків ЦД.
На сьогодні з’явилась нова група препаратів — прямі інгібітори реніну. До них належить аліскірен. Механізм дії аліскірену полягає в пригніченні активності реніну, а також прореніну, що, згідно з сучасними уявленнями, також бере участь у перетворенні ангіотензиногену в ангіотензин I. До того ж ефект цього препарату проявляється за рахунок зв’язування рецепторів реніну на клітинній мембрані. У цьому контексті особливу зацікавленість викликають дані, згідно з якими активність реніну залежить від його зв’язування з рецепторами; у зв’язаному стані можливість утворення ангіотензину I збільшується в 4–5 разів.
Відомо, що активність реніну плазми достовірно впливає на ризик розвитку серцево-судинних захворювань, у тому числі інфаркту міокарда. Тому важливо не тільки блокувати його ефекти, але й контролювати його активність. Якщо розглядати вплив інгібіторів ангіотензинперетворюючого ферменту і сартанів на ренін-ангіотензинову систему, то привертає увагу той факт, що ці препарати за механізмом зворотного зв’язку підвищують концентрацію й активність реніну і прореніну в плазмі.
Вплив аліскірену на стан інсулінорезистентності в людей практично не вивчений. Немає переконливих доказів щодо впливу аліскірену й на ліпідний спектр крові. Тому метою нашого дослідження було вивчення впливу аліскірену на вуглеводний і ліпідний обміни в пацієнтів з АГ та МС.
Матеріали та методи
У дослідження було включено 64 пацієнти з м’якою та помірною АГ і ознаками МС, згідно з критеріями АТР ІІІ [22]. У дослідження не включалися хворі з цукровим діабетом 1-го та 2-го типів, верифікованою симптоматичною артеріальною гіпертензією, клінічними ознаками ішемічної хвороби серця, серцевою недостатністю, рівнем офісного АТ ≥ 180/110 мм рт.ст., декомпенсованими захворюваннями печінки (рівень АЛТ, АСТ вище від норми у 3 рази), гострою або хронічною нирковою недостатністю (рівень креатиніну крові ≥ 133 мкмоль/л для чоловіків і 124 мкмоль/л — для жінок), інфарктом міокарда чи гострим порушенням мозкового кровообігу в анамнезі, вагітністю та лактацією. Таким чином, усі пацієнти мали підвищений АТ у межах 140–179/90–109 мм рт.ст. та не мали цукрового діабету.
Усім пацієнтам на початку дослідження після семиденної відміни попередньо призначеної антигіпертензивної терапії та через шість місяців лікування проводили такі дослідження: вимірювання офісного АТ, вимірювання маси тіла та зросту, вимірювання окружностей талії та стегон, добове моніторування АТ (ДМАТ), біохімічний аналіз крові з визначенням ліпідного спектра, 2-годинний пероральний тест визначення толерантності до глюкози (ПГТТ). Офісне вимірювання систолічного (САТ) та діастолічного (ДАТ) АТ проводили на початку дослідження після семиденної (у разі необхідності) відміни усіх антигіпертензивних препаратів та через шість місяців перед прийомом наступної дози препарату. АТ вимірювали тричі у положенні сидячи з інтервалом 1–2 хвилини за допомогою ртутного сфігмоманометра. Визначали середнє з трьох вимірів. Частоту серцевих скорочень (ЧСС) визначали після другого вимірювання.
Індекс маси тіла обчислювали за формулою:
ІМТ (кг/м2) = маса тіла/(ріст2).
Окружність талії вимірювали горизонтально на рівні пупка, а окружність стегон — на рівні найбільш виступаючої їх частини. Співвідношення окружність талії/окружність стегон більше ніж 0,95 у чоловіків та 0,85 у жінок свідчило про наявність ожиріння за абдомінальним типом [2, 3].
ДМАТ проводили за допомогою апарата «АВРМ-04» (Meditech, Угорщина) за стандартною методикою, закладеною в апаратну програму обробки даних. При цьому вивчали такі показники: середньодобовий (т), денний (д), нічний (н) та максимальний (Макс.) САТ, середньодобовий, денний, нічний та максимальний ДАТ, ЧСС. При комп’ютерному аналізі ДМАТ для САТ і ДАТ розраховували часовий індекс (Час.ін), що характеризує часове перевантаження тиском протягом доби і визначається як відсоток вимірів АТ, що перевищує 140/90 мм рт.ст. удень і 120/80 мм рт.ст. уночі. Також визначали індекс навантаження тиском (Ін.пл), та індекс варіабельності (Ст.від.). Крім того, за допомогою програмного забезпечення вираховували добовий індекс (ДІ) — відсоток зниження нічного АТ порівняно з денним. Моніторування проводили в такому режимі: у денний час — кожні 15 хвилин, уночі (з 22.00 до 6.00) — кожні 30 хвилин. Хворі при проведенні ДМАТ вели звичайний спосіб життя, виконуючи побутові фізичні і психоемоційні навантаження.
2-годинний ПГТТ проводили за стандартною методикою на фоні трьох днів перебування хворого на звичайній дієті (уміст вуглеводів — 250–300 г, але не менше 150 г) та при звичайному фізичному навантаженні [30]. Пробу проводили вранці після нічного голодування та 20–30 хв відпочинку. Під час проведення дослідження паління та нервові стреси виключалися. Кров брали внутрішньовенно до прийому 75 г глюкози, через годину та через дві години після прийому. Визначали рівень глюкози сироватки крові та рівень інсуліну. Рівень інсуліну визначали радіоімунним методом із використанням стандартних ІРМА-наборів (фірма Immunotech, Чехія). Про порушення толерантності до глюкози говорили при виявленні через дві години рівня глюкози понад 7,8, але менше 11,1 ммоль/л. Якщо рівень глюкози перевищував 11,1 ммоль/л, то пацієнту виставлявся діагноз цукрового діабету, якщо це було на початку дослідження, пацієнт виключався з подальшого спостереження. При рівні глюкози натще більше ніж 6,1, але менше 7,0 ммоль/л, а через дві години менше ніж 7,8 ммоль/л, говорили про порушення толерантності до глюкози натще.
Інсулінорезистентність визначали після розрахунку індексу НОМА (гомеостатична модель оцінки інсулінорезистентності) за формулою [5]:
НОМА = (глюкоза натще в ммоль/л) ґ (інсулін натще в мкОД/мл)/22,5.
Оцінку величини індексу НОМА проводили відповідно до міжнародних критеріїв: при величині індексу НОМА 3 і більше вважали, що пацієнт має інсулінорезистентність [28, 33, 37]. Про значне погіршення чутливості тканин до інсуліну говорили, коли індекс НОМА на фоні лікування збільшувався і ставав 3 і більше. Якщо НОМА-індекс і на початку включення в дослідження, і наприкінці дослідження був менше ніж 3, то вважалося, що інсулінорезистентність суттєво не змінилася. Якщо ж на початку включення у дослідження НОМА індекс був 3 і більше, а наприкінці дослідження менше ніж 3, то говорили про значне зменшення інсулінорезистентності.
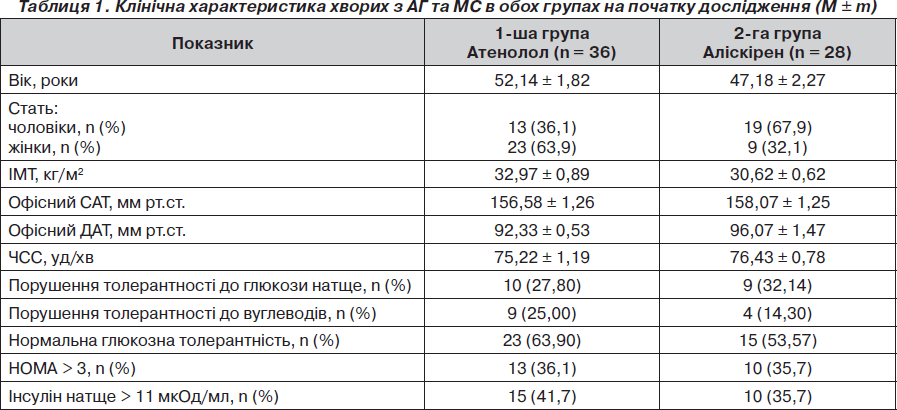
Залежно від лікування всі пацієнти були розподілені на дві групи: у першу групу ввійшли 36 пацієнтів (23 жінки та 13 чоловіків), які отримували атенолол у дозі 50–100 мг/добу, середня доза атенололу в дослідженні становила 77,8 ± 4,2 мг, середній вік хворих 52,14 ± 1,82 року. У другу групу ввійшли 28 пацієнтів (9 жінок, 19 чоловіків), які отримували аліскірен у дозі 150–300 мг/добу, середня доза аліскірену — 241,07 ± 14,36 мг, середній вік хворих — 47,18 ± 2,27 року. Якщо до кінця першого місяця прийому не досягався цільовий рівень АТ (< 140/90 мм рт.ст.), то до терапії додавали гідрохлортіазид у добовій дозі 12,5 мг/добу. Період спостереження становив 6 місяців. Пацієнтам надавали рекомендації щодо зміни способу життя. На період спостереження не призначалися статини, препарати групи глітазонів та метформін, що могли б впливати на інсулінорезистентність.
Статистичну обробку результатів проводили після створення баз даних у системах Microsoft Excel та Access. Середні показники обстежених пацієнтів визначали за допомогою пакета аналізу в системі Microsoft Excel. Усі інші статистичні розрахунки проводили за допомогою програми SPSS 13.0. Достовірність різниці середніх між групами визначалася методом незалежного t-тесту для середніх та з використанням аналізу ANOVA з post-hoc Tukey тестом за допомогою програми SPSS 13.0. Достовірність різниці між показниками на етапах лікування визначалася за допомогою парного двовибіркового тесту. Також проводили кореляційний непараметричний аналіз та регресійний уні- та мультифакторні аналізи.
Результати та їх обговорення
Характеристика пацієнтів залежно від призначеної терапії на початку дослідження подана в табл. 1. Як видно, групи достовірно не відрізнялися за основними показниками на початку дослідження. Також групи достовірно не відрізнялися за частотою призначення гідрохлортіазиду: у групі атенололу — 13 пацієнтів (36,1 %), у групі аліскірену — 13 (46,4 %) (р > 0,05). Таким чином, частка пацієнтів, які отримували моно- або комбіновану терапію, у групах спостереження була однаковою. Усі групи були однорідними за основними клінічними, біохімічними показниками, за даними ДМАТ. Початково інсулінорезистентність (НОМА > 3) спостерігалась в однакового числа хворих: у 36,1 % у групі атенололу та у 35,7 % у групі аліскірену (р > 0,05).
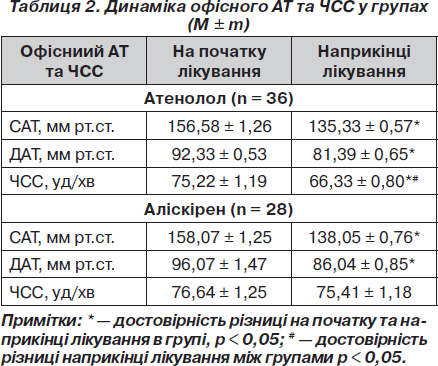
Вплив атенололу, аліскірену на показники офісного АТ та ЧСС. Зниження як САТ, так і ДАТ було еквівалентним в обох групах спостереження. Так, САТ знизився на 21,25 та 20,02 мм рт.ст. у групах атенололу та аліскірену відповідно, (р < 0,05 порівняно з початком в обох групах). ДАТ знизився на 10,94 та 10,03 мм рт.ст. відповідно в групах (р < 0,05 для обох значень). У групі атенололу спостерігалося достовірне зменшення ЧСС на 8,89 уд/хв (р < 0,05). У групі аліскірену зниження ЧСС було недостовірним. Таким чином, антигіпертензивний ефект атенололу та аліскірену був однаковим протягом періоду спостереження.
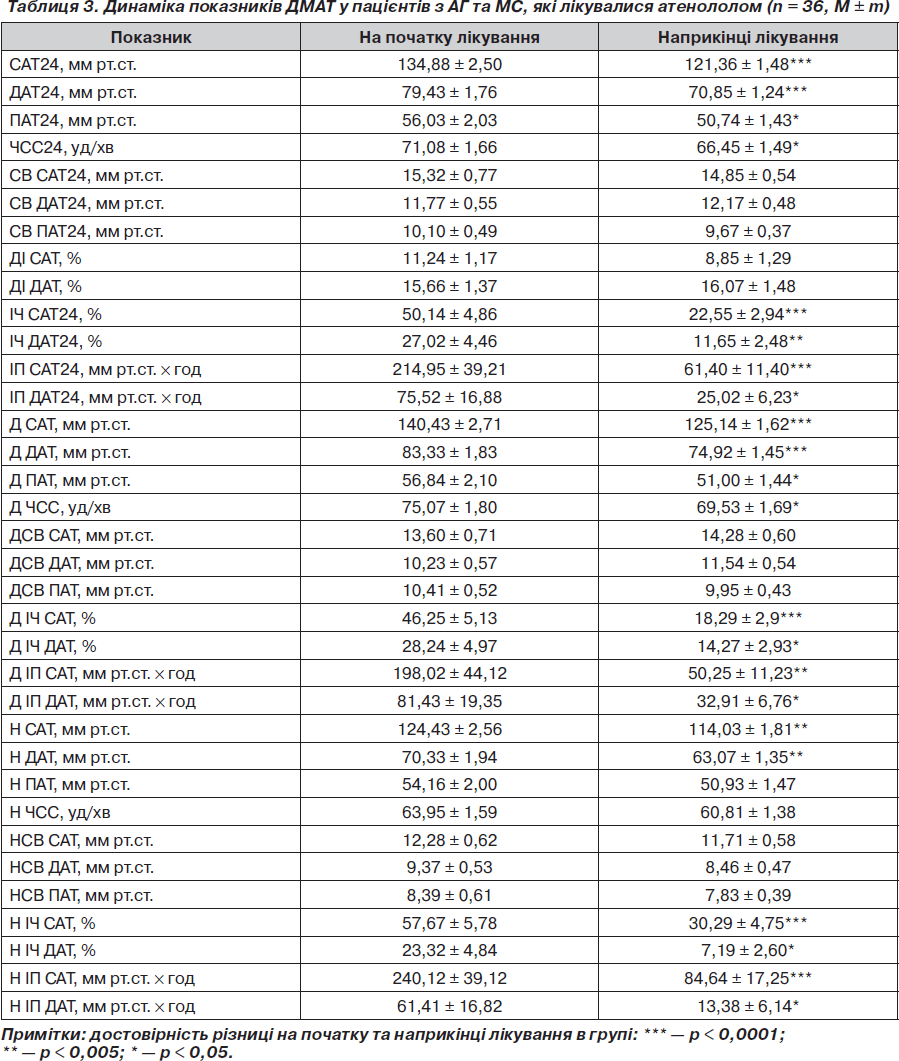
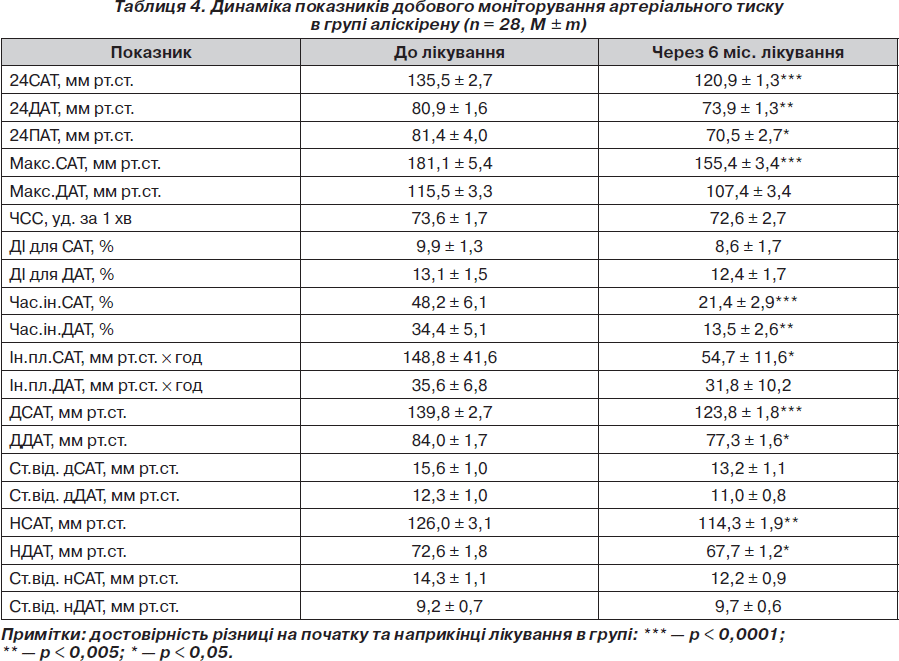
Вплив атенололу, аліскірену на показники АТ та ЧСС при добовому моніторуванні. На фоні лікування атенололом та аліскіреном зниження АТ при добовому моніторуванні після періоду лікування було достовірним і так само не відрізнялося у групах: зменшення середньодобового САТ становило 13,52 та 14,60 мм рт.ст. відповідно (р < 0,05 для всіх значень) (табл. 3, 4). Середньодобовий ДАТ знизився на 8,58 та 7,00 мм рт.ст. відповідно (р < 0,05 для обох значень). На фоні лікування атенололом середньодобова ЧСС зменшилася на 4,63 уд/хв (р < 0,05), на фоні прийому аліскірену ЧСС достовірно не змінилася (73,56 ± 1,74 уд/хв на початку та 72,60 ± 2,66 уд/хв наприкінці дослідження; р > 0,05). Можна зробити висновок, що атенолол та аліскірен за даними ДМАТ однаково ефективно знижували АТ при добовому моніторуванні.
Досягнення цільових рівнів офісного АТ та при ДМАТ на фоні лікування атенололом, аліскіреном. Досягнення цільового офісного АТ у групі атенололу спостерігалося у 30 пацієнтів (83,34 %), у групі аліскірену — у 26 пацієнтів (92,85 %) (р > 0,05 між групами). За даними ДМАТ цільового АТ у групі атенололу було досягнуто у 24 пацієнтів (66,67 %), у групі аліскірену — у 20 пацієнтів (71,42 %) (р > 0,05 між групами). Ми не виявили достовірної різниці в досягненні цільових рівнів як офісного АТ, так і при добовому моніторуванні в пацієнтів обох груп. Можна зробити висновок, що обидва препарати були однаково ефективними в досягненні цільових рівнів АТ.
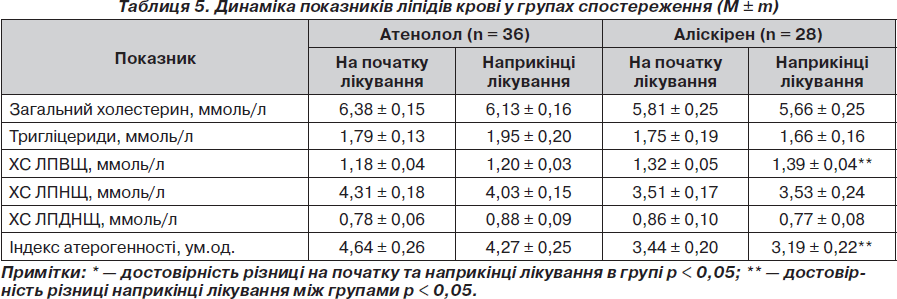
Порівняльна характеристика впливу атенололу, аліскірену на стан ліпідного обміну в пацієнтів з АГ та МС. На фоні лікування атенололом ми не відзначили достовірних змін показників ліпідного спектра сироватки крові, хоча спостерігалася тенденція до збільшення вмісту тригліцеридів (ТГ) у сироватці крові з 1,79 ± 0,13 ммоль/л до 1,95 ± 0,20 ммоль/л (р > 0,05), холестерину ліпопротеїдів дуже низької щільності (ХС ЛПДНЩ) з 0,78 ± 0,06 ммоль/л до 0,88 ± 0,09 ммоль/л (р > 0,05), меншою мірою холестерину ліпопротеїдів високої щільності (ХС ЛПВЩ) — з 1,18 ± 0,04 ммоль/л до 1,20 ± 0,03 ммоль/л (р > 0,05). Однонаправлені, але позитивні тенденції до зміни ліпідів сироватки крові спостерігалися на фоні лікування аліскіреном, але також ці зміни були недостовірними. Так, відзначалося зменшення вмісту в сироватці крові тригліцеридів із 1,75 ± 0,19 ммоль/л до 1,66 ± 0,16 ммоль/л (р > 0,05), рівня холестерину дуже низької щільності (ХС ЛПДНЩ) — із 0,86 ± 0,10 ммоль/л до 0,77 ± 0,08 ммоль/л (р > 0,05), збільшення ХС ЛПВЩ із 1,32 ± 0,05 ммоль/л до 1,39 ± 0,04 ммоль/л (р > 0,05) (табл. 5). Слід зазначити, що наприкінці періоду спостереження виявлена достовірна різниця між групами за рівнем ХС ЛПВЩ та індексом атерогенності. Таким чином, деякі позитивні зміни показників ліпідів крові (особливо ХС ЛПВЩ) були відзначені в групі аліскірену, тоді як у групі атенололу таких змін не спостерігалося. Оскільки в пацієнтів з АГ та МС існує прямий кореляційний зв’язок між рівнем НОМА та ТГ сироватки крові, то слід очікувати, що ці зміни можуть відображати позитивний вплив терапії на чутливість тканин до інсуліну.
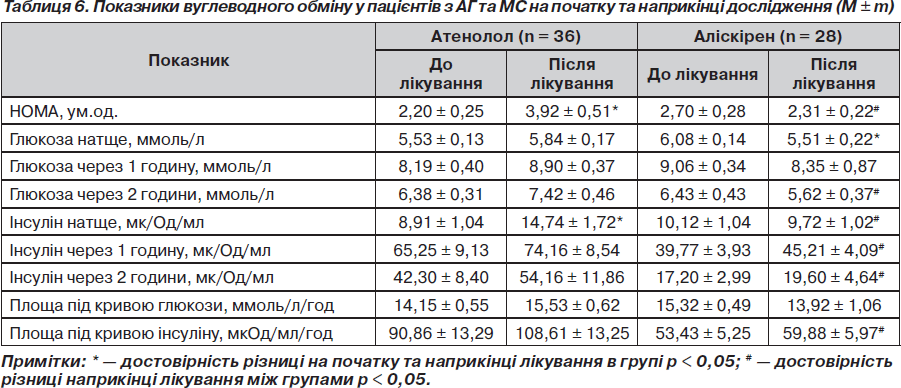
Результати впливу атенололу, аліскірену на показники вуглеводного обміну та стан інсулінорезистентності в пацієнтів з АГ та МС
Вивчення впливу препаратів на рівень глюкози показало, що на фоні прийому атенололу при повторному обстеженні спостерігалося недостовірне підвищення рівня глюкози натще з 5,53 ± 0,13 ммоль/л до 5,84 ± 0,17 ммоль/л (р > 0,05), але значно виріс рівень інсуліну натще з 8,91 ± 1,04 мкОд/мл до 14,74 ± 1,72 мкОд/мл (р < 0,05), що мало прояв у достовірному збільшенні індексу НОМА з 2,20 ± 0,25 ум.од. до 3,92 ± 0,51 ум.од. (р < 0,05), що свідчить про поглиблення інсулінорезистентності. Площа під кривою глюкози та площа під кривою інсуліну зросли, але недостовірно з 14,15 ± ± 0,55 ммоль/л/год до 15,53 ± 0,62 ммоль/л/год — та з 90,86 ± 13,29 мкОд/мл/год до 108,61 ± ± 13,25 мкОд/мл/год відповідно (р > 0,05).
Прийом аліскірену супроводжувався протилежною динамікою порівняно з атенололом: спостерігалося достовірне зменшенням рівня глюкози натще з 6,08 ± 0,14 ммоль/л до 5,51 ± 0,22 ммоль/л (р < 0,05), у той же час зменшився й рівень інсуліну натще, але недостовірно — з 10,12 ± 1,04 мкОд/мл до 9,72 ± 1,02 мкОд/мл (р > 0,05), що проявилося в тенденції до зменшення НОМА з 2,70 ± 0,28 ум.од. до 2,31 ± 0,22 ум.од. (р > 0,05), що свідчить про зменшення інсулінорезистентності. Площа під кривою глюкози та площа під кривою інсуліну практично не змінилися: недостовірно знизилася з 15,32 ± 0,49 ммоль/л/год до 13,92 ± 1,06 ммоль/л/год та з 53,43 ± ± 5,25 мкОд/мл/год до 59,88 ± 5,97 мкОд/мл/год відповідно (р > 0,05) (табл. 6).
Під час оцінки впливу препаратів на стан інсулінорезистентності було виявлено, що атенолол на відміну від аліскірену значною мірою поглиблював ІР, що проявилось у збільшенні рівня НОМА майже у 2 рази (на 78,18 %, р < 0,05). У той же час на фоні лікування аліскіреном ІР зменшувалася: показник НОМА зменшився на 14,5 % (р >0,05). Різниця між групою аліскірену та атенололу наприкінці лікування достовірна (р < 0,05). Наприкінці лікування ми спостерігали достовірну різницю між групами за показниками НОМА, глюкози через 2 години, інсуліну натще, через 1 та 2 години та площі під кривою інсуліну (табл. 6). Дані зміни можуть свідчити про позитивні метаболічні ефекти аліскірену порівняно з атенололом на вуглеводний обмін у пацієнтів з АГ та МС.
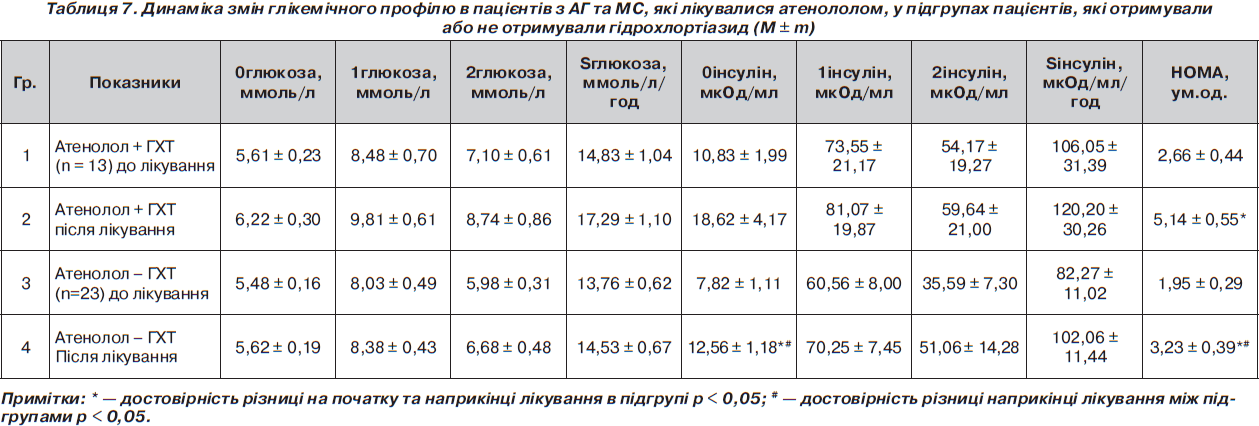
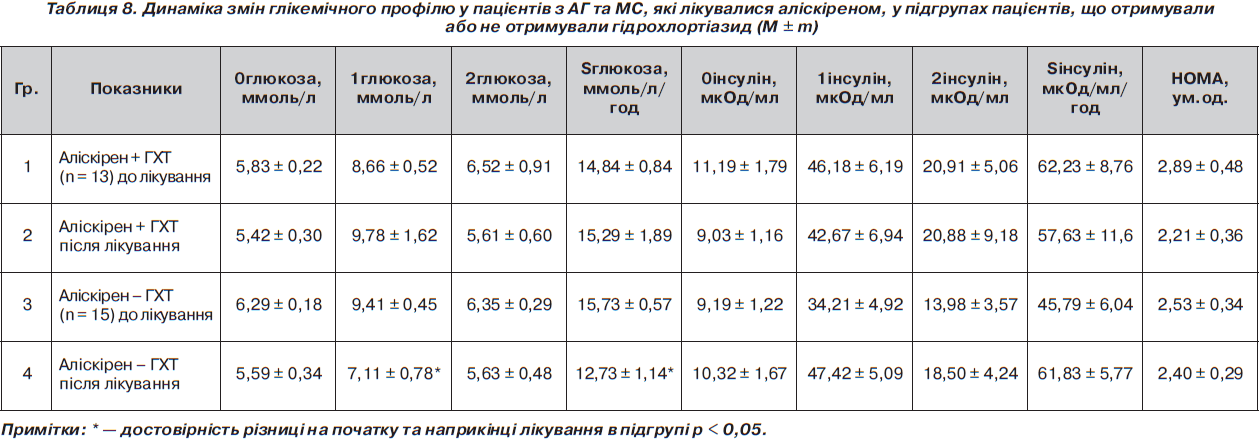
Під час оцінки впливу додавання гідрохлортіазиду (ГХТ) у підгрупах пацієнтів було виявлено, що в комбінації з атенололом відбувалося достовірно більш значне погіршення глікемічного профілю та поглиблення інсулінорезистентності порівняно з підгрупою без ГХТ. Так, НОМА збільшився в підгрупі атенолол + ГХТ (n = 13) з 2,66 ± 0,44 ум.од. до 5,14 ± 0,55 ум.од. (р < 0,005 у підгрупі), а в підгрупі атенолол – ГХТ (n = 23) з 1,95 ± 0,29 ум.од. до 3,23 ± 0,39 ум.од. (р < 0,05 у підгрупі; р < 0,05 між підгрупами). Такі зміни НОМА відбувалися за рахунок достовірного збільшення рівня інсуліну натще, причому в підгрупі з ГХТ на фоні прийому атенололу збільшення рівня інсуліну було достовірно більш вираженим порівняно з підгрупою атенололу без ГХТ (табл. 7). На відміну від цього в підгрупах із аліскіреном спостерігалося зменшення рівня індексу НОМА як із додаванням, так і без додавання ГХТ, хоча ці зміни були недостовірними (табл. 8). Так, НОМА зменшився в підгрупі аліскірен + ГХТ (n = 13) з 2,89 ± 0,48 ум.од. до 2,21 ± 0,36 ум.од. (р > 0,05 у підгрупі), а в підгрупі аліскірен – ГХТ (n = 15) з 2,53 ± 0,34 ум.од. до 2,40 ± 0,29 ум.од. (р > 0,05 у підгрупі; р > 0,05 між підгрупами). Однак були достовірними зміни площі під кривою глюкози та глюкози через 1 годину в підгрупі пацієнтів аліскірен без ГХТ (табл. 8). На фоні лікування аліскіреном додавання ГХТ не мало негативного впливу на стан інсулінорезистентності: різниця між підгрупами наприкінці лікування була недостовірною. Таким чином, можна зробити висновок, що монотерапія аліскіреном має позитивний вплив на показники вуглеводного обміну, а приєднання ГХТ не погіршує показники вуглеводного обміну, тому застосування такої комбінації можна вважати доцільним у пацієнтів з артеріальною гіпертензією та клінічними ознаками метаболічного синдрому.
У групі пацієнтів, які мали порушення толерантності до глюкози натще та лікувалися атенололом спостерігалася така динаміка глікемічного профілю: чверть пацієнтів (25 %) перейшли в групу порушеної толерантності до глюкози та 75 % — у групу нормальної толерантності до глюкози. У групі пацієнтів, які мали порушену толерантність до глюкози на фоні лікування атенололом відбулися найбільш виражені негативні зміни глікемічного профілю. Так, у 44,4 % пацієнтів виник цукровий діабет, 33,3 % залишилися в групі порушеної толерантності до глюкози та лише 22,2 % перейшли в групу з нормальною толерантністю до глюкози. У групі пацієнтів із нормальною толерантністю до глюкози на фоні лікування атенололом у 13,4 % пацієнтів спостерігався розвиток ЦД, у 8,7 % — порушення толерантності до глюкози, у 21,7 % — порушення глюкози натще, лише 56,5 % залишилися в групі нормальної толерантності до глюкози.
У групі пацієнтів, які мали початкове порушення вмісту глюкози натще та лікувалися аліскіреном, у 10 % развинувся ЦД, а 70 % перейшли в групу нормальної толерантності до глюкози. У групі пацієнтів, які мали порушену толерантність до глюкози, на фоні лікування аліскіреном усі пацієнти перейшли в групу нормоглікемії. У пацієнтів із початково нормальною толерантністю до глюкози в групі аліскірену ЦД розвинувся тільки у 14 %.
З огляду на результати клінічного застосування можна стверджувати, що аліскірен здатен зайняти місце одного з найбільш ефективних антигіпертензивних препаратів. Ефективність та безпечність аліскірену, а також дозозалежне зниження систолічного та діастолічного АТ під впливом цього препарату були підтверджені у 678 хворих на АГ І–ІІ ступеня у 8-тижневому плацебо-контрольованому клінічному дослідженні. Антигіпертензивний ефект аліскірену тривав упродовж 2 тижнів після його відміни. Потрібно зазначити добру переносимість препарату в будь-яких дозах: частота небажаних проявів не відрізнялася від такої у групі, що отримувала плацебо [23]. Aналіз клінічних досліджень, до яких увійшов 8481 хворий [7, 16], які одержували монотерапію аліскіреном або плацебо, продемонстрував, що однократний прийом аліскірену в дозі 150 або 300 мг на добу призводив до зниження систолічного АТ відповідно на 12,5 і 15,2 мм рт.ст. порівняно із зниженням на 5,9 мм рт.ст. у групі плацебо (р < 0,0001). Діастолічний АТ знижувався відповідно на 10,1 і 11,8 мм рт.ст. (у групі, що приймала плацебо, — на 6,2 мм рт.ст., р < 0,0001). При цьому не було виявлено розбіжностей в антигіпертензивному ефекті аліскірену в чоловіків та жінок. Нещодавно опубліковані результати [33] багатоцентрового контрольованого клінічного дослідження, у якому в 1124 хворих на АГ порівнювали ефективність аліскірену й гідрохлортіазиду як препаратів першої лінії, при необхідності до них додавали амлодипін. Уже після завершення періоду монотерапії (12-й тиждень) було виявлено, що аліскірен призводив до більш вираженого зниження АТ, ніж гідрохлортіазид (–17,4/–12,2 мм рт.ст. проти –14,7/–10,3 мм рт.ст., р < 0,001).
Аліскірен здатен гальмувати розвиток ураження нирок, що можна пояснити, по-перше, його антигіпертензивною дією, по-друге, це може бути обумовлено усуненням тканинного профіброгенного ефекту реніну і прореніну, що реалізується при взаємодії їх із прореніновими рецепторами. Установлено, що ренін і проренін безпосередньо індукують збільшення екскреції альбуміну з сечею. Тому в умовах гіперренінемії органні прояви діабетичної мікроангіопатії більш виражені [20], а в дітей, хворих на ЦД 1-го типу, збільшення концентрації прореніну у плазмі призводить до постійної альбумінурії [6]. Нефропротекторні властивості аліскірену та ІАПФ периндоприлу були порівнянними на експериментальній моделі діабетичної нефропатії (трансгенні щури лінії (mRen-2)27). Було виявлено, що обидва препарати практично однаково зменшують альбумінурію та прогрес гломерулосклерозу. На відміну від ІАПФ прямий інгібітор реніну більшою мірою обумовлював уповільнення тубулоінтерстиціального фіброзу [34]. В іншому експериментальному дослідженні, також виконаному на щурах, хворих на ЦД 2-го типу, як аліскірен, так і валсартан, призначений у максимальній дозі, знижували АТ і попереджували гіпертрофію лівого шлуночка, його діастолічної дисфункції, а також концентрацію передсердного натрійуретичного пептиду та альбумінурії. Через 3 тижні з моменту початку лікування всі тварини, які одержували аліскірен або валсартан в максимальній дозі, були живі; у групі, якій призначали мінімальну дозу валсартану, смертність становила 26 %, всі тварини, яким застосовували плацебо, загинули [4, 26].
Здатність аліскірену знижувати АТ і зменшувати екскрецію альбуміну з сечею підтверджена в клінічних роботах [11, 12, 24, 25]. У великому дослідженні AVOID [1, 8, 9, 10] у 599 хворих на діабетичну нефропатію та АГ за співвідношенням альбумін/креатинін сечі оцінювали вплив комбінації максимальних доз лозартану та аліскірену на екскрецію альбуміну з сечею. Додавання до лозартану (100 мг/добу) аліскірену (300 мг/добу) супроводжувалося достовірним зниженням співвідношення альбумін/креатинін сечі на 20 %, у тому числі у 24,7 % хворих — зниженням цього співвідношення на 50 % і більше; у групі, в якій лозартан комбінували із плацебо, зменшення співвідношення альбумін/креатинін сечі на 50 % було досягнуто лише в 12,5 % пацієнтів (р < 0,001). Таким чином, прямі інгібітори реніну можуть обумовлювати зменшення альбумінурії, особливо при комбінації їх із блокаторами рецепторів ангіотензину ІІ, що, очевидно, дозволяє досягти оптимального ступеня блокування РААС, необхідного для усунення генералізованої і локально-ниркової дисфункції ендотелію.
Відомі обмеження можливостей дослідження аліскірену на експериментальних моделях (висока специфічність блокади саме людського реніну) на сьогодні не дали однозначної відповіді про вплив препарату на метаболічні параметри. За винятком поодиноких експериментальних досліджень на щурах та мишах [14, 17–19] у доступній літературі відсутні детальні відомості як для хворих на АГ, так і з хронічною серцевою недостатністю. У нашій роботі ми намагалися визначити метаболічні ефекти тривалої терапії у хворих на АГ із МС на етапі без клінічного цукрового діабету. Як і передбачалося, метаболічний ефект аліскірену як блокатора РАС — від нейтрального до позитивного. Додавання ГХТ, що зазвичай погіршує ступінь метаболічних порушень (як у групі атенололу), у групі аліскірену не приводило до негативних змін показників вуглеводного обміну. Цей факт дозволяє говорити про певні протекторні властивості аліскірену.
Висновки
1. На фоні еквівалентного ефективного контролю артеріального тиску тривале лікування атенололом достовірно погіршувало інсулінорезистентність, що проявилось у збільшенні індексу НОМА на 78,2 % (р < 0,05). На фоні лікування аліскіреном стан інсулінорезистентності зменшувався, індекс НОМА зменшився на 14,5 % (р > 0,05).
2. Аліскірен може бути використаний, як метаболічно нейтральний препарат у пацієнтів із м’якою та помірною артеріальною гіпертензією та клінічними ознаками метаболічного синдрому без цукрового діабету з проявами інсулінорезистентності. Метаболічна нейтральність зберігається навіть при призначенні гідрохлортіазиду.
3. Призначення атенололу небажане в пацієнтів з артеріальною гіпертензією та клінічними ознаками метаболічного синдрому без цукрового діабету, незалежно від наявності чи відсутності в них проявів інсулінорезистентності, оскільки сприяє розвитку нових випадків цукрового діабету. Особливо небажане його поєднання з тіазидними діуретиками.
1. Чазова И.Е., Фомин В.В., Пальцева Е.М. Прямой ингибитор ренина алискирен — новые возможности защиты почек при артериальной гипертензии // Клиническая нефрология. — 2009. — № 1 — С. 44-49.
2. Зимин Ю.В. Инсулинорезистентность, гиперинсулинемия и артериальная гипертония // Кардиология. — 1996. — № 11. — С. 80-91.
3. Зимин Ю.В. Происхождение, диагностическая концепция и клиническое значение синдрома инсулинорезистентности или метаболического синдрома Х // Кардиология. — 1998. — № 6. — С. 71-81.
4. Aliskiren Trial in Type 2 Diabetes Using Cardio-Renal Endpoints (ALTITUDE): rationale and study design // Nephrol. Dial. Transplant. — 2009. — 24(5). — 1663-71.
5. Bonora E., Targher G., Alberiche M., Bonadonna R.C., Saggiani F., Zenere M.B., Monanui T., Muggeo M. Homeostasis model assessment closely mirrors the glucose clamp technique in the assessment of insulin sensitivity // Diabetes Care. — 2000. — Vol. 23. — P. 57-63.
6. Chiarelli F., Pomilio M., De Luka F.A. et al. Plasma protein levels may predict prasistant microalbuminuria in children with diabetes // Pediatr. Nephrol. — 2001. — 16. — 116-20.
7. Dahlоf B., Anderson D.R., Arora V. et al. Aliskiren, a direct renin inhibitor, provides antihypertensive efficacy and excellent tolerability independent of age or gender in patients with hypertension (abstr) // J. Clin. Hypertens. — 2007. — 9 (Suppl. A). — A157.
8. Fogari R., Zoppi A., Mugellini A., Lazzari P., Derosa G. Different effects of aliskiren and losartan on fibrinolysis and insulin sensitivity in hypertensive patients with metabolic syndrome // Horm. Metab. Res. — 2010. — 42(12). — 892-896.
9. Gradman A., Schmieder R., Lins R., Nussberger J., Chiang Y., Bedigian M. Aliskiren, a novel orally effective renin inhibitor, provides dose-dependent antihypertensive efficacy and placebo-like tolerability in hypertensive patients // Circulation. — 2005. — 8. — 1012-1018.
10. Hogan M. Aliskiren plus Optimal Therapy Reduces Albuminuria, AVOID Study Says // Nephrology Times. — 2008. — 1(7). — 1-8.
11. Horkэ K. Direct renin inhibitor aliskiren in the treatment of cardiovascular and renal diseases // Vnitr. Lek. — 2010. — 56(2). — 120-126.
12. Ingelfinger J. Aliskiren and Dual Therapy in Type 2 Diabetes Mellitus // N. Engl. J. Med. — 2008. — 358. — 2503-2505.
13. Iwai M., Horiuchi M. Role of renin-angiotensin system in adipose tissue dysfunctio // Hypertens. Res. — 2009. — 32(6). — 425-427.
14. Iwai M., Kanno H., Tomono Y., Inaba S., Senba I., Furuno M., Mogi M., Horiuchi M. Direct renin inhibition improved insulin resistance and adipose tissue dysfunction in type 2 diabetic KK-A(y) mic // J. Hypertens. — 2010. — 28(7). — 1471-1481.
15. Fogari R. et al. Beta-blocker effects on plasma lipids during prolonged treatment of hypertensive patients with hypercholesterinemia // J. Cardiovasc. Pharmacol. — 1999. — Vol. 33. — P. 534.
16. Jordan J., Engeli S., Boye S.W. et al. Direct renin inhibition with aliskiren in obese patients with arterial hypertension // Hypertension. — 2007. — 49. — 1047-55.
17. Kang Y.S., Lee M.H., Song H.K., Hyun Y.Y., Cha J.J., Ko G.J., Kim S.H., Lee J.E., Han J.Y., Cha D.R. Aliskiren improves insulin resistance and ameliorates diabetic vascular complications in db/db mice // Nephrol. Dial. Transplant. — 2010. — 4.
18. Lambers Heerspink H.J., Perkovic V., de Zeeuw D. Renal and cardioprotective effects of direct renin inhibition: a systematic literature review // J. Hypertens. — 2009. — 27(12). — 2321-2331.
19. Lastra G., Habibi J., Whaley-Connell A. Direct Renin Inhibition Improves Systemic Insulin Resistance and Skeletal Muscle Glucose Transport in a Transgenic Rodent Model of Tissue Renin Overexpression // Endocrinology. — 2009. — 150(6). — 2561-2568.
20. Luetscher J.A., Kramer F.B., Wilson D.M. et al. Increased plasma inactive rennin in diabetes mellitus. A marker of mikrovascular comlications // M. Eng. S. Med. — 1985. — 312. — 1412-17.
21. McMurray J. et al. Effects of the Oral Direct Renin Inhibitor Aliskiren in Patients with Symptomatic Heart Failure // Circ. Heart Fail. — 2008. — 1. — 17-24.
22. National Institutes of Health: Third Report of the National Cholesterol Education Program Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Washington, DC, US Govt. Printing Office, 2001 (NIH publ. no. 01-3670).
23. Oh B.-H., Mitchell J., Herron J.R. at al. Aliskiren, an oral rennin inhibitor, provides dose-dependenti efficacy and sustained 24-hour blood pressure control in patients with hypertension // J. Am. Coll. Cardiol. — 2007. — 49. — 1157-63.
24. Oparil S., Yarows S. Efficacy and safety of combined use of aliskiren and valsartan in patients with hypertension: a randomised, double-blind trial // Lancet. — 2007. — 370(9583). — 221-229.
25. Parving H., Persson F. Aliskiren Combined with Losartan in Type 2 Diabetes and Nephropathy // N. Engl. J. Med. — 2008. — 358. — 2433-2446.
26. Pilz B., Shagdarsuren E., Wellner M. et al. Aliskiren, a human rennin inhibitor, ameliorates cardiac and renal damage in double-transgenetic rars // Hypertension. — 2005. — 46(3). — 569-76.
27. Reaven G. Metabolic Syndrome // Circulation. — 2002. — Vol. 106. — P. 286.
28. Reaven G.M. Counterpoint: just being alive is not good enough // Clinical Chemistry. — 2005. — Vol. 51. — P. 1354-1357.
29. Reaven G.M. Dr. Reaven responds // Clinical Chemistry. — 2005. — Vol. 51. — P. 1083-1084.
30. Reaven G.M. Role of insulin resistance in human disease // Diabetes. — 1988. — Vol. 37. — P. 1595-1607.
31. Reaven G.M., Hoffman B.B. A role for insulin in the aetiology and course of hypertension // Lancet. — 1987. — Vol. 2. — P. 435-437.
32. Reaven G.M., Lithell H., Landsberg L. Hypertension and associated metabolic abnormalities: the role of insulin resistance and the sympathoadrenal system // N. Engl. J. Med. — 1996. — Vol. 334. — P. 374-381.
33. Schmieder R.E., Philipp T., Guerediaga J. et al. Long-term antihypertensive efficacy and safety of the oral direct renin inhibitor aliskiren: a 12-month randomized, double-blind comparator trial with hydrochlorothiazide // Circulation. — 2009. — 119(3). — 417-25.
34. Straessen J., Li Y. and Richart T. Oral Renin Inhibitors // Lancet. — 2006. — 368(9545). — 1449-1456.