Журнал «» 4(18) 2011
Вернуться к номеру
Передопераційний відбір та ведення хворих з артеріальною гіпертензією1
Авторы: Athanasios J. Manolis, Serap Erdine, Claudio Borghi, Kostas Tsioufis
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
Артеріальна гіпертензія (АГ) уражає близько мільярда людей у всьому світі, переважно літнього віку, і являє собою основний фактор ризику розвитку ішемічної хвороби серця, серцевої недостатності, патології нирок та цереброваскулярних ускладнень. Загальна поширеність АГ сягає 20–25 %. Вона є найпоширенішою проблемою, з якою стикаються лікарі перед проведенням оперативних втручань некардіохірургічного профілю. Численні дослідження показали, що АГ 1-го або 2-го ступеня (< 180/110 мм рт.ст.) не є незалежним фактором ризику періоперативних серцево-судинних ускладнень [1]. На жаль, незважаючи на високу поширеність АГ і наявність численних ефективних антигіпертензивних препаратів, багато пацієнтів мають неконтрольований високий артеріальний тиск. Тому передопераційна оцінка — це унікальна нагода виявити АГ у пацієнтів і розпочати відповідне лікування. Незважаючи на те, що АГ — це найпоширеніший медичний привід для відмови у проведенні необхідних операцій, залишається незрозумілим, чи виправдане відкладання втручання до досягнення належного рівня АТ і чи це призводить до зниження серцевого ризику [2].
У повсякденній клінічній практиці дуже часто перед нами постають такі питання: чи оперувати пацієнта із неконтрольованою АГ? Чи відкласти втручання? Чи мають пацієнти із неконтрольованою АГ підвищений передопераційний ризик розвитку серцево-судинних ускладнень? У чому саме полягає ризик серцево-судинних ускладнень безпосередньо під час проведення та після операції? Яким чином можна зменшити або усунути цей ризик? Чи є дані, на які можна спиратися, приймаючи рішення? У цій галузі у нас немає переконливих даних доказової медицини, водночас багато даних стосовно передопераційного ризику, асоційованого з АГ, що надходять із неконтрольованих досліджень, свідчать на користь необхідності попередньої корекції АТ.
Патофізіологія
Підвищений АТ обумовлений збільшенням системного судинного опору, підвищенням переднавантаження, активацією симпатичної нервової системи (СНС) і ренін-ангіотензинової системи (РАС), денервацією барорецепторів, швидким збільшенням об’єму циркулюючої крові, надмірною продукцією серотоніну, зміною серцевих рефлексів. Зниження тонусу симпатичної нервової системи під час анестезії приводить до відносного зниження серцевого перед- і післянавантаження. Під час ініціації проведення анестезії симпатична активація може викликати підвищення артеріального тиску на 20–30 мм рт.ст. і збільшення частоти серцевих скорочень до 15–20 ударів за хвилину в нормотензивних людей [3]. Ця реакція може бути більш вираженою у нелікованих гіпертоніків. Під час глибокої анестезії хворі з уже існуючою АГ більш схильні до інтраопераційної лабільності артеріального тиску, що може призвести до ішемії міокарда. У ранньому післяопераційному періоді, коли пацієнт відходить від анестезії, артеріальний тиск і частота серцевих скорочень підвищуються повільно [4].
Передопераційна оцінка
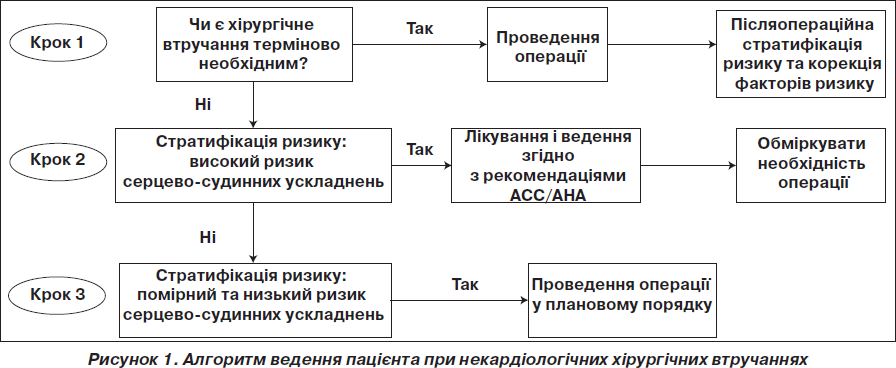
Безумовно, перед операцією ми повинні приймати зважене рішення, керуючись безпекою пацієнта під час та після операції та необхідністю не зволікати і не скасовувати операції невиправдано. Важливо знати, чи був у пацієнта раніше встановлений діагноз АГ і чи отримував він антигіпертензивне лікування, тому що багато пацієнтів стривожені під час передопераційного періоду і це може призводити до тимчасового підвищення в них артеріального тиску. Лікарям слід дотримуватися Європейських рекомендацій стосовно вимірювання і діагностики підвищеного артеріального тиску [5]. Наступним і найважливішим кроком є стратифікація ризику, оскільки пацієнти високого ризику потребують подальшого обстеження, в той час як пацієнти середнього і низького ступеня ризику підлягають операції без подальшого зволікання.
Величезний відсоток захворюваності й смертності у хірургічних хворих некардіохірургічного профілю припадає на серцево-судинні ускладнення [6]. Передопераційне проведення неінвазивних функціональних тестів асоціюється з поліпшенням однорічної виживаності хворих і зменшенням госпіталізацій. Однак переваги для пацієнтів середнього ризику були незначними, а зволікання заради детального обстеження у пацієнтів низького ризику призводило до збільшення смертності [7]. Супутня патологія, особливо захворювання серця, цукровий діабет, метаболічний синдром і ниркова недостатність, підвищують ризик серцево-судинних періоперативних ускладнень. Стани, що обов’язково вимагають попереднього додаткового обстеження і лікування: гострий коронарний синдром, декомпенсована серцева недостатність, виражена аритмія, а також тяжкі вади клапанів. Рівень переглянутого індексу серцевого ризику відрізняється помірно між пацієнтами низького і високого ризику серцево-судинних ускладнень після проведення некардіологічної операції [8]. Крім того, при попередньому обстеженні пацієнта ми маємо звертати увагу на симптоми й ознаки, які характерні для вторинних АГ. У метааналізі результатів 30 спостережень було встановлено, що ймовірність періоперативних серцевих подій в середньому в 1,31 раза вища в гіпертензивних, ніж у нормотензивних пацієнтів. [9]. Дуже низький гомілково-плечовий індекс є незалежним чинником ризику розвитку післяопераційних серцево-судинних ускладнень [10]. Хоча, здається, що повинна бути тенденція до збільшення частоти періоперативних гемодинамічних порушень у пацієнтів із ішемією міокарда, аритміями на фоні тяжкої гіпертензії, існуючі дані однозначно не підтримують думку про те, що перенесення строків операції для оптимізації артеріального тиску зменшить ризик післяопераційних серцево-судинних ускладнень. Відповідно до цього у рекомендаціях ACC/AHA неконтрольована АГ як така розглядається лише як малий фактор ризику, що не впливає на загальне періоперативне ведення хворих [11]. Однак відзначається брак великомасштабних досліджень з достатньою кількістю пацієнтів із тяжкою АГ, які б дозволили отримати статистично достовірні результати і зробити певні висновки щодо цієї категорії пацієнтів.
Електрокардіограма повинна бути рутинним дослідженням у пацієнтів із високим артеріальним тиском, адже вона дозволяє виявити гіпертрофію лівого шлуночка, ознаки перевантаження серця, аритмії та ішемії. Наявність зубця Q або значного підйому або депресії сегмента ST було пов’язано з підвищенням частоти серцево-судинних періоперативних ускладнень. Тому, можливо, у деяких випадках було б виправдано зв’язатися з лікуючим терапевтом для отримання інформації про попередній рівень артеріального тиску, щоб уникнути хибних висновків на основі лише результатів вимірювання артеріального тиску в лікарні при надходженні хворого (для виключення наявності АГ «білого халату»). У цьому аспекті лікар може дотримуватись зручного клінічного алгоритму, що складається з 5 питань: чи є ця операція невідкладною? Чи має пацієнт супутні серцево-судинні захворювання? Які специфічні ризики асоціюються із цією конкретною операцією? Які функціональні можливості має пацієнт? Чи є у пацієнта будь-які додаткові фактори ризику? На рис. 1 показано алгоритм діагностичної оцінки стану пацієнтів, яким має проводитися некардіологічне хірургічне втручання.
Періоперативне ведення
Як згадувалося раніше, ретельна оцінка основних причин АГ на передопераційному етапі важлива для кращого підбору лікування. Втім не тільки гіпертензія, але й гіпотонія становить ризик у періоперативний період. Водночас слід уникати виникнення як гіпертонічних кризів, так і глибокої гіпотензії, особливо в поєднанні з барорефлекторною тахікардією. Обидва ці стани однаково шкідливі. Швидке зниження тиску під час операції (зниження до рівня, меншого від передопераційного на 50 або > 33% від вихідного рівня протягом 10 хв) є незалежним предиктором періоперативних побічних явищ [12]. Підтримання артеріального тиску на рівні 70–100 % від початкового й уникнення тахікардії — це запорука успішного проведення операції гіпертонічним хворим. Особливу увагу потрібно звернути, якщо пацієнт приймає бета-блокатори й клонідин, раптова відміна яких може спричинити тахікардію й підвищення АТ внаслідок так званого ефекту «рикошету». У пацієнтів, які не в змозі приймати препарати внутрішньо, дозволяється використання трансдермального клонідину й парентеральне введення бета-блокаторів. Для пацієнтів із 3-м ступенем АГ потрібно зіставити потенційні переваги й ризики, пов’язані з відкладанням операції для оптимізації артеріального тиску. Для пацієнтів, які нездатні приймати ліки перорально, але потребують лікування, повинні бути використані парентеральні препарати. Внутрішньовенні бета-блокатори, у тому числі пропранолол, атенолол і метопролол, є препаратами вибору завдяки їх антиішемічній дії в післяопераційному періоді. Альтернативою можуть бути внутрішньовенний еналаприл, верапаміл або дилтіазем, і трансдермальний клонідин. У більш складних випадках перевага віддається лабеталолу, нітрогліцерину й натрію нітропрусиду. Парентерального гідралазину слід уникати у пацієнтів з ішемічною хворобою серця (особливо якщо пацієнт ще не приймає бета-блокатори), адже він може спричинити рефлекторну тахікардію, що може привести до ішемії. Використання сублінгвального ніфедипіну абсолютно протипоказане, оскільки асоціюється з підвищенням частоти інсультів, інфаркту міокарда й смерті. Безпосередньо під час операції контролювати артеріальний тиск можна за рахунок глибокого наркозу й використання вазодилататорів, таких як нітрогліцерин, або нітропрусид, або їх комбінації (табл. 1, 2).
Часто відразу під час виходу з наркозу пацієнтам дають антихолінестеразні або антихолінергічні препарати з метою зняття нервово-м’язової блокади, яка використовується під час анестезії. Після анестезії артеріальний тиск швидко підвищується за рахунок симпатичної активації у відповідь на тривогу і біль після пробудження, а також закінчення введення і дії наркотиків. Внутрішньовенні препарати будь-якого класу можуть використовуватись в ранньому післяопераційному періоді, однак перевагу слід віддавати препаратам із більшою тривалістю дії. Через зміни об’єму циркулюючої крові під час операції призначення препаратів крові, фізіологічних розчинів або петльових діуретиків може бути необхідне залежно від індивідуальних потреб пацієнта [13]. Для оптимізації АТ у післяопераційному періоді лікування також повинно включати в себе контроль над болем, тривогою, гіпоксією та гіпотермією.
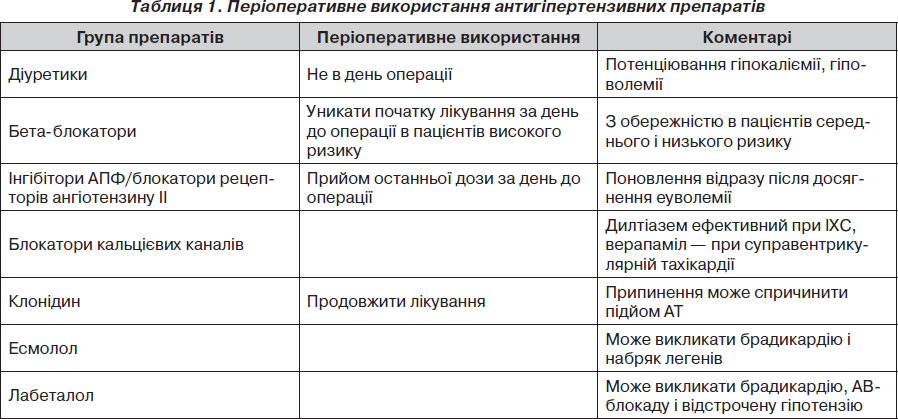
Сечогінні засоби. У пацієнтів, які отримують діуретики, потрібно звертати особливу увагу на рівень калію. Діуретики не слід вводити безпосередньо в день операції через можливу несприятливу взаємодію з анестетиками та потенціювання гіпокаліємії, яка, у свою чергу, може викликати аритмію і посилити ефекти як деполяризуючих, так і недеполяризуючих міорелаксантів.
Бета-блокатори. Недавні дослідження поставили під сумнів користь від періоперативного використання бета-блокаторів, особливо у пацієнтів з низьким і помірним ризиком серцевих подій. В останні кілька років особливий інтерес викликає питання про початок використання бета-блокаторів під час періоперативного періоду в таких хворих, в основному через суперечливі дані двох великих клінічних досліджень POISE та DECREASE-IV. Згідно з нещодавно опублікованими рекомендаціями ACC/AHA 2009 року [14, 15], у пацієнтів, які до операції вже отримувати бета-блокатори, лікування повинне бути продовжене періоперативно (клас I, рекомендації C). Для пацієнтів, з високим серцевим ризиком, які мають перенести втручання на судинах, бета-блокатори, можливо, слід рекомендувати та необхідно проводити попереднє титрування, орієнтуючись на частоту серцевих скорочень і АТ (рекомендації IIa, B). Для пацієнтів, які мають перенести хірургічне втручання або операцію на судинах помірного ризику, користь від призначення бета-блокаторів невизначена. Те ж стосується і пацієнтів низького ризику. Результати дослідження POISE дають підстави припускати, що перше призначення бета-блокаторів безпосередньо в день операції починаючи відразу з високих доз пов’язане з ризиком. Якщо вирішено призначити лікування бета-блокаторами, розпочинати його слід із малих доз задовго до запланованої операції та обережно титрувати дозу залежно від частоти серцевих скорочень і рівня артеріального тиску. Керівництва рекомендують ретельно проводити відбір пацієнтів, добирати дози, а також спостерігати в періоперативному періоді.
Інгібітори ангіотензинперетворюючого ферменту (ІАПФ) і блокатори рецепторів ангіотензину (БРА). Існує багато суперечок у літературі з приводу використання ІАПФ або БРА в періопераційному періоді у зв’язку з їх потенційними центральними ваготонічними ефектами. Ці препарати, окремо або в комбінації, справляють помірний гіпотензивний ефект або викликають брадикардію, особливо якщо їх прийом припинено менше ніж за 10 годин до операції. У деяких пацієнтів це може бути пов’язане зі зменшенням внутрішньосудинного об’єму. Продовження терапії ІАПФ вранці в день операції не пов’язане з кращим контролем АТ і ЧСС, але викликає більш виражену гіпотензію, що вимагає терапевтичного втручання. Хворі, які постійно отримували ІАПФ і БРА, повинні отримувати їх за день до втручання, без премедикації безпосередньо в день операції [16, 17]. Існують змішані докази того, що профілактика глікопіролатом може пом’якшити цей ефект. Слід розглянути також питання про поновлення терапії ІАПФ в ранньому післяопераційному періоді, відразу після досягнення еуволемії, для зменшення ризику розвитку ниркової дисфункції.
Блокатори кальцієвих каналів. Метааналіз 11 досліджень, до яких увійшло 1007 пацієнтів, показує, що застосування блокаторів кальцієвих каналів значно зменшує ішемію міокарда й частоту виникнення суправентрикулярної тахікардії [18]. Більшість цих переваг приписують дилтіазему. Дигідропіридини і верапаміл не зменшують частоту ішемії міокарда, хоча верапаміл знижує частоту суправентрикулярної тахікардії.
Клонідин. Клонідин має сприятливий симпатикоопосередкований ефект з двофазною відповіддю (у низьких дозах — центральне пригнічення симпатичної нервової системи з судинорозширювальним ефектом, у високих дозах — периферична активація й судинозвужуючий ефект). Це значно знижує частоту періоперативних серцево-судинних ускладнень у хворих з ішемічною хворобою серця, а також дозволяє досягти швидкого контролю артеріального тиску в періоперативному періоді, сприяє аналгезії та седації.
Есмолол. Есмолол — це селективний бета-1-адреноблокатор, який знижує частоту серцевих скорочень і серцевий викид, але може викликати підвищення системного судинного опору. Він має швидкий початок і коротку тривалість дії і може призвести до брадикардії, бронхоспазму, судом і набряку легенів.
Лабеталол. Лабеталол — це неселективний комбінований альфа- і бета-адреноблокатор, що мало впливає на частоту серцевих скорочень і серцевий викид. Він має помірну гіпотензивну дію і зазвичай використовується в екстрених ситуаціях. Може викликати бронхоспазм, брадикардію, АВ-блокаду і відстрочену гіпотензію.
Нітрогліцерин. Нітрогліцерин застосовується найбільш широко. У низьких дозах він знижує переднавантаження, а у великих — постнавантаження і може збільшити частоту серцевих скорочень. Це препарат вибору у хворих з ішемічною хворобою серця, а також при набряку легенів і серцевій недостатності.
При періоперативному веденні хворих необхідними є: а) точна документація передопераційного лікування (премедикації); б) рішення про припинення медикаментозного лікування напередодні операції; в) моніторинг біохімічних показників для визначення дози та уникнення побічних ефектів; г) належне знеболювання; д) використання допоміжної медикаментозної терапії; е) використання відповідних протоколів [19, 20].
Переклад Г. Доброход, Г.Д. Радченко
1. Lette J. et al. Preoperative and long-term cardiac risk assessment. Predictive value of 23 clinical descriptors, 7 multivariate scoring systems, and quantitative dipyridamole imaging in 360 patients // Ann. Surg. — 1992. — 216. — 192.
2. Casadei B. et al. Is there a strong rational for deferring elective surgery in patients with poorly controlled hypertension? // J. Hypertens. — 2005. — 23. — 19.
3. Kihara S. et al. Hemodynamic response among three tracheal intubation device in normotensive and hypertensive patients // Anesth. Analg. — 2003. — 96. — 890.
4. Goldman L. et al. Risk of general anesthesia and elective operation in the hypertensive patient // Anesthesiology. — 1979. — 50. — 285.
5. Mancia G. et al. 2007 Guidelines for the management of hypertension: the task force for the management of arterial hypertension of the ESH and ESC // J. Hypertens. — 2007. — 25. — 1105.
6. Mangano D.T. et al. Association of perioperative myocardial ischemia with cardiac morbidity and mortality in men undergoing noncardiac surgery // N. Engl. J. Med. — 1990. — 323. — 1781.
7. Wijeysundera D.N. et al. Non-invasive cardiac stress testing before elective major non-cardiac surgery: population based cohort study // Br. Med. J. — 2010. — 340. — 5526.
8. Ford M.K. et al. Systematic review: prediction of perioperative cardiac complications and mortality by the revised cardiac risk index // Ann. Intern. Med. — 2010. — 152. — 26.
9. Howell S.J. et al. Hypertension, hypertensive heart disease and perioperative heart disease // Br. J. Anesth. — 2004. — 92. — 570.
10. Fisher B.W. et al. The ankle-to-arm index predicts risk of cardiac complications after noncardiac surgery // Anesth. Analg. — 2008. — 107. — 149.
11. Eagle K.A. et al. ACC/AHA guidelines update for perioperative cardiovascular evaluation for non-cardiac surgery // Circulation. — 2002. — 105. — 1257.
12. Goldman L. et al. Risk of general anesthesia and elective operation in the hypertensive patient // Anesthesiology. — 1979. — 50. — 285.
13. Bisognano J. et al. Perioperative management of hypertension // Hypertension Primer. — 4th edition. — 2008. — 553.
14. Fleischmann K.E. et al. 2009 ACC/AHA focused update on perioperative beta blockade // J. Am. Coll. Cardiol. — 2009. — 54. — 13.
15. Chopra V. et al. Perioperative beta-blockers for major noncardiac surgery: primum non nocere // Am. J. Med. — 2009. — 122. — 222.
16. Schirmer U. et al. Preoperative administration of angiotensin-converting enzyme inhibitors // Anaesthest. — 2007. — 56. — 557.
17. Brabant S.M. et al. The hemodynamic effects of anesthetic induction in vascular surgical patients chronically treated with angiotensin II receptor antagonists // Anesth. Analg. — 1999. — 89. — 1388.
18. Wijeysundera D.N. Calcium channel blockers for reducing cardiac morbidity after noncardiac surgery: a meta-analysis // Anesth. Analg. — 2003. — 97. — 634.
19. Poldermans D. et al. Guidelines for pre-operative cardiac risk assessment and perioperative cardiac management in non-cardiac surgery // Eur. Heart. J. — 2009. — 30. — 2769.
20. Whinney C. et al. Perioperative medication management: general principles and practical applications // Clev. Clin. J. Med. — 2009. — 76. — S126-S132.