Международный неврологический журнал 5 (43) 2011
Вернуться к номеру
Применение глатирамера ацетата (копаксон) у ранее не лечившихся пациентов с рассеянным склерозом или лечившихся интерфероном β1b
Авторы: Zwibel H.L. for the Copolymer-1 Treatment Study Principal Investigators Multiple Sclerosis Centre, Baptisi/Health Doctors Hospital, Coral Gables, FL, USA
Рубрики: Неврология
Версия для печати
Цель. Оценить в рамках проспективного открытого исследования эффективность, безопасность и переносимость глатирамера ацетата (ГА) у ранее не лечившихся пациентов с ремиттирующей формой рассеянного склероза (РРС) и пациентов, принимавших интерферон β1b. Методы. На основании предыдущего опыта использования интерферона β1b пациенты были разделены на две группы. На момент включения в исследование пациенты, ранее принимавшие интерферон β1b (n = 247), были старше, имели более высокий средний балл по расширенной шкале инвалидизации (Expanded Disability Status Scale, EDSS), более длительное течение заболевания, высокую частоту обострений и индекс способности к передвижению, чем ранее не лечившиеся пациенты (n = 558). В течение 3,5 года каждые три месяца оценивалась безопасность лечения, оценка неврологического статуса по EDSS проводилась каждые 6 месяцев. Результаты. 247 ранее не лечившихся и 107 лечившихся ранее интерфероном β1b пациентов прервали лечение до конца исследования. Средняя продолжительность лечения ГА составила 36 и 24 месяца у нелечившихся и лечившихся ранее интерфероном β1b пациентов соответственно. По результатам последнего визита было выявлено, что частота обострений в год снизилась на 75 % в обеих группах (0,42 ± 0,84 и 0,34 ± 0,71 у нелечившихся и лечившихся ранее интерфероном β1b соответственно, Р = 0,1482). Динамика показателя по EDSS в среднем составила менее 0,5 в обеих группах независимо от начальных показателей EDSS, на 12-м, 18-м месяце и во время последнего обследования. Заключение. Предшествующая терапия интерфероном β1b не оказывала отрицательного влияния на эффективность, безопасность или переносимость назначаемого после него ГА. Переход на ГА может способствовать улучшению состояния пациентов, перешедших на ГА с терапии интерфероном β1b.
Бетасерон, Копаксон, EDSS; глатирамера ацетат, интерферон β1b, рецидив, ремиттирующий рассеянный склероз.
На сегодняшний день иммуномодулирующие препараты являются средством выбора для лечения ремиттирующего рассеянного склероза (РРС). Лечение РРС начинают со следующих иммуномодуляторов: рекомбинантного интерферона бета (ИНФ-b) (ИНФ-b1b для подкожного (п/к) введения, Бетасерон (Betlex Inc., Монтвилль, штат Нью-Джерси, США); п/к ИНФ-b1а, Ребиф (Serono Inc., Женева, Швейцария); ИНФ-b1а, Авонекс (Biogen Idec, Кэмбридж, штат Массачусетс, США) для внутримышечного введения (в/м) и глатирамера ацетата (ГА), Копаксон (TEVA Pharmeceuticals Ltd., Кфар-Саба, Израиль)). ГА и интерфероны снижают частоту обострений, увеличивают процент пациентов без рецидивов, уменьшают прогрессирование неврологического дефицита, снижают частоту появления новых очагов и накопление имеющихся повреждений в Т2-режиме на МРТ [1–7].
Доказано, что механизм воздействия всех препаратов ИНФ-b на иммунную систему при PC практически одинаков [8, 9] в отличие от ГА [9, 10]. Пациенты с РРС, которые не могут или не хотят продолжать терапию определенным иммуномодулятором из-за плохой переносимости или недостаточного эффекта, могут улучшить свое состояние, перейдя на другой класс иммуномодуляторов [11].
К сожалению, в настоящее время имеется мало информации о том, окажет ли влияние предыдущее лечение иммуномодулятором на действие нового иммуномодулятора с другим механизмом действия и какое [12]. Более того, остается неясным, увеличится ли частота отказа от второго иммуномодулятора, если пациент уже ранее отказывался от ранее предложенного. Для предотвращения подобных влияний и наложения результатов пациенты, ранее получавшие лечение иммуномодуляторами, из пилотных (базовых) исследований препаратов ИНФ-b и ГА исключались [1, 5, 6].
Данное масштабное (n = 805) проспективное открытое многоцентровое исследование терапии ГА было проведено на гетерогенной популяции пациентов с РРС, включая и тех пациентов, которые на момент начала исследования отказались от терапии ИНФ-b1b из-за непереносимости или неэффективности препарата. Проводилась оценка влияния предыдущей терапии ИНФ-b1b на безопасность, переносимость или эффективность терапии ГА в результате сравнения между группами ранее не лечившихся пациентов и пациентов, ранее получавших ИНФ-b1b.
Методы. Пациенты
Это исследование длительностью 3,5 года проводилось на благотворительной основе; это означает, что пациенты были включены в исследование для приема ГА до того, как препарат поступил в продажу в США. В результате этого критерии включения были достаточно широкими, а размеры групп не были установлены заранее.
Критерии включения — соответствие клиническим и лабораторным критериям достоверного PC по Poser et al. [13], возраст старше 18 лет, ремиттирующее течение заболевания и балл по расширенной шкале инвалидизации (EDSS) [14] ≤ 6,0. Женщины детородного возраста должны были предохраняться от беременности в течение всего периода исследования.
Критерии исключения: участие в двойных слепых плацебо-контролируемых исследованиях ГА в течение 3 лет исследования; беременность и грудное вскармливание; прием кортикостероидов, адренокортикотропного гормона (АКТГ) или облучение лимфоидной ткани в течение 30 дней до начала исследования.
Группы пациентов: пациенты были разделены на две группы в зависимости от того, был ли прием ИНФ-b1b до начала исследования или нет. Пациенты, ранее принимавшие ИНФ-b1b (8 мМЕ в любой день), составили группу ранее лечившихся, а те, которые не получали ИНФ-b, вошли в группу ранее не лечившихся пациентов.
Схема лечения и дизайн исследования
Во время скрининга проводились сбор анамнеза, неврологическое обследование, оценка жизненно важных функций и лабораторных показателей (анализ мочи, общий и биохимический анализ крови). Кроме того, в группе ранее лечившихся пациентов выяснялась причина отказа от ИНФ- b1b. Со слов пациентов собиралась информация о количестве рецидивов за последние 2 года. В течение 2 лет, предшествовавших началу исследования, в группе ранее лечившихся пациентов выделялись периоды приема ИНФ-b и периоды перерыва в лечении, в группе нелеченых больных — период отсутствия лечения.
Пациенты самостоятельно делали п/к инъекции 20 мг глатирамера ацетата ежедневно. Каждые 3 мес. на очередных визитах пациенты получали следующую партию ГА на 3 мес. во флаконах, соответствующих одной дозе. Каждая доза растворялась в 1 мл дистиллированной воды для инъекций.
Каждые 3 мес. проводилась оценка побочных эффектов, фиксировались обострения и сопутствующая терапия и производился подсчет препарата. Каждые 6 мес. проводилось открытое неврологическое обследование и лабораторные тесты. Лабораторные изменения расценивались как клинически значимые, если они отличались от нормальных показателей или не соответствовали имеющейся на момент включения пациента патологии (например, стабильным изменениям на электрокардиограмме, привычным показателям глюкозы при компенсированном диабете). Частота возникновения, тяжесть побочных эффектов и их потенциальная взаимосвязь с исследуемым препаратом также фиксировалась лечащим врачом. Под серьезным побочным эффектом понималось возникновение любого смертельного или угрожающего жизни состояния со стойким нарушением функции, обусловленного передозировкой препарата, требующего госпитализации (кроме обострения PC) или приводящего к развитию врожденной патологии или рака.
Критериями эффективности были: частота обострений в год, процент пациентов без рецидивов, длительность периода до возникновения первого обострения и уменьшение балла инвалидизации по шкале EDSS. Под стойким прогрессированием заболевания понималось изменение балла по шкале EDSS по сравнению с исходными ≥ 1, сохраняющееся 6 мес. При возникновении рецидива необходимо было сообщить о нем и зафиксировать в течение 7 дней от его начала. Под рецидивом понималось появление нового или усугубление имеющегося одного неврологического симптома или более, которые сохранялись на протяжении как минимум 48 часов и которым предшествовало относительно стабильное неврологическое состояние в течение не менее 30 дней. Событие расценивалось как рецидив только при выявлении объективных изменений в неврологическом статусе, соответствующих увеличению балла EDSS ≥ 0,5 или увеличение на одну ступень в двух или более (из семи) функциональных системах (ФС) Курцке или на две ступени в одной ФС по сравнению с прошлыми результатами. Короткий курс кортикостероидной терапии или АКТГ при резком обострении допускался. Не разрешалось применять следующие средства: исследуемые препараты, интерфероны, иммуносупрессоры или длительный курс и большие дозы стероидов (> 30 дней > 2000 мг преднизолона перорально или > 7 дней 1000 мг/день метилпреднизолона в/в).
Протокол исследования проходил проверку в Комиссии по биомедицинской этике (КБМ) каждого центра или соответствующей центральной КБМ. Исследование проводилось в соответствии с руководством о надлежащей клинической практике и рекомендациями Управления по контролю за продуктами и лекарствами. Перед участием в исследовании все пациенты подписали информированное согласие.
Статистические методы
Включение в это проспективное открытое многоцентровое исследование производилось на благотворительной основе. Количество пациентов в группах не было определено заранее, поэтому проспективных статистических вычислений размера выборки не проводилось.
Категориальные переменные в группах в начале исследования сравнивали с помощью критерия c2, а дискретные — t-критерия. Балл инвалидизации по шкале EDSS при включении в исследование сравнивали между группами при помощи критерия Кохрана. Причины прерывания терапии ИНФ-b1b до включения в исследование и причины прерывания ГА во время исследования были сведены в таблицу. Время выхода из исследования оценивалось при помощи кривых выживания Каплана — Майера и сравнивалось с использованием логарифмического рангового критерия.
Данные обо всех включенных в исследование пациентах использовали при оценке безопасности препарата. Частоту возникновения побочных эффектов в группах сравнивали при помощи критерия c2.
Частота обострений в год анализировалась при помощи ковариационного анализа (ANCOVA), с использованием в качестве зависимой переменной наличия лечения в соответствии с центральными целями исследования. В качестве ковариант использовали количество рецидивов за 2 года до включения в исследование, балл EDSS в начале исследования и возраст при включении в исследование. Оценивался процент пациентов без рецидивов, длительность периода до первого обострения с помощью кривых выживания Каплана — Майера, сравнение которых проводилось с использованием логарифмического рангового критерия. Оценку взаимосвязи между временем до первого рецидива и исходными ковариантами проводили с помощью регрессионного анализа Вейбулла. Также оценивался средний временной интервал между прекращением приема ИНФ-b1b и началом приема ГА (время задержки) и определялась корреляция между временем задержки и частотой обострений в год и между временем задержки и временем до первого рецидива.
Конечная оценка балла по шкале EDSS проводилась через 12 и 18 мес. и в конце исследования, а затем сравнивалась с исходным баллом на начало исследования. Оценивалась динамика балла в каждой группе в отдельности, а также в подгруппах пациентов внутри одной когорты, разделенных в зависимости от исходного балла по шкале EDSS (0–2, 2,5–4, > 4). Процент пациентов со стойким прогрессированием заболевания в группах сравнивался с использованием критерия c2. Среднегодовые показатели скорости ухудшения, определяемые по изменению состояния к концу исследования по сравнению с исходным уровнем в перерасчете на период в 1 год, были проанализированы для всех пациентов в каждой группе и для подгрупп пациентов, разделенных в зависимости от исходного балла EDSS. Изменения показателя по EDSS были представлены в виде категориальных переменных в соответствии со следующими критериями: констатировалось «улучшение или стабильное состояние», если балл EDSS увеличивался менее чем на 1,5, и «ухудшение», если за время исследования данный показатель увеличивался на ≥ 1,5 балла.
Результаты. Исходные параметры
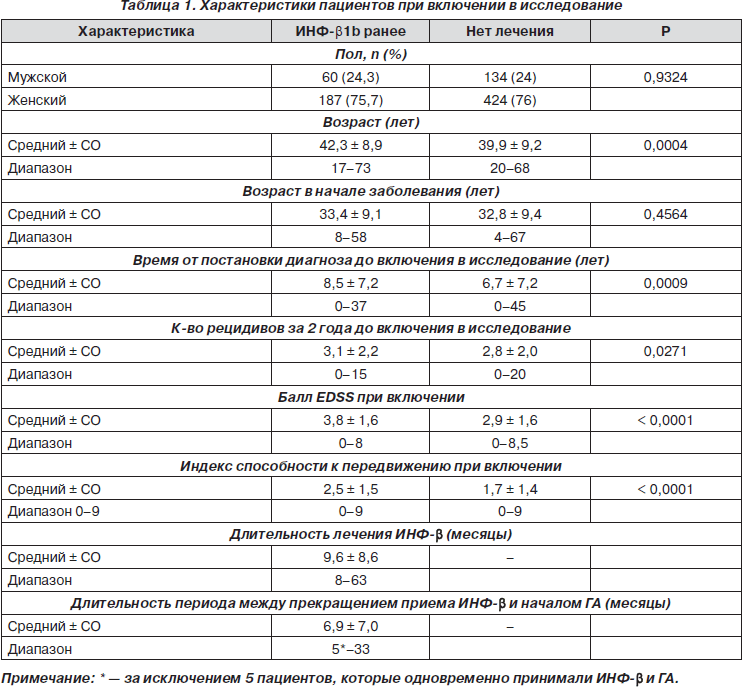
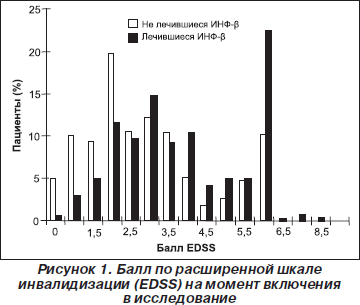
В исследование было включено 805 пациентов с РРС из 48 исследовательских центров: 247 пациентов составили группу принимавших ранее ИНФ-b1b и 558 больных — группу нелеченных ранее пациентов. На момент включения пациенты из группы ранее лечившихся больных были старше по возрасту и имели более длительный анамнез заболевания по сравнению с нелеченой группой (табл. 1). Тяжесть заболевания в группе лечившихся пациентов была больше, большее количество пациентов имели высокие баллы EDSS (р < 0,0001): приблизительно 22 % пациентов в группе лечившихся больных имели балл инвалидизации по EDSS, на момент включения равный 6,0 (необходима помощь при передвижении), и лишь 10 % — в группе не лечившихся больных (рис. 1).
Применение ИНФ-b1b
Средняя длительность лечения ИНФ-b1b в группе ранее лечившихся пациентов составляла около 10 мес. (диапазон: 8–63 мес.; табл. 1). Среднее время задержки между прекращением приема ИНФ-b и началом ГА приблизительно составило 6,9 мес.; 5 пациентов лечились одновременно двумя препаратами.
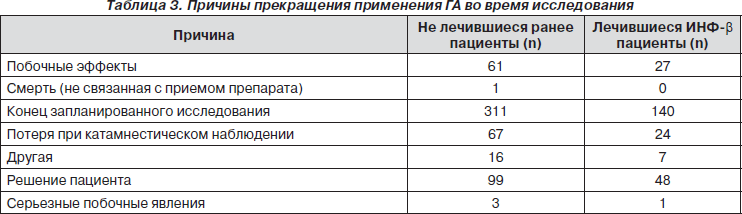
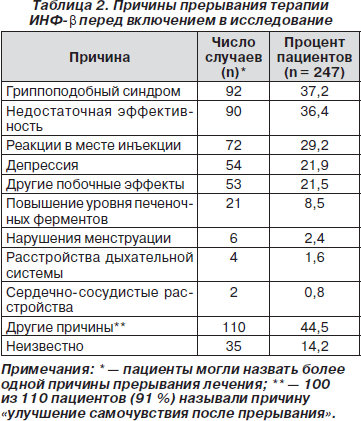
Причины отказа от лечения ИНФ-b были различными. Наиболее частой причиной было появление побочных эффектов в виде гриппоподобного синдрома, реакции в месте инъекции, депрессии и других явлений. Недостаточная эффективность ИНФ-b играла роль в принятии решения о прерывании терапии приблизительно у трети пациентов (табл. 2).
Длительность лечения глатирамера ацетатом
107 пациентов из группы ранее лечившихся и 247 нелечившихся пациентов прервали прием ГА до окончания исследования. Длительность терапии ГА в группе не лечившихся ранее пациентов составила 11 367 мес. (среднее ± СО: 20,3 ± 13,5 мес.), и 3645 мес. (среднее ± СО: 14,8 ± 7,7 мес.) — в группе пациентов, ранее принимавших ИНФ-b. Средняя продолжительность лечения ГА составила 36 мес. у нелечившихся и 24 мес. — у ранее лечившихся пациентов (р = 0,0330).
Безопасность и переносимость глатирамера ацетата
Причины отказа от лечения ГА между группами практически не различались. Наиболее частой причиной прекращения лечения было решение самого пациента (18,3 % всей выборки). Причины отказа от терапии ГА отражены в табл. 3. Из 88 пациентов (10,9 % каждой группы), указавших в качестве причины отказа возникновение побочных эффектов, 30 прервали терапию из-за появления реакций в местах инъекций. Одиннадцать пациентов прервали лечение из-за возникновения преходящей, самостоятельно регрессирующей, немедленной постинъекционной реакции (НПИР). Серьезные побочные эффекты стали причиной выбывания одного пациента из группы ранее лечившихся (кишечная непроходимость, не связанная с приемом ГА) и трех пациентов из группы нелечившихся (обморок (n = 1) и одышка (n = 1), возможно, связанные с приемом ГА; лихорадка (n = 1), не связанная с ГА).
Побочные эффекты, наблюдаемые при лечении ГА, по своей выраженности и частоте возникновения между группами не различались; большинство явлений (≥ 95 %) были оценены по степени тяжести как легкие или средние. Наиболее частыми побочными явлениями были: местные реакции на инъекции, которые отмечались у 61,5 % пациентов в группе нелечившихся и у 38,5 % пациентов, ранее принимавших ИНФ-b п/к (Р ≤ 0,02). Более 97 % местных реакций в обеих группах были расценены по степени тяжести как легкие или средние. У 125 пациентов (16 %) развилось 153 случая НПИР, характеризующихся расширением сосудов или болью в груди и сопровождающихся сердцебиением, тревогой или одышкой.
Серьезные побочные эффекты были зафиксированы у 5,3 % пациентов, ранее лечившихся, и у 8,1 % ранее не лечившихся пациентов. Среди случаев, встречавшихся более одного раза, можно выделить случайные травмы (4), инфекции (4), потерю сознания (5), психозы (2), камни в желчном пузыре (2), рак груди (2) и астму (2). Эти явления либо проходили со временем, либо приводили к выбыванию пациента из исследования (n = 4, см. выше).
Половых различий в профиле побочных явлений в группах не выявлялось. На фоне лечения ГА клинически значимых изменений лабораторных показателей или жизненно важных функций не наблюдалось.
Эффективность глатирамера ацетата
Рецидивы. Частота обострений в год за все время наблюдения в группах ранее лечившихся ИНФ-b и нелечившихся пациентов со средней продолжительностью лечения ГА 14,8 и 20,3 мес. соответственно значительно снизилась до 0,42 ± 0,84 и 0,34 ± 0,71 соответственно, р = 0,1482. По сравнению с частотой обострений за 2 года до исследования уровень рецидивов в год снизился на 75 % в обеих группах. Для всей исследуемой выборки балл инвалидизации по шкале EDSS и возраст на момент включения в исследование, а также количество обострений за 2 года до исследования были значимыми предикторами частоты обострений на фоне лечения. Прослеживалась отрицательная связь с возрастом (меньшая частота обострений в год при старшем возрасте) и положительная связь с исходным баллом EDSS и частотой обострений за 2 года до начала исследования.
У большинства пациентов из обеих групп за все 3,5 года исследования не было зафиксировано ни одного обострения: 68,4 % (169/247) пациентов в группе ранее лечившихся ИНФ-b и 69,5 % (388/558) в группе ранее не лечившихся пациентов (р > 0,9). Для пациентов без обострений средняя продолжительность терапии ГА составила 453 и 565 дней в группе лечившихся и ранее не лечившихся пациентов соответственно. Методом Каплана — Майера была оценена средняя продолжительность периода до возникновения первого рецидива, которая составила 1391 день в группе не лечившихся ранее пациентов. В группе получавших ранее ИНФ-b пациентов этот показатель отсутствует, т.к. у 50 % из них за все время исследования не было зафиксировано ни одного обострения. Длительность периода до первого обострения, рассчитанная для 25 % пациентов в группах ранее не лечившихся и лечившихся больных, составила 328 и 245 дней соответственно (р = 0,28).
Анализ с использованием регрессии Вейбулла показал, что длительность периода до первого обострения и частота обострений в год отрицательно связаны с исходным баллом EDSS на момент включения в исследование и частотой обострений за 2 предшествующих исследованию года (более раннее развитие рецидива наблюдается при исходно высоком балле по шкале EDSS и большей частоте обострений за 2 предшествующих года) и положительно связаны с возрастом (с увеличением возраста длительность периода до обострения увеличивается). Корреляции между временем задержки (промежутком между прекращением терапии ИНФ-b1b и началом ГА) и частотой обострений в год или длительностью периода до первого рецидива не выявлено.
Уровень инвалидизации
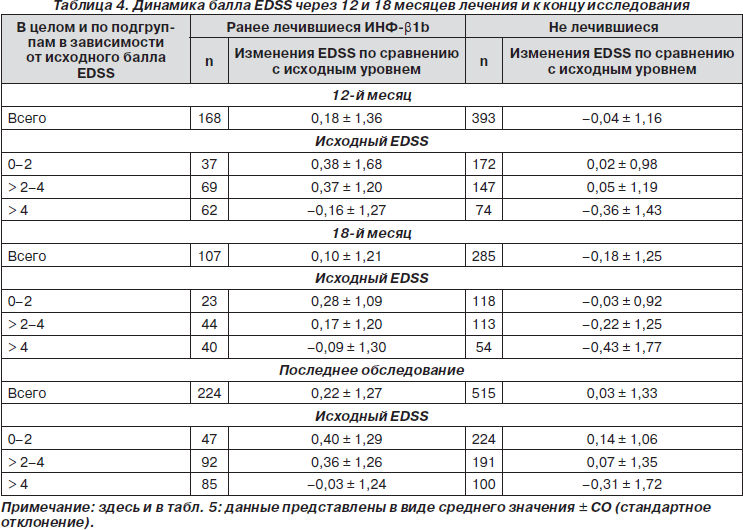
В табл. 4 отображена динамика показателя EDSS для всех пациентов и для пациентов, разделенных на подгруппы в соответствии с исходным баллом по EDSS на момент включения, через 12, 18 мес. лечения и в конце исследования. В каждой временной точке среднее изменение показателя по EDSS было меньше 0,5 балла для ранее лечившихся и нелечившихся пациентов независимо от исходного балла. Статистическая разница между баллами в группах в каждой временной точке (через 12, 18 месяцев и в конце исследования) была в пользу ранее не лечившихся пациентов (р = 0,0070, 0,0155 и 0,0018 соответственно). Внутри групп наблюдалась отрицательная связь между исходным показателем по EDSS и его динамикой на фоне лечения, что означает, что у пациентов с более высоким исходным баллом увеличение показателя по EDSS во всех оцениваемых точках было менее выраженным.
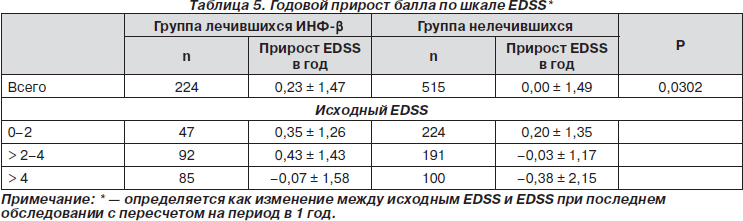
В табл. 5 представлен ежегодный прирост балла для всей выборки в целом и для подгрупп пациентов, разделенных в соответствии с исходным баллом EDSS. В целом среднегодовой прирост балла был выше в группе ранее лечившихся пациентов в подгруппах больных с исходным баллом 0–2 и 2–4 по EDSS по сравнению с группой нелеченых пациентов. Интересно, что прирост балла в подгруппе больных с наибольшим уровнем инвалидизации (> 4 баллов EDSS при включении) из ранее лечившейся ИНФ-b группы был ниже, чем в других подгруппах ранее лечившихся и подгруппе с наибольшей инвалидизацией в группе нелечившихся больных.
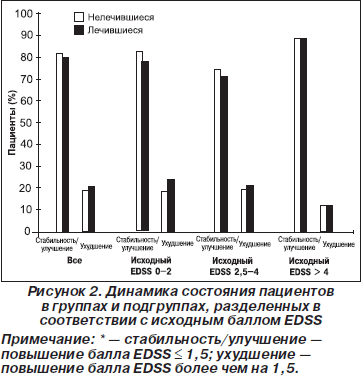
Статистической разницы по количеству пациентов с постоянным ухудшением между группами не выявлено (повышение балла EDSS ≥ 1 за 6 мес.; 7,7 % и 5,3 % среди нелечившихся и ранее лечившихся больных соответственно, р = 0,2090). Анализ категориальных переменных показал, что при средней продолжительности лечения ГА 20,3 и 14,8 мес. соответственно большинство пациентов из группы ранее не лечившихся, как и ранее лечившихся, имели стабильные или улучшившиеся показатели по EDSS (повышение < 1,5 балла) в целом и в подгруппах при разделении их в зависимости от исходного показателя EDSS (рис. 2).
Обсуждение
На момент проведения исследования не существовало объективных маркеров, которые позволили бы предварительно сказать, будут ли пациенты с РРС вообще отвечать на лечение, а также на какой из препаратов — ИНФ-b1b или ГА.
Часть пациентов не переносят какой-нибудь препарат или не отвечают на лечение им. Имеется немного данных, свидетельствующих, что отсутствие реакции на какой-либо определенный иммуномодулятор может повлиять на последующее лечение препаратом с другим механизмом действия. Кроме того, что доказана важность проведения профилактики иммуномодуляторами для замедления или предотвращения нарастания инвалидизации при РРС [7], необходимы доказательства того, что отсутствие ответа на какой-либо иммуномодулятор не обязательно влечет за собой неудачу при переводе пациента на другой препарат. Наши результаты показали, что предыдущее использование ИНФ-b1b не оказывает значительного влияния на последующую безопасность, переносимость и клиническую эффективность ГА у пациентов с РРС.
Результаты этого исследования могут быть полезными при планировании дизайна клинических исследований. Поскольку предыдущая терапия не влияла на последующий ответ на различные классы иммуномодуляторов, факт приема препарата может не быть критерием исключения при проведении клинических исследований. В обеих группах на фоне лечения ГА наблюдалось улучшение; разница между группами (например, прогрессирование балла EDSS) скорее всего отражает разницу в тяжести заболевания на момент включения в исследование (табл. 1). В последующих исследованиях с помощью рандомизации пациентов можно избежать ошибок, связанных с исходными различиями между группами.
Во время исследования меньше пациентов из группы ранее лечившихся прервали лечение ГА по сравнению с нелечившимися пациентами; однако эта группа закончила лечение раньше. Причина этого феномена неизвестна; возможно, пациенты, которые не могли или не хотели продолжать терапию ИНФ-b, имели большие надежды на новый препарат (в последующих исследованиях рандомизация может устранить фактор зависимости отказа от лечения от ожиданий пациента). Частота отказа от терапии ГА в обеих группах была выше по сравнению с другими исследованиями [15–17]. Дизайн этого открытого исследования сильно отличался от III фазы слепого клинического исследования, что могло неблагоприятно повлиять на участие пациентов в исследовании.
Безопасность и переносимость ГА не различались между группами нелечившихся и лечившихся ранее пациентов. В обеих группах локальное покраснение и болезненность в месте инъекции были наиболее частыми побочными эффектами. В группе ранее лечившихся ИНФ-b больных наблюдалась меньшая частота возникновения местных реакций на инъекцию ГА по сравнению с группой нелеченых больных, что, возможно, объясняется наличием опыта самостоятельных подкожных инъекций у леченых больных и тенденцией к снижению побочных реакций по мере увеличения длительности лечения [9]. Прием ГА сопровождался развитием транзиторных, не требующих лечения НПИР, характеризующихся хотя бы одним из следующих симптомов: расширением сосудов, чувством сдавления или боли в груди, дрожью, тахикардией или одышкой [10]. Приблизительно у 16 % пациентов отмечено появление одного и больше симптомов НПИР; большая часть симптомов была легкой или средней степени выраженности и проходила самостоятельно.
Результаты эффективности ГА в нашем исследовании были сопоставимы с результатами, полученными при переводе 85 пациентов с РРС с в/м применения ИНФ-b1а раз в неделю на протяжении 18–24 мес. на ГА из-за токсичности препарата (n = 19; 24 %) или недостаточной его эффективности (n = 60; 76 %) [12]. Через 36–42 мес. терапии ГА частота обострений снизилась на 58 % по сравнению с частотой во время в/м приема ИНФ-b1а (р = 0,0001). Значимое снижение частоты обострений наблюдалось среди пациентов, сменивших терапию из-за недостаточной эффективности ИНФ-b1а (1,29 против 0,48 соответственно; р = 0,0001).
Снижение частоты обострений на фоне ГА в данном исследовании более значимо (приблизительно на 75 % в обеих группах), чем в плацебо-контролируемых исследованиях [1, 3]. Частично это может быть связано с тем, что предыдущий анамнез о рецидивах собирался со слов пациента (хотя это могло привести и к недостаточному отчету о предыдущих рецидивах) в отличие от периода исследования, когда факт рецидива устанавливался врачом с использованием более строгих критериев обострения. Тем не менее приблизительно у 69 % из 805 пациентов с РРС за все время исследования на протяжении приблизительно 15 и 20 мес. не было зафиксировано ни одного обострения в группах лечившихся ранее и нелечившихся пациентов. Достоверной разницы в снижении частоты обострений на фоне терапии ГА между лечившимися и не лечившимися ранее пациентами выявлено не было, несмотря на разницу исходных характеристик пациентов. В целом влияние исходных данных на частоту обострений в год варьировало; более старший возраст в начале исследования коррелировал с большим снижением частоты обострений, а более высокий балл по шкале EDSS и/или частота обострений на момент включения коррелировали с меньшим снижением частоты рецидивов.
Средний балл по EDSS оставался таким же или уменьшался у большинства пациентов (> 80 %) в обеих группах, в то время как стойкое ухудшение наблюдалось менее чем у 10 % пациентов. Таким образом, несмотря на большую продолжительность заболевания и меньшую длительность приема ГА, пациенты из группы ранее лечившихся ИНФ-b получили значительную терапевтическую пользу от ГА. Разница в динамике балла по EDSS между группами свидетельствует о различной скорости прогрессирования заболевания у более пожилых пациентов с большей длительностью заболевания (группа ранее лечившихся ИНФ-b больных) по сравнению с молодыми пациентами, которые на более раннем этапе начали терапию иммуномодуляторами. Интересно, что ранее лечившиеся пациенты с высоким баллом инвалидизации по EDSS на момент начала исследования (> 4) отвечали на терапию ГА так же хорошо, как и ранее не лечившиеся пациенты с той же степенью инвалидизации. Это может быть обусловлено тем, что пациенты с PC имеют тенденцию к более медленному прогрессированию заболевания при баллах EDSS больше 4, чем при баллах от 0 до 4 [18]. Кроме того, меньшее нарастание балла по EDSS в группе не лечившихся ранее больных (табл. 4) соответствует данным о лучшем прогнозе, если терапия ГА началась на более ранних сроках заболевания (табл. 1) [15, 16].
В целом ежедневная терапия 20 мг п/к ГА была эффективной, безопасной и хорошо переносилась, и предшествовавшая терапия ИНФ-b никак на нее не повлияла. Пациенты, у которых не наблюдается улучшения при использовании одного класса иммуномодуляторов, могут получить значительный эффект при переходе на другой класс иммуномодулирующих препаратов.
Благодарности
Это исследование спонсировалось исследовательским грантом Teva Neuroscience США, Хоршам, штат Пенсильвания, США, и Teva Pharmaceuticals Ltd., Летах Тиква, Израиль.
Оригинал статьи опубликован в Acta Neurol. Scand., 2006, 113, p. 378-386.
1. Johnson К.Р., Brooks B.R., Cohen J.A. et al. Copolymer 1 reduces relapse rate and improves disability in relapsing-remitting multiple sclerosis // Neurology. — 1995. — 45. — 1268-76.
2. Johnson K.P., Brooks B.R., Cohen J.A. et al. Extended use of glatiramer acetate (Copaxone) is well tolerated and maintains its clinical effect on multiple sclerosis relapse rate and degree of disability // Neurology. — 1998. — 50. — 701-8.
3. Comi G., Filippi M., Wolinsky J.S. et al. European/Canadian multicenter, double-blind, randomized, placebo-controlled study of the effects of glatiramer acetate on magnetic resonance imaging-measured disease activity and burden in patients with relapsing multiple sclerosis // Ann. Neurol. — 2001. —49. — 290-7.
4. Jacobs L.D., Cookfair D.I., Rudick R.A. et al Intramuscular interferon beta-1a for disease progression in relapsing multiple sclerosis // Ann. Neurol. — 1996. — 39. — 285-94.
5. IFNβ Multiple Sclerosis Study Group. Interferon beta-1b is effective in relapsing-remitting multiple sclerosis. I. Clinical results of a multi-center, randomized, double-blind, placebo-controlled trial // Neurology. — 1993. — 43. — 655-61.
6. Prisms Study Group. Randomized double-blind placebo-controlled study of interferon β-1a in relapsing/remitting multiple sclerosis // Lancet. — 1998. — 352. — 1498-504.
7. Jeffery D.R. Early intervention with immunomodulatory agents in the treatment of multiple sclerosis // J. Neurol. Sci. — 2002. — 197. — 1-8.
8. Yong V.W. Differential mechanisms of action of interferon-b and glatiramer acetate in MS // Neurology. — 2002. — 59. — 802-8.
9. Milo R., Panitch H. Glatiramer acetate or interferon-β for multiple sclerosis. A guide to drug choice // CNS Drugs. — 1999. — 11. — 289-306.
10. Teva Neuroscience Inc. Copaxone® (glatiramer acetate injection) prescribing information. Kansas City, MO: Teva Neuroscience Inc., 2002.
11. Waubant E., Vukusic S., Gignoux L. et al. Clinical cha-racteristics of responders to interferon therapy for relapsing MS // Neurology. — 2003. — 61. — 184-9.
12. Caon C., Ching W., Din M., Zvartau-Hind M., Lisak R., Khan O. Extended follow-up and clinical course after change of immunomodulatory therapy in relapsing-remitting MS // Proceedings of the 13th Annual Meeting of the European Neurological Society, Istanbul, Turkey, 2003.
13. Poser C.M., Pay D.W., Scheinberg L. et al. New diagnostic criteria for multiple sclerosis: guidelines for research protocols // Ann. Neurol. — 1983. — 13. — 227-31.
14. Kurtzke J.F. Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS) // Neurology. — 1983. — 33. — 1444-52.
15. Johnson K.P., Brooks B.R., Ford C.C. et al. Glatiramer acetate (Copaxone®): comparison of continuous versus delayed Appendix therapy in a six year organized multiple sclerosis trial // Mult. Scler. — 2003. — 9. — 585-91.
16. Johnson K.P., Ford C.C., Lisak R.P. et al. Glatiramer acetate (Copaxone®): neurologic consequence of delaying glatiramer acetate therapy for multiple sclerosis: 8-year data // Acta Neurol. Scand. — 2005. — 111. — 42-7.
17. Ford C., Johnson K., Brooks B. et al. Sustained efficacy and tolerability of glatiramer acetate in relapsing-remitting multiple sclerosis patients for over 10 years // Proceedings of the 19th Annual Meeting of the European Committee for Treatment and Research in Multiple Sclerosis (ECTRIMS), Milan, Italy, 2003. — 485.
18. Confavreux C., Vukusic S., Moreau T., Adeleine P. Relapses and progression of disability in multiple sclerosis // N. Engl. J. Med. — 2000. — 343. — 1430-8.