Международный неврологический журнал 5 (43) 2011
Вернуться к номеру
Результаты доклинических и клинических исследований эффективности цитиколина 2009 и 2010 года
Авторы: Dаvalos A., Department of Neurosciences, Hospital Germans Trias i Pujol, Badalona, Universitat Autònoma de Barcelona, Barcelona, Spain
Secades J., Medical Department, Ferrer Group, Barcelona, Spain
Рубрики: Неврология
Версия для печати
Цитиколин является нейропротектором и обладает способностью восстанавливать нервные клетки, в некоторых странах его используют в лечении острого ишемического инсульта. Продолжаются исследования по изучению эффективности этого лекарственного препарата. В данном обзоре мы обратили особое внимание на последние публикации и доклады об основных текущих экспериментальных и клинических проектах, в которых используют цитиколин для восстановления после инсульта.
Острый инсульт, восстановление головного мозга, цитиколин, нейропротекция.
Цитидин-5-дифосфохолин (CDP-холин, или цитиколин) является важным промежуточным звеном в синтезе фосфатидилхолина, основного фосфолипида головного мозга. Экзогенный CDP-холин подвергается гидролизу и абсорбируется в виде цитидина и холина, затем происходит повторный синтез CDP-холина под действием CTP-фосфохолинцитидилилтрансферазы, являющейся ферментом, ограничивающим скорость синтеза фосфат-идилхолина [1–4]. CDP-холин также является донором холина в биосинтезе нейромедиатора ацетилхолина. Эффективность CDP-холина изучали среди более 11 000 добровольцев и пациентов, положительный эффект наблюдался при ишемии головного мозга, черепно-мозговых травмах и нарушениях памяти. Лечение CDP-холином прекрасно переносится, побочные эффекты встречаются редко, никогда не бывают тяжелыми и проявляются в основном в виде нарушения пищеварения, дискомфорта со стороны желудочно-кишечного тракта и возбуждения [1–4].
В исследованиях цитиколина продолжают изучать новые механизмы его действия, способность оказывать нейропротекторное действие и восстанавливать нервные клетки. Мы уделили основное внимание результатам исследований цитиколина, опубликованных в прошлом году.
Фундаментальные исследования
H.J. Lee и соавт. [5] изучали влияние цитиколина на уменьшение выраженности поражений белого вещества головного мозга и снижение когнитивных способностей, вызванных хронической гиперперфузией у крыс, путем проведения гистопатологических исследований и тестов на познавательное поведение. Животных разделили на группы немедленного и отсроченного лечения. Крысам в группе немедленного лечения проводили ложную операцию, вводили цитиколин (500 мг/кг в день) или фосфатно-солевой буфер в течение 21 дня после двусторонней окклюзии общей сонной артерии. В группе отсроченного лечения крысам вводили цитиколин 500 мг/кг в день или фосфатно-солевой буфер в течение 21 дня, начиная с 8-го дня после проведения оперативного вмешательства. Цитиколин или фосфатно-солевой буфер вводили интраперитонеально. С 17-го дня лечения крыс помещали в радиальный лабиринт с 8 ответвлениями для изучения когнитивных способностей. В группе немедленного лечения когнитивные функции сохранились у крыс, получавших цитиколин, а объем поражений белого вещества головного мозга и количество TUNEL-положительных клеток значительно отличались между группами животных, получавших цитиколин и фосфатно-солевой буфер. В группе отсроченного лечения не произошло снижения объема поражений белого вещества головного мозга и уменьшения количества TUNEL-положительных клеток, однако улучшение когнитивных функций было очевидным в группе животных, получавших цитиколин, по сравнению с группой, получавшей фосфатно-солевой буфер. Авторы пришли к выводу, что цитиколин позволяет предотвратить развитие поражений белого вещества головного мозга и способствует улучшению когнитивных функций даже на фоне отсроченного начала лечения.
На последней Европейской конференции по инсульту (Барселона, май 2010 года) прозвучали 2 новых доклада о фундаментальных исследованиях цитиколина. D. Giralt и соавт. [6] впервые представили нашему вниманию систематический обзор и методологию метаанализа для оценки доказательств протекторного влияния цитиколина в моделях инсульта на животных. Были выполнены 42 исследования эффективности лечения цитиколином на моделях ишемии головного мозга у животных. Проанализировали пятнадцать исследований с использованием модели очаговой ишемии, в которых описаны процедуры с участием 313 животных и представлены данные о влиянии цитиколина на размер зоны инфаркта (n = 313) или функциональный исход (n = 104). Оценка качества исследований варьировала в диапазоне от 0 до 10 баллов согласно рекомендациям по надлежащей лабораторной практике. В целом введение цитиколина привело к уменьшению объема инфаркта на 28 % (95% доверительный интервал (ДИ) от 19 до 38; р < 0,001), и этот эффект был более выражен при транзиторной ишемии (30 %; 95% ДИ от 15 до 45) по сравнению с моделями перманентной ишемии (25 %; 95% ДИ от 17 до 33). Улучшений в неврологических исходах не зарегистрировали (13 %; 95% ДИ от 4 до 30; р = 0,2). Качество исследований было невысоким (5 баллов; межквартильный размах от 4 до 8). Однако при стратификации по оценке качества (0–4 балла — низкое качество, 5–10 баллов — высокое качество) результаты высококачественных исследований продемонстрировали влияние цитиколина на уменьшение размера зоны инфаркта (30 %; 95% ДИ от 25 до 34), аналогичное таковому в исследованиях низкого качества (29 %; 95% ДИ от 25 до 33). При сравнении доз обнаружили, что у животных, получавших высокие дозы (300–500 мг/кг) цитиколина, улучшение было более выраженным (27 %; 95% ДИ от 9 до 46), чем у животных, получавших низкие дозы препарата (100–300 мг/кг; 18 %; 95% ДИ от 5 до 32; р < 0,001). Авторы пришли к выводу, что результаты этого метаанализа в очередной раз подтвердили позитивное влияние цитиколина на уменьшение объема инфаркта: доза цитиколина от 300 до 500 мг/кг является оптимальной в качестве возможного нейропротектора для лечения инсульта у человека.
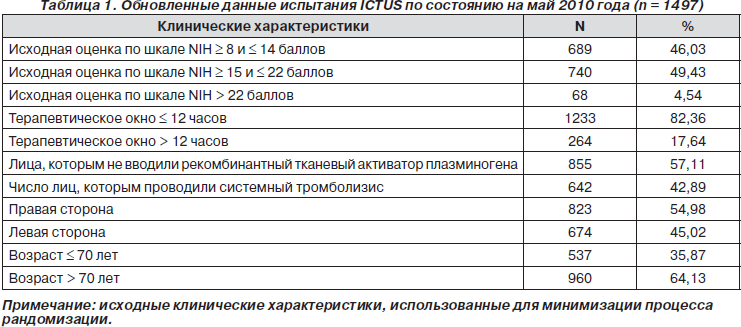
Известно, что стимуляция эндогенных трофических факторов и экзогенное введение мезенхимальных стволовых клеток (МСК) могут привести к улучшению репаративных процессов и неврологического восстановления. M. Gutiйrrez и соавт. [7] проанализировали терапевтический эффект цитиколина, МСК и их сочетания на репаративные процессы и функциональное восстановление после перманентной окклюзии средней мозговой артерии. Самцов крыс Sprague-Dawley (Harland Ibйrica SL, Барселона; n = 35) разделили на 5 групп: группа 1 — ложнооперированные, группа 2 — контрольная, группа 3 — получавшие цитиколин (интраперитонеально, 500 мг/кг); группа 4 — получавшие МСК (внутривенно, 2 × 106 клеток); группа 5 — получавшие комбинацию цитиколина и МСК. Эффект лечения оценивали по функциональным шкалам, объему инфаркта по результатам МРТ, окрашиванию срезов тканей мозга гематоксилином и эозином, гибель нейронов выявляли с помощью TUNEL-окрашивания, клеточную пролиферацию оценивали с помощью BrdUrd-иммуногистохимического анализа, экспрессию сосудистого эндотелиального фактора роста изучали методом иммунофлюоресценции, а уровни интерлейкина-6 и фактора некроза опухоли a в плазме крови определяли с помощью иммуноферментного анализа. Крыс забили через 14 дней. Во всех группах лечения через 24 часа и 14 дней неврологические показатели были лучше, чем в контрольной группе (рис. 1). Ни в одной группе лечения не произошло уменьшения объема инфаркта, но при введении цитиколина и МСК снизилось количество TUNEL-положительных клеток (р < 0,05), увеличилось количество BrdUrd-положительных клеток и возрос уровень экспрессии сосудистого эндотелиального фактора роста в периинфарктной зоне по сравнению с контрольной группой. Авторы пришли к выводу, что введение цитиколина и МСК оказывает одинаковый положительный эффект на неврологическое восстановление, уменьшение гибели нейронов и стимулирует нейро- и ангиогенез.
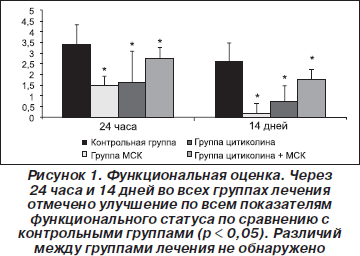
Было показано, что повышение содержания железа независимо ассоциировано с неблагоприятным исходом у пациентов с острым инсультом [8]. В связи с этим N. De Gregorio-Rocasolano и соавт. [9] показали, что цитиколин позволяет защитить нейроны от токсичного влияния железа. Они инкубировали первично культивированные нейроны с железом в течение 48 часов, а затем в течение 90 минут подвергали их кислородно-глюкозной депривации (КГД). Гибель клеток определяли через 15 минут и 24 часа после восстановления нормоксии (реперфузии). Предварительная обработка 20 и 50 ммоль/л железа привела к ранней гибели нейронов по сравнению с необработанными культурами. Различие в числе погибших клеток (%) через 15 минут и 24 часа после реперфузии было максимальным в контрольной группе и снижалось в зависимости от концентрации железа. Авторы пришли к выводу, что избыточное содержание железа приводит к ранней гибели клеток после реперфузии и снижению количества жизнеспособных клеток, сохраняющихся после восстановления нормоксии (рис. 2).
Клинические исследования
J.L. Saver [10] опубликовал формальный метаанализ исследований, включающих результаты 10 испытаний цитиколина при лечении ишемического и геморрагического инсультов. Цель этого метаанализа заключалась в оценке положительного терапевтического влияния цитиколина. У 2279 пациентов, включенных в исследования, назначение цитиколина по сравнению с плацебо было ассоциировано с существенным снижением частоты развития летального исхода или потери трудоспособности в течение длительного периода последующих наблюдений (57,0 и 67,5 %, отношение шансов (ОШ) = 0,64; 95% ДИ от 0,54 до 0,77; р < 0,001). Анализ, ограниченный данными 4 крупнейших (n > 100) исследований с участием пациентов с ишемическим инсультом, выявил однородную группу хорошо изученных испытаний, в которых были получены аналогичные результаты. Анализ безопасности во всех испытаниях, содержащих данные об уровне летальности по окончании периода наблюдений, продемонстрировал отсутствие побочных эффектов цитиколина: цитиколин 179/1235 (14,5 %) по сравнению с плацебо 135/966 (14,0 %, ОШ = 0,99; 95% ДИ от 0,77 до 1,21; р = 0,94).
Недавно были опубликованы результаты исследования по контролю за клиническим использованием препарата [11]. Цель исследования заключалась в оценке эффективности и безопасности перорального назначения цитиколина 4191 пациенту с острым ишемическим инсультом в Корее. Цитиколин назначали перорально (500–4000 мг/сут) в течение первых 24 часов от момента появления симптомов инсульта 3736 пациентам (группа раннего лечения) и спустя 24 часа от начала инсульта 455 пациентам (группа отсроченного лечения) курсом не менее 6 недель. Через 6 недель лечения произошло улучшение по всем показателям, таким как оценка по сокращенному варианту шкалы NIH, индекс Бартел и оценка по модифицированной шкале Рэнкина (р < 0,05). Безопасность цитиколина была отличной, зарегистрировали только 37 побочных эффектов у 31 пациента (0,73%). Наиболее частыми побочными эффектами были головная боль (n = 3), желудочно-кишечные расстройства (n = 5), системные кровотечения (n = 4) и осложнения, связанные с инсультом (n = 8).
Было показано, что увеличение числа циркулирующих эндотелиальных прогениторных клеток (ЭПК) после острого ишемического инсульта ассоциировано с хорошим функциональным исходом, уменьшением роста зоны инфаркта и неврологическим улучшением [12]. В связи с этим T. Sobrino и соавт. [13] изучали влияние назначения цитиколина в остром периоде инсульта на увеличение концентрации ЭПК в крови. В исследование проспективно включили сорок восемь пациентов с впервые развившимся нелакунарным ишемическим инсультом, поступивших в течение 12 часов от момента появления симптомов заболевания. Пациентов включили в группу лечения, в которой назначали цитиколин в дозе 2000 мг/сут в течение 6 недель (n = 26), и в группу контроля, в которой цитиколин не назначали (n = 22). Колонии ЭПК количественно определяли по прорастающим колониеобразующим эндотелиальным клеткам (CFU-EC). Прирост ЭПК в течение первой недели рассчитали как разницу в числе CFU-EC при поступлении и на 7 день. Исходное количество CFU-EC у пациентов, получавших и не получавших цитиколин, практически не отличалось (7,7 ± 6,1 и 9,1 ± 7,3 CFU-EC; p = 0,819). Однако у пациентов, получавших цитиколин и рекомбинантный тканевый активатор плазминогена, прирост ЭПК был больше, чем у пациентов, получавших только цитиколин или не получавших этот препарат вовсе (35,4 ± 15,9; 8,4 ± 8,1 и 0,9 ± 10,2 CFU-EC; р < 0,001). В модели логистической регрессии терапия цитиколином (ОШ = 7,6; 95% ДИ от 2,3 до 137,5; р = 0,006) и комбинированное лечение цитиколином и рекомбинантным тканевым активатором плазминогена (OШ = 108,5; 95% ДИ от 2,9 до 1094,2; р = 0,001) были независимо ассоциированы с увеличением ЭПК ≥ 4 CFU-EC. Авторы пришли к выводу, что назначение цитиколина и комбинированная терапия цитиколином и рекомбинантным тканевым активатором плазминогена при остром ишемическом инсульте приводят к повышению содержания ЭПК.
Сосредоточив внимание на репаративных эффектах цитиколина, G. Ortega и соавт. [14] представили результаты клинического исследования по оценке безопасности и эффективности цитиколина в отношении сохранения когнитивных функций после инсульта. Авторы включили в исследование 347 пациентов с впервые развившимся инсультом, у которых оценку когнитивных функций проводили с помощью полного набора нейропсихологических тестов через 6 недель (± 3 дня) и 6 месяцев (± 7 дней) после учетного события. Все пациенты получали цитиколин (2 г/сут) в течение 6 недель, а затем были рандомизированы в группы продолжения лечения цитиколином (1 г/сут) до 6 месяцев (n = 172) или прекращения лечения цитиколином (n = 175). Снижение когнитивных способностей по каждому домену оценивали с использованием модели логистической регрессии. Средний возраст пациентов составил 67,2 года, среднее время обучения — 5,7 года. Исходные характеристики были сопоставимы между группами. Тридцать пациентов умерли в течение периода наблюдений. У четырех пациентов развились побочные эффекты, связанные с приемом цитиколина, но они продолжили лечение. Через 6 месяцев у пациентов, не получавших цитиколин, зарегистрировали более значительные когнитивные нарушения в сфере внимания, исполнительных функций (ОШ = 1,7; 95% ДИ от 1,09 до 2,73; p = 0,019) и ориентации во времени (ОШ = 1,73; 95% ДИ от 1,02 до 2,93; р = 0,042). Авторы пришли к выводу, что лечение цитиколином в течение 6 месяцев после впервые развившегося ишемического инсульта является безопасным и эффективным в отношении улучшения когнитивных функций.
В настоящее время продолжается проведение двух крупных клинических испытаний цитиколина. Испытание Citicoline Brain Injury Treatment Trial (COBRIT), проводимое в США, является рандомизированным двойным слепым плацебо-контролируемым многоцентровым исследованием, посвященным анализу влияния лечения цитиколином (по 100 мг 2 раза в день) в течение 90 дней, по сравнению с плацебо, на функциональный исход у пациентов с травматическим поражением головного мозга легкой, средней и тяжелой степеней тяжести [15]. В общей сложности планируют исследовать 1292 пациента в течение расчетного периода продолжительностью 32 месяца. Первичная конечная точка включает оценки по множеству шкал, которые будут проанализированы как комплексный показатель методом общего тестирования через 90 дней. Показатели включают оценки по следующим ключевым группам тестов: калифорнийский тест вербального научения II (California Verbal Learning Test II); тест Controlled Oral Word; тест на выявление ассоциаций (Association Test); тест повторения цифр (Digit Span Test); расширенная шкала исходов Глазго (Extended Glasgow Outcome Scale); индекс скорости обработки информации (Processing Speed Index); Струп-тест, части 1 и 2 (Stroop Test part 1, Stroop Test part 2), тест построения маршрута, части А и B (Trail-Making Test, parts A and B). Ко вторичным конечным точкам относятся выживаемость, токсичность и скорость восстановления. После промежуточного анализа размер выборки был увеличен почти до 1500 пациентов, и первые результаты ожидаются в 2011 году.
В Европе мы разрабатываем испытание ICTUS [16]. Это многоцентровое рандомизированное (при минимизации) двойное слепое плацебо-контролируемое исследование. Оно будет сопровождаться последовательным анализом (треугольная модель) [17], с верхним пределом в 2600 пациентов. Мощность такого дизайна в отношении определения эффекта лечения в 1,26 (общее ОШ) составляет 80 %. Первичная конечная точка будет состоять из глобального теста, включающего 3 показателя успешности лечения, которые будут оценивать через 12 недель после лечения на основе критериев в зависимости от времени от учетного события до начала лечения: неврологический исход (оценка по шкале NIH ≤ 1 балла), инвалидность (оценка по модифицированной шкале Рэнкина ≤ 1 балла) и активность в повседневной жизни (индекс Бартел ≥ 95), все показатели усредняются с помощью общего теста. Уточненный вариант испытания ICTUS был представлен на последней Европейской конференции по инсульту; на 3 мая 2010 года в 50 активных центрах в Испании, Португалии и Германии в исследование включили 1497 пациентов. В табл. 1 представлены характеристики пациентов в соответствии с 5 факторами, используемыми в процессе минимизации рандомизации. Отметим, что у 54 % пациентов исходная оценка по шкале NIH составляет более 15 баллов, а 43 % пациентам проводили системный тромболизис.
Таким образом, проведение фундаментальных исследований способствует увеличению числа доказательств, свидетельствующих о роли цитиколина в защите и восстановлении головного мозга. Продолжающиеся ключевые клинические испытания могут подтвердить результаты небольших исследований, в которых указывается на эффективность цитиколина при травматическом повреждении головного мозга и церебральной ишемии.
Впервые опубликовано в журнале Stroke. — 2011. — 42 (Suppl. 1). — S36-S39
1. Secades J.J., Lorenzo J.L. Citicoline: Pharmacological and clinical review, 2006 Update // Methods Find Exp. Clin. Pharmacol. — 2006. — 28 (Suppl. B). — 1-56.
2. Adibhatla R.M., Hatcher J.F., Larsen E.C. Cytokine biology, lipid metabolism and citicoline in stroke // J. Cereb. Blood Flow Metab. — 2007. — 27 (Suppl. 1). — B06-B02.
3. Adibhatla R.M., Hatcher J.F. Role of lipids in brain injury and diseases // Future Lipidol. — 2007. — 2. — 403-422.
4. Adibhatla R.M., Hatcher J.F. Lipid oxidation and peroxidation in CNS health and disease: from molecular mechanisms to therapeutic opportunities // Antioxid. Redox Signal. — 2010. — 12. — 125-169.
5. Lee H.J., Kang J.S., Kim Y.I. Citicoline protects against cognitive impairment in a rat model of chronic cerebral hypoperfusion // J. Clin. Neurol. — 2009. — 5. — 33-38.
6. Giralt D., Garcнa-Bonilla L., Campos M., Sosti V., Rosell A., Montaner J. Selecting the optimal dose of citicoline treatment in animal models of focal cerebral ischemia through a meta-analysis // Cerebrovasc. Dis. — 2010. — 29 (Suppl. 2). — 165.
7. Gutiйrrez M., Rodriguez-Frutos B., Alvarez-Grech J., Exposito-Alcaide M., Vallejo-Cremades M., Merino J., Diez-Tejedor E. Effects of citicoline and mesenchymal stem cells in acute cerebral infarct. Experimental study in rats // Cerebrovasc. Dis. — 2010. — 29 (Suppl. 2). — 317-318.
8. Pйrez de la Ossa N., Sobrino T., Silva Y., Blanco M., Millбn M., Gomis M., Agulla J., Araya P., Revertй S., Serena J., Dбvalos A. Iron-related brain damage in patients with intracerebral hemorrhage // Stroke. — 2010. — 41. — 810-813.
9. De Gregorio-Rocasolano N., Ponce J., Guirao V., Pйrez de la Ossa N., Dбvalos A., Gasull T. Iron overload increases early death of neurons during hypoxia and lowers the opportunity to save neurons after reperfusion // Cerebrovasc. Dis. — 2009. — 27 (Suppl. 6). — 114.
10. Saver J.L. Citicoline: update on a promising and widely available agent for neuroprotection and neurorepair // Rev. Neurol. Dis. — 2008. — 5. — 167-177.
11. Cho H.J., Kim Y.J. Efficacy and safety of oral citicoline in acute ischemic stroke: drug surveillance study in 4,191 cases // Methods Find Exp. Clin. Pharmacol. — 2009. — 31. — 171-176.
12. Sobrino T., Hurtado O., Moro M.A., Rodrнguez-Yбсez M., Castellanos M., Brea D., Moldes O., Blanco M., Arenillas J.F., Leira R., Dбvalos A., Lizasoain I., Castillo J. The increase of circulating endothelial progenitor cells after acute ischemic stroke is associated with good outcome // Stroke. — 2007. — 38. — 2759-2764.
13. Sobrino T., Rodrнguez-Gonzбlez R., Blanco M., Brea D., Perez-Mato M., Rodriguez-Yanez M., Leira R., Castillo J. CDP-choline treatment increases circulating endothelial progenitor cells in acute ischemic stroke // Neurol. Res. — 2010. — in press.
14. Ortega G., Jacas C., Quintana M., Ribу M., Santamarina E., Maisterra O., Molina C., Montaner J., Roman G., Alvarez-Sabнn J. Citicoline treatment prevents neurocognitive decline after a first ischemic stroke // Cerebrovasc. Dis. — 2010. — 29 (Suppl. 2). — 268.
15. Zafonte R., Friedewald W.T., Lee S.M., Levin B., Diaz-Arrastia R., Ansel B., Eisenberg H., Timmons S.D., Temkin N., Novack T., Ricker J., Merchant R., Jallo J. The citicoline brain injury treatment (COBRIT) trial: design and methods // J. Neurotrauma. — 2009. — 26. — 2207-2216.
16. Dбvalos A. Protocol 06PRT/3005: ICTUS study: International Citicoline Trial on acUte Stroke (NCT00331890) oral citicoline in acute ischemic stroke. Lancet Protocol Reviews 2007. Available at: http://www.thelancet. com/journals/lancet/ misc/protocol/protocolreviews. Accessed April 10, 2008.
17. Bolland K., Whitehead J., Cobo E., Secades J.J. Evaluation of a sequential global test of improved recovery following stroke as applied to the ICTUS trial of citicoline // Pharm. Stat. — 2009. — 8. — 136-149.