Международный неврологический журнал 5 (43) 2011
Вернуться к номеру
Особливості когнітивних порушень у хворих із метаболічним синдромом
Авторы: Копчак О.О., Центральний госпіталь МВС України, м. Київ
Рубрики: Неврология
Версия для печати
Мета дослідження: з’ясувати особливості зв’язку метаболічного синдрому (МС) та його окремих компонентів із когнітивними порушеннями; вивчити характер зв’язку між когнітивними розладами та МС у пацієнтів з дисциркуляторною енцефалопатією (ДЕ) різного віку; встановити, чи існують особливості когнітивних порушень у хворих із ДЕ з МС порівняно з пацієнтами без такого. До дослідження увійшли 160 хворих із ДЕ віком від 45 до 89 років, які становили дві групи: основну (з МС) та контрольну (без МС). Всі пацієнти були розподілені на 3 вікові підгрупи: 45–59 років — середній вік, 60–74 — похилий вік, 75–89 років — старечий вік. Ступінь когнітивних порушень оцінювали за допомогою короткої шкали оцінки психічного статусу (Mini Mental State Examination). Додатково використовували: методику заучування 10 слів, таблиці Шульте, тест заучування парних взаємопов’язаних слів (The Paired Associates Learning Test). З усіх компонентів МС лише цукровий діабет вірогідно впливав на стан когнітивних функцій у хворих. Лише в пацієнтів похилого віку виявлено вірогідний зв’язок МС із тяжкістю когнітивних розладів. Найбільш чутливими до впливу МС у хворих з ДЕ виявилися процеси запам’ятовування, збереження й відтворення інформації, розумова працездатність, темп сенсомоторних реакцій.
Когнітивні розлади, дисциркуляторна енцефалопатія, метаболічний синдром, цукровий діабет.
У найближчому майбутньому серед населення розвинутих країн світу прогнозується загрозливе зростання поширеності деменції [10]. Цереброваскулярні хвороби є другою за частотою причиною набутого когнітивного дефіциту, особливо судинної деменції, а також відіграють значну роль у розвитку нейродегенеративної деменції, зокрема хвороби Альцгеймера [17].
Поєднання цереброваскулярних факторів та порушення таких когнітивних функцій, як пам’ять, інтелект, праксис, гнозис, мовлення чи увага, являють собою судинні когнітивні розлади (СКР) [16]. Наявність в одного пацієнта трьох або більше з таких факторів ризику: артеріальна гіпертензія (АТ > 130/85 мм рт.ст.) або вживання гіпотензивних препаратів, ожиріння (окружність талії > 94 см у чоловіків, > 80 см — у жінок) та дисліпідемія (підвищення рівня тригліцеридів сироватки крові ≥ 1,7 ммоль/л або нормальний рівень тригліцеридів при відповідній терапії; зниження рівня ліпопротеїдів високої щільності (ЛПВЩ) < 1 ммоль/л для чоловіків та < 1,3 ммоль/л для жінок або нормальний рівень ЛПВЩ при відповідній терапії), підвищення рівня глюкози плазми крові натще ≥ 5,6 ммоль/л або терапія гіперглікемії, дає право діагностувати метаболічний синдром (МС) [2]. Дотепер зв’язок між МС або його окремими складовими та СКР ще недостатньо вивчений, у літературі зустрічаються суперечливі дані щодо впливу метаболічного синдрому на вираженість СКР у хворих [4, 12]. M.G. Dik та співавтори [4] виявили вірогідний зв’язок між МС та значним зниженням когнітивних функцій у хворих, особливо швидкості обробки інформації. У дослідженні N.M. Gatto та співавторів [7] виявлено, що хворі з МС без цукрового діабету гірше виконували когнітивні тести, що оцінюють функцію вербальної та семантичної пам’яті, порівняно з пацієнтами без МС. З іншого боку, результати проспективних досліджень свідчать, що наявність цукрового діабету вірогідно підвищує частоту судинних когнітивних порушень, особливо судинної деменції, у хворих [19]. Зокрема, у лонгітудинальному дослідженні у хворих із цукровим діабетом ІІ типу порівняно з контрольною групою протягом 4-річного періоду спостерігали виражене наростання когнітивного дефіциту: зниження швидкості обробки інформації, концентрації уваги [19].
У проспективному дослідженні МС та розвитку когнітивних розладів у літніх жінок спостерігали зростання когнітивних порушень при наявності МС протягом чотирирічного періоду. Крім того, при вивченні ізольованого впливу кожного з п’яти компонентів метаболічного синдрому на стан когнітивних функцій у хворих відмічено, що лише гіперглікемія вірогідно підвищувала пов’язаний із віком ризик когнітивних порушень [21]. Водночас за даними іншого дослідження, тільки знижений рівень ліпопротеїдів підвищеної щільності вірогідно впливав на погіршення пам’яті у жінок похилого віку незалежно від інших чинників метаболічного синдрому [12]. С.М. Carlsson та співавтори [3] знайшли значний зв’язок між підвищеним рівнем атерогенних ліпопротеїдів у хворих та зниженням когнітивних функцій.
Суперечливими є дані щодо артеріальної гіпертензії та СКР. Пацієнти з підвищеним АТ у середньому віці мають високий ризик розвитку СКР [5]. Потребує уточнення зв’язок між СКР та артеріальною гіпертензією в похилому віці. У деяких дослідженнях виявлено підвищений ризик розвитку судинної деменції та хвороби Альцгеймера у пацієнтів похилого віку з підвищеним систолічним тиском [14]. Однак в інших дослідженнях не спостерігали жодного зв’язку між артеріальною гіпертензією в похилому віці та судинною деменцією [9].
A.M. Kanaya та співавтори [11] знайшли вірогідний зв’язок ожиріння з когнітивним зниженням в осіб чоловічої статі після виключення впливу інших компонентів метаболічного синдрому, в той час як у жінок не спостерігали подібного зв’язку. Цікаві дані виявлено щодо зв’язку індексу маси тіла (ІМТ) та СКР. Зокрема, T.F. Hughes та співавтори [8] пов’язують підвищений ІМТ у людей середнього віку та повільне його зниження в похилому віці зі зниженим ризиком виникнення деменції, вказуючи, що низький ІМТ або швидке його зниження в людей похилого віку можна вважати індикаторами деменції, особливо для тих, хто в середньому віці мав ожиріння або надмірну вагу.
C. Raffaitin [15] з колегами не виявили зв’язку між кількістю чинників метаболічного синдрому та ризиком когнітивного зниження у хворих, що збігається з результатами інших досліджень [20]. Не у всіх дослідженнях спостерігали наявність вірогідного зв’язку між метаболічним синдромом та когнітивним зниженням. Наприклад, van den Berg та колеги [18] при вивченні когнітивних функцій у пацієнтів старечого віку (≥ 85 років) не знайшли зв’язку між вираженістю когнітивного зниження та метаболічним синдромом. До механізмів, що пояснюють зв’язок метаболічного синдрому та СКР, належать мікросудинні та макросудинні порушення, запалення, ожиріння та інсулінова резистентність. Індуковані центральним ожирінням гормональні порушення (гіперлептинемія) супроводжуються гіперкортизолемією, що призводить до атрофії гіпокампу, внаслідок чого порушуються процеси навчання та пам’яті. Ці нейроендокринні порушення тісно пов’язані з активацією симпатичної нервової системи, що супроводжується структурними порушеннями в головному мозку. Запалення, що виникає через наявність ожиріння, на що вказують підвищені рівні прозапальних маркерів, таких як С-реактивний білок, інтерлейкін-6 та фактор некрозу пухлини альфа, також здійснює негативний вплив на когнітивні функції у хворих [20]. В основі зв’язку між запаленням та метаболічним синдромом лежить атеросклеротичний процес, що також робить внесок у розвиток когнітивного зниження у хворих [4]. Діабет призводить до СКР та деменції через декілька різних механізмів. Одним із них є ускладнення, що супроводжують діабет: гіпертензія, гіперліпідемія, інсульт. Крім того, цукровий діабет призводить до підвищення в’язкості крові, індукованої оксидативним стресом ендотеліальної дисфункції та пошкодження гематоенцефалічного бар’єру. Ці зміни, у свою чергу, призводять до порушення церебральної перфузії і, таким чином, до когнітивних розладів. Більше того, хронічна гіперглікемія супроводжується пошкодженням церебральних капілярів, потовщенням їх мембрани, що призводить до ішемії мозку, у результаті чого виникають структурні зміни в головному мозку: атрофічний процес, лакунарні інфаркти [4]. До ймовірних механізмів, через які гіпертензія призводить до виникнення СКР, належать: німі ішемічні вогнища, атрофія головного мозку, атеросклероз великих судин мозку, голови та шиї, ендотеліальна та клітинна дисфункція та зниження мозкового кровотоку. Найчастіше вогнища ураження локалізуються у глибинних відділах білої речовини головного мозку, що призводить до порушення фронто-стріато-палідо-таламічних зв’язків та як наслідок цього — до розвитку когнітивних порушень [21].
Метою даного дослідження було з’ясувати особливості зв’язку метаболічного синдрому та його окремих компонентів із когнітивними порушеннями; вивчити характер зв’язку між когнітивними розладами (КР) та метаболічним синдромом у пацієнтів із хронічною недостатністю мозкового кровообігу (ХНМК) середнього, похилого та старечого віку, а також за допомогою нейропсихологічних тестів оцінки різних когнітивних доменів встановити, чи існують особливості когнітивних порушень у хворих на ХНМК із метаболічним синдромом порівняно з пацієнтами без нього.
Матеріали та методи
У дослідження увійшли 160 хворих з ХНМК віком від 45 до 89 років (у середньому 63,1 ± 9,8 року), які перебували на лікуванні в неврологічному відділенні Центрального госпіталю Міністерства внутрішніх справ України. Залежно від наявності метаболічного синдрому пацієнти були розподілені на дві групи: основну (з метаболічним синдромом, n = 77) та контрольну (без метаболічного синдрому, n = 83), що були рівнозначні за віком, статтю, рівнем освіти. Всі пацієнти були розподілені на 3 вікові підгрупи: 45–59 років — середній вік, 60–74 — похилий вік, 75–89 років — старечий вік. В основній групі було 32 пацієнти середнього віку, 36 осіб похилого віку та 9 хворих старечого віку. У контрольній групі віковий склад хворих був таким: середній вік — 35, похилий — 36, старечий — 12 осіб. Клінічний діагноз у всіх випадках формулювався як дисциркуляторна енцефалопатія (ДЕ) атеросклеротичної, гіпертонічної, дисметаболічної, частіше змішаної етіології. В основній групі ДЕ ІІ стадії діагностовано у 41 хворого, з яких середнього віку були 21, похилого — 16, старечого — 4 особи; ІІІ стадії — у 36 пацієнтів , серед них середнього віку — 11, похилого — 20, старечого — 5 обстежених. У контрольної групи ДЕ ІІ стадії діагностовано у 47 хворих, з яких середнього віку були 24, похилого — 16, старечого — 7 осіб; ІІІ стадії — у 36 пацієнтів, серед них середнього віку — 11, похилого — 20, старечого — 5 обстежених. Всі хворі пройшли клініко-неврологічне обстеження з вимірюванням АТ, нейропсихологічне тестування. Пацієнтам також визначали антропометричні показники: вагу в кілограмах та зріст у метрах, за допомогою яких обчислювали індекс маси тіла (ІМТ). Індекс маси тіла розраховують за формулою: І = m/h2, де m — маса тіла в кілограмах, h — зріст у метрах. Відповідно до рекомендацій ВОOЗ розроблена така інтерпретація показників ІМТ: 16 і менше – виражений дефіцит маси; 16,5–18,49 — недостатня маса тіла; 18,5–24,99 — норма; 25,00–29,99 — надлишкова маса тіла; 30,00–34,99 — ожиріння першого ступеня; 35,00–39,99 — ожиріння другого ступеня; 40 і більше — ожиріння третього ступеня.
Пацієнтам проводили загальні лабораторні тести (загальний аналіз крові, загальний аналіз сечі, біохімічний аналіз крові, ліпідограма), інструментальні дослідження (комп’ютерна та/або магнітно-резонансна томографія головного мозку). За даними МРТ головного мозку, у більшості хворих виявляли численні вогнища лейкоареозу перивентрикулярно і в субкортикальних відділах обох півкуль головного мозку, в окремих випадках спостерігали численні та/або поодинокі лакунарні вогнища, що були розташовані у стратегічних для когнітивних функцій відділах головного мозку: у глибинних відділах білої речовини, у лобній та скроневій частках. З метою оцінки ступеня когнітивних порушень використовували коротку шкалу оцінки психічного статусу (Mini Mental State Examination — MMSE), що складається з ряду субтестів, які дозволяють швидко й ефективно оцінити орієнтування в часі, місці, стан короткочасної, довгочасної пам’яті, функцію мови, гнозису, праксису [6]. Сума балів за субтестами становить загальний бал MMSE. Результат отримували шляхом сумації балів за кожним із пунктів шкали. Максимальний показник — 30 балів. За даними MMSE, 29–30 балів оцінювали як відсутність порушення когнітивних функцій, 27–28 балів — легкі, 24–26 балів — помірні когнітивні порушення, 20–23 бали — початкова стадія деменції, < 20 — більш виражені стадії деменції [1].
Стан когнітивних функцій хворих додатково оцінювали з використанням ряду сучасних нейропсихологічних тестів: методика заучування 10 слів, яка дозволяла дослідити процеси пам’яті (запам’ятовування, збереження і відтворення інформації). Для оцінки темпу сенсомоторних реакцій, розумової працездатності, об’єму активної уваги пацієнтів використовували таблиці Шульте. З метою дослідження негайної та відстроченої розпізнавальної пам’яті на вербальні стимули застосовували Тест заучування парних взаємопов’язаних слів (The Paired Associates Learning Test-PALT) [13].
Статистичну обробку отриманих результатів проводили на комп’ютері з використанням пакета статистичного аналізу Microsoft Excel 97. Вірогідність різниці між середніми кількісними значеннями двох виборок визначали за коефіцієнтом Стьюдента (t). Для з’ясування характеру та ступеня взаємозв’язку між різними показниками визначали коефіцієнт кореляції (r), а також коефіцієнт кореляції рангів Спірмена (r). З метою оцінки значимості різниці двох незалежних виборок використовували критерій Вілкоксона. Ми також використовували показник відповідності c2 для визначення вірогідності різниці декількох відносних величин, що пов’язані між собою.
Результати та їх обговорення
Всі обстежені нами пацієнти скаржилися на головний біль, запаморочення, шум у вухах, голові, хиткість при ході, слабкість у нижніх кінцівках, оніміння дистальних відділів кінцівок, зниження пам’яті, порушення концентрації уваги, зниження фону настрою, підвищену знервованість, порушення нічного сну. У неврологічному статусі у хворих виявлено: ослаблену конвергенцію очних яблук, виражені субкортикальні рефлекси, ознаки пірамідної та екстрапірамідної недостатності, патологічні рефлекси згинальної та розгинальної групи, координаторні та чутливі порушення.
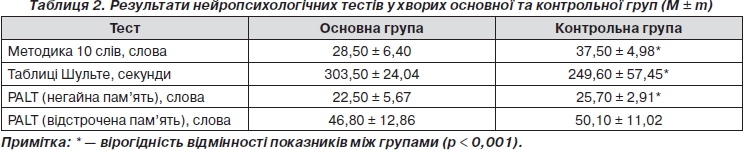
Основні характеристики пацієнтів із метаболічним синдромом та без такого наведені в табл. 1.
Поширеність окремих компонентів метаболічного синдрому у хворих основної групи становила: ожиріння — у 100 %, гіперглікемії (цукровий діабет ІІ типу) — у 48 %, артеріальної гіпертензії — у 100 %, підвищеного рівня тригліцеридів сироватки крові — у 74 %, зниженого рівня ліпопротеїдів високої щільності або нормального рівня ЛПВЩ при відповідній терапії — у 100 % пацієнтів. З огляду на прийняті критерії метаболічного синдрому у 100% пацієнтів основної групи виявлено 3, у 74 % — 4, у 38 % — 5 із прийнятих критеріїв метаболічного синдрому. Як видно з табл. 1, серед пацієнтів із метаболічним синдромом переважали особи жіночої статі з середнім рівнем освіти, у яких вірогідно частіше в анамнезі були серцева недостатність (р < 0,05), цукровий діабет (р < 0,001), артеріальна гіпертензія (р < 0,001), ожиріння (р < 0,001), підвищення рівня тригліцеридів (р < 0,001), зниження рівня ліпопротеїдів високої щільності в сироватці крові (р < 0,001).
Ми вивчали зв’язок окремих компонентів метаболічного синдрому з когнітивними порушеннями у хворих. Зокрема, за допомогою рангової кореляції Спірмена ми не виявили вірогідного зв’язку між рівнем артеріального тиску при артеріальній гіпертензії (r = 0,18, p > 0,05), індексом маси тіла при ожирінні (r = –0,13, p > 0,05), підвищеним рівнем тригліцеридів (r = –0,28, p > 0,05), зниженим рівнем холестерину ЛПВЩ (r = –0,11, p > 0,05) та ступенем когнітивних порушень за даними MMSE у хворих основної групи.
Окремо ми оцінили стан когнітивних функцій у хворих основної групи з цукровим діабетом та без нього (рис. 1).
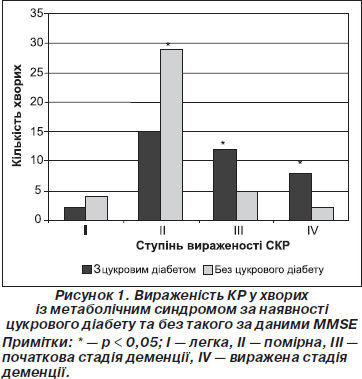
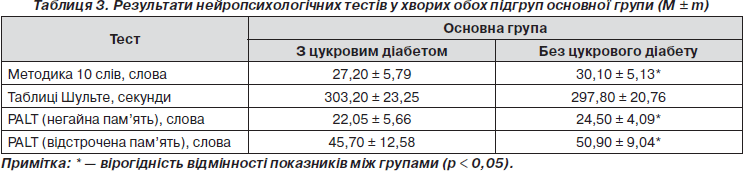
Як видно з рис. 1, у пацієнтів із метаболічним синдромом за наявності цукрового діабету вірогідно більш вираженими були початкова деменція (c2 = 4,43, р < 0,05) та виражені стадії деменції (c2 = 4,87, р < 0,05), у той час як у пацієнтів без цукрового діабету значно вираженішими були помірні когнітивні порушення (c2 = 8,02, р < 0,01). Вірогідної різниці щодо супеня вираженості легких когнітивних порушень (c2 = 0,56, р > 0,05) у пацієнтів основної групи з цукровим діабетом та без нього виявлено не було. Отже, у пацієнтів із метаболічним синдромом при наявності цукрового діабету виявлено більш виражені КР за даними MMSE порівняно з хворими без цукрового діабету. Отримані нами результати свідчать, що з усіх компонентів метаболічного синдрому лише цукровий діабет вірогідно впливав на стан когнітивних функцій у хворих, що збігається з даними літератури [21]. Ми також вивчали характер зв’язку між КР та метаболічним синдромом у пацієнтів середнього, похилого та старечого віку. При порівнянні ступеня вираженості КР у пацієнтів середнього віку основної та контрольної групи виявлено, що легкі когнітивні порушення вірогідно частіше зустрічалися у пацієнтів без метаболічного синдрому (c2 = 4,8, р < 0,05). Не знайдено вірогідної різниці щодо питомої ваги помірних когнітивних порушень (c2 = 1,47, р > 0,05) та деменції (c2 = 1,75, р > 0,05) у хворих середнього віку основної та контрольної груп. Серед пацієнтів похилого віку вірогідно частіше спостерігали: легкі когнітивні порушення (c2 = 10,2, р < 0,01) у контрольній групі, початкову та виражену деменцію (c2 = 6,02, р < 0,05) в основній групі. Вираженість помірних КР була однаковою у пацієнтів похилого віку в обох клінічних групах. Водночас у підгрупі хворих старечого віку вірогідної різниці щодо вираженості легких (c2 = 0,78, р > 0,05), помірних КР (c2 = 1,04, р > 0,05) та деменції (c2 = 2,04, р > 0,05) у пацієнтів із метаболічним синдромом та без такого виявлено не було. Таким чином, з огляду на наведені дані серед усіх вікових підгруп лише в пацієнтів похилого віку виявлено вірогідний зв’язок метаболічного синдрому з тяжкістю КР, зокрема існування метаболічного синдрому значно частіше призводило до розвитку деменції різного ступеня вираженості у хворих основної групи порівняно з контрольною групою, у той час як у пацієнтів контрольної групи вірогідно частіше виявляли легкі КР. Ми також досліджували можливий вплив метаболічного синдрому та цукрового діабету на стан окремих когнітивних функцій у пацієнтів. Хворі основ- ної групи (з метаболічним синдромом) були додатково розподілені на 2 підгрупи: підгрупа з цукровим діабетом (n = 37) та підгрупа без цукрового діабету (n = 40). Дані нейропсихологічних тестів у хворих основної та конт-рольної груп наведені нижче (табл. 2, 3).
Як видно з наведених у табл. 2 даних, у пацієнтів контрольної групи були вірогідно вищими показники, що характеризують короткочасну вербальну й семантичну пам’ять та увагу за методикою заучування 10 слів порівняно з такими у хворих основної групи (p < 0,001). При порівнянні підгруп пацієнтів основної групи виявлено також вірогідну різницю результатів за методикою 10 слів між хворими з цукровим діабетом та без такого (p < 0,05) (табл. 3). У разі дослідження темпу сенсомоторних реакцій за таблицями Шульте, у хворих основної клінічної групи відмічено вірогідне збільшення сумарного часу, що використовувався на відшукування цифр (303,50 ± 24,04), порівняно з пацієнтами контрольної групи (249,60 ± 57,45, p < 0,001). Це вказувало на вірогідне зниження швидкості сенсомоторних реакцій, розумової працездатності, об’єму активної уваги у хворих з метаболічним синдромом. Водночас ми не спостерігали вірогідної різниці показників темпу сенсомоторних реакцій за таблицями Шульте у пацієнтів обох підгруп основної клінічної групи (303,20 ± 23,25 та 297,80 ± 20,76, p > 0,05). За результатами дослідження пам’яті з використанням методики PALT у пацієнтів з метаболічним синдромом та цукровим діабетом був вірогідно зменшений об’єм негайної (22,05 ± 5,66 та 24,50 ± 4,09, p < 0,05) та відстроченої пам’яті (45,70 ± 12,58 та 50,90 ± 9,04, p < 0,05) порівняно з даними хворих із метаболічним синдромом без цукрового діабету (табл. 3). У хворих основної групи порівняно з контрольною був вірогідно зменшений об’єм лише негайної памяті за даною методикою (22,50 ± 5,67 та 25,70 ± 2,91, p < 0,001). Щодо результатів дослідження відстроченої пам’яті, то показники PALT у пацієнтів основної та контрольної групи суттєво не відрізнялися (46,80 ± 12,86 та 50,10 ± 11,02, p > 0,05) (табл. 2).
Висновки
Таким чином, при вивченні зв’язку окремих компо-нентів метаболічного синдрому з СКР в обстежених нами хворих ми виявили, що лише цукровий діабет з усіх компонентів метаболічного синдрому вірогідно впливав на стан їх когнітивних функцій. Оцінюючи в порівняльному аспекті стан когнітивних функцій у пацієнтів різних вікових підгруп основної групи, ми знайшли вірогідний зв’язок метаболічного синдрому з тяжкістю КР лише у пацієнтів похилого віку. Зокрема, в похилому віці наявність метаболічного синдрому значно частіше призводила до розвитку деменції різного ступеня вираженості у хворих основної групи порівняно з контрольною групою, у той час як у пацієнтів контрольної групи вірогідно частіше виявляли легкі КР. Найбільш чутливими до впливу метаболічного синдрому у хворих із дисциркуляторною енцефалопатією виявилися процеси запам’ятовування, збереження й відтворення інформації, розумова працездатність, темп сенсомоторних реакцій, об’єм активної уваги, негайна розпізнавальна пам’ять на вербальні стимули. Водночас ми спостерігали вірогідний негативний вплив цукрового діабету у хворих із метаболічним синдромом на обсяг негайної та відстроченої розпізнавальної пам’яті на вербальні стимули. Отже, своєчасна та адекватна терапія існуючого метаболічного синдрому та його окремих компонентів, зокрема цукрового діабету, сприятиме зменшенню ризику розвитку як додементних, так і дементних СКР у хворих і покращенню якості їхнього життя.
1. Бачинська Н.Ю. Синдром умеренных когнитивных нарушений // Нейро News. — 2010. — № 2/1. — С. 12-17.
2. Alberti K.G.M., Eckel R.H., Grundy S.M. et al. Harmonizing the Metabolic Syndrome A Joint Interim Statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity // Circulation. — 2009. — Vol. 120. — P. 1640-1645.
3. Carlsson C.M., Nondahl D.M., Klein B.E.K. et al. Increased atherogenic lipoproteins are associated with cognitive impairment: effects of statins and subclinical atherosclerosis // Alzheimer Dis. Assoc. Disord. — 2009. — Vol. 23(1). — P. 11-17.
3. Dik M.G., Jonker C., Comijs H.C. et al. Contribution of metabolic syndrome components to cognition in older persons // Diabetes Care. — 2007. — Vol. 30. — P. 2655-2660.
4. Fillit H., Nash D.T., Rundek T., Zuckerman A. Cardiovascular risk factors and dementia // Am. J. Geriatr. Pharmacother. — 2008. — № 6(2). — Р. 100-18.
5. Folstein M., Folstein S., McHugh P.R. Mini-mental state: a practical method for grading the cognitive state of patients for the clinical // J. Psychiatr. Res. — 1975. — Vol. 12. — P. 189-198.
6. Gatto N.M., Henderson V.W., St John J.A. et al. Metabolic syndrome and cognitive function in healthy middle-aged and older adults without diabetes // Neuropsychol. Dev. Cogn. B. Aging. Neuropsychol. Cogn. — 2008. — № 15(5). — P. 627-641.
7. Hughes T.F., Borenstein A.R., Schofield E., Wu Y., Larson E.B. Association between late-life body mass index and dementia // Neurology. — 2009. — Vol. 72. — P. 1741-1746.
8. Johnson K.C., Margolis K.L., Espeland M.A., et al. A prospective study of the effect of hypertension and baseline blood pressure on cognitive decline and dementia in postmenopausal women: the Women’s Health Initiative Memory Study // J. Am. Geriatr. Soc. — 2008. — Vol. 56(8). — P. 1449-58.
9. Kalaria R.N., Maestre G.E., Arizaga R. et al. Alzheimer’s disease and vascular dementia in developing countries: prevalence, management, and risk factors // Lancet Neurol. — 2008. — № 7. — Р. 812-826.
10. Kanaya A.M., Karla Lindquist K., Harris T.B. Total and Regional Adiposity and Cognitive Change in Older Adults // Arch. Neurol. — 2009. — Vol. 66(3). — P. 329-335.
11. Komulainen P., Lakka T.A., Kivipelto M. et al. Metabolic syndrome and cognitive function: a population-based follow-up study in elderly women // Dement. Geriatr. Cogn. Disord. — 2007. — Vol. 23. — P. 29-34.
12. Parmenter B.A., Denney D.R., Lynch S.G. The cognitive perfomance of patients with multiple sclerosis during periods of high and low fatigue // Multiple Sclerosis. — 2003. — № 9. — Р. 111-118.
13. Qiu C., Winblad B., Fratiglioni L. The age-dependent relation of blood pressure to cognitive function and dementia // Lancet Neurol. — 2005. — № 4(8). — Р. 487-99.
14. Raffaitin C., Gin H., Empana J.F. et al. Metabolic Syndrome and Risk for Incident Alzheimer’s Disease or Vascular Dementia // Diabetes Care. — 2009. — Vol. 32. — P. 169-174.
15. Roman G.C., Sachdev P., Royall D.R., Bullock R.A., Orgogozo J.M., Lopez-POusa S., Arizaga R., Wallin A. Vascular cognitive disorder: a new diagnostic category updating vascular cognitive impairment and vascular dementia // J. Neurol. Sci. — 2004. — Vol. 226(1–2). — P. 81-7.
16. Strozyka D., Dickson D.W., Lipton R.B. et al. Contribution of vascular pathology to the clinical expression of dementi // Neurobiol Aging. — 2010 October. — 31(10). — 1710-1720.
17. Van den Berg E., Biessels G.J., de Craen A.J.M., Gussekloo J., Westendorp R.G.J. The metabolic syndrome is associated with decelerated cognitive decline in the oldest old // Neurology. — 2007. — Vol. 69. — P. 979-985.
18. Van den Berg E., Reijmer Y.D., de Bresser J. A 4 year follow-up study of cognitive functioning in patients with type 2 diabetes mellitus // Diabetologia. — 2010. — Vol. 53. — P. 58-65.
19. Yaffe K., Kanaya A., Lindquist K. et al.The metabolic syndrome, inflammation, and risk of cognitive decline // JAMA. — 2004. — Vol. 292. — P. 2237-2242.
20. Yaffe K., Weston A.L., Blackwell Т., Krueger K.A. The metabolic syndrome and development of cognitive impairment among older women // Arch. Neurol. — 2009. — Vol. 66(3). — P. 324-328