Международный неврологический журнал 5 (43) 2011
Вернуться к номеру
Перспективы использования отечественного препарата Пропес в стратегии лечения больных с хроническими нейроинфекциями
Авторы: ВОЛОШИНА Н.П., профессор, руководитель отделения нейроинфекций и рассеянного склероза ГУ «Институт неврологии, психиатрии и наркологии» АМН Украины, г. Харьков, Терещенко Л.П., ведущий научный сотрудник отделения нейроинфекций и рассеянного склероза
ГУ «Институт неврологии, психиатрии и наркологии» АМН Украины, г. Харьков
Рубрики: Неврология
Версия для печати
Обследовано 85 пациентов с хроническими нейроинфекциями (ХНИ). Диагноз был поставлен на основании результатов клинико-лабораторных и нейровизуализационных исследований. Установлено, что лечение ХНИ препаратом Пропес, в котором иммунокорригирующие свойства сочетаются с противовоспалительной активностью, приводит к быстрому и значительному клиническому улучшению, способствует стабилизации прогрессирования заболевания, снижает риск возникновения обострений, значительно улучшает качество жизни больных.
Хроническая нейроинфекция, лечение, профилактика, Пропес.

 Хронические нейроинфекции (ХНИ) остаются серьезной проблемой здравоохранения и относятся к полиэтиологическим заболеваниям, вызываемым различными возбудителями, среди которых ведущее значение придается вирусам. Вирусы снижают функциональную активность иммунной системы, что приводит к тяжелому клиническому течению заболеваний и возникновению различных осложнений на сердечно-сосудистую систему, легкие, нервную систему, и, как правило, являются пусковым механизмом аутоиммунных заболеваний, нередко — онкологических [1–3].
Хронические нейроинфекции (ХНИ) остаются серьезной проблемой здравоохранения и относятся к полиэтиологическим заболеваниям, вызываемым различными возбудителями, среди которых ведущее значение придается вирусам. Вирусы снижают функциональную активность иммунной системы, что приводит к тяжелому клиническому течению заболеваний и возникновению различных осложнений на сердечно-сосудистую систему, легкие, нервную систему, и, как правило, являются пусковым механизмом аутоиммунных заболеваний, нередко — онкологических [1–3].
Неуклонный рост числа больных с непрерывно рецидивирующими хроническими воспалительными заболеваниями является индикатором глобального ухудшения иммунного статуса населения [1–4]. Как показывают исследования последних лет [4–6], наиболее часто в сыворотке крови больных с манифестацией ХНИ обнаруживают репликацию вирусов герпес-группы Herpes simplex [1, 2, 6, 7], Herpes zoster, Cytomegalovirus, вируса Эпштейна — Барр (ЭБВ), для которых характерны повсеместное распространение в человеческой популяции (убиквитарность), способность поражать все органы и системы человеческого организма (пантропизм), а также пожизненная персистенция в организме человека, оппортунистичность [4, 5, 20]. Эти вирусные агенты имеют сложную стратегию паразитирования в организме человека, что предусматривает возможность формирования принципиально разных форм инфекции (первичная, латентная, персистирующая, реактивированная), каждая из которых выбирается вирусом в зависимости от иммунного статуса инфицированного организма [1, 8, 21]. Вирусы могут длительное время персистировать в клетках хозяина в виде латентной инфекции. Известно, что вирусоносительство ассоциировано с целым рядом аномалий в генах нейропептидов, шаперонов и убиквитин-протеосомной системы, функционирование которых тесно связано с маркерами системного воспалительного процесса (фактор некроза опухоли a), который, прогрессируя, в дальнейшем способствует развитию нейродегенеративных изменений в тканях ЦНС [4, 5, 8, 9, 20, 21].
При недостаточности иммунной системы или при массированном поступлении вирусов развивается вирусемия и происходит развитие острых (манифестных) форм заболевания. В последние годы существенно изменилось течение указанных вирусных заболеваний, что проявляется возрастанием числа атипичных и тяжелых форм болезней, с более частой регистрацией их у лиц молодого возраста. Широкое бессимптомное течение заболеваний, полиморфизм клинических проявлений, пожизненная персистенция в организме, частые рецидивы заболевания с формированием резистентных форм ставят проблему раннего выявления и лечения в разряд социально значимых и актуальных.
Современные исследования выдвинули проблему ХНИ на одно из первых мест как причину сосудистых церебральных нарушений, сохраняя основные патогенетические и клинические закономерности, свойственные нарушениям кровообращения. ХНИ, как варианты патологии нервной системы, имеют свои особенности, связанные с природой заболевания, и учет этих особенностей играет важную роль в распознавании и лечении.
Считается, что поражения нервной системы при ХНИ отображают общие закономерности развития инфекционного процесса в организме с дезорганизацией соединительнотканных структур, включая мезенхимальные образования нервной системы (сосуды, сосудистые сплетения, мозговые оболочки). Присоединение паренхиматозных элементов мозга происходит в связи с изменениями в сосудах, причем стойкость, длительность и обратимость церебральных нарушений связана с функциональным состоянием центральных и периферических вазомоторных систем, особенностями поражения мозговых сосудов, компенсаторными возможностями коллатерального кровообращения, состоянием сердечной деятельности и общей гемодинамики.
Характерными клиническими симптомами системного поражения, обусловленного герпесвирусными инфекциями, являются: длительная гипертермия (вследствие влияния на центр терморегуляции гипоталамуса), снижение веса и анорексия (за счет активации ферментов, мобилизующих липиды из жирового депо), остеопороз (вследствие активации остеокластов, осуществляющих резорбцию костной ткани), миомаляция и хондродистрофия (путем активации гистиоцитов и усиленной продукции свободных радикалов и агрессивных ферментов), анемия (вследствие посредничества простагландина Е2, который модифицирует структуру мембран эритроцитов, что приводит к усиленной эритрофагии в селезенке). Алгические феномены — в связи со снижением порога болевого восприятия, эпилептические припадки, прогрессирующая психопатологическая симптоматика. Грубые двигательные нарушения, связанные с поражением пирамидных путей, встречаются лишь в ограниченном числе случаев. В частности, церебральный энцефалит, обусловленный вирусом герпеса 1-го типа, может проявляться в виде изолированного синдрома делирия, что часто является причиной диагностических ошибок, и только возникновение судорог дает возможность заподозрить органическое поражение мозга.
На сегодняшний день определены несколько вариантов вирусных энцефалопатий: острая некротизирующая энцефалопатия, синдром Рейя, с отеком и набуханием мозга, эпиприпадками, нарушением психических функций, с развитием полиорганной недостаточности или гематофагоцитоза. Наиболее вероятным объяснением развития связанных с вирусом энцефалопатий считается «цитокиновый шторм», возникновение которого связывают с нарушениями регуляции иммунной системы [19].
Для диагностики ХНИ у больных важными являются анамнестические данные о частоте и тяжести инфекционных эпизодов, осложненных аллергическими или аутоиммунными нарушениями, выявление феноменов мультифокальности и полисистемности очагов инфекции, а также глубоких и стойких изменений иммунного статуса при проведении иммунологических исследований при клинической манифестации ХНИ [5].
Определенное значение имеет и высокая уязвимость головного мозга к инфекции. Современные визуализирующие методы исследования позволили точно оценивать наличие, распространенность и выраженность деструкции мозговой ткани. К типичным МРТ-признакам персистирующей инфекции относят выявление неспецифического повышения интенсивности сигнала от белого вещества на Т2-взвешенных изображениях, наличие атрофического процесса корковых участков мозга и гиппокампальный склероз единичных или множественных энцефалитических очагов на разных стадиях воспалительного процесса, гиперплазии сосудистых сплетений желудочков мозга, признаков лептоменингита, хронических синуситов, гидроцефалии и перивентрикулярного отека мозга.
Клиническая дифференциация вирусных инфекций затруднена из-за сходной симптоматики, в связи с чем диагноз ХНИ выставляют на основании совокупности клинических, неврологических, иммунологических, а также данных нейровизуалиации, создающих целостность картины болезни.
С учетом перечисленных свойств герпесвирусов очевидны трудности в терапии больных с ХНИ, страдающих частыми рецидивами на фоне постоянной репликации вирусов в организме. Сложность терапии ХНИ обуслов-лена также такими факторами, как вариабельность чувствительности больных к используемым препаратам, развитие резистентности вируса к лекарственным средствам, необходимость использования подчас непростых схем комбинированной терапии из 3–4 препаратов, выработка вирусами в процессе эволюции механизмов снижения эффективности иммунного ответа хозяина. Важную роль играют также смешанные инфекции, при которых часто наблюдается взаимная стимуляция инфекционных агентов. Серьезным обстоятельством является то, что многие вирусные заболевания достаточно сложно контролировать существующими способами специфической и неспецифической профилактики и терапии.
Во всем мире продолжается поиск эффективных препаратов, восстанавливающих антиинфекционную защиту макроорганизма. Наибольшую эффективность терапии хронических инфекционных заболеваний следует ожидать от препаратов, изменяющих регуляцию иммунной системы. В последние десятилетия в клинической медицине используется новый класс препаратов на основе регуляторных пептидов — природных биорегуляторов, которые помимо непосредственной антиоксидантной функции обладают способностью восстанавливать функциональные нарушения, препятствуя развитию патологических процессов в организме, воздействовать на регенеративные тканевые модуляторы, регулировать процессы воспалительного ответа и апоптоза. Пептиды являются универсальным «языком», понятным и естественным для организма как на системном, так и на клеточном уровнях, что обеспечивает вектор саногенеза организма. Биорегулирующая терапия пептидными препаратами позволяет корректировать нарушенные адаптационно-компенсаторные процессы в организме, лежащие в основе развития иммунозависимых состояний.
Учеными Научно-прозводственного предприятия «НИР» (Киев) разработан уникальный препарат Пропес, содержащий природный полипептидный комплекс и свободные аминокислоты, полученные в результате специфического протеолиза из эмбриональной ткани крупного рогатого скота. Препарат стимулирует функциональную активность мононуклеарных фагоцитов и клеток — природных киллеров, то есть активизирует неспецифические иммунные реакции организма. Угнетает продукцию провоспалительных цитокинов при аллергических заболеваниях. Препарат имеет выраженные антитоксические эффекты, улучшает функции печени, угнетает развитие опухолевых процессов, способствует регрессии опухолей путем их резорбции. В мировой фармацевтике не имеет аналогов и показывает четкие и ценные для больных качества.
Препарат был успешно апробирован во многих лечебных учреждениях и научно-исследовательских центрах Украины [14]. В настоящее время для клинического применения препарата зарегистрирована лекарственная форма в виде раствора для инъекций.
Препарат не обладает мутагенными, эмбриотоксическими, тератогенными, пирогенными и гемолитическими свойствами. Несомненным его достоинством является нетоксичность, что обеспечивает большую терапевтическую широту применения.
В медицинской практике Пропес рекомендован для лечения заболеваний с нарушением иммунологического статуса. К настоящему времени получен достаточно обширный опыт клинического применения препарата как по рекомендованным нозологиям [14], так и по широкому кругу других заболеваний [14]. Способность возобновлять активную и адекватную работу иммунных комплексов, регулируя баланс между разными звеньями антиинфекционной защиты, открывает препарату возможности улучшать процессы восстановления иммунного баланса в условиях иммунодефицита. Учитывая сказанное, перспективным является проведение комплексного клинико-лабораторного исследования эффективности применения препарата Пропес в терапии больных ХНИ.
Цель исследования — изучить эффективность препарата Пропес на фоне стандартной терапии больных с ХНИ по данным клинических, иммунологических и биохимических обследований.
В задачи исследования входило:
— изучить поврежденные звенья иммунной системы у больных с хронической нейроинфекцией;
— определить корреляцию этих изменений и неврологического дефицита;
— оценить влияние препарата Пропес на динамику указанных показателей и клиническое течение заболевания.
Материалы и методы
В отделе нейроинфекций и рассеянного склероза ИНПН АМН Украины с 2008 по 2011 г. проведено динамическое обследование 85 больных с ХНИ.
Всем больным исследовали соматический и неврологический статус по общепринятым методикам. Проведена лабораторная и инструментальная (МРТ) диагностика больных с ХНИ; иммунологическое и вирусологическое исследования с фенотипированием циркулирующих лимфоцитов периферической крови (СD3, СD4, СD8, СD16, СD19) и определением содержания иммуноглобулинов классов А, М, G в сыворотке крови в динамике; биохимические исследования крови с определением показателей системного воспаления (С-реактивный протеин, аланин-аминотрансфераза (АлТ), аспартатаминотрансфераза (АсТ), щелочная фосфатаза (ЩФ)).
Обработка фактических данных — с применением методов вариационной статистики и программ Statistica 6.0.
Дизайн исследования включал оценку всех параметров с учетом исходного состояния и состояния после лечения.
Критериями включения в настоящее исследование являлись: ХНИ с резистентностью к традиционной терапии, наличие длительного субфебрилитета, выраженной астении, лимфаденопатии одной или нескольких зон, наличие признаков клинического иммунодефицита (частые рецидивы, синуситы, фурункулез, аллергические реакции), детекция вирусной ДНК или антигенов методом реакции иммунофлюоресценции РИФ, обнаружение иммуноглобулинов M, G методом иммуноферментного анализа (ИФА), а также результаты иммуноблота.
Из исследования исключили пациентов, которые в рамках проводимой ранее терапии принимали лекарственные средства, влияющие на показатели иммунного статуса.
Пропес включали в состав комплексной терапии пациентов после получения информированного согласия по форме, установленной в клинике ИНПН АМН.
Больным с ХНИ основной группы (n = 40) препарат Пропес применялся в виде в/м введений по 2 мл с интервалом введения 24 часа, курсом по 10 инъекций.
Больным с ХНИ группы сравнения (n = 45) проводилась фоновая терапия, которая была унифицирована и включала препараты, необходимые для лечения конкретного пациента. В данной группе экстракорпоральные методы детоксикации и другие средства иммунокорригирующего действия не применялись.
Для оценки иммунологических данных обследовано 20 практически здоровых добровольцев в возрасте от 21 года до 37 лет (средний возраст 25,4 ± 4,3 года) без хронических болезней и не болевших за год до исследования острыми заболеваниями, с отсутствием травм и оперативных вмешательств.
Эффективность терапии препаратом Пропес больных оценивалась по динамике выраженности симптомов, иммунологических и биохимических показателей больных в процессе лечения.
Контрольные осмотры проводились через 1 и 6 месяцев. При анализе данных обращалось внимание на характер течения заболевания — благоприятный (стабильный) или неблагоприятный (с периодами обострения).
Результаты исследований
Среди 85 обследованных пациентов с ХНИ было 48 женщин и 37 мужчин. Возрастная структура была следующей: 10–19 лет — 5 пациентов; 20–29 лет — 24; 30–39 лет — 45; 40–49 лет — 4; 50–59 и более — 7 пациентов. Видно, что основу группы наблюдения составили лица трудоспособного возраста от 20–40 лет (69 пациентов — 81 %).
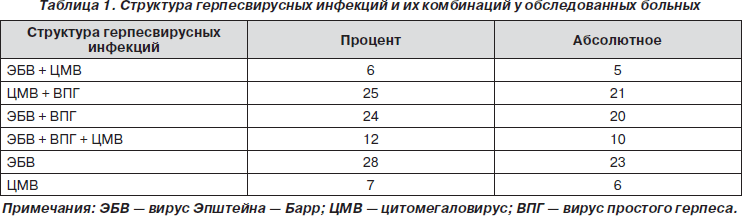
Наиболее часто у 23 (28 %) обследованных больных с ХНИ встречались микст-инфекции, вызванные вирусом Эпштейна — Барр. При этом рецидивирующая цитомегаловирусная и инфекция вируса простого герпеса имели место у 25 % больных, вызванная вирусами Эпштейна — Барр в сочетании с вирусом простого герпеса — у 24 %.
Вирусная инфекция лабораторно была подтверждена с помощью метода реакции иммунофлюоресценции — у 17 (19 %) больных, полимеразной цепной реакции (ПЦР) — у 5 (5,8 %) пациентов; методом иммуноблотинга антитела класса М к специфическим и высокоспецифическим белкам выявлены в 16 (18,8 %) случаях.
Приведенные результаты отражают высокий уровень определения ДНК-содержащих цитомегаловирус (ЦМВ), ЭБВ и вируса герпеса человека в периферической крови больных с ХНИ, что свидетельствует о значимой роли персистенции вирусов в развитии воспалительных процессов у них, а также в формировании персистирующих вариантов течения заболевания.
По данным литературы, среди инфекционных заболеваний на долю смешанных инфекций приходится 50 %. Микст-инфекции отличаются своеобразным развитием патологического процесса в организме и клинических проявлений, более тяжелым течением и частыми неблагоприятными исходами. При смешанной инфекции взаимодействие болезнетворных организмов часто протекает на фоне выраженной аллергизации и аутоиммунизации, что сопровождается нарушением резистентности к инфекционным агентам [17].
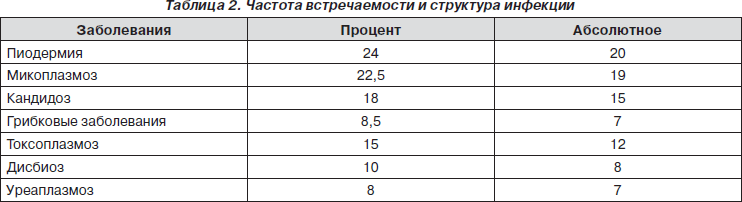
У обследованных нами пациентов изучалась частота встречаемости и структура других инфекций, помимо вирусных, которые нашли отражение в табл. 2.
Микст-генотип обнаруживался у 24 обследованных пациентов (28,2 %).
Приведенные данные показывают, что наиболее часто у обследованных больных с ХНИ наблюдались гнойничковые заболевания кожи, микоплазмоз, кандидоз, токсоплазмоз и хламидиоз.
Сопутствующая патология у обследованных пациентов с ХНИ: хроническая инфекция верхних — 29 (34,1 %) и нижних дыхательных путей — 6 (7,05 %) , хронические гинекологические заболевания — 24 (28,2 %) и хронические простатиты — 11 (13 %), частые респираторно-вирусные инфекции — 17 (20 %), заболевания желудочно-кишечного тракта — 37 (43,5 %), инфекции мочевыводящих путей — 48 (56,4 %), полиартритический синдром — 21 (24,7 %), аутоиммунный тиреоидит — 13 (15,2 %), отиты — 10 (11,7 %), синуситы — 19 (22,3 %).
Клинически ХНИ у обследованных пациентов характеризовалась феноменологическим многообразием, обусловленным как патогенетическими особенностями инфекционного процесса, так и преимущественным поражением тех или иных структур головного мозга. Больные с ХНИ жаловались на головные боли распирающего характера, слабость, головокружение несистемного характера, гиперсенситивность, неустойчивость артериального давления (АД), частые ознобоподобные состояния, субфебрилитет, боли в суставах и позвоночнике, шум и чувство тяжести в голове, заложенность в ушах, ощущение «сетки», «пелены» перед глазами, нарушения сна, ослабление памяти, внимания, эмоциональную лабильность, парестезии, страх, тревогу, сужение круга интересов.
Среди обследованных больных с ХНИ при МРТ-исследовании выявлялись участки атрофии коры головного мозга — у 45 (52,9 %) больных, участки гиппокампального склероза — у 31 (36,4 %) больного, признаки гидроцефалии и перивентрикулярного отека мозга — у 26 (30,5 %), расширение конвекситальных пространств — у 36 (42,3 %), единичные — у 19 (22,3 %) или множественные — у 13 (15,2 %) пациентов очаги воспалительного характера на разных стадиях развития.
Терапия с включением препарата Пропес проведена 40 больным в возрасте от 17 до 39 лет, среди которых 21 женщина и 19 мужчин.
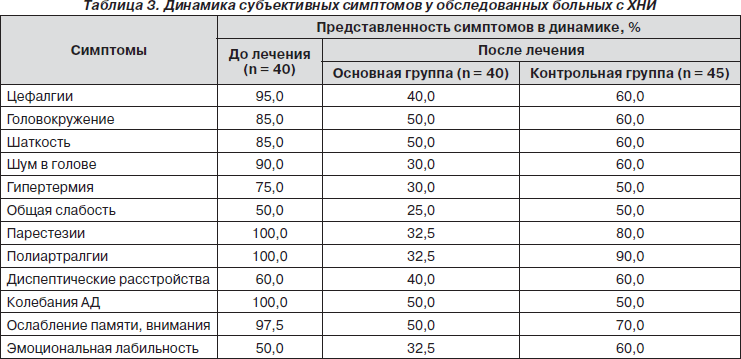
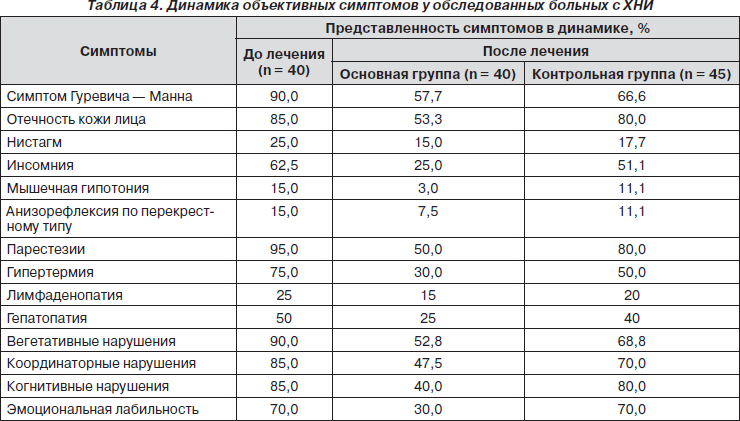
Динамика субъективных и объективных неврологических симптомов у больных с ХНИ при лечении препаратом Пропес представлена в табл. 3, 4.
Как видно из представленных таблиц, прием препарата Пропес способствовал ряду позитивных изменений со стороны церебральных симптомов. Уменьшились частота и выраженность головных болей, вестибулярных и диспептических расстройств, редуцировались парестезии и слабость, улучшились когнитивные и эмоционально-волевые функции.
У больных контрольной группы на фоне проводимой терапии также отмечалась тенденция к улучшению субъективной и объективной симптоматики, ее выраженность была значительно меньшей.
Все больные с ХНИ, обследованные с применением комплекса иммунологических методик, распределены на 3 группы в соответствии с тяжестью процесса:
1) легкое течение (общая слабость, 3–4 рецидива в год, аллергические проявления, осложнения, дефицит иммунного статуса 10 %);
2) среднетяжелое течение (4–5 обострений в год, слабость, гипертермия, дефицит иммунитета 20–30 %);
3) тяжелое течение (более 6 рецидивов в год, наличие признаков общей интоксикации (слабость, потеря веса более 10 кг за 1 месяц, потливость, гипертермия), выраженные алгические феномены, дефицит иммунитета 40 % и более).
Иммунодефицит в среднем по группе больных составил 29,1 ± 2,1 %, что свидетельствовало о значительной его выраженности в исследованной группе.
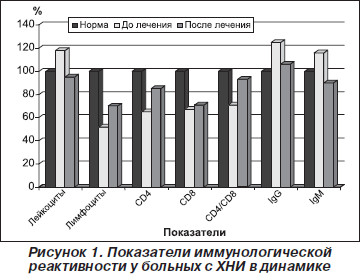
Проведенное комплексное иммунологическое исследование больных с ХНИ выявило наличие выраженной дисфункции иммунной системы, проявляющееся в наличии иммунных нарушений в разных звеньях иммунитета как со стороны численности иммунорегуляторных клеток, так и показателей гуморального звена иммунитета. Содержание Т-лимфоцитов в периферической крови больных с ХНИ было достоверно сниженным по сравнению с контролем до начала лечения, тогда как после его окончания отмечалась нормализация показателя абсолютного содержания Т-клеток.
Показатели содержания Т-хелперно-индукторной субпопуляции лимфоцитов (СD4) однонаправленно и достоверно снижались во всех группах больных с ХНИ. Содержание Т-лимфоцитов супрессорно-цитотоксической субпопуляции (СD8) уменьшалось, и после лечения препаратом отмечалась тенденция к его нормализации, а у больных с легким течением заболевания такая динамика была достоверной в абсолютном выражении.
Соотношение СD4-/СD8-лимфоцитов в группе больных с легким течением заболевания к концу курса лечения увеличивалось, в остальных группах увеличение носило характер тенденции. Общей тенденцией было также увеличение относительного и абсолютного содержания в крови лимфоцитов-киллеров СD19, которое в группе со среднетяжелым течением носило достоверный характер. Исследования показали, что после лечения в группе с тяжелым течением заболевания отмечалось уменьшение содержания СD19-лимфоцитов, хотя такая динамика и не носила достоверного характера, в то же время у больных со среднетяжелым течением болезни терапия не оказывала влияния на процентное и абсолютное содержание В-лимфоцитов. Было установлено, что содержание иммуноглобулинов А и М в группах со среднетяжелым и тяжелым течением ХНИ после окончания терапии препаратом Пропес уменьшалось, хотя и оставалось превышающим нормативное.
На рис 1. представлены показатели иммунологической реактивности у больных с ХНИ в динамике терапии.
При проведении клинического обследования у 20 (50 %) больных определялось увеличение печени до 2 см ниже края реберной дуги, но без симптомов, характерных для хронического заболевания печени, и признаков сердечной недостаточности. У 12 (30 %) пациентов при биохимическом исследовании отмечено увеличение по- казателей АлТ, у 6 (15 %) — АлТ и АсТ. Повышение актив- ности щелочной фосфатазы было отмечено у 11 (25 %) больных. Билирубин при этом оставался в пределах нормы, что свидетельствовало о наличии у обследованных больных картины хронического гепатита с активностью патологического процесса. Серологическое исследование не установило признаков инфицирования вирусами гепатита В и С. Спустя 1 месяц после комплексной терапии с включением препарата Пропес при биохимическом исследовании у 11 больных отмечалась нормализация показателей активности трансаминаз, у 2 больных — снижение активности АлТ. Через 6 месяцев после окончания лечения при биохимическом исследовании крови у 14 пациентов уровень трансаминаз был в пределах нормы.
Развитие выраженной системной интоксикации у 6 (7 %) пациентов основной группы с ХНИ сопровождалось значительным снижением активности трансаминаз, которые в динамике наблюдения за больными приходили к нормативным значениям.
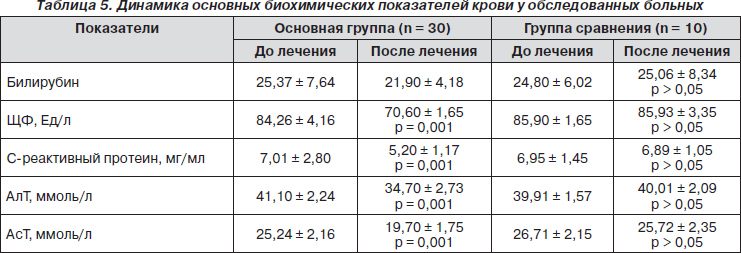
Динамика основных биохимических показателей представлена в табл. 5.
Обращает на себя внимание влияние препарата Пропес на показатели С-реактивного протеина, что позволяет говорить о корригирующем влиянии препарата на процессы системного воспаления.
Следует отметить выраженный гепатопротекторный эффект, который проявлялся в снижении исходно повышенных показателей трансаминаз печени, щелочной фосфатазы.
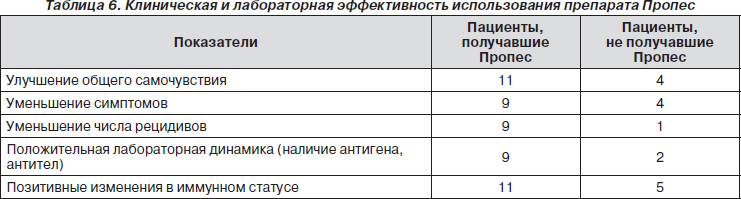
Для изучения эффективности препарата у больных с ХНИ проведено попарное сравнение у 15 пациентов в каждой группе с помощью метода последовательных планов [18]. Замкнутые последовательные планы позволяют проводить сравнение 2 вариантов или методов лечения без вычислений. В группы были отобраны те пациенты, о которых имелась наиболее полная информации. Первую группу составили пациенты, в комплексное лечение которых входил Пропес, во 2-й группе препарат не использовался.
Как видно из табл. 6, пациенты обеих групп различались по всем показателям. При анализе изменений в иммунном статусе было установлено, что у пациентов, получавших Пропес, быстрее наступала модуляция иммунного ответа в сторону нормы, а у пациентов, не получавших препарат, сохранялись сниженными такие показатели, как СD4, иммунорегуляторный индекс, доля СD3-положительных лимфоцитов, доля лимфоцитов в лейкоцитарной формуле.
6-месячный катамнез больных основной группы выявил наличие обострения инфекционного процесса у 1 (8,3 %) из 12 пациентов, у остальных 11 (91,6 %) сохранялось состояние клинической ремиссии.
Обсуждение
Одной из актуальных проблем современной медицины является высокая заболеваемость герпесвирусными инфекциями, которые широко распространены в человеческой популяции. Они способны поражать практически все органы и системы организма и трудно поддаются терапии. Это позволяет рассматривать хронические формы заболевания как общее системное заболевание организма.
Вирусы герпес-группы при недостаточности иммунитета часто встречаются в виде латентной инфекции и вызывают поражение ЦНС. В последние годы существенно изменилась клиническая картина заболеваний: возросло число атипичных и тяжелых форм, которые стали чаще регистрироваться у лиц молодого возраста, хронизация инфекций с клиническими симптомами астении, лимфаденопатии, субфебрилитета и различными неврологическими проявлениями. Хронические, рецидивирующие и атипичные формы инфекции связывают с наличием у этих пациентов иммунодефицитных состояний. В связи с тем что препарат Пропес позиционируется как лекарственное средство с иммуномодулирующей активностью, проведено исследование больных с ХНИ на фоне вторичного иммунодефицита.
У большинства обследованных больных с ХНИ неврологические проявления заболевания связаны с нарушением иммунного статуса. Иммунодепрессию вызывало длительное (в среднем 10,3 ± 3,4 месяца) течение инфекционного процесса, манифестация которого происходила в результате активации вирусной инфекции. У всех обследованных больных при вирусологическом исследовании в сыворотке крови было выявлено превышающее более чем в 5 раз по сравнению с контролем содержание вирусов герпес-группы.
Иммунологическое исследование больных с ХНИ выявило наличие дисфункции иммунной системы, проявляющейся в виде иммунных нарушений в разных звеньях системы иммунитета со стороны как численности иммунорегуляторных клеток, так и показателей гуморального звена иммунитета. При изучении субпопуляционного состава мононуклеаров крови выявлено снижение количества СD4-, СD8-лимфоцитов по сравнению с группой контроля. Низкая доля лимфоцитов крови у исследованной нами группы больных с ХНИ свидетельствует о том, что при хронической герпесвирусной инфекции СD-Т-клеточный ответ на антигены является слабым.
При изучении В-клеточного звена иммунитета определялось число СD19-клеток (В-лимфоцитов) и содержание в сыворотке крови иммуноглобулинов M, A, G. Исследование показало, что средние значения относительного содержания СD19-клеток у больных с ХНИ были недостоверно выше по сравнению с группой контроля, что свидетельствовало о неэффективном для элиминации вируса ответе. Средние значения IgM, IgG у больных с ХНИ недостоверно превышали таковые в группе сравнения. Вместе с тем отмечено повышение уровня IgM, что указывало на активацию хронического инфекционного процесса. Эти данные свидетельствовали об активации гуморального иммунитета у больных с ХНИ.
На фоне лечения препаратом Пропес через 1 месяц после окончания лечения в крови обследованных больных с ХНИ повысилось количество клеток, экспрессирующих СD4, по сравнению с показателями до лечения. Содержание СD4-лимфоцитов достоверно повысилось по сравнению с исходными данными. Повышение уровня СD4- и снижение СD8-лимфоцитов привело к повышению иммунорегуляторного индекса (р = 0,02), а количество лимфоцитов, экспрессирующих СD19, снизилось. Отмечено достоверное снижение IgM в сыворотке крови, что косвенно свидетельствовало о сдвиге клеточного звена иммунитета и ликвидации иммунной недостаточности после применения препарата Пропес.
Кроме улучшения показателей иммунного статуса также отмечено положительное влияние препарата на биохимические показатели крови. Спустя 1 месяц после терапии при биохимическом исследовании у 11 (55 %) больных отмечалась нормализация показателей активности трансаминаз, у 2 (10 %) больных — снижение активности АлТ. Через 6 месяцев после окончания лечения при биохимическом исследовании крови у 14 (70 %) пациентов уровень трансаминаз был в пределах нормы.
Обобщая результаты проведенных исследований, следует подчеркнуть, что применение препарата Пропес в терапии больных с ХНИ было эффективно и способствовало достижению быстрого и значительного улучшения клинической ремиссии как при среднетяжелых, так и при тяжелых клинических формах заболевания.
При планировании рациональной терапии больных с обострениями ХНИ требуется пересмотр терапевтической стратегии и назначение базисной терапии иммунодефицита для адекватной коррекции выявленных дефектов последнего. Оценка иммунного статуса этой категории больных дает не только важную диагностическую информацию, но и позволяет контролировать качество проводимой терапии. Терапия больных с ХНИ лучше происходит в тех случаях, когда удается восстановить состояние иммунной системы.
Выводы
Комплексная терапия с применением препарата Пропес способствует регрессу неврологической симптоматики и улучшению клинического состояния пациентов с ХНИ, положительной лабораторной динамике заболевания и позволяет снизить частоту рецидивов.
Проведенное исследование показывает значимое системное положительное влияние препарата Пропес на лечение ХНИ. Воздействуя на иммунную систему, препарат эффективно уменьшает активность системного воспаления, улучшает функциональное состояние печени, что приводит к улучшению клинического состояния больных с ХНИ, сокращает сроки обострения и способствует ремиссии.
Полученные результаты исследования характеризуют Пропес как лекарственное средство, обладающее оригинальным фармакологическим спектром, в котором иммунокорригирующие свойства в равной степени сочетаются с противовоспалительной активностью, как перспективный препарат в терапии ХНИ. Несомненными преимуществами препарата в ряду других, применяемых в терапии ХНИ, являются отсутствие побочного действия, хорошая переносимость, малая эффективная доза.
Клинический пример 1
Больной Б., 1984 года рождения, был направлен в ИНПН АМН Украины с диагнозом: последствия нейроинфекции с ликворно-гипертензионным синдромом, левосторонней сенсомоторной недостаточностью, вегетативно-висцеральными пароксизмальными состояниями, с легким вестибулоатактическим и тревожно-астеническим синдромами на фоне хронической персистирующей микст-инфекции и соединительнотканной дисплазии. Медикаментозная гепатопатия.
При поступлении предъявлял жалобы на упорные головные боли, больше в левой половине головы, головокружение, шаткость при наклонах, поворотах, субфебрилитет, приступы с ознобом, сердцебиением, жаром, удушьем, витальным страхом, ощущением «кома» в горле, повышенную чувствительность к громким звукам, повышенную жажду (выпивает до 5 л в день), повышенную потливость, парестезии кожных покровов, зуд, похолодание кистей и стоп, чувство онемения в них.
При анализе анамнестических данных выяснено, что больной на протяжении последних нескольких лет имел частые и длительные инфекционные эпизоды ОРВИ, хронического тонзиллита, хронического пиелонефрита по 3–4 раза в году, пневмонии — в прошлом. Ухудшение состояния отмечает в последние месяцы, когда после перенесенного гриппа с высокой температурой появилась жажда, неуверенность при ходьбе, выраженная слабость. Неоднократно лечился в стационарах по месту жительства с диагнозами: острый трахеобронхит, хронический эрозивный гастродуоденит в стадии обострения, хронический холецистит, хронический пакреатит с внешнесекреторной недостаточностью, стадия обострения. При КТ-исследовании выявлены признаки гиперплазии вилочковой железы, кисты печени. При обследовании методом ИФА положительные титры антител к НВ (IgM + IgG), к ЦМВ при отрицательных ДНК-тестах, при положительных ПЦР-тестах. В неврологическом статусе выявлялась выраженная астения, эмоциональная и вегетативная лабильность плюс симптом Гуревича — Манна. Болезненные экскурсии глазных яблок. Горизонтальный установочный нистагм. Асимметрия лицевой мускулатуры за счет сглаженности левой носогубной складки. Отечность языка. Гиперстезия кожи головы больше слева + синдром Штрюмпеля и намек на синдром Бабинского слева. Атаксия в пробе Ромберга. Дистальные отделы конечностей холодные на ощупь.
При проведении дополнительных исследований выявлен дефицит клеточного звена иммунитета за счет СD4- и СD8-лимфоцитов с хелперной и супрессорной активностью. Повышение иммуноглобулинов A и G свидетельствовало о воспалении слизистых. Почти в 2 раза повышены лимфоцитотоксические аутоантитела. Таким образом, у пациента имели место инфекционный, аллергический, аутоиммунный синдромы и тяжелое, резистентное к лечению течение хронической нейроинфекции, которая обусловливала всю неврологическую симптоматику, а также симптомы других эндокринопатий (вилочковой железы, поджелудочной железы, печени, почек). Проведено комплексное лечение с включением панавира, гепадифа, реосорбилакта, гидазепама, сонапакса, Пропеса. На фоне такой терапии у больного удалось не только уменьшить неврологические проявления заболевания, но и достичь ремиссии инфекционного процесса. Иммунологическая динамика: СD4 — 27 (после лечения — 34); СD8 — 15 (17); СD4/СD8 — 1,8 (1 : 2); СD19 — 21 (18); IgA — 3,0 (3,45); IgG — 18,23 (17); IgM — 1,07 (2,11); С-реактивный протеин — 48 (6).
Клинический пример 2
Больной М., 34 года. Поступил в клинику ИНПН АМН Украины с диагнозом: инфекционно-аллергический арахноидит с выраженным ликворно-гипертензионным, вестибулоатактическим, вегетодистоническим синдромом с синкопальными пароксизмальными состояниями на фоне синдрома позвоночной артерии.
При анализе анамнестических данных выявлено, что с детства часто болел ОРВИ, которые осложнялись бактериальными инфекциями, синуситами, ангинами, бронхитами. В 11 лет перенес пиелонефрит, пневмонию, в последние 2 года беспокоит чувство тяжести в правом подреберье, сухость во рту, нарушение сна.
При МРТ-обследовании выявлен очаг в правой доле сосудистого поствоспалительного генеза размером до 4 мм. Расширено субарахноидальное пространство в лобно-теменной области. Остаточные явления этмоидита и фронтита.
При иммунологическом обследовании отмечался лейкоцитоз. Повышение всех классов иммуноглобулинов, свидетельствующих об активном хроническом воспалении с вовлечением слизистых. Дефицит клеточного звена иммунитета за счет СD4, СD8. Вирусологическое исследование методом ИФА выявило наличие в крови ЦМВ + ВПГ, положительные титры антител к НВ (IgM + IgG), к ЦМВ при отрицательных ДНК-тестах, при положительных ПЦР-тестах. При биохимическом исследовании крови повышен уровень трансаминаз печени: АлТ — 98, АсТ — 64. При УЗИ — печень увеличена на 15 мм за счет правой доли.
Заключение: жировой гепатоз. Панкреатопатия. Хронический простатит.
Больному был выставлен диазноз: последствия перенесенной нейроинфекции в виде рецидивирующего инфекционно-аллергического арахноэнцефалита на фоне микст-инфекции с признаками иммунодефицита за счет недостаточности клеточного звена иммунитета и поражения паренхиматозных органов (печени, поджелудочной железы, простаты). Больному проведена комплексная терапия с включением препаратов: панавир, гепадиф, Пропес, кавинтон, пентоксифиллин, физиотерапия.
На фоне проведенной терапии у больного удалось не только достичь положительной динамики со стороны нервной системы, иммунного статуса: СD3 — 49 (53), СD4 — 29 (34), СD8 — 16 (17), СD4/СD8 — 1 : 8 (1 : 2), СD19 — 16 (12), IgA — 4,44 (3/19), лимфоцитотоксические аутоантитела — 22 (8), но и нормализовать биохимические показатели крови (АлТ — 39, АсТ — 35).
Список литературы находится в редакции